Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Déterminer transmis par le sol Statut helminthiase et la condition physique des enfants d'âge scolaire
Dans cet article
Résumé
L'infection chronique par des helminthes transmis par le sol (STHS) provoque une malabsorption, retard de croissance et émaciation chez l'enfant qui grandit. Par conséquent, il est plausible que ces infections réduisent également la condition physique des enfants. Ici, nous visualisons deux techniques pour le diagnostic du STHS et le test de 20 mètres de navette course pour évaluer l'aptitude physique des enfants.
Résumé
Helminthes transmis par le sol (STH) les infections sont courantes. En effet, plus de 1 milliard de personnes sont touchées, surtout dans le monde en développement, où la pauvreté règne et le comportement d'hygiène, l'approvisionnement en eau et l'assainissement sont souvent déficients 1,2. Ascaris lumbricoides, Trichuris trichiura, et les deux espèces d'ankylostome, Ancylostoma duodenale et Necator americanus, sont les plus répandues STHS 3. Le fardeau mondial estimé en raison de l'ankylostome la maladie, l'ascaridiose et la trichocéphalose est de 22,1, 10,5, et 6,4 millions d'années de vie ajustées sur l'incapacité (DALY), respectivement 4. En outre, un 30-100000000 de personnes sont infectées par Strongyloides stercoralis, les espèces les plus négligés STH d'importance mondiale qui provoque sans doute aussi un impact considérable pour la santé publique 5,6. Espèces multiples infections (c.-à-STHS différents abrités dans un seul individu) sont monnaie courante, et les infections ont été lin ked à une baisse de productivité et les perspectives économiques ainsi des pays en développement 1,3.
Pour le diagnostic du STHS communs, l'Organisation mondiale de la Santé (OMS) recommande la technique de Kato-Katz 7,8, qui est une méthode relativement simple pour déterminer la prévalence et l'intensité de ces infections. Il facilite la détection des œufs de parasites que les sujets infectés passent dans leurs selles.
En ce qui concerne le diagnostic de S.stercoralis, il n'existe actuellement aucun outil simple et précise. La technique de Baermann est la méthode la plus largement utilisée pour le diagnostic. Le principe de la technique de Baermann est que les larves actives S.stercoralis migrer hors d'un échantillon éclairé fécale fraîche que les larves sont phototactiques 9. Il nécessite du matériel de laboratoire moins sophistiqués et moins de temps que les méthodes de culture et immunologiques 5. t "> morbidités associées aux infections STH gamme de symptômes aigus, mais commun, tels que douleurs abdominales, diarrhée, prurit, des symptômes chroniques, telles que l'anémie, la malnutrition et la sous-et la déficience cognitive 10. Puisque les symptômes sont généralement non spécifiques et subtile, ils passent souvent inaperçues, sont considérées comme une condition normale par les personnes concernées, ou sont traités comme des symptômes d'autres maladies qui pourraient être plus commune dans un contexte donné. Par conséquent, il est concevable que la véritable charge de géohelminthiases est sous-estimée par l'évaluation s'appuyant sur des outils d'auto-déclarés signes et les symptômes, comme c'est habituellement le cas dans les enquêtes de population.
Dans les années 1980 et début des années 1990, Stephenson et ses collègues ont mis en évidence la possibilité de géohelminthiases abaissement de la condition physique des garçons âgés de 6-12 ans 11,12. Cette ligne de recherche scientifique a récemment pris un nouvel élan 13,14,15. Le 20 mètres (m) de test de course navette a été mis au point und validé par Léger et al. 16 et est utilisé dans le monde entier pour mesurer la capacité aérobique des enfants 17. Le test est facile à standardiser et peut être exécuté partout où un 20-m long cours et de roulage à plat et une source audio sont disponibles, ce qui rend son utilisation intéressante dans les ressources sont limitées 13. Afin de faciliter et de normaliser les tentatives d'évaluer si les géohelminthiases avoir un effet sur l'aptitude physique des enfants d'âge scolaire, nous présentons des méthodes qui diagnostiquent les géohelminthiases ou d'adaptation des mesures physiques qui sont simples à exécuter et encore, fournir des résultats précis et reproductibles. Cela permettra de générer de nouvelles preuves concernant l'impact sur la santé des géohelminthiases.
Protocole
1. Kato-Katz Technique
- Placez une norme de Kato-Katz modèle avec un trou pour la tenue de 41,7 milligrammes (mg) de selles sur une lame de microscope.
- Scoop 2-3 grammes (g) d'un nouvel échantillon fécal sur un morceau de papier journal ou du papier d'aluminium, puis appuyez sur un morceau de fil ou de treillis de plastique sur le dessus pour la tamiser.
- En utilisant une petite spatule en plastique, grattez la matière tamisée au large de la maille et remplir complètement le trou dans le modèle de Kato-Katz avec elle. À éliminer l'excès de matières fécales, le niveau de la teneur du trou avec la spatule.
- Verticalement supprimer le modèle sans déranger les matières fécales maintenant adhérer à la lame de microscope. Le modèle et la spatule peut être nettoyé à l'eau avec un détergent, et réutilisés.
- Placez un morceau de cellophane, préalablement trempé dans une solution de vert malachite glycérine pendant au moins 24 heures (h), au-dessus de l'échantillon fécal sur la lame de microscope.
- Pour répartir les matières fécales dans une goutte épaisse, appuyez doucement sur un chiffon propre microdiapositive portée contre la lame échantillon, distribution uniforme de la matière à l'intérieur d'un cercle d'un diamètre légèrement plus petit que la largeur de la lame de microscope.
- Laissez la lame pour dégager pendant 30-60 minutes (mn), au cours de laquelle les lames doivent être tenus à l'écart de la lumière directe. Ensuite, examiner systématiquement la goutte épaisse sous un microscope optique (40-100x de grossissement). Comptez le nombre d'œufs STH et les stratifier par espèce (c.-à-A.lumbricoides, T.trichiura et l'ankylostome). Fait à noter, les œufs d'helminthes d'autres (par exemple Schistosoma mansoni) peuvent également être détectés par cette méthode et doivent être comptés et enregistrés séparément.
- Pour obtenir une estimation normalisée de l'intensité de l'infection, conventionnellement exprimé en nombre d'œufs par gramme de selles (EPG), il faut multiplier le nombre d'œufs par 24 (24 x 41,7 mg ≈ 1 g).
2. Technique Baermann
- Mettre en place un stand qui peut tenir un verre d'entonnoir et fixer un tube de caoutchouc, fermé d'espritClip ha, au fond de l'entonnoir.
- Placez un tamis ou un morceau de grillage en forme de cône, dans l'entonnoir et il couche avec un morceau de gaze médicale.
- Remplir l'entonnoir avec de l'eau du robinet et s'assurer que l'ensemble set-up ne fuit pas.
- Écoper 20-30 g de selles fraîches sur le milieu de la gaze médicale et de s'assurer qu'il est complètement immergé dans l'eau. Ajouter plus d'eau si nécessaire. Plier la gaze médicale sur l'échantillon.
- D'en bas, brille la lumière artificielle à l'entonnoir pendant 2 heures.
- Drainer 50 millilitres (ml) de la partie inférieure de l'eau dans l'entonnoir dans un tube de centrifugation en douceur libérer la fixation sur le tube en caoutchouc.
- Centrifuger l'eau collectée à 600 xg (force centrifuge relative) pendant 5 min et versez délicatement le surnageant sans déranger le sédiment. Conserver les dernières gouttes dans le tube.
- Remettre en suspension les sédiments et 2 gouttes de pipette de la solution sur une lame de microscope et examiner le coulisseausous un microscope optique (grossissement 40x pour la détection et 100-400x de grossissement pour confirmation de l'espèce). Larves de premier stade (L1) de S. stercoralis sont vivants et se déplacer activement au microscope.
3. 20-m Exécuter le test navette
- Mesurer un 20-m terrain plat et rectiligne et le marquer avec des cônes.
- Aidez le participant essai porter un moniteur de fréquence cardiaque sur le poignet et l'émetteur correspondant autour de la poitrine 18. Cet équipement permet la fréquence cardiaque du participant doit être mesurée avant et après le test et donc surveille si le participant a exercé l'effort maximal.
- Demandez aux participants de lancer d'avant en arrière sur le parcours en suivant le rythme des signaux sonores pré-enregistrés délimitant 20 m tours. À partir d'une vitesse de déplacement de 8,5 km à l'heure (km / h), la fréquence des signaux d'indication 20-m augmente les intervalles par un équivalent de 0,5 km / h toutes les minutes.
- Assurez-eau participant commence un nouveau 20-m intervalle chaque fois qu'un signal est émis et il se termine avant l'arrivée du prochain signal d'.
- Arrêter le participant si il / elle ne parvient pas à suivre le rythme pour deux périodes consécutives de 20 m d'intervalle.
- Enregistré la plus forte vitesse de fonctionnement indiqué dans le dernier intervalle où le participant a rempli entièrement, avec l'âge et le sexe du participant.
- Vérifiez que la fréquence cardiaque atteint à la fin de l'essai est le taux de l'enfant cardiaque maximale 19. Si cette fréquence cardiaque n'est pas atteint, l'enfant pourrait ne pas avoir exercé un effort maximal, et donc le test doit être répété.
- Estimer la capacité maximale aérobie (VO 2 max) du participant, en utilisant une équation mis de l'avant par la firme Léger et ses collègues: VO 2 max = 31.025 + 3.238 * Vitesse (en km / h) - 3,248 * âge (années) + 0,1536 * La vitesse (en km / h) * âge (en années).
4. Les résultats représentatifs
Sur le plan deDiagnostic STH avec la technique de Kato-Katz, caractéristiques uniques des œufs d'helminthes différentes permettre l'identification de la plupart des espèces 20. Les oeufs de A.lumbricoides (environ 45-75 micromètres (um) de long et de 35-50 um de large, figure 1) ont des parois plus épaisses que les coquilles des œufs de T.trichiura (figure 2) et l'ankylostome (figure 3). Un ovule fécondé de A.lumbricoides (Figure 1) a une couche externe albumineuse, qui lui donne une apparence dorée, tandis qu'un œuf non fécondé n'a pas cette couche extérieure et est légèrement allongé et plus globale. Les oeufs de T.trichiura (environ 50 m de long et de 22 um de large, figure 2) sont allongés et ont des besoins spécifiques bouchons polaires. L'ankylostome oeufs (environ 64-76 m de long et de 36 à 40 um de large, figure 3), d'autre part, ont une paroi très mince, suivie d'un anneau clair autour d'un amas dense de cellulesdans le centre de l'oeuf.
S.stercoralis larves L 1 (figure 4) sont d'environ 180-380 um de long et ont une cavité buccale très court. Une ébauche distincte des organes génitaux (mis en évidence par une flèche bleue dans la figure 4) peut être observée et la queue des larves (mis en évidence par une flèche rouge dans la figure 4) a une extrémité pointue.
Comme l'impact réel des géohelminthiases sur la condition physique des enfants est encore en discussion 13,14,15, il n'ya pas de résultat représentatif de leur impact à ce stade. Interprétation des résultats navette de 20 m de test d'exécution peut être effectuée de diverses manières. La condition physique des enfants peuvent être comparées entre les sujets infectés et non infectés, qui sont similaires en termes d'âge et le sexe, d'autres conditions de santé potentiellement concernés, le statut socioéconomique et les habitudes culturelles. Cela peut être fait dans une enquête transversale 13,14,15 où l'Statut d'infection STH et la condition physique des enfants infectés et non infectés sont évalués à un moment particulier. La force de la preuve sera plus élevé lorsque l'on suit un design essai contrôlé randomisé où la condition physique des enfants d'âge scolaire est évaluée avant et après anthelminthique / traitement placebo, permettant à la fois l'évaluation à court et à long terme. On peut encore tenter d'identifier une éventuelle relation dose-réponse entre l'intensité de géohelminthiases et la forme physique et de comparer les différents niveaux de multiparasitisme 1 avec la condition physique. Dans le travail présenté par Yap et ses collègues 15, forme physique, telle que représentée par le VO 2 max, a été trouvé à être considérablement réduite chez les enfants infectés par le T.trichiura par rapport aux enfants qui n'étaient pas infectées par T.trichiura (figure 5) .
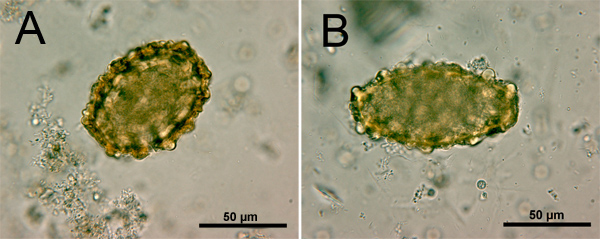
Figu re 1. Images microscopiques d'œufs fécondés A.lumbricoides: (A) et non fécondé (B) sous un grossissement de 500x. Barre d'échelle = 50 um.
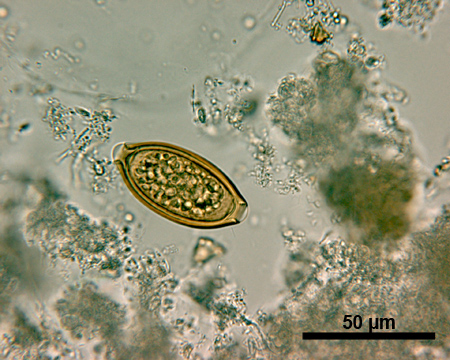
Figure 2. Image microscopique d'un œuf sous un grossissement de 500x T.trichiura. Barre d'échelle = 50 um.
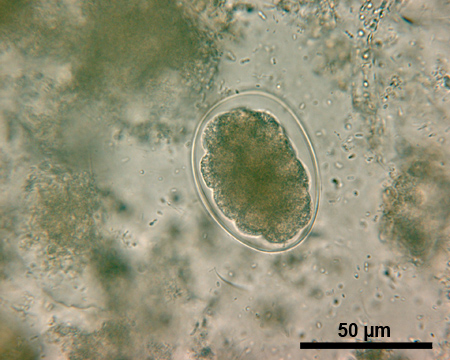
Figure 3. Image microscopique d'un œuf sous un grossissement de 500x ankylostomes. Barre d'échelle = 50 um.
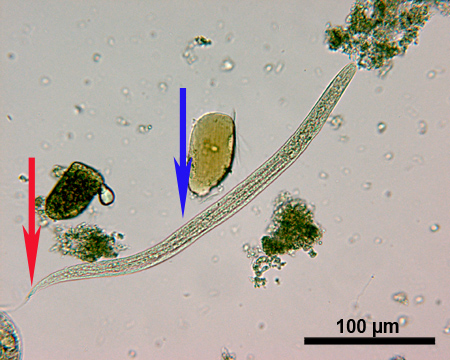
Figure 4. Image microscopique d'une S.stercoralis L 1 sous un grossissement de 250x larve. Les flèches indiquent la queue (rouge) et des organes génitaux primordium (bleu). Barre d'échelle = 100 um.
d/3966/3966fig5.jpg "/>
Figure 5. Graphique montrant le niveau de condition physique des enfants infectés par le T.trichiura rapport au niveau de la condition physique des enfants non infectés par T. trichiura.
Discussion
Les trois protocoles décrits dans le présent document ont été testés et exécutés dans la partie sud-ouest de la province du Yunnan, République populaire de Chine parmi les membres de la minorité ethnique Bulang 21 et dans différentes régions d'Afrique 6,13,14.
Il ya plusieurs modèles disponibles pour la technique de Kato-Katz. Chaque distincte trou de taille va délivrer une quantité nette de matières fécales. Pour le calcul des EPG, il est donc néce...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier les communautés de la province du Yunnan, République populaire de Chine et d'Agboville, Côte d'Ivoire, pour leur participation dans les études décrites ci-dessus. Nous sommes redevables aux équipes locales de terrain qui ont aidé à l'essai et l'exécution des protocoles. Nous sommes particulièrement reconnaissants aux collègues suivants du Swiss Tropical et de Santé Publique Institut: Yvette Endriss pour fournir des images microscopiques, Hanspeter Marti et son équipe pour le soutien de laboratoire et Stefanie Krauth pour son aide lors du tournage vidéo. Enfin, nous remercions les deux relecteurs anonymes pour une série d'observations utiles.
matériels
Remarque: Les matières figurant dans cette liste sont génériques et peuvent être obtenus à partir de différentes sources.
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Kato-Katz kit [400 modèles en plastique avec un trou de 6 millimètres (mm) (diamètre) dans un modèle de 1,5 mm d'épaisseur; 400 spatule en plastique, un rôle 20-m de l'écran de nylon 80; un maillage de rôle 20-m de cellophane hydrophile, 34 um d'épaisseur.] | Vestergaard Frandsen | S'il vous plaît noter que la solution de glycérine vert-malachite n'est pas inclus dans ce kit, mais peut être acheté à n'importe quel fournisseur de produits chimiques. | |
| Entonnoir en verre [environ 8 centimètres (cm) de large et 6 cm de profondeur] | L'entonnoir en verre pour la technique de Baermann devrait être capable de tenir environ 60 ml d'eau. The taille du tuyau en caoutchouc et de la gaze est dépendante du type d'ampoule de verre utilisé. | ||
| Microscope biologique | Olympe | CX21LED/CX21 | |
| Centrifuger | Shanghai Medical Instruments Group | 80 - 2T | |
| Pré-enregistrés des signaux | Conception Bitworks | Équipe Bleep Test Version 1.3.1 | application iPhone |
| Moniteur de fréquence cardiaque | POLAR | FT1 | Regarder et le transmetteur |
Références
- Steinmann, P., Utzinger, J., Du, Z. W., Zhou, X. N. Multiparasitism: a neglected reality on global, regional and local scale. Advances in Parasitology. 73, 21-50 (2010).
- Bethony, J., Brooker, S., Albonico, M., Geiger, S., Loukas, A., Diemert, D., Hotez, P. J. The soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm. Lancet. 367, 1521-1532 (2006).
- Hotez, P. J., Molyneux, D. H., Fenwick, A., Kumaresan, J., Ehrlich Sachs, S., Sachs, J. D., Savioli, L. Control of neglected tropical diseases. New England Journal of Medicine. 357, 1018-1027 (2007).
- Chan, M. S. The global burden of intestinal nematode infections-fifty years on. Parasitology Today. 13, 438-443 (1997).
- Olsen, A., van Lieshout, L., Marti, H., Polderman, T., Polman, K., Steinmann, P., Stothard, R., Thybo, S., Verweij, J. J., Magnussen, P. Strongyloidiases - the most neglected of the neglected tropical diseases. Transactions of the Royal Society of Tropical Medicine and Hygiene. 103, 967-972 (2009).
- Becker, S. L., Sieto, B., Silue, K. D., Adjossan, L., Kone, S., Hatz, C., Kern, W. V., N'Goran, E. K., Utzinger, J. Diagnosis, clinical features, and self-reported morbidity of Strongyloides stercoralis and hookworm infection in a co-endemic setting. PLoS Neglected Tropical Diseases. 5, e1292 (2011).
- World Health Organization. Action against worms. WHO Newsletter. (11), (2008).
- Montresor, A., Crompton, D. W. T., Hall, A., Bundy, D. A. P., Savioli, L. Guidelines for the evaluation of soil-transmitted helminthiasis and schistosomiasis at community level. World Health Organization. , (1998).
- García, L. S., Bruckner, D. A. . Diagnostic medical parasitology. , (2001).
- Brooker, S. Estimating the global distribution and disease burden of intestinal nematode infection: adding up the numbers - a review. International Journal for Parasitology. 40, 1137-1144 (2010).
- Stephenson, L. S., Latham, M. C., Kinoti, S. N., Kurz, K. M., Brigham, H. Improvements in physical fitness of Kenyan schoolboys infected with hookworm, Trichuris trichiura and Ascaris lumbricoides following a single dose of albendazole. Transactions of the Royal Society of Tropical Medicine and Hygiene. 84, 277-282 (1990).
- Stephenson, L. S., Latham, M. C., Adams, E. J., Kinoti, S. N., Pertet, A. Physical fitness, growth and appetite of Kenyan school boys with hookworm, Trichuris trichiura and Ascaris lumbricoides infections are improved four months after a single dose of albendazole. Journal of Nutrition. 123, 1036-1046 (1993).
- Bustinduy, A. L., Thomas, C. L., Fiutem, J. J., Parraga, I. M., Mungai, P. L., Muchiri, E. M., Mutuku, F., Kitron, U., King, C. H. Measuring fitness of Kenyan children with polyparasitic infections using the 20-meter shuttle run test as a morbidity metric. PLoS Neglected Tropical Diseases. 5, e1213 (2011).
- Müller, I., Coulibaly, J. T., Fürst, T., Knopp, S., Hattendorf, J., Krauth, S. J., Stete, K., Righetti, A. A., Glinz, D., Yao, A. K., Pühse, U., N'Goran, E. K., Utzinger, J. Effect of schistosomiasis and soil-transmitted helminth infections on physical fitness of school children in Côte d'Ivoire. PLoS Neglected Tropical Diseases. 5, e1239 (2011).
- Yap, P., Du, Z. W., Chen, R., Zhang, L. P., Wu, F. W., Wang, J., Wang, X. Z., Zhou, H., Zhou, X. N., Utzinger, J., Steinmann, P. Soil-transmitted helminth infections and physical fitness in school-aged Bulang children of southwest China: results from a cross-sectional survey. Parasites and Vectors. 5, 50 (2012).
- Léger, L. A., Mercier, D., Gadoury, C., Lambert, J. The multistage 20 metre shuttle run test for aerobic fitness. Journal of Sports Sciences. 6, 93-101 (1988).
- Tomkinson, G. R., Léger, L. A., Olds, T. S., Cazorla, G. Secular trends in the performance of children and adolescents (1980-2000): an analysis of 55 studies of the 20 m shuttle run test in 11 countries. Sports Medicine. 33, 285-300 (2003).
- Mahon, A. D., Marjerrison, A. D., Lee, J. D., Woodruff, M. E., Hanna, L. E. Evaluating the prediction of maximal heart rate in children and adolescents. Research Quarterly for Exercise and Sport. 81, 466-471 (2010).
- Bogitsh, B. J., Carter, C. E., Oeltmann, T. N. . Human Parasitology. , (2011).
- Steinmann, P., Zhou, X. N., Du, Z. W., Jiang, J. Y., Wang, L. B., Wang, X. Z., Li, L. H., Marti, H., Utzinger, J. Occurence of Strongyloides stercoralis in Yunnan province, China, and comparison of diagnostic methods. PLoS Neglected Tropical Diseases. 1, e75 (2007).
- Martin, L. K., Beaver, P. C. Evaluation of Kato thick-smear technique for quantitative diagnosis of helminth infections. American Journal of Tropical Medicine and Hygiene. 17, 382-391 (1968).
- Dacombe, R. J., Crampin, A. C., Floyd, S., Randall, A., Ndhlovu, R., Bickle, Q., Fine, P. E. Time delays between patient and laboratory selectively affect accuracy of helminth diagnosis. Transactions of the Royal Society of Tropical Medicine and Hygiene. 101, 140-145 (2007).
- Knopp, S., Mgeni, A. F., Khamis, I. S., Steinmann, P., Stothard, J. R., Rollinson, D., Marti, H., Utzinger, J. Diagnosis of soil-transmitted helminths in the era of preventive chemotherapy: effect of multiple stool sampling and use of different diagnostic techniques. PloS Neglected Tropical Diseases. 2, e331 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon