Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Suivi de la contamination microbienne dans les environnements de vente au détail à l'aide de poudre fluorescente - Un détail Charcuterie Environnement Exemple
Dans cet article
Résumé
L'objectif général de cette étude était de démontrer le mécanisme de contamination croisée potentielle de pathogènes d'origine alimentaire Listeria monocytogenes dans un cadre de charcuterie au détail. Cette méthodologie peut être appliquée à une variété d'environnements différents pour suivre la contamination de l'agent pathogène.
Résumé
La contamination croisée des agents pathogènes d'origine alimentaire dans l'environnement de vente au détail est un problème de santé publique important contribuant à un risque accru de maladie d'origine alimentaire. Les aliments prêts-à-manger (PAM) transformés tels que les produits de charcuterie, de fromage, et dans certains cas des produits frais, ont été impliqués dans des flambées de maladies d'origine alimentaire dues à la contamination par des agents pathogènes comme Listeria monocytogenes. En ce qui concerne L. monocytogenes, trancheuses de charcuterie sont souvent la principale source de contamination croisée. L'objectif de cette étude était d'utiliser un composé fluorescent pour simuler la contamination bactérienne et le suivi de cette contamination dans un environnement de détail. Une cuisine d'épicerie maquette a été conçu pour simuler l'environnement de vente au détail. Charcuterie a été inoculé avec le composé fluorescent et les bénévoles ont été recrutés pour compléter un ensemble de tâches similaires à ceux attendus d'un employé de la distribution alimentaire. Les volontaires ont été invités à trancher, ensemble, et de stocker la viande dans un réfrigérateur épicerie. Le potentielcontamination croisée a été suivi dans l'environnement simulé détail par écouvillonnage des zones spécifiques et en mesurant la densité optique de la zone frottée avec un spectrophotomètre. Les résultats ont indiqué que le réfrigérateur (c.-à-épicerie cas) adhérence et les différents domaines de la trancheuse avaient le risque le plus élevé de contamination croisée. Les résultats de cette étude peuvent être utilisés pour développer du matériel de formation plus ciblée pour les employés au détail. En outre, des méthodes similaires pourraient également être utilisés pour suivre la contamination microbienne dans les environnements de production alimentaire (par exemple de petites fermes), les hôpitaux, maisons de soins infirmiers, les navires de croisière et les hôtels.
Introduction
La contamination croisée des agents pathogènes d'origine alimentaire dans l'environnement de préparation des aliments, en particulier dans la section de détail, est une préoccupation majeure en raison d'un risque accru de maladies d'origine alimentaire à partir d'une variété de sources, y compris les viandes ainsi que les légumes 1-5. Le plus souvent, les bactéries pathogènes pénètrent dans l'environnement de vente au détail grâce à des produits alimentaires contaminés 6. Les aliments prêts-à-manger préparés au niveau du détail sont particulièrement préoccupantes, car il est généralement aucune intervention ou de traitement (c.-à-cuisson ou de chauffage) avant la consommation 7. En outre, les agents pathogènes présents sur les aliments contaminés RTE peuvent ensuite être transférées à d'autres produits alimentaires ou les surfaces de contact avec les aliments dans l'environnement de vente au détail.
Bien que la contamination croisée peut se produire dans n'importe quel type d'environnement de l'alimentation au détail, épiceries fines sont d'un intérêt particulier en raison précisément de l'association de RTE charcuterie avec l'agent pathogène Listeria monocytogènes 2. Basé sur une évaluation des risques analyse menée par la US Food and Drug Administration (FDA) et le ministère de la fonction d'inspection (USDA-FSIS) Agriculture salubrité des aliments et des États-Unis, les produits de charcuterie contaminés sont probablement responsables de 90% des cas de listériose - un rare maladie humaine encore grave causée par L. monocytogenes - aux États-Unis 8. En général, les produits de charcuterie en tranches dans des établissements de services de détail et des produits alimentaires ont été associées à un risque plus élevé de L. monocytogenes par rapport à la charcuterie prétranchées dans une usine inspectée par l'USDA par le fabricant 9. Cela pourrait être en raison de la probabilité accrue d'introduction d'agents pathogènes par les manipulateurs d'aliments, ingrédients bruts, ou les aliments transformés qui peuvent être contaminés de post-traitement 7. Dans l'ensemble, la listériose représente environ 28% des décès estimés causés par la maladie d'origine alimentaire chaque année aux États-Unis
En raison de l'enrisque accru de L. monocytogenes contamination dans les produits de charcuterie en tranches au niveau du détail, l'épicerie se trancheuse a été identifié comme un facteur important pour le transfert de surface des agents pathogènes d'origine alimentaire dans l'environnement de vente au détail 2,10. Comme indiqué par Sheen 1, tranchage est la dernière étape de traitement préalable à la consommation et, par conséquent, la trancheuse de charcuterie doit être considéré comme un point de contrôle critique pour la compréhension et la prévention de la contamination croisée 1.
L'objectif général de cette étude était de développer une méthodologie pour suivre la contamination dans l'environnement de la charcuterie de détail à l'aide d'une poudre fluorescente comme Glo Germ. Il s'agit d'un composé fluorescent qui a été utilisé pour simuler la contamination bactérienne de la croix et les pratiques d'hygiène 11,12. Cette étude a été conçue pour suivre le transfert de pathogènes des viandes contaminées à la trancheuse, l'environnement, et d'autres produits de charcuterie. Il est crucial de comprendre les voies de contamination à développer à la fois des interventions efficaces et de matériel éducatif pour les employés et les gestionnaires de détail. Une approche similaire peut être utilisée pour simuler le transfert de pathogènes dans d'autres environnements de traitement (par exemple, de volaille et de bœuf), les fermes et les hôpitaux.
Protocole
Une. Courbe standard
- Peser 37,5 mg poudre fluorescente et dissoudre dans 6 ml d'éthanol 200 preuve. Faire 2 dilutions en série de cette solution dans l'éthanol 200 preuve.
- Vortex tous les échantillons pendant 10 secondes et mesurer l'absorbance à 370 nm.
- Calculer la quantité de poudre fluorescente par 1 ml d'éthanol 200 preuve.
- Préparer la courbe étalon (concentration en mg / ml sur l'axe des y et l'absorbance à 370 nm sur l'axe des x) pour démontrer l'absorbance en fonction de la concentration de poudre fluorescente.
2. Inoculer de charcuterie (Bologne) avec la poudre fluorescente
- Couper la viande de charcuterie dans environ 100 mm des échantillons d'épaisseur à l'aide d'un couteau propre et planche à découper. Préparer trois échantillons étiquetés A, B, et C.
- Manteau de l'échantillon A uniformément avec la poudre fluorescente utilisant un peu humide, une éponge propre. Etaler la poudre sur l'échantillon de viande uniformément. Ne pas inoculer des échantillons B et C avec la poudre fluorescente.
- Envelopper les échantillons d'une pellicule de plastique et étiqueter l'échantillon revêtu de poudre fluorescente «A» et les deux autres échantillons que B et C avec du ruban adhésif.
- Placer les échantillons dans le cas de la charcuterie ou un réfrigérateur qui s'est tenue à 4 ° C dans la cuisine maquette où l'expérience sera réalisée.
3. Mock Deli Préparation Cuisine
- Fournir des gants propres et 70% d'éthanol par pulvérisation dans la cuisine.
- Montez noir ampoules fluorescentes compactes de 13 W ampoules autour de la zone de trancheuse.
- Préparer une découpe cm de feuille d'aluminium de 5 cm x 5 à servir de matrice pour pistonnage.
- Préparer tubes de 15 ml contenant 6 ml d'éthanol à 95%.
4. Configuration vidéo
Mont trois caméras vidéo dans des endroits stratégiques pour observer tous les domaines de la charcuterie maquette en même temps. Allumez les caméras avant de simuler la procédure de trancheuse (comme expliqué dans le protocole 5) et d'analyser les résultats en même temps (commeexpliqué au protocole no 7).
5. Simulation procédures Deli trancher pour le suivi de la contamination croisée
Afin d'améliorer la taille de l'échantillon et intégrer variation, effectuer cette étude en recrutant des participants après l'approbation du protocole par le Conseil de l'institution respective Institutional Review. Le participant peut être un étudiant d'université qui peuvent ou peuvent ne pas avoir une expérience de travail dans des environnements de charcuterie au détail. Assurez-vous que chaque participant porte des gants une fois qu'ils entrent dans les épicerie. Prenez un «avant» l'image sous une lumière fluorescente noir suivi d'un "après" image à la fin de l'étude. Fournir des instructions écrites et verbales claires à chaque participant comme suit:
- Aller au réfrigérateur.
- Retirer la viande étiquetée «A».
- Déroulez la viande et enregistrer une pellicule de plastique.
- Placez la viande sur le plateau de transport de trancheuse.
- Fixer la viande avec la poignée de la viande.
- Mettre l'interrupteur sur ON.
- Réglez slibouton d'index cer à "2".
- Trancher et distribuer 5 morceaux de viande sur du papier épicerie.
- Mettre l'interrupteur sur OFF et relâchez poignée de viande.
- Placer les tranches de viande dans un sac plastique étiqueté «A».
- Envelopper la viande "A" et retourner dans le réfrigérateur.
- Répétez les étapes 2-11 de viandes étiquetées «B» et «C».
6. Quantifier poudre fluorescente
Quantifier la poudre fluorescente après l'achèvement du tranchage maquette (section 5.4) dans la cuisine de la charcuterie. Pour ce faire, le texte suivant:
- Utilisez les 5 cm x 5 cm modèle de feuille d'aluminium stérile et placez-le sur les zones marquées sur la figure 1.
- Utiliser un tampon d'alginate de calcium de coton stérile imbibé d'éthanol à 95%, nettoyer la zone, et les placer dans 6 ml d'éthanol à 95% dans un tube en polypropylene stérile.
- Vortex le tube à fond et le transfert dans une cuvette en verre pour lire l'absorbance à 370 nm.
- Reportez-vous à la standard courbe pour déterminer la quantité de poudre fluorescente (y) en utilisant l'équation suivante: y = mx + b où x est l'absorbance, m est la pente de la courbe d'étalonnage, et b est l'ordonnée à l'origine.
- Pour la normalisation des données, le calcul de la poudre fluorescente pour cent de l'air échantillonné à l'aide de la formule suivante:
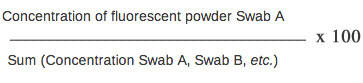
7. Analyse de la vidéo
Filmer les participants comme ils accomplir des tâches 5.1 à 5.12. Synchroniser et sauvegarder les enregistrements vidéo sur DVD de sorte que tous les angles peuvent être affichés en même temps. Regardez les vidéos pour enregistrer le nombre de touches à la main (le nombre de fois volontaires touchent les domaines de la charcuterie maquette) sur différentes surfaces dans l'environnement charcuterie (4 différents chercheurs analyseront les énoncés indépendamment des données complètes).
Résultats
Figure 1 représente les domaines de la trancheuse qui ont été frottée après les bénévoles ont complété les tâches assignées. Les bénévoles ont été filmés pour analyser la fréquence moyenne des contacts de la main sur ces différentes surfaces. La fréquence des contacts de la main a été analysée par quatre observateurs différents et moyenne. Ces résultats sont illustrés sur la figure 2. Les données montrent que la poignée de la viande, emballage de charcuterie, ...
Discussion
L'objectif général de cette étude était de démontrer comment la contamination croisée bactérienne pourrait se produire dans un environnement de charcuterie de détail afin d'élaborer des stratégies pour contrôler et réduire le risque de maladie d'origine alimentaire. L'environnement de la charcuterie de détail présente un risque particulièrement élevé pour L. monocytogenes contamination. L'USDA-FSIS rapporté que la charcuterie en tranches au magasin de détail a un sept fois...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier tous les étudiants du laboratoire de sécurité alimentaire et les bénévoles qui ont participé à cette étude. Cette recherche a été financée par une subvention de l'Initiative de sécurité nationale de l'USDA intégrée des aliments (NIFSI) (Prix de # 10507316).
matériels
| Name | Company | Catalog Number | Comments |
| Glo Germ Powder | Glo Germ Co | Purchased from vendor | |
| Ethanol | Sigma | E7023 | |
| Permanent markers | Sharpie | Purchased from stationary store | |
| Gloves | VWR | 82026-424 | |
| Deli Meat | NA | NA | Bologna Chub from regular grocery store |
| Cutting Board | NA | NA | A regukar kitchen cutting board |
| Knife | NA | NA | A regular kitchen knife |
| 5 cm x 5 cm sterile templates | NA | NA | Aluminum foil templates cut into 5 cm x 5 cm templates and sterilized |
| 15 ml Polypropylene centrifuge tubes | VWR | 89039-664 | |
| Cotton swabs | Puritan | 25-806 | |
| Glass cuvettes | VWR | 470019-186 | |
| Vortex | VWR | 58816-121 | |
| Flip camera | Flip Ultra HD | NA | Purchased online |
| Deli slicer | Bizerba | SE-12 | |
| Deli refrigerator | True Company | TDBD-722 | |
| Scale | NA | ||
| Spectrophotometer | Milton Roy Company | NA | Spectronic 20D |
Références
- Sheen, S., Hwang, C. A. Mathematical modeling the cross-contamination of Escherichia coli O157: H7 on the surface of ready-to-eat meat product while slicing. Food Microbiol. 27, 37-43 (2010).
- Crandall, P., Neal, J., et al. Minimizing the risk of Listeria monocytogenes in retail delis by developing employee focused, cost effective training. Agric. Food Anal. Bacteriol. 1, 159-174 (2011).
- Koo, O. K., Sirsat, S. A., et al. Physical and chemical control of Salmonella in ready-to-eat products. Agric. Food Anal. Bacteriol. 2, 56-68 (2012).
- Hanning, I. B., Johnson, M. G., Ricke, S. C. Precut prepackaged lettuce: a risk for listeriosis?. Foodborne Pathog. Dis. 5, 731-746 (2008).
- Hanning, I. B., Nutt, J. D., Ricke, S. C. Salmonellosis outbreaks in the United States due to fresh produce: sources and potential intervention measures. Foodborne Pathog. Dis. 6, 635-648 (2008).
- Zhu, M., Du, M., et al. Control of Listeria monocytogenes contamination in ready‐to‐eat meat products. Compr. Rev. Food Sci. Food Safety. 4, 34-42 (2005).
- Lianou, A., Sofos, J. N. A review of the incidence and transmission of Listeria monocytogenes in ready-to-eat products in retail and food service environments. J. Food Protect. 70, 2172-2198 (2007).
- . Quantitative risk assessment of relative risk to public health from foodborne Listeria monocytogenes among selected categories of ready-to-eat foods. , .
- Endrikat, S., Gallagher, D., et al. A comparative risk assessment for Listeria monocytogenes in prepackaged versus retail-sliced deli meat. J. Food Protect. 73, 612-619 (2010).
- Pradhan, A. K., Ivanek, R., et al. Comparison of public health impact of Listeria monocytogenes product-to-product and environment-to-product contamination of deli meats at retail. J. Food Protect. 74, 1860-1868 (2011).
- Jones, C. K. Handwashing Technique Analysis. Patent number 5900067. , (1999).
- Gibson, K. E., Koo, O. K., et al. Observation and relative quantification of cross-contamination within a mock retail delicatessen environment. Food Control. 31, 116-124 (2013).
- Xiao, M., Zheng, G., et al. Method and System for Fecal Detection. Patent number 5821546. , (1998).
- Waldroup, A., Kirby, J. Method and System for Fecal Detection. Patent number 5621215. , (1997).
- Ashby, K. D., Wen, J., et al. Fluorescence of dietary porphyrins as a basis for real-time detection of fecal contamination on meat. J. Agric. Food Chem. 51, 3502-3507 (2003).
- Cabrera-Diaz, E., Moseley, T. M., et al. Fluorescent protein marked Escherichia coli biotype I strains as surrogates for enteric pathogens in validation of beef carcass interventions. J. Food Protect. 72, 295-303 (2009).
- Byrd, J., Hargis, B., et al. Fluorescent marker for the detection of crop and upper gastrointestinal leakage in poultry processing plants. Poult. Sci. 81, 70-74 (2002).
- Vorst, K. L., Todd, E. C., et al. Transfer of Listeria monocytogenes during mechanical slicing of turkey breast bologna, and salami.. J. Food Protect. 69, 619-626 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon