Method Article
Haut débit, l’absolue détermination de la teneur d’une protéine sélectionnée aux niveaux de tissus en utilisant Quantitative Dot Blot Analysis (QDB)
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous démontrons un processus détaillé de l’analyse quantitative dot tache (QDB) par détermination de la teneur absolue d’une protéine ciblée, plafonnement protéines actine, gelsoline-like (CAPG), dans trois tissus de souris différente. Nous démontrons un haut débit, la technique d’immunoblot commode, quantitative pour validation des biomarqueurs au niveau cellulaire et tissulaire.
Résumé
Faute d’une commode, méthode immunoblot quantitative, haut débit pour la détermination absolue de la teneur d’une protéine spécifique au niveau cellulaire et tissulaire entrave considérablement les progrès dans la recherche de la protéomique. Résultats provenant de techniques d’immunotransfert actuellement disponibles sont également relatifs, empêchant tout effort visant à combiner les études indépendantes avec une analyse à grande échelle des échantillons de protéines. Dans cette étude, nous montrons le processus de l’analyse quantitative dot tache (QDB) pour réaliser une quantification absolue dans un format haut débit. À l’aide d’un niveau de protéine disponibles dans le commerce, nous sommes en mesure de déterminer la teneur absolue du plafonnement protéines actine, la gelsoline ressemblant (CAPG) dans des échantillons de protéines préparées à partir de trois tissus de souris différents (rein, rate et la prostate), ainsi qu’un détail explication des détails expérimentaux. Nous vous proposons l’analyse QDB comme une méthode d’immunoblot commode, quantitative, haut débit de quantification absolue de protéines individuelles au niveau cellulaire et tissulaire. Cette méthode facilitera considérablement le biomarqueur validation et vérification de la voie dans les différents domaines de la recherche biologique et biomédicale.
Introduction
Aux côtés d’avec les avancements passionnants en recherche en génomique dans les dernières années, le domaine de la recherche biomédicale témoins aussi l’avancement significatif dans la recherche de la protéomique. Avec l’augmentation de l’accumulation de données biologiques à la fois génomiques et protéomiques, utilisant des outils bioinformatiques pour analyser ces données est devenue le centre de recherche biomédicale à l’avenir perceptible. Par conséquent, le succès de la recherche bioinformatical déclenche la demande de nombre et de meilleure qualité des données de la communauté de la recherche biologique et biomédicale, une tâche ne peut être atteint que grâce à l’avancement de la technique à la génomique et protéomique.
Spectrométrie de masse (SM) et l’analyse par immunotransfert sont actuellement deux techniques dominantes de l’analyse des protéines. MS a dominé la recherche protéomique dans les dernières années pour permettre l’analyse de milliers de protéines individuelles en même temps. Les techniques basées sur immunoblot, y compris la tache occidentale et la dot blot, d’autre part, ont également joué un rôle important dans la recherche de protéines même depuis son invention1,2,3,4, 5. Enzymatique immunosorbent assay (ELISA)5,6,7 et inversion de phase protéine microarray (RPPM)8,9 peut être considéré comme le format haut débit d’immunoblot analyse. Cependant, toutes ces méthodes de dosage immunologique, sauf ELISA, mesurent le niveau de l’expression relative d’une protéine spécifique. Le caractère relatif de ces méthodes va devenir un véritable problème pour les études de population, comme l’analyse doit se faire en même temps, empêchant tout effort visant à augmenter la taille de la piscine au moyen d’analyses multiples. En outre, les résultats provenant de ces études ne sont semi-quantitatifs, ce qui complique toute tentative de bio-informatique dans l’analyse des données. Pendant ce temps, bien qu’ELISA est bien adaptée pour l’analyse des échantillons de protéines absolu à haut débit, cette technique semble relever des défis dans des environnements complexes tels que les cellules ou tissus en raison de sa capacité de fixation faible et le multiplexage,10.
Nous avons développé une méthode d’immunoblot adaptée aux études sur la population ayant les caractéristiques principales d’être pratique, haut débit, quantitatif et adapté à la détermination absolue de la teneur en protéines et nommé cette technique quantitative point de tache analyse (QDB)11. Dans cette étude, nous présenter un protocole détaillé pour QDB analyse et illustrent la méthode de détermination de la teneur en protéines absolue d’une protéine spécifique, CAPG, dans trois tissus de souris différents, y compris les reins, la rate et la prostate. Nous pensons que ce protocole détaillé illustre bien la faisabilité et la commodité de cette méthode et fournir des conseils sur comment éviter les pièges potentiels dans la pratique de cette méthode.
Protocole
Toutes les procédures d’animaux ont été réalisées conformément aux Directive de Binzhou Medical University Animal Use et approuvés par la Commission d’examen éthique de l’Université de médecine de Binzhou.
1. préparation de l’échantillon
- Prendre le tissu de souris 50 mg dans un Tube de 1,5 mL. Ajouter 200 µL de tampon de lyse (50 mM Hepes, pH 7,4, 137 mM NaCl, 5 mM EDTA, EGTA, 5 mM 1 mM MgCl2, 10 mM Na2P2O7, 1 % X-100 Triton, 10 % de glycérol), complétée avec les inhibiteurs de la protéase et de la phosphatase (100 mM NaF, 0,1 mM phénylméthylsulfonyle fluorure, 5 µg/mL pepstatine, 10 µg/mL leupeptine, aprotinine 5 µg/mL).
- Homogénéiser le tissu avec un homogénéisateur pendant 1 min sur la glace.
- Centrifugation pendant 10 min à de 8 000 x g à 4 ° C.
- Recueillir le liquide surnageant dans des tubes neufs (1,5 mL) et retirer 1 µL pour dosage concentration protéique avec kit de BCA.
Remarque : Tous les tampons de lyse couramment utilisés pour l’analyse par western blot et Dot blot analyse peuvent être utilisés pour l’analyse QDB.
2. déterminer la spécificité des anticorps
- Préparer les lysates de sample (20 µg) à la section 1.4, IgG BSA gratuit (20 µg), protéine standard (600 pages), pour analyse par western blot.
Remarque : IgG BSA libre est utilisé comme contrôle négatif et la protéine standard est utilisée comme témoin positif. La spécificité de l’anticorps est démontrée en montrant une bande de bonne taille à l’aide de l’analyse par western blot.
3. définir la gamme de linéarité de l’analyse QDB
- Dissoudre la protéine standard avec FD2O. diluer la protéine à une concentration de 1 200 pg/µL.
- Diluer le concentré de protéine de l’échantillons préparés dans la section 1.4 à 4 µg/µL.
- Dissoudre la BSA avec FD2O. diluer la protéine à une concentration de 1 200 pg/µL à 4 µg/µL.
- Une série de dilution de protéines standard et échantillons préparés ont été préparés avec l’aide du tableau 1 et tableau 2.
- Mix 10 µL dilution standard protéines ou dilution préparé échantillons et 10 µL 2 x tampon de chargement (120 millimètres Tris-HCl pH 6,8, 20 % glycérol, SDS de 4 %, 0,2 % bleu de bromophénol, 200 mM DTT) ensemble.
| S1 (0pg/µl) | S2 (33.3pg / µl) | S3 (100pg/µl) | S3 (300pg/µl) | S5 (600pg/µl) | S6 (1200pg/µl) | |
| protein(1200pg/µl) standard | 0 | 1.39 | 4.17 | 12,5 | 25 | 50 |
| IgG BSA gratuit (4pg/µl) | 50 | 48.61 | 45,83 | 37,5 | 25 | 0 |
| total | 50 | 50 | 50 | 50 | 50 | 50 |
Le tableau 1. Système de dilution pour les courbe standard de protéines.
| X1 (0µg/µl) | X2 (0,25 / µl) | X3 (0.5µg / µl) | X4 (1µg/µl) | X5 (2 µg/µl) | X6 (4 µg/µl) | |
| Sample(4µg/µL) | 0 | 3.125 | 6.25 | 12,5 | 25 | 50 |
| IgG BSA(4µg/µl) gratuit | 50 | 46.875 | 43,75 | 37,5 | 25 | 0 |
| total | 50 | 50 | 50 | 50 | 50 | 50 |
Le tableau 2. Système de dilution des échantillons préparés
- Faire chauffer le mélange à 85 ° C pendant 5 min.
4. processus d’analyse QDB
-
Exemple d’application
- Soutenir la plaque QDB pour éviter le fond de la plaque de touche la surface de la table. Par exemple, utiliser une boîte de pointe de pipette vide comme support.
- Charger jusqu'à 2 µL de l’échantillon au centre de la membrane au bas de l’unité individuelle de la plaque QDB.
-
Sécher la plaque
- Laisser la plaque QDB chargée pendant 1 h à la salle tempérée (RT) ou en guise d’alternative, laisser la plaque chargée à 37 ° C pendant 15 min dans un endroit bien aéré.
-
La plaque de blocage
- Trempez la plaque QDB dans le tampon de transfert (0,039 M Glycine, 0,048 M Tris, 0,37 % SDS, 20 % d’alcool méthylique) et secouez légèrement la plaque pendant 10 s.
- Rincez la plaque QDB doucement avec un mélange TBST (Tris-buffered saline, 0,1 % Tween 20) trois fois et puis laver la plaque pendant 5 min dans un mélange TBST sous agitation constante.
- Bloquer la plaque QDB avec un tampon de blocage (5 % de lait dans un mélange TBST (100 µL/puits) pendant 1 h sous agitation constante.
-
Incubation des anticorps primaires
- Diluer l’anticorps primaire dans le tampon de blocage à une concentration choisie (à partir de 1:500 à 1:5 000) et ajouter 100 µL à chaque puits individuels d’une plaque bien 96 ordinaire. Insérer la plaque QDB dans la plaque 96 puits et incuber les boîtes combinées soit pendant 2 h à ta ou toute la nuit à 4 ° C sous agitation constante.
- Vous pouvez également placer la plaque QDB à l’intérieur d’une boîte et remplir la boîte avec un tampon de blocage 2 à 3 mm au-dessus de la portion de la membrane de la plaque si le même anticorps est utilisé pour une plaque entière. Ajoutez l’anticorps primaire à la concentration choisie et incuber la plaque soit pendant 2 h à ta ou toute la nuit à 4 ° C par sous agitation constante.
- Rincez la plaque délicatement avec un mélange TBST pendant trois fois avant il est lavé avec un mélange TBST pour trois fois, chaque fois pendant 5 min sous agitation constante.
-
Incubation d’anticorps secondaire
- Diluer l’anticorps secondaire dans le tampon de blocage à la concentration choisie (à partir de 1:1, 000 à 01:50, 000) et chaque aliquote 100 µL/puits dans une plaque 96 puits ou dans une boîte comme décrit à la section 4.4.2 et puis incuber la plaque QDB à l’intérieur soit l’APL bien 96 chargé te ou la boîte pendant 1 h à RT sous agitation constante.
- Rincez la plaque QDB doucement 3 fois avec un mélange TBST, puis laver la plaque de 3 fois, 5 min chacun avec un mélange TBST sous agitation constante.
-
Quantification
- Préparer le substrat chimiluminescence améliorée (ECL) en suivant les instructions du fabricant.
- Substrat de ECL aliquote dans un 96 plaque puits (100 µL/puits) et insérer la plaque QDB à l’intérieur de la plaque 96 puits pendant 2 min sous agitation constante.
- Retirez la plaque QDB de la 96 puit plaque et agiter brièvement pour enlever l’excès de liquide. Placez la plaque sur une plaque de microtitration blanc.
- Allumez le lecteur de microplaques et sélectionnez « plaque avec couvercle » sur l’interface utilisateur avant de placer les plaques combinées (QDB plate + adaptateur de plaque blanche) dans le lecteur de microplaque pour la quantification.
Remarque : Assurez-vous d’utiliser la plaque de microtitration blanc, opaque comme un adaptateur pour éviter toute interférence de la plaque. Assurez-vous de choisir « plaque avec couvercle » afin d’éviter le blocage de la machine lorsqu’il est combiné plaques (adaptateur, QDB plaque + 96 plaque puits) sont placées dans le lecteur de microplaques.
Résultats
La détermination de la quantité absolue d’une protéine dont la protéine GPAW en tissu souris nécessite un anticorps spécifique tant une protéine purifiée en standard. La gamme de linéarité des analyses de la protéine étalon et les lysats doit également être établi avant toute analyse à grande échelle. La gamme de linéarité de l’anticorps est fortement tributaire de l’anticorps en soi, et la gamme de dilution appropriée d’anticorps spécifique doivent être vérifiées par chaque utilisateur individuel.
Nous avons d’abord déterminé la spécificité de l’anticorps du GPAW en rein de souris, tissus de rate et de la prostate par analyse par western blot avec le contrôle négatif (IgG gratuit BSA) et le contrôle positif (protéine du GPAW disponible dans le commerce) (Figure 1A). L’anticorps anti-GPAW était spécifique contre les lysats de rate de souris, coeur, muscle et prostate (une seule bande détectée). Bandes non spécifiques ont été observées dans les lysats du rein et du foie. Toutefois, dans le rein lysat, les bandes non spécifiques ont été significativement plus faibles que la bande spécifique, ce qui suggère que l’anticorps est adapté à l’analyse de tissus rénaux. Ensuite, la gamme de linéarité de la protéine étalon et de la quantité de lysats d’analyses ont été déterminées par deux courbes dose côte à côte. Une protéine CAPG disponible dans le commerce a été diluée en série comme indiqué au tableau 1 basée sur nos expériences passées et les lysats de tissus du rein souris, la rate et la prostate ont été dilués également basé sur la quantité de protéines totales dans les lysats déterminés par un kit de dosage de protéines totales BCA. Deux études de dose a eu lieu à côté et complotés ensemble dans la Figure 1B. La quantité appropriée de lysats de rein de souris, de rate et de la prostate ont été choisis en fonction des signaux QDB mesurées par le lecteur de microplaque en unité arbitraire. La leçon primitive de cette expérience est illustrée dans le tableau 3.
Dans la dernière étape, la norme de protéine GPAW en série diluée et les lysats de rein de souris, la rate et la prostate ont été chargés sur la plaque de QDB. Dans ce cas, nous avons choisi de charge 0,3 µg/échantillon de lysats de rein de souris et de la rate et 1 µg/échantillon de lysats d’analyse de souris de la prostate, comme à ces niveaux, la lecture de QDB prit fin au moins 20 fois le fond bien dans la gamme linéaire de l’analyse basé sur la courbe de dose de la protéine étalon et les lysats. La plaque a été soumise au protocole QDB décrit avant que la plaque a été quantifiée directement par le lecteur de microplaques. À l’aide de la protéine en série diluée de CAPG purifiée, nous pourrions établir une courbe dose-réponse, l’équation et R2 par analyse de régression simple à l’aide de logiciels disponibles (par exemple, Microsoft office excel). Le QDB signaux de lysats des reins de souris, de rate et la prostate ont été convertie à la quantité absolue de protéine du GPAW en ces lysats en utilisant l’équation établie, et les résultats ont été corrigés par la quantité de protéines totales, dans ce cas, 0,3 microgramme de lysats de rates de souris et les reins et 1 microgramme de lysats de prostates de souris, pour la concentration finale de protéine du GPAW dans ces tissus pg/µg. Les résultats sont présentés dans la Figure 1C avec la leçon primitive montrée tableau 4.
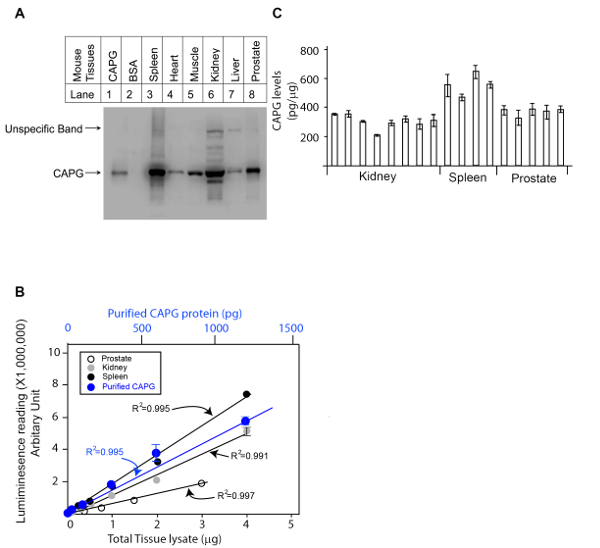
Figure 1 . Résultat représentatif d’une analyse QDB pour déterminer les niveaux absolus du GPAW en trois tissus de souris (rein, la rate et la prostate). A. examinant la spécificité des anticorps anti-CAPG de lapin à l’aide de la souris les lysats de tissus préparés à partir de rate, coeur, Muscle, rein, foie et la Prostate à l’aide occidentale tache analyse avec le contrôle négatif (IgG gratuit BSA) et le contrôle positif (dans le commerce protéine du GPAW disponible). B. définir les analyses de gamme linéaire de QDB des anticorps anti-CAPG de lapin à l’aide de lysats préparés à partir de la prostate, rein, rate et à l’aide de purifié recombinant protein CAPG standard. Les résultats ont été réanalysés en moyenne. C. la détermination absolue des niveaux du GPAW dans les lysats préparés à partir de la prostate, rate et les reins de souris. Chaque barre représente un tissu d’une souris individuelle. Les résultats ont été la moyenne des trois exemplaires. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
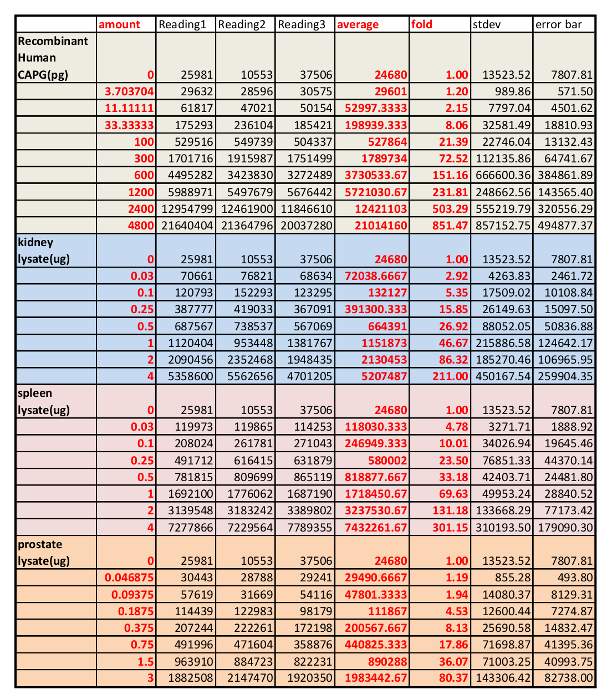
Tableau 3 : Résultent de lecteur de microplaques des études dose utilisant à la fois dilués en série, lysats de mise en commun des rates de souris, reins et de la prostate et protéine recombinante purifiée de CAPG.
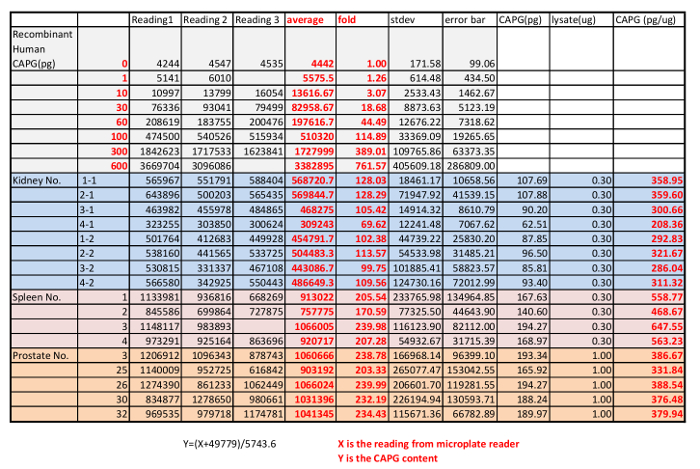
Tableau 4 : Résultat du lecteur de microplaques de l’analyse QDB du niveau absolu CAPG dans les reins de souris (8), rate (4) et de la prostate (5) en utilisant une protéine recombinante du GPAW en standard.
Discussion
Parmi tous les test immunologique disponible les techniques actuelles d’analyse des protéines sauf ELISA, analyse QDB est la seule méthode pour obtenir la teneur absolue d’une protéine spécifique aux niveaux cellulaire et tissulaire dans un format haut débit. Bien que stable isotope-étiqueté standard, spectrométrie de masse est en mesure de réaliser une quantification absolue de quelques protéines, cette méthode n’est pas encore conçue pour des performances haut débit. Dans cette étude, nous avons démontré le processus d’analyse QDB pour atteindre la détermination absolue du niveau de protéine du GPAW en tissus de souris, y compris les reins, la rate et la prostate. CAPG s’observait entre 200 à 360 pg/g dans les tissus de rein de souris, 460 à 650 pg/g de rates de souris et 330 à 390 pg/g dans les tissus de la prostate souris.
Par rapport à l’ELISA, analyse QDB nécessite des efforts minimales pour être développé dans un laboratoire régulier. Tout d’abord, la plaque QDB est basée sur une membrane de nitrocellulose pour éliminer l’étape de revêtement en ELISA. Deuxièmement, analyse QDB exige seulement un au lieu de deux anticorps spécifiques dans un sandwich ELISA. Troisièmement, la capacité de liaison haute de membrane de nitrocellulose par rapport à la surface de la plaque ELISA permet aussi la membrane supporter les étapes de lavage rigoureux généralement utilisés dans l’analyse d’immunoblot pour réduire les parasites de fond. Cette fonctionnalité est très utile dans l’analyse compliquées lysats préparés à partir de cellules et de tissus. En revanche, en raison de la capacité de liaison relativement faible des plaques ELISA, la réduction de l’arrière-plan lors de l’analyse des lysats cellulaires et tissulaires compliqués devient un véritable défi dans le processus de développement.
Analyse QDB peut être adopté facilement dans n’importe quel laboratoire avec l’accès d’un anticorps spécifique. Cependant, il est important de mentionner que la spécificité de l’anticorps est un terme relatif, limité par des facteurs incluant les espèces, les types de tissus et types de cellules. Comme le montre la Figure 1A, CAPG anticorps est spécifique lors de l’analyse de lysat de la prostate, rate et le rein de souris et devient encore non spécifiques lors de l’analyse de foie de souris. En effet, on retrouve régulièrement un anticorps à être spécifiques d’un tissu type, mais pas toujours spécifique à l’autre type de tissu de la même espèce. Ainsi, immunobuvardage préalable est nécessaire pour assurer la spécificité de l’analyse QDB. En effet, la relative spécificité de l’anticorps peut être la cause de faux résultats, souvent liées à l’analyse d’ELISA, comme n’importe quel effort de l’entreprise de fabrication peut avoir passé afin d’assurer la spécificité de l’essai, ils ne peuvent pas épuiser tous les possibles types d’échantillons, les utilisateurs peuvent choisir d’analyser à l’aide de leurs produits d’ELISA.
Comme avec tous les tests immunologiques, un problème potentiel avec la méthode d’analyse QDB est le manque d’uniformité de la qualité de l’anticorps commerciaux. Même si la qualité apparente d’un anticorps de la même compagnie (même Catalogue numéro, etc.) est utilisé, il pourrait y avoir des différences importantes d’un achat à l’autre en raison de la variabilité de lot. Par conséquent, sauf si est atteint la pleine confiance dans la qualité de l’anticorps disponibles, re-qualifier l’anticorps lors de chaque achat est important.
En résumé, nous fournissons ici un protocole détaillé et un exemple lorsque vous utilisez la méthode d’analyse QDB pour atteindre absolue détermination quantitative d’une protéine spécifique au niveau des tissus. Nous montrons que la méthode d’analyse QDB est un outil pratique pour quiconque s’intéresse à haut débit, l’analyse quantitative par immunotransfert. Sa capacité à atteindre l’absolue détermination de la teneur d’une protéine spécifique au niveau cellulaire et tissulaire distingue aussi cette technique d’immunoblot traditionnelles techniques. Cette fonctionnalité permet la combinaison et la comparaison des résultats d’analyses multiples, une étape nécessaire surtout dans les grandes études de population et la réalisation des études d’association pertinents au niveau de la protéine dans un proche avenir.
Déclarations de divulgation
Les auteurs Yunyun Zhang, Wenfeng Zhang et Jiandi Zhang sont des employés de Zestern Biotechniques qui produit des plaques QDB utilisées dans cet Article. WenFeng Zhang et Yunyun Zhang déclarent les conflits d’intérêts et Jiandi Zhang a déposé des demandes de brevet. Les autres ne réclamer aucun intérêts opposés.
Remerciements
Ce travail est soutenu par Taishan érudits Construction Engineering (G.T.), le Shandong Excellent Young Scientist Award (ZR2016JL026 à G. T.), National Fondation sciences naturelles de Chine (31771284, 3167070448 et 81641108), Shandong naturelles provinciales Fondation de la science (ZR2016JL026, 2017GSF18103)-sciences provinciale Shandong et technologie Plan (J14LE01 et J15LK03), plan(2015ZH083) de science et technologie Yantai et Binzhou médicale Université scientifique fonds de recherche (BY2013KYQD17, BY2013KYQD18), le Conseil de recherche suédois accorder 621-2011-4423 et 2015-4870. Ce travail est également parrainé par « Yantai Double cent talents Plan » et « Yantai Hi-Tech Zone océan Talent Plan bleu ».
matériels
| Name | Company | Catalog Number | Comments |
| Microplate reader | Tecan | Tecan Infinite 200 PRO | |
| QDB plate | Yantai Zestern Co.Ltd | Plates are available upon request for verification purpose either through email or visiting www.zestern.net. | |
| Peroxidase AffiniPure Donkey Anti-Rabbit IgG (H+L) (min X Bov, Ck, Gt, GP, Sy Hms, Hrs, Hu, Ms, Rat, Shp Sr Prot) | jackson | 711-035-152 | |
| Enhanced chemiluminesence substrate | Thermo | 32134 | |
| Rabbit anti-CAPG | Sino Biologic Inc | 14213-T52 | |
| CAPG protein | Sino Biologic Inc | 14213-HNAE | |
| Hepes | Sigma | H4034 | |
| Nacl | Tianjin Ruiji Jin special Chemical Co., Ltd | 10461220 | |
| Mgcl2 | Tianjin Zhiyuan Chemical Reagent Co., Ltd | 20120802 | |
| EDTA | Sigma | E9884-500G | |
| EGTA | Sigma | BNN1913 | |
| Na2P2O7 | Haituo Chinese medicine test | 20160914 | |
| Triton X-100 | Sigma | T9284 | |
| Glycerol | Sigma | G7757 | |
| phenylmethylsulfonyl fluoride | Sigma | P7626-5G | |
| pepstatin | Sigma | Z290033 | |
| leupeptin | Sigma | L2884 | |
| aprotinin | Sigma | A3428 | |
| Tris-Hcl | Sigma | T6455 | |
| SDS | Sigma | L5750-500G | |
| DTT | Sigma | 43815-1G | |
| Bromphenol Blue | Sigma | B-0126 | |
| NaF | Sigma | S7920 |
Références
- Renart, J., Reiser, J., Stark, G. R. Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure. Proc Natl Acad Sci U S A. 76 (7), 3116-3120 (1979).
- Burnette, W. N. "Western blotting": electrophoretic transfer of proteins from sodium dodecyl sulfate--polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. Anal Biochem. 112 (2), 195-203 (1981).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76 (9), 4350-4354 (1979).
- Uhlen, M., et al. A proposal for validation of antibodies. Nat Methods. 13 (10), 823-827 (2016).
- Hawkes, R., Niday, E., Gordon, J. A dot-immunobinding assay for monoclonal and other antibodies. Anal Biochem. 119 (1), 142-147 (1982).
- Engvall, E., Perlmann, P. Enzyme-linked immunosorbent assay (ELISA). Quantitative assay of immunoglobulin. G. Immunochemistry. 8 (9), 871-874 (1971).
- Engvall, E., Jonsson, K., Perlmann, P. Enzyme-linked immunosorbent assay. II. Quantitative assay of protein antigen, immunoglobulin G, by means of enzyme-labelled antigen and antibody-coated tubes. Biochim Biophys Acta. 251 (3), 427-434 (1971).
- Paweletz, C. P., et al. Reverse phase protein microarrays which capture disease progression show activation of pro-survival pathways at the cancer invasion front. Oncogene. 20 (16), 1981-1989 (2001).
- Tibes, R., et al. Reverse phase protein array: validation of a novel proteomic technology and utility for analysis of primary leukemia specimens and hematopoietic stem cells. Mol Cancer Ther. 5 (10), 2512-2521 (2006).
- Solier, C., Langen, H. Antibody-based proteomics and biomarker research - current status and limitations. Proteomics. 14 (6), 774-783 (2014).
- Tian, G., et al. Quantitative dot blot analysis (QDB), a versatile high throughput immunoblot method. Oncotarget. 8 (35), 58553-58562 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon