Method Article
Utilisant la tomographie par cohérence optique et réponse optocinétique comme lectures structurale et fonctionnelle de système visuel chez les souris et les Rats
Dans cet article
Résumé
Un protocole détaillé pour l’évaluation des afficheurs structurels et visuelles chez les rongeurs par réaction d’optocinétique et de tomographie par cohérence optique est présenté. Les résultats fournissent des indications précieuses pour la recherche ophtalmologique ainsi que neurologique.
Résumé
Tomographie par cohérence optique (OCT) est une technique rapide, non invasif, interférométrique permettant une imagerie rétinienne. C’est un outil idéal pour l’étude des processus de neurodégénérescence, neuroprotection et neuro-réparation impliquant le système visuel, comme ces souvent corréler avec modifications rétiniennes. Comme une lecture fonctionnelle, œil compensatoire visuellement évoqué et mouvements de la tête sont couramment utilisés dans les modèles expérimentaux portant sur la fonction visuelle. Combinant les deux techniques permet une enquête quantitative in vivo de la structure et la fonction, qui peut être utilisée pour enquêter sur les conditions pathologiques ou pour évaluer le potentiel de nouvelles thérapeutiques. Un grand avantage des techniques présentées est la possibilité d’effectuer des analyses longitudinales permettant l’étude des processus dynamiques, en réduisant la variabilité et permet de réduire le nombre d’animaux nécessaires pour les expériences. Le protocole décrit vise à fournir un manuel pour l’acquisition et l’analyse des scans rétiniens de haute qualité des souris et des rats en utilisant un support personnalisé faible coût avec une option pour livrer l’anesthésie par inhalation. En outre, le guide proposé vise comme un manuel d’instruction pour les chercheurs qui utilisent optocinétique analyse de la réponse (OKR) chez les rongeurs, qui peuvent être adaptés à leurs besoins et intérêts.
Introduction
L’examen de la voie visuelle, dans le cadre du système nerveux central, s’est avéré pour être un point de départ efficace en abordant non seulement ophtalmologique1,2,3,4,5 , mais aussi neurologiques6,7,8,9,10,11,12,13,14 ,15,16 questions. Ces dernières années, OCT et OKR ont été identifiés comme des outils utiles analytiques, non invasif pour évaluer une grande variété de rétinopathies et rétiniennes manifestations dans divers modèles de rongeurs17,18,19 , 20 , 21 , 22 , 23 , 24 , 25. OCT permet de rapide et de haute résolution en vivo visualisation de la rétine morphologie et structure chez les souris et les rats, avec des résultats en bon accord avec les coupes histologiques des rétines animaux26. OKR constitue une méthode rapide et robuste pour évaluer quantitativement la fonction visuelle.
Nombreux appareils OCT permettent simultanée balayage laser ophtalmologique (cSLO) imagerie confocale avec différentes longueurs d’onde, qui fournit des informations de diagnostic concernant les pathologies rétiniennes, c'est-à-dire, la visualisation des dépôts de lipofuscine ou des altérations de la rétine pigment épithélium27. En outre, en vivo imagerie de fluorescence étiquetés cellules chez les animaux transgéniques est possible28,29,30,31,32. Toutefois, l’application des technologies de l’OCT dans les modèles de rongeurs est toujours difficile, principalement en raison de la taille de petit oeil. Plusieurs appareils disponibles dans le commerce nécessitent des adaptations, et souvent une taille différente du titulaire est nécessaire à l’image des animaux d’espèces différentes. En outre, animaux nécessite une anesthésie pour la mesure.
OKR appareils peuvent être utilisés pour évaluer la fonction visuelle chez les rongeurs. Les animaux sont placés sur une plate-forme au centre d’un cylindre réel ou virtuel affichant un déplacement grinçant, de suivre les animaux avec tête réflexive et les mouvements du cou. Cette réponse optocinétique est réduite ou éliminée dans le cas de la réduction ou la perte de la fonction visuelle.
Ce protocole vise à présenter un manuel pour le mesurage de l’épaisseur rétinienne en utilisant un dispositif OCT commercialement disponible avec un support personnalisé offrant inhalant anesthésie. Le protocole montre comment analyser les scans de volume à l’aide du logiciel fourni par le fabricant. Pour le test visuel, vise à fournir des instructions sur la façon d’utiliser un système disponible dans le commerce pour évaluer l’OKR.
Protocole
Toutes les procédures d’animaux ont été effectuées conformément aux directives d’expérimentales approuvés par les autorités régionales (Agence nationale pour la Nature, l’environnement et la Protection des consommateurs ; référence numéro 84-02.04.2014.A059) et sont conformes à l’Association pour Recherche en Vision et Ophthalmology (ARVO) déclaration sur l’utilisation des animaux en ophtalmique et Vision Research et la directive européens 2010/63/ce relative à la protection des animaux utilisés à des fins scientifiques.
1. confocal Scanning Laser ophtalmologique-optical Coherence Tomography
Remarque : Le protocole de mesure cSLO-OCT est adaptable pour toutes les souches de rats et de souris de laboratoire.
- Préparation mise en place et l’imagerie pré
Remarque : La configuration du système de l’appareil de OCT utilisé dans le présent protocole a déjà été décrit ailleurs31. -
Préparation rongeur inhalant anesthésie
- Placer le rongeur dans une chambre à induction et mettre le vaporisateur isoflurane concentration de 2 % à 2 L/min O2.
- Vérifier si le rongeur est anesthésié par pincement de la queue, retirez-la de la chambre et l’envelopper dans une serviette en papier pour garder au chaud.
- Placer le rongeur dans le support personnalisé33 et accrocher les incisives maxillaires sur la barre de morsure intégrée de l’embout buccal, relié à l’évaporateur (isoflurane de 2,5 % à 2 L/min O2).
- Appliquer une goutte de 2.5%-Tropicamide phényléphrine 0,5 % sur chaque œil pour la dilatation pupillaire.
- Essuyez tout excès de liquide des gouttes pour les yeux après 1 min et lubrifier les yeux avec le gel ophtalmique méthyl-cellulose basée (par exemple, hypromellose 0,3 % collyre) afin d’éviter le séchage dehors et la turbidité de la cornée.
- Placer les lentilles de contact personnalisé (+ 4 dioptries) sur l’oeil de la souris à la main ou avec une pincette. Couvrir le œil de rat avec une plaque de verre (par exemple, ronde 12 mm diamètre verre couvre-objet) sans propriétés optiques pour garantir une surface plane.
Remarque : Fréquence respiratoire de moniteur pendant l’anesthésie. Augmentez ou diminuez l’Isoflurane concentration si nécessaire.
-
Mesure et analyse
Remarque : Assurez-vous d’effectuer et de signaler les mesures OCT en ligne avec les recommandations de APOSTEL34 part contrôle de la qualité selon l’OSCAR-IB consensus critères35. Que ces recommandations ont été élaborées pour les images OCT humaines, certains critères ne sont pas ou seulement partiellement applicable.- Pour le œil gauche de l’image, positionner le support tel que présenté dans la Figure 1 a à veiller à ce que l’ampoule de le œil gauche des visages rongeurs la caméra.
- Appuyez sur le bouton Démarrer dans le coin droit de l’affichage du panneau contrôle pour démarrer le mode d’acquisition.
- Placez le levier de filtre à R et sélectionnez BR + OCT pour l’imagerie du fond de œil réflectance bleue et acquisition de B-scan sur le panneau de configuration.
- Définir la distance de mise au point à environ 38 dioptries à l’aide de la molette de mise au point sur le dos de l’appareil et effectuer un zoom avant sur la rétine jusqu'à ce que l’analyse de l’OCT est visible à l’écran.
Remarque : Lors de la première mesure, le bras de référence doit être adapté pour la mesure de rongeur. Appuyez sur la combinaison Ctrl + Alt + Maj + O et ajuster la valeur du bras référence dans la fenêtre ouverte jusqu'à ce que le OCT-scan apparaît à l’écran. - Afin d’assurer un trajet optique au milieu de la pupille avec un angle orthogonale à la rétine dans tous les plans, la position du disque optique au milieu de la piste illuminée (BR) et ajuster la ligne horizontale et verticale B-scans à un niveau horizontal en rotation/rotation le titulaire (Figure 1 b) ou en déplaçant la caméra.
- Sélectionnez le mode de balayage de volume et affectez-lui 25 B-scans en mode haute résolution à 50 suivi automatique en temps réel (ART, pixellisé de 50 A-Scans en moyenne) sur l’écran du logiciel.
- Centre au milieu de la grille d’analyse de volume sur le disque optique et commencer l’acquisition en appuyant sur le bouton de sensibilité noir, puis acquérir sur le panneau de configuration.
- Placez le levier de filtre à A, sélectionnez Bleu Auto floraison (BAF) sur le panneau de commande et régler la luminosité de l’image avec le bouton de sensibilité. Appuyez sur le bouton de sensibilité, puis acquérir pour cellules fluorescentes image (par exemple, EGFP) ou dépôts fluorescent auto.
- Appliquez le gel ophtalmique sur le œil du rongeur pour prévenir la déshydratation et mettre l’animal dans une cage séparée avec une source de chaleur.
- Superviser les rongeurs jusqu'à ce qu’il est complètement remis de l’anesthésie, dans une cage séparée et logement individuel. Lorsque l’animal est ambulatoire, renvoyez-le à la cage.
- Pour l’analyse des scans volume, utilisez la segmentation automatique du logiciel de l’appareil OCT en cliquant-droit sur le scan et sélectionnez Segmentation puis Tous les calques. S’assurer que la qualité des images OCT est suffisante et de définir les seuils de qualité pour chaque série d’expériences, par exemple, > 20 décibels.
- Effectuer la correction manuelle des couches en double-cliquant sur la numérisation souhaitée, sélectionnez le Profil d’épaisseur et cliquez sur Modifier les Segmentations de couche. Sélectionnez un calque, par exemple, appuyez sur ILM pour intérieur limitant la membraneet, si nécessaire, corriger la ligne verte en déplaçant les points rouges de glisser et déposer à la position correcte.
Remarque : Veillez à ce que l’enquêteur effectuant la correction manuelle est aveuglé pendant les groupes expérimentaux. - Sélectionnez l’onglet Carte d’épaisseur et choisir le traitement précoce, 1, 2, 3 mm , de grille d’étude (ETDRS) de rétinopathie diabétique. Centrez le cercle intérieur du disque optique (Figure 2, gauche).
- Calculer l’épaisseur des couches rétiniennes des valeurs épaisseur fournies par le logiciel pour les différents secteurs rétiniens d’intérêt. Pour calculer les valeurs d’épaisseur moyenne des analyses de volume, utilisez l’entier 1, 2, 3 mm ETDRS grille, ce qui couvre un angle de 25° environ, à l’exclusion du cercle intérieur de 1 mm, qui contient du disque optique (Figure 2, droite).
- Effectuer l’analyse statistique en utilisant le logiciel adéquat. Si les deux yeux d’un animal est inclus, envisager une comptabilité de modèle statistique pour dans les corrélations inter-oeil sujet (p. ex., des équations d’estimation généralisées ou mixtes modèles linéaires), comme les yeux d’un sujet sont statistiquement dépendantes36 .
2. réponse optocinétique
Remarque : Par la suite, est fourni un manuel détaillé pour les mesures OKR des souris et des rats, qui peut être adapté aux besoins spécifiques de chacun.
-
Mise en place et mesure préalable de préparations
- Allumez l’ordinateur. Après que le système a démarré, tourner sur les écrans de la chambre d’essai tel que décrit plus en détail ailleurs37.
- Sélectionnez une plate-forme appropriée pour la mesure des rats ou des souris.
Remarque : La taille de la plate-forme est sélectionnée selon la taille du corps du rongeur. L’animal doit être en mesure de s’asseoir correctement sur la plate-forme sans la possibilité de se promener. - Ouvrez la fenêtre de préréglages en double-cliquant sur le logiciel, sélectionnez nouveau groupe et choisissez le nom du groupe, le nombre de sujets, les espèces et les souches. Sélectionnez un stimulus variable : fréquence spatiale/temporelle, de sensibilité au contraste, de vitesse ou d’orientation dans le menu déroulant, puis appuyez sur Créer un nouveau groupe.
- Mettre l’accent sur la plate-forme en manipulant la bague de mise au point de la caméra sur le dessus de la chambre et de calibrer le système en alignant (glisser / déplacer) le cercle rouge autour du cercle noir sur la plate-forme.
-
Mesure et analyse
- Placez l’animal sur la plate-forme, laissez-le s’adapter à l’environnement pendant environ 5 min. soulever l’animal en arrière sur la plate-forme si elle tombe (Figure 3 a).
- Sélectionnez le numéro de l’objet et l’état sur le coin supérieur droit de l’écran du logiciel (Figure 3 b). Un stimulus est variable, les autres stimuli sont gardés constants. Ceci est confirmé par le symbole cadenas ouvert ou fermé serrure à côté de la stimulation.
- Démarrer mesure en sélectionnant ◄ pour Oui ou ■ No, si l’animal suit ou ne suit pas, respectivement.
Remarque : Suivi dans le sens horaire correspond à la gauche et vers la gauche suivi à le œil droit. Le logiciel change au hasard la direction de la grille mobile. - Sélectionnez la taille de palier du stimulus manuellement en cliquant sur les flèches vers le haut et vers le bas à côté de l’impulsion variable ou laissez-le s’adapter automatiquement par le logiciel, si le seuil de stimulation converge.
- Pour des résultats optimaux, animer l’animal, , par exemple, en haut siffler sons et découpage, en cliquant sur le symbole de la boîte noire ou blanche sur l’écran du logiciel. Effectuer ces actions à plusieurs reprises dans le cas des mesures prolongées.
- Pour l’analyse de données, sélectionnez l’onglet résumé et cliquez sur fichier | Tableau/graphique d’exporter pour exporter l’ensemble de données désiré.
- Effectuer l’analyse statistique en utilisant le logiciel désiré (voir aussi l’étape 1.3.15).
Résultats
En utilisant l’imagerie de OCT 3rd génération peptide de la myéline oligodendrocyte glycoprotéine (MOG) induit des modèles de souris de l’encéphalomyélite allergique expérimentale (EAE), haute résolution sections morphologiques de la rétine de souris ont été obtenues. Grâce à cette technologie, les capacités de protection des différentes substances ont été démontrées17. Les valeurs d’épaisseur des couches rétiniennes internes (IRL) obtenues sont en bon accord avec le nombre de cellules ganglionnaires rétiniennes (RGC) obtenues par coloration histologique de la rétine wholemounts (Figure 4).
OKR surveillance fournit une lecture fonctionnelle de la neurodégénérescence vu par OCT. Dans ces expériences, fonction visuelle évalués comme fréquence spatiale par OKR et dystrophies dommages évalués comme IRL amincissement par OCT, étaient en corrélation étroite17. Différents protocoles peuvent être utilisés pour examiner l’acuité visuelle en changeant la fréquence spatiale ou temporelle, la sensibilité au contraste, l’orientation ou la vitesse de la grille mobile. Dans le modèle de l’EAE, une fréquence spatiale améliorée de 0,05 cycles/degré (c/d) des animaux traités avec la substance 1 a été détectée par rapport aux souris non traitées de MOG-EAE (Figure 5).

Figure 1 : support personnalisé pour la mesure de l’OCT. (A) OCT imagerie de souris C57BL/6J en utilisant le support personnalisé33 et (B) l’axe de rotation autour de le œil de rongeur. Rotation dans le plan transversal (à gauche) et dans le plan axial (à droite) est démontrée. Ce chiffre a été modifié par Dietrich, M. Al.33. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
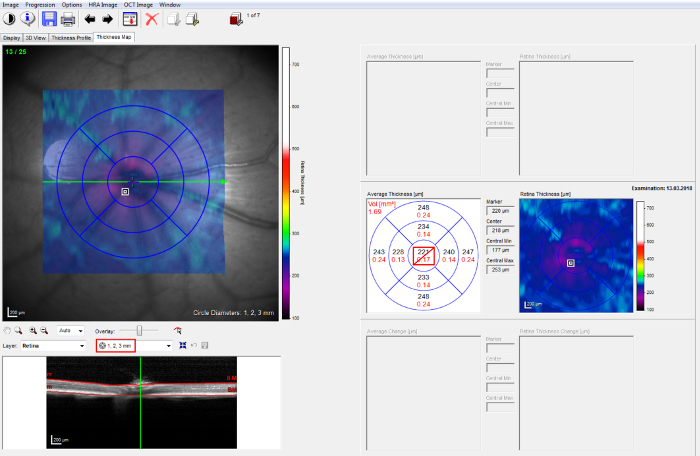
Figure 2 : OCT après analyse de l’acquisition. « 1, 2, 3 mm » grille ETDRS sur le protocole de volume B-scan 25 (à gauche). L’épaisseur des couches rétiniennes est fournie pour les différents secteurs rétiniens par le logiciel (à droite). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
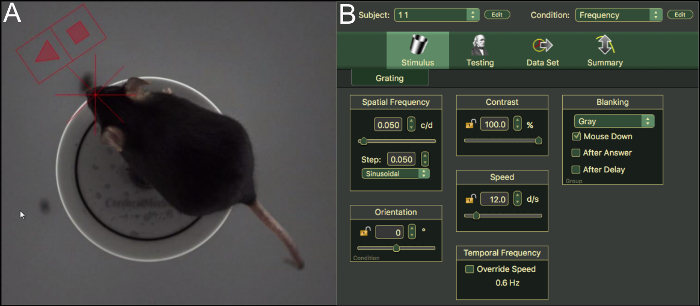
Figure 3 : mesure OKR des souris et des stimulus paramètres. Haut (A) découvre à travers la caméra analyse une souris C57BL/6J sur la plate-forme dans la chambre. (B) l’interface utilisateur et les paramètres du logiciel OKR. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
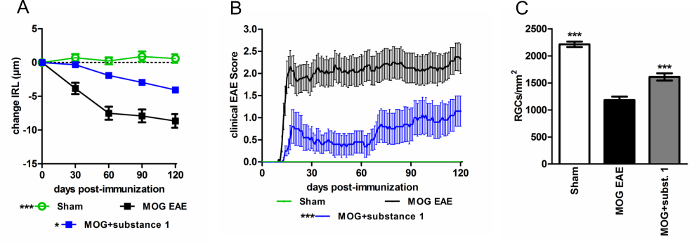
Figure 4 : souris C57BL/6J avec MOG EAE montrent une évolution de la maladie atténué lorsque traitée avec substance 1 par rapport aux témoins non traités. (A), la dégénérescence des couches rétiniennes internes est réduite (B) et la clinique score EAE est atténuée au cours de l’EAE lorsqu’on a administré la substance 1. Souris ont été marqués par jour, et OCT mesures ont été effectuées tous les mois sur une période de 120 jours. Les graphiques représentent la moyenne et l’écart-type d’au moins dix animaux par groupe. (*p < 0,05, ***p < 0,001, aire sous la courbe comparée par analyse de la variance avec les post-hoc test de Dunnett). (C) le changement d’épaisseur IRL est en bon accord avec perte RGC (***p < 0,001, par analyse de la variance avec post-hoc test de Dunnett, par rapport aux souris non traitée de MOG). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
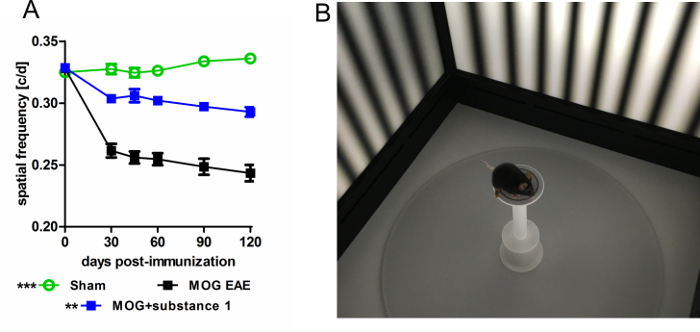
Figure 5 : mesure OKR de souris C57BL/6J avec MOG-EAE. (A), OKR révèle une acuité visuelle améliorée d’animaux traitée avec la substance 1 par rapport aux souris non traitées de MOG EAE mesurées par seuil de fréquence spatiale stable sur une période de 120 jours. Les graphiques représentent la moyenne et l’écart-type d’au moins six animaux par groupe (**p < 0,01, ***p < 0,001, aire sous la courbe comparée par analyse de la variance avec les post-hoc test de Dunnett). (B) Image de souris C57BL/6J dans la chambre d’essai. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce protocole prévoit une instruction pour les mesures d’épaisseur et l’examen de la fonction visuelle chez les rongeurs. Les affichages visuels sont de plus en plus utilisés dans la recherche translationnelle18,26,38,39,40 et sont facilement transférables aux essais cliniques. L’avantage considérable d’OCT par rapport aux enquêtes histologiques lors des expérimentations animales, c’est que les analyses longitudinales sont possibles permettant l’étude des processus pathologiques dynamiques, largement réduire la variabilité et le nombre de animaux nécessaires par l’étude. En outre, imagerie in vivo avec OCT n’est pas sous réserve de la fixation, coupe ou coloration des artefacts qui peuvent influer sur l’épaisseur de la couche dans les études histologiques.
Cependant, l’orientation orthogonale du faisceau laser sur tous les plans par rapport à la rétine est une étape essentielle pour assurer la qualité et la reproductibilité des valeurs d’épaisseur. Il nécessite une formation de l’enquêteur et est obligatoire avant l’acquisition de scans d’OCT. En outre, comme les appareils commerciaux sont construits à des applications humaines, la qualité des images de OCT rongeurs est reste inférieure par rapport à B-scans de patients humains. Dans l’expérience des auteurs, il peut être difficile de distinguer la rétine interne différente couches (couche des fibres nerveuses rétiniennes, couche de cellules de ganglion et couche plexiforme interne) au cours de la correction manuelle. Nous recommandons donc d’analyser ces couches comme une lecture composée (IRL).
Le montage expérimental offre une option d’anesthésie volatile, par exemple, inhalant isoflurane, qui est, selon notre expérience, plus sûre et plus facile à contrôler que l’anesthésie injectable, par exemple, la kétamine-xylazine41,42 et réduit le risque du réveil prématuré des rongeurs en cas d’acquisition plus longue temps (par exemple, lors de l’exécution de l’imagerie de cellules marquées fluorescent). Dans une étude préliminaire, les scans du volume ont été identifiés comme les protocoles la validité plus élevée et la fiabilité. La fiabilité de contre-essai inter-évaluateurs et test était excellente lorsque les analyses de volume à l’exclusion de la partie centrale contenant du disque optique ont été évaluées avec les valeurs (coefficient de corrélation intraclasse) ICC au-dessus de 0,85 pour toutes les évaluations.
La mesure de la réponse optocinétique est basée sur le réflexe involontaire optocinétique, qui se produit en réponse à un champ sans cesse en mouvement. Chez les rongeurs, contrairement aux autres espèces, le mouvement implique non seulement les yeux, mais toute la tête, qui peut facilement être détectée à l’aide de la caméra.
Faire la distinction entre « suivi » ou normale des mouvements comportementales des animaux exige une formation de l’enquêteur, et il est important d’être aveuglé pour le groupe expérimental. En outre, les animaux ont besoin d’une phase d’adaptation pour accueillir la création expérimentale et pendant les protocoles de mesure depuis longtemps, les animaux doivent être animé à plusieurs reprises pour s’assurer que « aucun suivi » n’est due à atteindre le seuil des OKR et ne pas à une diminution de attention. Il y a aussi une variabilité importante souche au sujet de la fonction visuelle du laboratoire souris et les rats43,44. L’acuité visuelle du rongeur doit donc être évaluée avant ils sont testés et certaines souches, tels que des souris SJL, même peut-être pas adaptés aux mensurations OKR, car ils sont homozygotes pour l’allèle Pde6brd1 (dégénérescence rétinienne 1).
En résumé, l’examen de la rétine morphologie et fonction visuelle dans des modèles animaux permet d’enquêtes non invasif et longitudinales des dommages structuraux et fonctionnels qui se produisent dans le contexte de l’EAE et peut être utile dans d’autres modèles impliquant le visuel système, y compris mais non limité aux modèles des rétinopathies ou de lésions du nerf optique.
Déclarations de divulgation
Le travail présenté sans lien avec que les auteurs déclarent les informations financières suivantes :
Michael Dietrich a reçu des honoraires de haut-parleur de Novartis. Andrés Cruz-Herranz est un stagiaire postdoctoral de la National Multiple Sclerosis Society. Ari J. Green a siégé au Conseil scientifique de MedImmune, Novartis, OCTIMS, création 5 Biosciences et Bionure ; est rédactrice adjointe du JAMA neurologie ; a été membre du conseil éditorial de neurologie ; est titulaire d’un brevet pour les molécules de la remyélinisation et voies ; consulté au sujet de la création 5 Sciences ; recherche reçu soutien de Novartis Pharma OCTIMs, création Sciences SRA, NINDS, NIA, National multiple Sclerosis Society, Sherak Foundation et la Fondation Hilton ; est titulaire d’actions ou stock-options en création 5 ; et a servi comme témoin expert à Mylan v Teva Pharma. Hans-Peter Hartung bénéficie d’honoraires pour siéger à des comités directeurs de Biogen Idec, GeNeuro, Sanofi Genzyme, Merck, Novartis Pharmaceuticals, Octapharma, Opexa Therapeutics, Teva Pharmaceuticals, MedImmune, Bayer HealthCare, avance Pharma, et Roche, les droits d’avoir siégé sur des comités consultatifs de Biogen Idec, Sanofi Genzyme, Merck, Novartis Pharmaceuticals, Octapharma, Opexa Therapeutics, Teva Pharmaceuticals et Roche et conférence de Biogen Idec, Sanofi Genzyme, Merck, Novartis Pharmaceuticals , Octapharma, Opexa Therapeutics, Teva Pharmaceuticals, MedImmune et Roche. Philipp Albrecht a reçu une indemnisation pour siéger à des comités consultatifs scientifiques pour Ipsen, Novartis, Biogen ; Il a reçu des honoraires de haut-parleur et parcourez le soutien de Novartis, Teva, Biogen, Merz Pharmaceuticals, Ipsen, Allergan, Bayer Healthcare, Esai, UCB et Glaxo Smith Kline ; Il a reçu le soutien à la recherche de Novartis, Biogen, Teva, Merz Pharmaceuticals, Ipsen et Roche. Les autres auteurs ne rapportent aucune divulgation.
Remerciements
Ce travail a été soutenu par des subventions de la Fondation Dr Robert Pfleger Ilselore Luckow-fondation, ainsi que Biogen et Novartis à pa Figure 1 b a été reproduite de « manipulateurs positionnels confiné pour l’imagerie oculaire de rats et de souris anesthésiés : un guide de bricolage. Dietrich, M., Cruz-Herranz, A., Yiu, Aktas, O., Brandt, A. U., H., Hartung, HP., Green, A., Albrecht, P. BMJ ophtalmologie ouverte. 1 (1), e000008, 2017" avec la permission du BMJ Publishing Group Ltd.
matériels
| Name | Company | Catalog Number | Comments |
| Heidelberg Spectralis HRA+OCT system | Heidelberg Engineering, Germany | N/A | ophthalmic imaging platform system |
| Heidelberg Eye Explorer | Heidelberg Engineering, Germany | N/A | Version 1.9.10.0 |
| blue 25D non-contact lens | Heidelberg Engineering, Germany | N/A | lens for rodent mesurement |
| OptoMotry | CerebralMechanics Inc., Canada | N/A | system for visual function analysis |
| OptoMorty HD software | CerebralMechanics Inc., Canada | N/A | Version 2.1.0 |
| Inhalation Anesthetic Isoflurane | Piramal Critical Care, Bethlehem, PA, USA | 803250 | inhalation anesthetic |
| Phenylephrin 2.5%-Tropicamide 0.5% | University Hospital Düsseldorf, Germany | N/A | pupillary dilation |
| Visc-Ophtal | Dr. Robert Winzer Pharma GmbH, Berlin, Germany | 58407 | ophthalmologic eye gel |
| GraphPad Prism | GraphPad Software Inc, San Diego, CA, USA | N/A | statistical analysis software, Version 5.00 |
| IBM SPSS Statistics | IBM Corporation, Armonk, New York, USA | N/A | statistical analysis software, Version 20 |
Références
- Folgar, F. A., Jaffe, G. J., Ying, G. -. S., Maguire, M. G., Toth, C. A. Comparison of optical coherence tomography assessments in the comparison of age-related macular degeneration treatments trials. Ophthalmology. 121 (10), 1956-1965 (2014).
- Mowatt, G., et al. Optical coherence tomography for the diagnosis, monitoring and guiding of treatment for neovascular age-related macular degeneration: a systematic review and economic evaluation. Health Technology Assessment. 18 (69), 1-254 (2014).
- Schlanitz, F. G., et al. Identification of Drusen Characteristics in Age-Related Macular Degeneration by Polarization-Sensitive Optical Coherence Tomography. American Journal of Ophthalmology. 160 (2), 335-344 (2015).
- Makiyama, Y., et al. Prevalence and spatial distribution of cystoid spaces in retinitis pigmentosa: investigation with spectral domain optical coherence tomography. Retina. 34 (5), 981-988 (2014).
- Al Rashaed, S., Khan, A. O., Nowilaty, S. R., Edward, D. P., Kozak, I. Spectral-domain optical coherence tomography reveals prelaminar membranes in optic nerve head pallor in eyes with retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology. 22, (2015).
- Albrecht, P., et al. Retinal pathology in idiopathic moyamoya angiopathy detected by optical coherence tomography. Neurology. 85 (6), 521-527 (2015).
- Albrecht, P., Fröhlich, R., Hartung, H. -. P., Kieseier, B. C., Methner, A. Optical coherence tomography measures axonal loss in multiple sclerosis independently of optic neuritis. Journal of Neurology. 254 (11), 1595-1596 (2007).
- Albrecht, P., et al. Retinal neurodegeneration in Wilson's disease revealed by spectral domain optical coherence tomography. PLoS One. 7 (11), e49825 (2012).
- Albrecht, P., et al. Optical coherence tomography in parkinsonian syndromes. PLoS One. 7 (4), e34891 (2012).
- Albrecht, P., et al. Degeneration of retinal layers in multiple sclerosis subtypes quantified by optical coherence tomography. Multiple Sclerosis Journal. 18 (10), 1422-1429 (2012).
- Bhaduri, B., et al. Detection of retinal blood vessel changes in multiple sclerosis with optical coherence tomography. Biomedical Optics Express. 7 (6), 2321-2330 (2016).
- Knier, B., et al. Optical coherence tomography indicates disease activity prior to clinical onset of central nervous system demyelination. Multiple Sclerosis Journal. 22 (7), 893-900 (2016).
- Ringelstein, M., et al. Subtle retinal pathology in amyotrophic lateral sclerosis. Annals of Clinical and Translational Neurology. 1 (4), 290-297 (2014).
- Ringelstein, M., et al. Retinal pathology in Susac syndrome detected by spectral-domain optical coherence tomography. Neurology. 85 (7), 610-618 (2015).
- Satue, M., et al. Relationship between Visual Dysfunction and Retinal Changes in Patients with Multiple Sclerosis. PLoS One. 11 (6), e0157293 (2016).
- Thomson, K. L., Yeo, J. M., Waddell, B., Cameron, J. R., Pal, S. A systematic review and meta-analysis of retinal nerve fiber layer change in dementia, using optical coherence tomography. Alzheimer's & Dementia. 1 (2), 136-143 (2015).
- Dietrich, M., et al. Early alpha-lipoic acid therapy protects from degeneration of the inner retinal layers and vision loss in an experimental autoimmune encephalomyelitis-optic neuritis model. Journal of Neuroinflammation. 15 (1), 71 (2018).
- Knier, B., et al. Neutralizing IL-17 protects the optic nerve from autoimmune pathology and prevents retinal nerve fiber layer atrophy during experimental autoimmune encephalomyelitis. Journal of Autoimmunity. 56, 34-44 (2014).
- Augustin, M., et al. In Vivo Characterization of Spontaneous Retinal Neovascularization in the Mouse Eye by Multifunctional Optical Coherence Tomography. Investigative Ophthalmology & Visual Science. 59 (5), 2054-2068 (2018).
- Tode, J., et al. Thermal Stimulation of the Retina Reduces Bruch's Membrane Thickness in Age Related Macular Degeneration Mouse Models. Translational Vision Science & Technology. 7 (3), 2 (2018).
- Gabriele, M. L., et al. Optic nerve crush mice followed longitudinally with spectral domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 52 (5), 2250-2254 (2011).
- Carpenter, C. L., Kim, A. Y., Kashani, A. H. Normative Retinal Thicknesses in Common Animal Models of Eye Disease Using Spectral Domain Optical Coherence Tomography. Advances in Experimental Medicine and Biology. 1074, 157-166 (2018).
- Alam, N. M., et al. A mitochondrial therapeutic reverses visual decline in mouse models of diabetes. Disease Models & Mechanisms. 8 (7), 701-710 (2015).
- Bricker-Anthony, C., Rex, T. S. Neurodegeneration and Vision Loss after Mild Blunt Trauma in the C57Bl/6 and DBA/2J Mouse. PLoS One. 10 (7), e0131921 (2015).
- Segura, F., et al. Assessment of Visual and Chromatic Functions in a Rodent Model of Retinal Degeneration. Investigative Ophthalmology & Visual Science. 56 (11), 6275-6283 (2015).
- Fischer, M. D., et al. Noninvasive, in vivo assessment of mouse retinal structure using optical coherence tomography. PLoS One. 4 (10), e7507 (2009).
- Ward, M. E., et al. Individuals with progranulin haploinsufficiency exhibit features of neuronal ceroid lipofuscinosis. Science Translational Medicine. 9 (385), (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), e40352 (2012).
- Lidster, K., et al. Neuroprotection in a novel mouse model of multiple sclerosis. PLoS One. 8 (11), e79188 (2013).
- Munguba, G. C., et al. Nerve fiber layer thinning lags retinal ganglion cell density following crush axonopathy. Investigative Ophthalmology & Visual Science. 55 (10), 6505-6513 (2014).
- Kokona, D., Jovanovic, J., Ebneter, A., Zinkernagel, M. S. In Vivo Imaging of Cx3cr1gfp/gfp Reporter Mice with Spectral-domain Optical Coherence Tomography and Scanning Laser Ophthalmoscopy. Journal of Visualized Experiments. (129), (2017).
- Leung, C. K. S., et al. In vivo imaging of murine retinal ganglion cells. Journal of Neuroscience Methods. 168 (2), 475-478 (2008).
- Dietrich, M., et al. Whole-body positional manipulators for ocular imaging of anaesthetised mice and rats: A do-it-yourself guide. BMJ Open Ophthalmology. 1 (1), e000008 (2017).
- Cruz-Herranz, A., et al. The APOSTEL recommendations for reporting quantitative optical coherence tomography studies. Neurology. 86 (24), 2303-2309 (2016).
- Tewarie, P., et al. The OSCAR-IB consensus criteria for retinal OCT quality assessment. PLoS One. 7 (4), e34823 (2012).
- Fan, Q., Teo, Y. -. Y., Saw, S. -. M. Application of advanced statistics in ophthalmology. Investigative Ophthalmology & Visual Science. 52 (9), 6059-6065 (2011).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Groh, J., Stadler, D., Buttmann, M., Martini, R. Non-invasive assessment of retinal alterations in mouse models of infantile and juvenile neuronal ceroid lipofuscinosis by spectral domain optical coherence tomography. Acta Neuropathologica Communications. 2, 54 (2014).
- Seeliger, M. W., et al. In vivo confocal imaging of the retina in animal models using scanning laser ophthalmoscopy. Vision Research. 45 (28), 3512-3519 (2005).
- Shindler, K. S., Guan, Y., Ventura, E., Bennett, J., Rostami, A. Retinal ganglion cell loss induced by acute optic neuritis in a relapsing model of multiple sclerosis. Multiple Sclerosis Journal. 12 (5), 526-532 (2006).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
- Szczesny, G., Veihelmann, A., Massberg, S., Nolte, D., Messmer, K. Long-term anaesthesia using inhalatory isoflurane in different strains of mice-the haemodynamic effects. Zeitschrift für mikroskopisch-anatomische Forschung. 38 (1), 64-69 (2004).
- Prusky, G. T., Harker, K., Douglas, R. M., Whishaw, I. Q. Variation in visual acuity within pigmented, and between pigmented and albino rat strains. Behavioural Brain Research. 136 (2), 339-348 (2002).
- Wong, A. A., Brown, R. E. Visual detection, pattern discrimination and visual acuity in 14 strains of mice. Genes, Brain, and Behavior. 5 (5), 389-403 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon