Method Article
Tramite tomografia ottica di coerenza e risposta Optokinetic come strutturale e funzionale sistema visivo letture in topi e ratti
In questo articolo
Riepilogo
Un protocollo dettagliato per la valutazione delle letture strutturali e visivi in roditori dalla risposta di tomografia e optokinetic ottica di coerenza è presentato. I risultati forniscono informazioni preziose per la ricerca oftalmologica, nonché neurologica.
Abstract
Tomografia a coerenza ottica (OCT) è una tecnica veloce, non invasivo, interferometrica permettendo di imaging ad alta risoluzione della retina. È uno strumento ideale per lo studio dei processi di neurodegenerazione, neuroprotezione e neuro-riparazione che coinvolgono il sistema visivo, come questi spesso correlano bene con cambiamenti retinici. Come una lettura funzionale, visivamente evocato occhio compensativo e movimenti della testa sono comunemente usati nei modelli sperimentali che coinvolgono la funzione visiva. La combinazione di entrambe le tecniche consente un'indagine quantitativa in vivo della struttura e funzione, che può essere utilizzato per indagare le condizioni patologiche o per valutare il potenziale di nuove terapie. Un grande vantaggio delle tecniche proposte è la possibilità di eseguire analisi longitudinale che consente lo studio dei processi dinamici, riduzione della variabilità e riduce il numero di animali necessari per gli esperimenti. Il protocollo descritto mira a fornire un manuale per acquisizione e analisi di scansioni di alta qualità della retina di topi e ratti utilizzando un supporto personalizzato basso costo con un'opzione per fornire anestesia inalatoria. Inoltre, la guida proposta è da intendersi come un manuale di istruzioni per i ricercatori che usando analisi di risposta (OKR) optocinetico nei roditori, che possono essere adattati ai loro specifici bisogni e interessi.
Introduzione
L'esame della via visiva, come parte del sistema nervoso centrale, ha dimostrato di essere un efficace punto di partenza nell'affrontare non solo oftalmologici1,2,3,4,5 , ma anche neurologico6,7,8,9,10,11,12,13,14 ,15,16 domande. Negli ultimi anni, OCT e OKR sono stati identificati come utili strumenti analitici, non invasivo per valutare una grande varietà di retinopatie e manifestazioni retiniche in vari modelli del roditore17,18,19 , 20 , 21 , 22 , 23 , 24 , 25. OCT permette veloci e ad alta risoluzione in vivo della morfologia retinica e struttura in topi e ratti, con risultati in buon accordo con le sezioni istologiche delle retine animali26. OKR costituisce un metodo veloce e robusto per valutare quantitativamente la funzione visiva.
Molti dispositivi di OCT consentono simultanea confocale imaging oftalmoscopia (cSLO) in scansione laser con diverse lunghezze d'onda, che fornisce informazioni diagnostiche sulle patologie retiniche, vale a dire, visualizzazione dei depositi di lipofuscin o alterazioni di retinico Pigmento epitelio27. Inoltre, in vivo imaging di fluorescenza etichettati cellule in animali transgenici è possibile28,29,30,31,32. Tuttavia, l'applicazione della tecnologia OCT nei modelli del roditore è ancora difficile, principalmente a causa delle dimensioni di piccolo occhio. Dispositivi disponibili in commercio diversi richiedono adattamenti e spesso per gli animali di specie diverse di immagine è necessaria una dimensione diversa del titolare. Inoltre, gli animali richiedono anestesia per la misurazione.
OKR dispositivi possono essere utilizzati per valutare la funzione visiva nei roditori. Gli animali sono posti su una piattaforma al centro di una bombola di reale o virtuale visualizzati da un movimento grati, che traccia gli animali con testa riflessivo e movimenti del collo. Questa risposta optokinetic è ridotto o eliminata in caso di riduzione o perdita della funzione visiva.
L'obiettivo di questo protocollo è di presentare un manuale per la misurazione dello spessore retinico utilizza un dispositivo di OCT disponibile in commercio con un supporto personalizzato fornendo anestesia inhalant. Il protocollo di seguito viene illustrato come analizzare volume scansioni utilizzando il software fornito dal produttore. Per testing visivo, l'obiettivo è di fornire istruzioni su come utilizzare un sistema disponibile in commercio per valutare l'OKR.
Protocollo
Animale tutte le procedure sono state eseguite in conformità con le linee guida sperimentale approvate dalle autorità regionali (Agenzia di stato per natura, ambiente e protezione dei consumatori; riferimento numero 84-02.04.2014.A059) e sono conformi all'associazione per Ricerca in visione e Oftalmologia (ARVO) istruzione per l'uso degli animali in oftalmica e Vision Research e la direttiva europea 2010/63/UE sulla protezione degli animali utilizzati a fini scientifici.
1. confocale scansione Laser oftalmoscopia-optical Coherence Tomography
Nota: Il protocollo per la misura cSLO-OCT è adattabile per tutti i ceppi di ratti e topi di laboratorio.
- Set-up e pre-imaging preparati
Nota: La configurazione di sistema del dispositivo OCT utilizzato in questo protocollo è già stato descritto altrove31. -
Preparazione del roditore per anestesia inhalant
- Posizionare il roditore in un'aula di induzione e impostare il vaporizzatore ad una concentrazione di isoflurane del 2% a 2 L/min O2.
- Verifica se il roditore è anestetizzato pizzicando la coda, rimuoverlo dall'alloggiamento e avvolgerlo in un tovagliolo di carta per tenerlo caldo.
- Posizionare il roditore in supporto personalizzato33 e gancio incisivi maxillary sulla barra integrata morso del pezzo bocca, collegato al vaporizzatore (2,5% isoflurane a 2 L/min O2).
- Applicare una goccia di fenilefrina 2.5%-Tropicamide 0,5% su ogni occhio per la dilatazione pupillary.
- Asciugare il liquido in eccesso di collirio dopo 1 min e lubrificare gli occhi con gel oftalmico basata di metil-cellulosa (ad es., ipromellosa 0,3% collirio) per evitare l'essiccamento fuori e torbidità della cornea.
- Posizionare personalizzato lente a contatto (+ 4 diottrie) sull'occhio del mouse a mano o usando il forcipe. Coprire l'occhio del ratto con una lastra di vetro (ad es., tondo 12mm diametro vetrino coprioggetti) senza proprietà ottiche per garantire una superficie piana.
Nota: Frequenza respiratoria di monitor durante l'anestesia. Aumentare o diminuire la concentrazione di Isoflurane se necessario.
-
Misurazione e analisi
Nota: Assicurarsi di eseguire e segnalare le misurazioni OCT in linea con le raccomandazioni di APOSTEL34 ed eseguire il controllo di qualità secondo i criteri di consenso OSCAR-IB35. Come queste raccomandazioni sono state sviluppate per immagini OCT umane, alcuni criteri non sono o solo parzialmente applicabile.- Per l'occhio sinistro di immagine, posizionare il titolare come presentato in Figura 1A per garantire che il bulbo oculare sinistro delle facce del roditore della fotocamera.
- Premere il pulsante Start nell'angolo destro del display del pannello di controllo per avviare la modalità di acquisizione.
- Impostare la leva di filtro R e selezionare BR + OCT per riflettanza blu del fondo imaging e acquisizione di B-scan sul pannello di controllo.
- Impostare la distanza di messa a fuoco a circa 38 diottrie utilizzando la manopola di messa a fuoco sul retro della fotocamera e zoom sulla retina fino a quando la scansione OCT è visibile sullo schermo.
Nota: Presso la prima misurazione, il braccio di riferimento dovrà essere adattata per misura del roditore. Premere la combinazione Ctrl + Alt + Maiusc + O e regolare il valore del braccio di riferimento nella finestra aperta fino a OCT-scansione appare sullo schermo. - Per garantire un percorso ottico attraverso il centro della pupilla con un angolo ortogonale alla retina in tutti i piani, posizionare il disco ottico nel mezzo del campo illuminato (BR) e regolare la linea orizzontale e verticale B-Scan ad un livello orizzontale di rotazione/tornitura il titolare (Figura 1B) o lo spostamento della telecamera.
- Selezionare la modalità di scansione del volume e impostarlo su 25 B-scansioni in modalità ad alta risoluzione al monitoraggio in tempo reale automatica 50 (arte, rasterizzata da 50 Media A-Scan) sulla schermata del software.
- Centro al centro della griglia scansione volume su disco ottico e avviare acquisizione premendo la manopola di sensibilità nero e quindi acquisire il pannello di controllo.
- Impostare la leva di filtro ad A, selezionare Blu Auto Florescence (BAF) sul pannello di controllo e regolare la luminosità dell'immagine con la manopola della sensibilità. Premere la manopola della sensibilità e quindi acquisire per cellule fluorescenti di immagine (ad es., EGFP) o depositi fluorescente auto.
- Applicare il gel oftalmico sull'occhio del roditore per prevenire la disidratazione e mettere l'animale in una gabbia separata con una fonte di calore.
- Sorvegli il roditore finché è completamente recuperato dall'anestesia, in una gabbia separata e alloggiato individualmente. Quando l'animale è ambulatoriale, tornare alla gabbia a casa.
- Per l'analisi delle scansioni di volume, utilizzare la segmentazione automatizzata del software del dispositivo OCT facendo clic destro sulla scansione e selezionare segmentazione poi Tutti i livelli. Assicurarsi che la qualità delle immagini OCT è sufficiente e definire i tagli di qualità per ogni serie di esperimenti, per esempio, > 20 decibel.
- Eseguire la correzione manuale degli strati facendo doppio clic sull'esplorazione desiderata, selezionare Spessore profilo e fare clic su Edit Layer segmentazioni. Selezionare un livello, ad esempio, premere ILM per la membrana limitante internae, se necessario, correggere la riga verde spostando i puntini rossi di trascinamento della selezione nella posizione corretta.
Nota: Verificare che lo sperimentatore eseguendo la correzione manuale è accecato per i gruppi sperimentali. - Selezionare la scheda Mappa spessore e scegliere il trattamento precoce di 1, 2, 3 mm di griglia di studio (ETDRS) di retinopatia diabetica. Centro cerchio interno su disco ottico (Figura 2, sinistra).
- Calcolare lo spessore degli strati retinici dai valori di spessore forniti dal software per i diversi settori della retina di interesse. Per calcolare i valori di spessore medio da volume scansioni, utilizzare tutta la 1, 2, griglia ETDRS di 3 mm, che copre un angolo di circa 25°, escludendo il cerchio interno 1 mm, che contiene il disco ottico (Figura 2, destra).
- Eseguire l'analisi statistica usando software adeguato. Se entrambi gli occhi di un animale sono inclusi, si consideri una contabilità modello statistico all'interno di correlazioni Inter-occhio oggetto (ad esempio, generalizzato equazioni di stima o misto modelli lineari), come gli occhi di un soggetto sono statisticamente dipendenti36 .
2. Optokinetic risposta
Nota: Di seguito viene fornito un manuale dettagliato per misurazioni OKR di topi e ratti, che può essere adattato alle esigenze specifiche.
-
Preparazioni pre-misura e set-up
- Accendere il computer. Una volta avviato il sistema, attivare le schermate della camera test come descritto più dettagliatamente altrove37.
- Selezionare una piattaforma adatta per la misurazione di topi o ratti.
Nota: La dimensione della piattaforma è selezionata in base alla dimensione del corpo del roditore. L'animale deve essere in grado di sedersi correttamente sulla piattaforma senza la possibilità di muoversi a piedi. - Aprire la finestra delle pre-impostazioni facendo doppio clic sul software, selezionare nuovo gruppo e scegliete il nome del gruppo, il numero di soggetti, la specie e ceppi. Selezionare un variabile stimolo: frequenza spaziale/temporale, sensibilità al contrasto, velocità o orientamento nel menu a discesa, quindi premere Crea nuovo gruppo.
- Concentrarsi sulla piattaforma di manipolare la ghiera di messa a fuoco della fotocamera sulla parte superiore della camera e calibrare il sistema di allineamento (trascinamento) il cerchio rosso intorno al cerchio nero sulla piattaforma.
-
Misurazione e analisi
- Posizionare l'animale sulla piattaforma, lasciarlo di adattarsi all'ambiente per ~ 5 min Lift l'animale indietro sulla piattaforma se si scende (Figura 3A).
- Selezionare oggetto numero e condizione l'angolo superiore destro della schermata del software (Figura 3B). Uno stimolo è variabile, gli altri stimoli vengono mantenuti costanti. Ciò è confermato dal simbolo lucchetto aperto o lucchetto chiuso accanto lo stimolo.
- Avviare la misurazione selezionando ◄ per Sì o ■ per No, se l'animale o brani non tiene traccia, rispettivamente.
Nota: Rilevamento in senso orario corrisponde per il tracciamento di sinistro ed in senso antiorario per l'occhio destro. Il software cambia in modo casuale la direzione della griglia mobile. - Selezionare le dimensioni di passaggio dello stimolo manualmente facendo clic sulle frecce su e giù accanto lo stimolo variabile o lasciarlo adattare automaticamente dal software, se la soglia di stimolo converge.
- Per risultati ottimali, animare l'animale, ad es., alta fischi suoni e tranciatura, cliccando sul simbolo di scatola nera o bianca sulla schermata del software. Eseguire queste azioni ripetutamente in caso di misurazioni prolungate.
- Per l'analisi dei dati, selezionare la scheda di Riepilogo e fare clic su File | Grafico/tabella di esportazione per esportare il set di dati desiderato.
- Eseguire l'analisi statistica utilizzando il software desiderato (Vedi anche punto 1.3.15).
Risultati
Facendo uso di 3rd generazione OCT imaging nel peptide di myelin oligodendrocyte glycoprotein (MOG) indotto da modelli murini di encefalomielite autoimmune sperimentale (EAE), sezioni ad alta definizione morfologiche della retina di topo sono stati ottenuti. Utilizzando questa tecnologia, la capacità protettiva di diverse sostanze erano dimostrata17. I valori di spessore degli strati retinici interni (IRL) ottenuti sono in buon accordo con i numeri delle cellule retiniche del ganglio (RGC) ottenute dalla macchiatura istologici di wholemounts retinica (Figura 4).
OKR monitoraggio consente una lettura funzionale del neurodegeneration visto da OCT. In questi esperimenti, funzione visiva valutata come frequenza spaziale da OKR e neuroaxonal danno valutato come IRL assottigliamento di OCT, erano in stretta correlazione17. Vari protocolli possono essere impiegate per esaminare l'acuità visiva modificando la frequenza spaziale o temporale, la sensibilità al contrasto, l'orientamento o la velocità della griglia mobile. Nel modello di EAE, una frequenza spaziale migliorata di 0,05 cicli/grado (c/d) di animali trattati con la sostanza 1 è stato rilevato rispetto ai topi non trattati di MOG-EAE (Figura 5).

Figura 1: supporto personalizzato per la misura di OCT. (A), OCT imaging di un mouse C57BL/6J utilizzando il supporto personalizzato33 e (B) l'asse di rotazione intorno all'occhio del roditore. Rotazione nel piano trasversa (a sinistra) e il piano assiale (a destra) è dimostrato. Questa figura è stata modificata da Dietrich, M. et al.33. Clicca qui per visualizzare una versione più grande di questa figura.
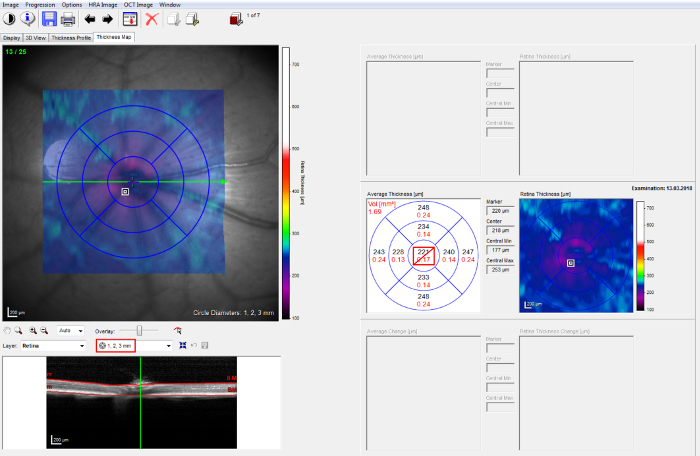
Figura 2: acquisizione analisi post-OCT. griglia ETDRS "1, 2, 3 mm" (a sinistra) sul protocollo di volume 25 B-scan. Lo spessore degli strati retinici è fornito per i diversi settori della retina dal software (a destra). Clicca qui per visualizzare una versione più grande di questa figura.
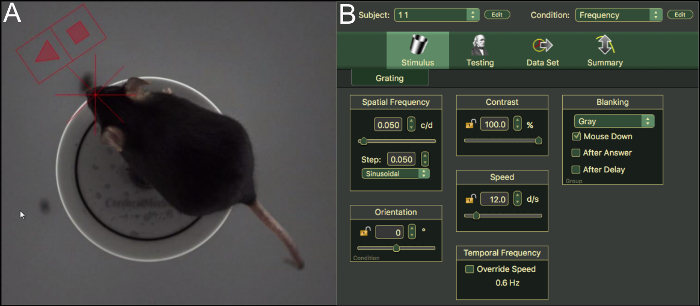
Figura 3: misura OKR di topi e stimolo impostazioni. Vista dall'alto (A) attraverso la telecamera analizzando un mouse C57BL/6J sulla piattaforma in aula. (B) interfaccia utente e le impostazioni del software OKR. Clicca qui per visualizzare una versione più grande di questa figura.
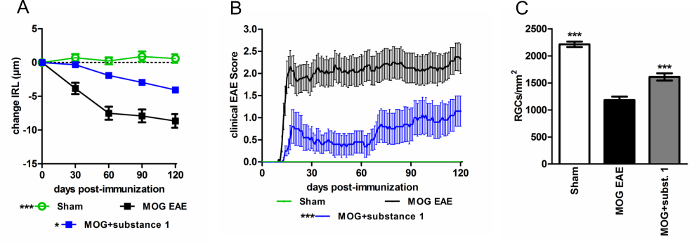
Figura 4: topi C57BL/6J con MOG EAE mostrano un decorso della malattia attenuato quando trattati con sostanza 1 rispetto ai comandi non trattati. (A), la degenerazione degli strati retinici interni è ridotta (B) e la clinica Punteggio EAE è attenuato durante il corso EAE quando amministrava la sostanza 1. Topi sono stati segnati tutti i giorni, e OCT sono state effettuate mensilmente per un periodo di 120 giorni. I grafici rappresentano la media e l'errore standard di almeno dieci animali per gruppo. (*p < 0,05, * * *p < 0,001, area sotto la curva rispetto mediante ANOVA con test post-hoc di Dunnett). (C) il cambiamento di spessore IRL è in buon accordo con perdita RGC (* * *p < 0,001, mediante ANOVA con test post-hoc di Dunnett, rispetto ai topi non trattati di MOG). Clicca qui per visualizzare una versione più grande di questa figura.
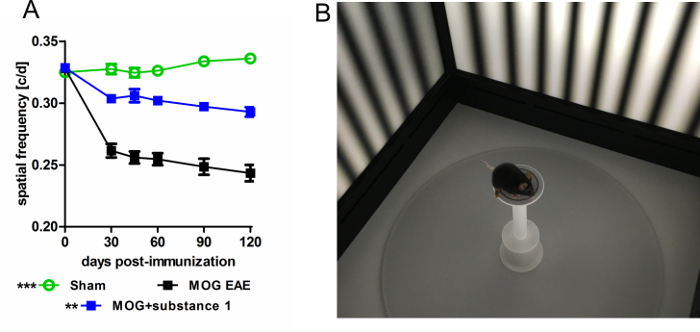
Figura 5: misura OKR dei topi C57BL/6J con MOG-EAE. (A), OKR rivela un'acuità visiva migliore degli animali trattate con sostanza 1 rispetto ai topi non trattati di MOG EAE misurati dalla soglia di frequenza spaziale test per un periodo di 120 giorni. I grafici rappresentano la media e l'errore standard di almeno sei animali per gruppo (* *p < 0.01, * * *p < 0,001, area sotto la curva rispetto mediante ANOVA con test post-hoc di Dunnett). (B) immagine di un topo C57BL/6J nella camera di prova. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo fornisce un'istruzione per le misurazioni di spessore e l'esame della funzione visiva nei roditori. Visual letture sono sempre più utilizzate nella ricerca traslazionale18,26,38,39,40 e sono facilmente trasferibili ai test clinici. Il vantaggio significativo di OCT rispetto alle indagini istologiche negli esperimenti sugli animali è che analisi longitudinale sono possibili permettendo l'indagine dei processi patologici dinamici, in gran parte riducendo la variabilità e il numero di animali necessari per studio. Inoltre, imaging in vivo con OCT non è soggetto a fissazione, taglio o manufatti, che possono interessare lo spessore dello strato in indagini istologiche di colorazione.
Tuttavia, l'orientamento ortogonale del fascio laser in tutti i piani in relazione alla retina è un passaggio fondamentale per garantire la qualità e la riproducibilità dei valori di spessore. Si richiede un certo allenamento dello sperimentatore ed è obbligatoria prima dell'acquisizione di scansioni OCT. Inoltre, come i dispositivi commerciali sono costruiti per applicazioni sull'uomo, la qualità delle immagini OCT roditore è ancora inferiore rispetto a B-Scan dei pazienti umani. Nell'esperienza degli autori, può essere difficile distinguere retinico interno diverso strati (strato delle fibre nervose retiniche, strato delle cellule del ganglio e strato plessiforme interno) durante la correzione manuale. Si consiglia pertanto di analizzare questi strati come una lettura composta (IRL).
La messa a punto sperimentale fornisce un'opzione per anestesia volatile, ad esempio, sostanze inalante isoflurano, che è, nella nostra esperienza, più sicuro e più facile da controllare rispetto l'anestesia iniettabile, per esempio, ketamina-xilazina41,42 e riduce il rischio del risveglio prematuro dei roditori in caso di acquisizione più volte (ad esempio, quando si esegue imaging delle cellule fluorescente etichettate). In uno studio preliminare, volume scansioni sono stati identificati come i protocolli con la più alta validità e affidabilità. L'affidabilità inter-rater e test di ripetizione della prova era eccellente quando volume scansioni escluse la parte centrale contenente il disco ottico sono stati valutati con ICC (coefficiente di correlazione intra-classe) valori superiori 0.85 per tutte le valutazioni.
La misurazione della risposta optokinetic si basa sul riflesso optocinetico involontario, che si verifica in risposta a un campo in continuo movimento. Nei roditori, a differenza delle altre specie, il movimento coinvolge non solo gli occhi, ma tutta la testa, che possa essere facilmente individuata utilizzando la fotocamera.
Distinzione tra "rilevamento" o normali movimenti comportamentali degli animali richiede un certo allenamento dello sperimentatore ed è importante essere accecato per il gruppo sperimentale. Inoltre, gli animali hanno bisogno di una fase di adattamento per ospitare l'impostazione sperimentale e durante protocolli di misura da sempre, gli animali devono essere animato ripetutamente per assicurare che "no tracking" è a causa di raggiungere la soglia OKR e non alla riduzione attenzione. C'è anche una variabilità di sforzo significativo per quanto riguarda la funzione visiva di laboratorio topi e ratti43,44. L'acuità visiva del roditore pertanto dovrebbero essere valutato prima che essi sono testati e alcuni ceppi, come topi SJL, potrebbero anche non essere adatti per misurazioni OKR, quanto sono omozigoti per l'allele Pde6brd1 (degenerazione retinica 1).
In sintesi, l'esame della morfologia retinica e della funzione visiva nei modelli animali permette per indagini non invasive, longitudinale di danni strutturali e funzionali che si verificano nel contesto di EAE e può essere utile in altri modelli che coinvolgono il visual sistema, incluso ma non limitato ai modelli di retinopatie o lesioni del nervo ottico.
Divulgazioni
Indipendenti per il lavoro presentato che gli autori dichiarano le seguenti informazioni finanziarie:
Michael Dietrich ricevuto onorari altoparlante da Novartis. Andrés Cruz-Herranz è un postdoctoral fellow della National Multiple Sclerosis Society. Ari J. Green servito sul comitato consultivo scientifico di MedImmune, Novartis, OCTIMS, Inception 5 Biosciences e Bionure; è associate editor di JAMA neurologia; era un membro del Consiglio editoriale della neurologia; detiene un brevetto per remyelination molecole e vie; consultati per Inception 5 Scienze; sostegno alla ricerca ricevuti da Novartis Pharma OCTIMs, Inception Scienze SRA, NINDS, NIA, National MS Society, Fondazione Sherak e Hilton Foundation; detiene azioni o stock option 5 Inception; e servito come testimone esperto presso Mylan v Teva Pharma. Hans-Peter Hartung ha ricevuto commissioni per il servizio sulle comitati direttivi da Biogen Idec, GeNeuro, Sanofi Genzyme, Merck, Novartis Pharmaceuticals, Octapharma, Opexa Therapeutics, Teva Pharmaceuticals, MedImmune, Bayer HealthCare, avanti Pharma, e Roche, tasse per il servizio sulle bordi consultivi da Biogen Idec, Sanofi Genzyme, Merck, Novartis Pharmaceuticals, Octapharma, Opexa Therapeutics, Teva Pharmaceuticals e Roche e conferenza commissioni da Biogen Idec, Sanofi Genzyme, Merck, Novartis Pharmaceuticals , Octapharma, Opexa Therapeutics, Teva Pharmaceuticals, MedImmune e Roche. Philipp Albrecht ricevuto un indennizzo per il servizio sulle Scientific Advisory Board per Ipsen, Novartis, Biogen; ha ricevuto onorari di altoparlante e supporto di viaggio da Novartis, Teva, Biogen, Merz Pharmaceuticals, Ipsen, Allergan, Bayer Healthcare, Esai, UCB e Glaxo Smith Kline; ha ricevuto il sostegno alla ricerca da Novartis, Biogen, Teva, Merz Pharmaceuticals, Ipsen e Roche. Gli altri autori non segnalano nessun informazioni integrative.
Riconoscimenti
Questo lavoro è stato sostenuto da borse di studio del Dr. Robert Pfleger-Fondazione e Ilselore Luckow-Foundation, nonché Biogen e Novartis a PA. Figura 1B è stato riprodotto da "manipolatori posizionale Whole-body per l'imaging oculare di ratti e topi anestetizzati: una guida fai da te. Dietrich, M., Cruz-Herranz, A., Yiu, H., Aktas, O., Brandt, A. U., Hartung, HP., Green, A., Albrecht, P. BMJ Open Oftalmologia. 1 (1), e000008, 2017" con il permesso dal BMJ Publishing Group Ltd.
Materiali
| Name | Company | Catalog Number | Comments |
| Heidelberg Spectralis HRA+OCT system | Heidelberg Engineering, Germany | N/A | ophthalmic imaging platform system |
| Heidelberg Eye Explorer | Heidelberg Engineering, Germany | N/A | Version 1.9.10.0 |
| blue 25D non-contact lens | Heidelberg Engineering, Germany | N/A | lens for rodent mesurement |
| OptoMotry | CerebralMechanics Inc., Canada | N/A | system for visual function analysis |
| OptoMorty HD software | CerebralMechanics Inc., Canada | N/A | Version 2.1.0 |
| Inhalation Anesthetic Isoflurane | Piramal Critical Care, Bethlehem, PA, USA | 803250 | inhalation anesthetic |
| Phenylephrin 2.5%-Tropicamide 0.5% | University Hospital Düsseldorf, Germany | N/A | pupillary dilation |
| Visc-Ophtal | Dr. Robert Winzer Pharma GmbH, Berlin, Germany | 58407 | ophthalmologic eye gel |
| GraphPad Prism | GraphPad Software Inc, San Diego, CA, USA | N/A | statistical analysis software, Version 5.00 |
| IBM SPSS Statistics | IBM Corporation, Armonk, New York, USA | N/A | statistical analysis software, Version 20 |
Riferimenti
- Folgar, F. A., Jaffe, G. J., Ying, G. -. S., Maguire, M. G., Toth, C. A. Comparison of optical coherence tomography assessments in the comparison of age-related macular degeneration treatments trials. Ophthalmology. 121 (10), 1956-1965 (2014).
- Mowatt, G., et al. Optical coherence tomography for the diagnosis, monitoring and guiding of treatment for neovascular age-related macular degeneration: a systematic review and economic evaluation. Health Technology Assessment. 18 (69), 1-254 (2014).
- Schlanitz, F. G., et al. Identification of Drusen Characteristics in Age-Related Macular Degeneration by Polarization-Sensitive Optical Coherence Tomography. American Journal of Ophthalmology. 160 (2), 335-344 (2015).
- Makiyama, Y., et al. Prevalence and spatial distribution of cystoid spaces in retinitis pigmentosa: investigation with spectral domain optical coherence tomography. Retina. 34 (5), 981-988 (2014).
- Al Rashaed, S., Khan, A. O., Nowilaty, S. R., Edward, D. P., Kozak, I. Spectral-domain optical coherence tomography reveals prelaminar membranes in optic nerve head pallor in eyes with retinitis pigmentosa. Graefe's Archive for Clinical and Experimental Ophthalmology. 22, (2015).
- Albrecht, P., et al. Retinal pathology in idiopathic moyamoya angiopathy detected by optical coherence tomography. Neurology. 85 (6), 521-527 (2015).
- Albrecht, P., Fröhlich, R., Hartung, H. -. P., Kieseier, B. C., Methner, A. Optical coherence tomography measures axonal loss in multiple sclerosis independently of optic neuritis. Journal of Neurology. 254 (11), 1595-1596 (2007).
- Albrecht, P., et al. Retinal neurodegeneration in Wilson's disease revealed by spectral domain optical coherence tomography. PLoS One. 7 (11), e49825 (2012).
- Albrecht, P., et al. Optical coherence tomography in parkinsonian syndromes. PLoS One. 7 (4), e34891 (2012).
- Albrecht, P., et al. Degeneration of retinal layers in multiple sclerosis subtypes quantified by optical coherence tomography. Multiple Sclerosis Journal. 18 (10), 1422-1429 (2012).
- Bhaduri, B., et al. Detection of retinal blood vessel changes in multiple sclerosis with optical coherence tomography. Biomedical Optics Express. 7 (6), 2321-2330 (2016).
- Knier, B., et al. Optical coherence tomography indicates disease activity prior to clinical onset of central nervous system demyelination. Multiple Sclerosis Journal. 22 (7), 893-900 (2016).
- Ringelstein, M., et al. Subtle retinal pathology in amyotrophic lateral sclerosis. Annals of Clinical and Translational Neurology. 1 (4), 290-297 (2014).
- Ringelstein, M., et al. Retinal pathology in Susac syndrome detected by spectral-domain optical coherence tomography. Neurology. 85 (7), 610-618 (2015).
- Satue, M., et al. Relationship between Visual Dysfunction and Retinal Changes in Patients with Multiple Sclerosis. PLoS One. 11 (6), e0157293 (2016).
- Thomson, K. L., Yeo, J. M., Waddell, B., Cameron, J. R., Pal, S. A systematic review and meta-analysis of retinal nerve fiber layer change in dementia, using optical coherence tomography. Alzheimer's & Dementia. 1 (2), 136-143 (2015).
- Dietrich, M., et al. Early alpha-lipoic acid therapy protects from degeneration of the inner retinal layers and vision loss in an experimental autoimmune encephalomyelitis-optic neuritis model. Journal of Neuroinflammation. 15 (1), 71 (2018).
- Knier, B., et al. Neutralizing IL-17 protects the optic nerve from autoimmune pathology and prevents retinal nerve fiber layer atrophy during experimental autoimmune encephalomyelitis. Journal of Autoimmunity. 56, 34-44 (2014).
- Augustin, M., et al. In Vivo Characterization of Spontaneous Retinal Neovascularization in the Mouse Eye by Multifunctional Optical Coherence Tomography. Investigative Ophthalmology & Visual Science. 59 (5), 2054-2068 (2018).
- Tode, J., et al. Thermal Stimulation of the Retina Reduces Bruch's Membrane Thickness in Age Related Macular Degeneration Mouse Models. Translational Vision Science & Technology. 7 (3), 2 (2018).
- Gabriele, M. L., et al. Optic nerve crush mice followed longitudinally with spectral domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 52 (5), 2250-2254 (2011).
- Carpenter, C. L., Kim, A. Y., Kashani, A. H. Normative Retinal Thicknesses in Common Animal Models of Eye Disease Using Spectral Domain Optical Coherence Tomography. Advances in Experimental Medicine and Biology. 1074, 157-166 (2018).
- Alam, N. M., et al. A mitochondrial therapeutic reverses visual decline in mouse models of diabetes. Disease Models & Mechanisms. 8 (7), 701-710 (2015).
- Bricker-Anthony, C., Rex, T. S. Neurodegeneration and Vision Loss after Mild Blunt Trauma in the C57Bl/6 and DBA/2J Mouse. PLoS One. 10 (7), e0131921 (2015).
- Segura, F., et al. Assessment of Visual and Chromatic Functions in a Rodent Model of Retinal Degeneration. Investigative Ophthalmology & Visual Science. 56 (11), 6275-6283 (2015).
- Fischer, M. D., et al. Noninvasive, in vivo assessment of mouse retinal structure using optical coherence tomography. PLoS One. 4 (10), e7507 (2009).
- Ward, M. E., et al. Individuals with progranulin haploinsufficiency exhibit features of neuronal ceroid lipofuscinosis. Science Translational Medicine. 9 (385), (2017).
- Chauhan, B. C., et al. Longitudinal in vivo imaging of retinal ganglion cells and retinal thickness changes following optic nerve injury in mice. PLoS One. 7 (6), e40352 (2012).
- Lidster, K., et al. Neuroprotection in a novel mouse model of multiple sclerosis. PLoS One. 8 (11), e79188 (2013).
- Munguba, G. C., et al. Nerve fiber layer thinning lags retinal ganglion cell density following crush axonopathy. Investigative Ophthalmology & Visual Science. 55 (10), 6505-6513 (2014).
- Kokona, D., Jovanovic, J., Ebneter, A., Zinkernagel, M. S. In Vivo Imaging of Cx3cr1gfp/gfp Reporter Mice with Spectral-domain Optical Coherence Tomography and Scanning Laser Ophthalmoscopy. Journal of Visualized Experiments. (129), (2017).
- Leung, C. K. S., et al. In vivo imaging of murine retinal ganglion cells. Journal of Neuroscience Methods. 168 (2), 475-478 (2008).
- Dietrich, M., et al. Whole-body positional manipulators for ocular imaging of anaesthetised mice and rats: A do-it-yourself guide. BMJ Open Ophthalmology. 1 (1), e000008 (2017).
- Cruz-Herranz, A., et al. The APOSTEL recommendations for reporting quantitative optical coherence tomography studies. Neurology. 86 (24), 2303-2309 (2016).
- Tewarie, P., et al. The OSCAR-IB consensus criteria for retinal OCT quality assessment. PLoS One. 7 (4), e34823 (2012).
- Fan, Q., Teo, Y. -. Y., Saw, S. -. M. Application of advanced statistics in ophthalmology. Investigative Ophthalmology & Visual Science. 52 (9), 6059-6065 (2011).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45 (12), 4611-4616 (2004).
- Groh, J., Stadler, D., Buttmann, M., Martini, R. Non-invasive assessment of retinal alterations in mouse models of infantile and juvenile neuronal ceroid lipofuscinosis by spectral domain optical coherence tomography. Acta Neuropathologica Communications. 2, 54 (2014).
- Seeliger, M. W., et al. In vivo confocal imaging of the retina in animal models using scanning laser ophthalmoscopy. Vision Research. 45 (28), 3512-3519 (2005).
- Shindler, K. S., Guan, Y., Ventura, E., Bennett, J., Rostami, A. Retinal ganglion cell loss induced by acute optic neuritis in a relapsing model of multiple sclerosis. Multiple Sclerosis Journal. 12 (5), 526-532 (2006).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
- Szczesny, G., Veihelmann, A., Massberg, S., Nolte, D., Messmer, K. Long-term anaesthesia using inhalatory isoflurane in different strains of mice-the haemodynamic effects. Zeitschrift für mikroskopisch-anatomische Forschung. 38 (1), 64-69 (2004).
- Prusky, G. T., Harker, K., Douglas, R. M., Whishaw, I. Q. Variation in visual acuity within pigmented, and between pigmented and albino rat strains. Behavioural Brain Research. 136 (2), 339-348 (2002).
- Wong, A. A., Brown, R. E. Visual detection, pattern discrimination and visual acuity in 14 strains of mice. Genes, Brain, and Behavior. 5 (5), 389-403 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon