Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un Guide pratique pour la Production et l’imagerie TEP/CT de 68Ga-DOTATATE pour les tumeurs neuro-endocrines en pratique clinique quotidienne
Dans cet article
Résumé
Tumeurs neuro-endocrines bien différenciées surexpriment les récepteurs de la somatostatine qui peuvent être utilisés pour l’imagerie diagnostique avec la somatostatine radiomarquées analogique 68Ga-DOTATATE. Ce protocole décrit en détail le radiomarquage de 68Ga-DOTATATE, contrôle qualité, préparation du patient et l’imagerie TEP/CT ultérieur. Protection contre les rayonnements et des constrictions de temps en raison de la courte demi-vie de 68Ga sont prises en compte.
Résumé
Tumeurs neuroendocrines sont une forme rare de cancer qui proviennent des cellules neuroendocrines et pourrez assister à presque n’importe où dans tout le corps. Bien qu’hétérogène en présentation, un dénominateur commun parmi ces tumeurs est la surexpression des récepteurs de la somatostatine. 68 GA-DOTATATE est une analogique de somatostatine marquée avec le positron émetteur gallium-68 (68Ga). Pour les tumeurs neuro-endocrines bien différenciés, tomographie par émission de 68Ga-DOTATATE (PET) / imagerie de la tomodensitométrie (TDM) est utilisé pour le diagnostic, la détermination de la charge de morbidité et la sélection de la thérapie.
Ce protocole décrit en détail le radiomarquage de 68Ga-DOTATATE, contrôle qualité, préparation du patient et l’imagerie TEP/CT ultérieur. Radiomarquage de 68Ga-DOTATATE est réalisée avec un module étiquetage automatique couplé à un germanium-68 (68Ge) /68générateur de Ga. Contrôle de la qualité du produit final évalue la pureté radiochimique avec instantanée en couche mince et chromatographie en phase solide et le pH avant l’injection de patients. Contrôle périodique de la qualité est effectué afin de déterminer la percée de Ge de 68et stérilité (teneur en acide-(2-hydroxyethyl)-1-piperazineethanesulfonic 4 (HEPES). Préparation du patient comprend des instructions du patient, un protocole pour 68Ga-DOTATATE pendant le traitement par analogues de la somatostatine et l’administration intraveineuse de produit radiopharmaceutique. Pour la TEP/CT, paramètres d’imagerie, l’acquisition et de reconstruction sont décrits. Pour chaque étape, protection contre les rayonnements est en surbrillance, ainsi que des constrictions de temps en raison de la courte demi-vie de 68ga.
Entièrement automatisé de production interne et contrôle de la qualité de 68Ga-DOTATATE conduit à des taux de réussite très élevé (95 %) et produit deux à quatre doses patients par lot, selon le rendement du générateur. En conclusion, l’imagerie TEP/CT de Ga-DOTATATE 68est une méthode rapide et non invasive de fournir des renseignements sur le fardeau de la tumeur de tumeurs neuroendocrines (filets) tout en aidant au diagnostic et le traitement de choix.
Introduction
Les filets sont un groupe hétérogène de tumeurs qui se dégage des cellules neuroendocrines. Ils peuvent se produire à n’importe quel emplacement dans le corps, mais sont plus courants dans le tractus gastro-intestinal, pancréas et poumons1. Bien que les filets sont une maladie rare, leur incidence aux États-Unis a augmenté de 1,09 pour 100 000 habitants en 1973 à 6,98 pour 100 000 habitants en 20122. Pour un diagnostic précis et la mise en scène d’un filet, 68Ga-DOTATATE TEP/CT est la norme de diligence. Ce protocole décrit la production et de contrôle de la qualité de 68Ga-DOTATATE, en plus de la préparation du patient et de l’acquisition d’images TEP/CT.
Les filets bien différenciés sont caractérisées par une surexpression des récepteurs de la somatostatine1. Analogues de la somatostatine qui se lient à ce récepteur peuvent être marqués avec un isotope radioactif permettant l’imagerie de médecine nucléaire. Dans un premier temps, iode-123 a été utilisé avec l’imagerie gamma caméra, qui fut bientôt remplacé par indium-111 (111)3,4. 111 La scintigraphie en-octreotide prit fin la méthode de référence pour l’imagerie de médecine nucléaire NET pour une décennie5. Pendant ce temps, les progrès techniques ont été faites en PET, qui a une sensibilité et une résolution à imagerie gamma caméra supérieure. Pour les filets, les analogues de la somatostatine couplés à l’émetteur les positrons 68Ga, tels que 68Ga-DOTATATE, ont été développés6.
68 Récepteur de ga-la somatostatine (68Ga-SRS) TEP/CT est la modalité actuelle de choix dans l’imagerie de médecine nucléaire des filets bien différenciés. La supériorité de 68Ga-SRS TEP/CT sur 111en-octréotide a été démontrée dans plusieurs études7,8. La sensibilité déclarée et la spécificité situent environ 90-95 % et 85 % à 100 %, respectivement9,10. Une méta-analyse a montré que 68Ga-SRS TEP/CT conduit à un changement de direction chez 44 % des cas, même si précédée par 111en-octreotide scintigraphie11. Dans les lignes directrices, 68Ga-SRS TEP/CT est maintenant recommandé sur 111en-octreotide scintigraphie pour NET d’imagerie, et il est également approuvé par la Food and Drug Administration et European Medicines Agency12. Une ligne directrice pour l’imagerie tumorale avec 68Ga conjugué peptides est également disponible13.
Ce protocole détaille le radiomarquage de 68Ga-DOTATATE (se conformer aux exigences de contrôle de la qualité de la Pharmacopée européenne14), préparation du patient et l’imagerie TEP/CT ultérieur. Protection contre les rayonnements et des constrictions de temps en raison de la courte demi-vie de 68Ga sont prises en compte.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. GENERALITES rayonnement et sécurité radiopharmaceutique
- S’assurer que les matières radioactives sont seulement a travaillé avec et manipulés par personnel qualifié. La dose reçue par le personnel de l’hôpital, les patients et toutes les personnes présentes d’autre devrait être toujours aussi basses que raisonnablement possible (ALARA).
- Concernant la préparation des médicaments radiopharmaceutiques, se conformer aux législations, règlements et lignes directrices, telles que les bonnes pratiques de fabrication (BPF).
Attention : Le protocole suivant est pour l’imagerie de Ga-DOTATATE TEP/CT 68des adultes uniquement et n’est pas adapté pour les enfants ou les femmes enceintes.
2. les préparatifs nécessaires avant l’étiquetage des 68Ga-DOTATATE
- Éluer les 68Ge / générateur Ga68avec l’acide chlorhydrique (HCl) selon les spécifications du fabricant, entre 4 et 24 h avant le début de l’étiquetage 68Ga-DOTATATE.
3. étiquetage des 68Ga-DOTATATE
NOTE : Les préparatifs et l’étiquetage des 68Ga-DOTATATE prend 90 min et doit être démarré 2 h avant la gestion des patients, afin de permettre le contrôle de qualité. Le module étiquetage devrait être placé dans un blindage de plomb qui peut être fermé pendant le processus de labellisation pour assurer la radioprotection du personnel. Si un kit enregistré est utilisé, puis le résumé des caractéristiques du produit (RCP) doit être suivi ou une validation croisée localement avec le protocole présenté.
- Placez le 68kit étiquetage Ga sur le module étiquetage selon les spécifications du fabricant. Placez les trois collecteurs sur les unités de module correspondant. Fixez les solutions fournies dans le 68kit étiquetage Ga pour les collecteurs.
- Préparer le flacon final dans un environnement stérile, comme une unité d’écoulement ou à flux laminaire.
- Placer un filtre de 0,22 µm décharger sous un filtre aéré de 0,22 µm et fixer le filtre de décharger à une aiguille stérile (20 G). Placer l’aiguille avec les deux filtres attachés dans un flacon stérile de 30 mL. Placer un filtre courbé ventilé de 0,2 µm avec une aiguille (22 G) dans le même flacon stérile comme par l’Etape 3.2 pour permettre l’évacuation.
- Attacher le flacon stérile avec le filtre de décharger à la sortie du module étiquetage et placez la cuvette dans le fil de blindage suffisant pour les émetteurs de positrons.
- Attachez la sortie des 68Ga /68générateur de Ge à l’entrée du module étiquetage.
- Dissoudre 50 µg de HA-DOTATATE (DOTA-3-iodo-Tyr3-octreotate) ou 20 µg de peptide DOTATATE (DOTA-0-Tyr3-octreotate) dans 1,5 mL de solution de tampon HEPES 1,5 M fournie dans le kit et le placer dans le flacon de réaction.
- Fermer le blindage de plomb autour du module et de commencer la production de 68étiquetage Ga-DOTATATE via l’ordinateur tablette attaché au module étiquetage.
- Attendez que la synthèse de 68Ga-DOTATATE est fini (~ 36 min).
- Après marquage, enlever les aiguilles avec des filtres à partir du flacon de verre et fermer le blindage de plomb autour de la cuvette.
- Testez l’intégrité du filtre 0,22 µm décharger comme suit.
- Remplissez une seringue (10 mL) avec de l’air et placez la seringue sur le dessus du filtre. Place l’aiguille attachée au filtre dans un tube rempli d’eau.
- Forcer l’air à travers le filtre et l’aiguille et déterminer quand les bulles commencent à se former. L’air doit être compressée en < 20 % du volume initial.
- Mesure l’activité de 68Ga-DOTATATE produit en plaçant le flacon dans un calibreur de dose et note le temps de référence de l’activité (ART).
- Dans un environnement stérile comme une enceinte à flux laminaire, prélever 0,5 mL de 68Ga-DOTATATE du flacon pour le contrôle qualité et préparer les seringues pour la gestion des patients.
NOTE : Placer la solution avec 68Ga-DOTATATE dans le blindage de plomb. Dans ce protocole, la solution diluée n’a pas à être protégé en raison de la faiblesse de l’activité et le temps d’exposition court. Toutefois, une évaluation des risques de radiation est souhaitable avant d’effectuer le contrôle de la qualité des 68Ga-DOTATATE.
4. contrôle de la qualité de 68Ga-DOTATATE avant d’administrer le patient
Remarque : Le contrôle de la qualité de 68Ga-DOTATATE prend 30 min et 30 min avant d’administrer le patient devrait débuter. Les dilutions décrites des solutions mères mènent à < 5 % temps morts dans l’équipement de mesure. Cela peut varier entre les différents équipements et doit être testé avant d’effectuer le contrôle de la qualité des 68Ga-DOTATATE. La Pharmacopée européenne décrit le contrôle de la qualité des injections d’edotreotide de gallium basé sur les critères de publication suivants : aspect = limpide et incolore ; pH = 4,0 – 8,0 ; stérilité ; endotoxines < ui 175 par volume administré ; l’éthanol < 10 % v/v ; pureté de radionucléide > 99,9 % de l’activité totale ; la pureté radiochimique > 91 % de l’activité totale ; absence d’autres impuretés ; HEPES < 200 µg / administré volume14. Tous les tests ont été évaluées lors de la validation de la méthode de préparation. Pour le contrôle régulier de la qualité, un sous-ensemble de tests (basés sur le suivi de tendance) a été réalisé et décrit ci-dessous. L’extraction en phase solide dans le présent protocole a été une validation croisée avec et obtient les mêmes résultats que la méthode de chromatographie liquide à haute performance décrite dans la Pharmacopée européenne. Ceci a été effectué selon GMP.
- Préparer à l’avance les solutions suivantes.
- Préparer une solution d’acétate d’ammonium 1 M en dissolvant 3,9 g d’acétate d’ammonium dans 50 mL d’eau. La solution peut être conservée à température ambiante pendant 2 semaines.
- Préparer l’acide éthylènediaminetétraacétique (EDTA) de 5 mM en dissoudre 0,1 g d’EDTA dans 50 mL d’eau. La solution peut être conservée à température ambiante pendant 1 an.
- Préparer 50/50 d’acétate d’ammonium méthanol : 1 M. La solution peut être conservée à température ambiante pendant 24 h.
- Inspecter visuellement le produit final 68Ga-DOTATATE pour s’assurer que c’est un liquide incolore sans toutes les particules.
- Mesurer le pH de la 68solution Ga-DOTATATE avec une bande d’indicateur de pH. Le pH devrait se situer entre 6,5 et 7,5.
- Mesurer les colloïdes Ga 68par instantanée en couche mince (technologique).
- Ajouter 500 µL d’eau et 20 µL de 68Ga-DOTATATE pour préparer une solution-mère et homogénéiser (colloïdes de Ga68[GC]) en agitant soigneusement le flacon.
- Coupez une bande de papier fibre technologique - gel de silice (SG) verre d’au moins 7 cm de long et 1 cm de large.
Remarque : Utilisez uniquement le papier technologique-SG propre sans dommages. Si le document est endommagé, les composants voyageant avec le solvant peuvent être entravées et les résultats seront inexacts. - Ajouter 5 µL de GC 1,5 cm du bas de la feuille technologique-SG et le placer dans un tube contenant 2 mL d’acétate d’ammonium de 50/50 méthanol : 1 M. Veiller à ce que les 68Ga-DOTATATE ne vient pas en contact avec le liquide. Fermer les tubes pour empêcher l’évaporation.
- Attendre quelques minutes jusqu'à ce que le solvant a voyagé au moins 5 cm au dessus où le 68Ga-DOTATATE a été appliquée. Couper le papier en deux et placez le fond et les parties supérieures dans des tubes distincts (BH1 et UH1).
- Placez le UH1 et tubes BH1 dans un endroit bien contrer et déterminant le nombre d’échelons dans chaque flacon dans la fenêtre d’énergie de keV 400 – 600 pour 30 s, pour déterminer le pourcentage de colloïde (voir les calculs en étapes 4.4.7–4.4.9).
- Répétez les étapes 4.4.2–4.4.5 pour acquérir BH2 et UH2...
- Effectuer une mesure de fond d’un vide bien encontre et déterminer le nombre d’échelons dans la fenêtre d’énergie de keV 400 – 600 pendant 30 s.
- Corriger les décomptes UH1, UH2, BH1 et BH2 pour la désintégration et l’arrière-plan (déterminé à l’étape 4.4.7) pour obtenir des UH1cor, UH2cor, BH1cor, BH2cor. ΔT est la différence entre la mesure de l’échantillon et l’ART (déterminé à l’étape 3.11) en quelques minutes.
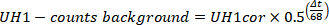
- Calculer le nombre de colloïdes Ga 68avec la formule suivante ; Notez que cela devrait être inférieure à 3 %. UH1cor, UH2cor, BH1cor, BH2cor sont les valeurs corrigées obtenues à l’étape 4.4.8.
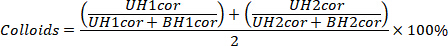
- Déterminer les ions de Ga 68par séparation de la colonne.
- Faire une solution par dilution 20 µL de 68Ga-DOTATATE dans 1 mL d’EDTA à 5 mM.
- Préparer une cartouche de C-18 en le rinçant lentement avec 1 mL d’éthanol à 100 %, suivi par 1 mL d’eau stérile.
- Préparer un échantillon (S) en diluant 10 µL de la solution mère dans 1 mL d’eau stérile, mettez-le dans un comptoir bien et déterminer le nombre d’échelons dans la fenêtre d’énergie de keV 400 – 600 pendant 30 s.
- Rincer l’échantillon lentement (5 à 10 mL/min) à travers la cartouche C-18 avec une seringue et collecter le reste de la solution (C). Rincer le tube d’échantillon avec 1 mL d’eau, puis rincez ceci par le biais de la colonne dans le tube de prélèvement.
- Placer le tube collecteur (C), le tube d’échantillon vide (E) et la seringue (Sy) dans un compteur de puits et de déterminer le nombre de numération dans chacun d’eux dans la fenêtre énergie de 400 à 600 keV pour 30 s. utilisation pour estimer le pourcentage d’ion (voir les calculs en étapes 4.5.7 et 4.5 .8.
- Répétez les étapes 4.5.2\u20124.5.5.
- Corriger les décomptes pour la désintégration et l’arrière-plan (déterminé à l’étape 4.4.7) C, S, E, et Sy pour déterminer C «, S', E « et Sy, pour déterminer le nombre de chefs d’accusation à l’ART avec la formule suivante, dans laquelle Δt est la différence de temps entre l’ART et de l’échantillon mesuré en m inutes.
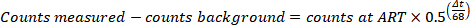
- Calculer les 68pourcentage ion Ga avec la formule suivante ; Notez que cela devrait être inférieure à 2 %.
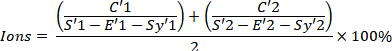
- Déterminer la pureté radiopharmaceutique en calculant le montant total de 68Ga-DOTATATE avec la formule suivante, qui doit être au moins de 91 %.
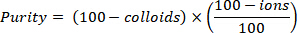
5. contrôle de la qualité périodique de 68Ga-DOTATATE après la gestion des patients
Remarque : Cette modification doit être effectuée > 48 h après la préparation de 68Ga-DOTATATE permettant la décomposition de 68ga.
- Préparer à l’avance les solutions suivantes.
- Préparer la solution de référence HEPES en dissolvant 20 mg de HEPES dans 50 mL d’eau stérile. La solution peut être conservée à température ambiante pendant 6 mois.
NOTE : Ceci est basé sur la dose maximale recommandée de HEPES de 200 µg / volume administré. - Préparer 25 : 75 v/v eau : acétonitrile.
- Préparer la solution de référence HEPES en dissolvant 20 mg de HEPES dans 50 mL d’eau stérile. La solution peut être conservée à température ambiante pendant 6 mois.
- Déterminer la concentration HEPES dans le produit final (chaque semaine).
- Transfer 3 µL de solution de 68Ga-DOTATATE par incréments de 1 µL à un document technologique-SG F de254 d’au moins 8 cm de longueur. Utiliser un sèche-cheveux pour sécher le papier entre les applications de 1 µL.
- Répétez l’étape 5.2.1 avec la solution de référence HEPES.
- Placer les bandes dans un solvant de 25 : 75 eau : acétonitrile. S’assurer que les solutions appliquées n’entrent pas en contact avec le liquide.
- Attendre quelques minutes jusqu'à ce que le solvant a voyagé au moins 2/3 de la longueur du papier.
- Élaborer le document pendant au moins 4 min dans une chambre fermée avec des cristaux d’iode.
- Évaluer visuellement le résultat ; une tache jaune devrait apparaître. La tache sur le papier avec 68Ga-DOTATATE devrait être moins intense que celle de la solution de référence.
- Déterminer les 68percée de Ge dans le produit final (par mois).
- Préparer un échantillon avec 200 µL de solution de Ga-DOTATATE (G) du 68. Placez-le dans un compteur bien et déterminer le nombre d’échelons dans chacune dans la fenêtre d’énergie de keV 400 – 600 pendant 30 s.
- Répétez l’étape 5.3.1.
- Corriger les décomptes en sol pour déterminer G' pour la désintégration, pour déterminer le nombre de chefs d’accusation à l’ART avec la formule suivante, dans laquelle Δt est le décalage horaire entre l’ART et de l’échantillon mesuré en minutes.
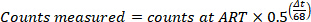
- Calculer la percée de Ge de 68(MBq/MBq), qui devrait être moins de 0,001 %, avec la formule suivante.
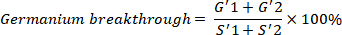
- Déterminer la stérilité du produit final (par mois).
- Ajouter le restant 68solution Ga-DOTATATE au milieu trypticase soja-bouillon (BST). Incuber pendant 14 jours à 30-35 ° C.
- Vérifiez que le support de la BST est un liquide clair après la période d’incubation.
6. patiente préparation et administration de 68Ga-DOTATATE
Remarque : L’activité injectée dans le présent protocole fournit des images de bonne qualité avec le système TEP/TDM et le protocole d’imagerie tel que décrit à l’article 7. Avec d’autres systèmes d’imagerie et de protocoles, l’activité injectée doit être optimisée.
- Envoyer à l’avance, la nomination et le dossier patient avec informations sur 68Ga-DOTATATE TEP/CT, par la poste à chaque patient. Confirmer chaque rendez-vous par téléphone 1 jour à l’avance.
- Nourriture et boissons ne se limitent pas avant l’imagerie TEP/CT de Ga-DOTATATE 68. Conseiller aux patients de boire un extra 1 L d’eau dans les 2 h avant l’imagerie. Il est également recommandé de patients n’apportent pas les enfants ou les femmes enceintes avec eux pour le service de médecine nucléaire.
- Le jour de la 68Ga-DOTATATE TEP/CT, ont les patients arriver au département de médecine nucléaire 60 min avant l’imagerie. Prendre une histoire médicale courte.
- Se renseigner sur la date de la dernière administration analogue de la somatostatine. Ce n’est pas une contre-indication à 68Ga-DOTATATE TEP/CT mais il est à noter.
- Placer une canule intraveineuse dans le bras et le rincer avec du sérum physiologique pour vérifier le placement de la canule.
- Injecter 100 MBq de 68Ga-DOTATATE 45 min avant l’imagerie TEP/CT.
7. l’imagerie TEP/CT
- Placez le patient avec les bras au-dessus de leur tête sur le scanner TEP/CT. Demander au patient de rester toujours tout au long de l’examen.
- Acquérir une image de sondage et sélectionnez la zone de numérisation de la glande pituitaire à la mi-cuisse, sauf indication contraire en raison de signes cliniques.
- Effectuer une bas-dose CT scan avec 40 mAs, 140 keV et tranches de 5 mm pour la correction d’atténuation et de corrélation anatomique.
- Effectuer un PET scan avec 150 s par position lit, commençant à la tête du patient.
- Reconstruire les images de CT avec tranches de projection et de 5 mm arrière filtrés.
- Reconstruire les images de PET BLOB-OS-TF, avec trois itérations et 33 sous-ensembles avec une taille de voxel de 4 x 4 x 4 mm.
- Envoyer toutes les images pour le système d’archivage et de communication des images locales (PACS).
Access restricted. Please log in or start a trial to view this content.
Résultats
Faisant usage d’un système d’étiquetage automatique, 357 lots de 68Ga-DOTATATE ont été produits entre décembre 2014 et octobre 2018. Le 357 produites, 17 lots a échoué et 340 lots ont été libérés, conduisant à un taux de réussite global de 95,2 %. Des lots ayant échouées, 11 ont été causés par une défaillance technique, tandis que dans six cas, le produit 68Ga-DOTATATE ne satisfaisait pas aux spécifications. Figure 1
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce protocole décrit la production et l’imagerie TEP/CT ultérieur de 68Ga-DOTATATE. Afin que l’utilisation efficace de chaque lot de produits de 68Ga-DOTATATE, un flux de production optimale avec un timing rigoureux est nécessaire. Puisque la demi-vie de 68Ga est 68 min, une relativement petite temporisation de 15 min conduit à une perte de 15 % de la radioactivité. Cela nécessite une communication active entre l’usine de production, le personnel, administrer la dose au patient...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient tout le personnel impliqué dans l’imagerie TEP/CT de Ga-DOTATATE 68au département de médecine nucléaire du Netherlands Cancer Institute.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Biosolve | 012007 | > 99.9 % |
| Ammonium acetate | Merck | 101116 | ≥ 98 % |
| Aqua / Water for injections | Braun | ||
| Automated labeling system | Scintomics | GRP 3V | |
| C-18 cartridge | Waters | WAT023501 | Sep-Pak C18 Plus Light |
| Dose calibrator | Veenstra Instruments | VIK-202-5051 | |
| EDTA | Merck | 324503 | |
| Ethanol | Sigma Aldrich | 32221-M | ≥ 99.8 % |
| Ga-68 labeling kit | ABX | SC-01 | |
| Ge-68/Ga-68 generator | Eckert & Ziegler | 1850 MBq | |
| HA-DOTATATE | Scintomics | GRPC/R-000095 | |
| HCl 0.1M for elution | ABX | HCl-03 | |
| HEPES | Sigma Aldrich | H3375 | ≥ 99.5 % |
| Iodine | Sigma Aldrich | 207772 | ≥ 99.8 %, solid |
| ITLC-SG F254 plates | Merck | 105735 | TLC Silica gel 60 F254 |
| ITLC-SG paper | Agilent | SGI0001 | Glass fiber |
| Methanol | Sigma Aldrich | 32213-M | ≥ 99.8 %, Ph. Eur. |
| Non-vented filter | Merck | SLMPL25SS | Millex-MP filter 0.22 µm |
| PET/CT | Philips | Gemini TOF | |
| pH indicator strips | Merck | 109584 | MColorpHast (pH2.0-9.0) |
| Tryptic soy broth medium | Biotrading | K111F010QK | |
| Vented filter | Merck | SLGV0250S | Cathivex GV 0.22 µm |
| Well counter | Canberra (now Mirion) | Osprey Digital Tube Base MCA Detector 76 BP76/3M-X |
Références
- Oronsky, B., Ma, P. C., Morgensztern, D., Carter, C. A. Nothing but NET: A Review of Neuroendocrine Tumors and Carcinomas. Neoplasia. 19 (12), 991-1002 (2017).
- Dasari, A., et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncology. 3 (10), 1335-1342 (2017).
- Krenning, E. P., et al. Localistion of endocrine-related tumours with radioiodinated analogue of somatostatin. The Lancet. 333 (8632), 242-244 (1989).
- Krenning, E. P., et al. Somatostatin receptor scintigraphy with [111In-DTPA-D-Phe1]- and [123I-Tyr3]-octreotide: the Rotterdam experience with more than 1000 patients. European Journal of Nuclear Medicine. 20 (8), 716-731 (1993).
- Balon, H. R., et al. Procedure guideline for somatostatin receptor scintigraphy with (111)In-pentetreotide. Journal of Nuclear Medicine. 42 (7), 1134-1138 (2001).
- Kayani, I., et al. Functional Imaging of Neuroendocrine Tumors With Combined PET/CT Using 68Ga-DOTATATE (Dota-DPhe1,Tyr3-octreotate) and 18F-FDG. Cancer. 112 (11), 2447-2455 (2008).
- Hofman, M. S., Kong, G., Neels, O. C., Hong, E., Hicks, R. J. High management impact of Ga-68 DOTATATE (GaTate) PET/CT for imaging neuroendocrine and other somatostatin expressing tumours. Journal of Medical Imaging and Radiation Oncology. 56 (1), 40-47 (2012).
- Srirajaskanthan, R., et al. The role of 68Ga-DOTATATE PET in patients with neuroendocrine tumors and negative or equivocal findings on 111In-DTPA-octreotide scintigraphy. Journal of Nuclear Medicine. 51 (6), 875-882 (2010).
- Deppen, S. A. 68Ga-DOTATATE Compared with 111In-DTPA-Octreotide and Conventional Imaging for Pulmonary and Gastroenteropancreatic Neuroendocrine Tumors: A Systematic Review and Meta-Analysis. Journal of Nuclear Medicine. 57 (6), 872-878 (2016).
- Yang, J., et al. Diagnostic role of Gallium-68 DOTATOC and Gallium-68 DOTATATE PET in patients with neuroendocrine tumors: a meta-analysis. Acta Radiologica. 55 (4), 389-398 (2014).
- Barrio, M., et al. The Impact of Somatostatin Receptor-Directed PET/CT on the Management of Patients with Neuroendocrine Tumor: A Systematic Review and Meta-Analysis. Journal of Nuclear Medicine. 58 (5), 756-761 (2017).
- Strosberg, J. R., et al. The North American Neuroendocrine Tumor Society Consensus Guidelines for Surveillance and Medical Management of Midgut Neuroendocrine Tumors. Pancreas. 46 (6), 707-714 (2017).
- Virgolini, I., et al. Procedure guidelines for PET/CT tumour imaging with 68Ga-DOTA-conjugated peptides: 68Ga-DOTA-TOC, 68Ga-DOTA-NOC, 68Ga-DOTA-TATE. European Journal of Nuclear Medicine and Molecular Imaging. 67 (10), 2004-2010 (2010).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Monograph 01/2013:2482 Gallium (68Ga) edotreotide injection. European Pharmacopoeia 9th Edition. , (2017).
- Brogsitter, C., et al. Twins in spirit part II: DOTATATE and high-affinity DOTATATE – the clinical experience. European Journal of Nuclear Medicine and Molecular Imaging. 41 (6), 1158-1165 (2014).
- Sandström, M., et al. Comparative biodistribution and radiation dosimetry of 68Ga-DOTATOC and 68Ga-DOTATATE in patients with neuroendocrine tumors. Journal of Nuclear Medicine. 54 (10), 1755-1759 (2013).
- Aalbersberg, E. A., et al. Influence of lanreotide on uptake of 68Ga-DOTATATE in patients with neuroendocrine tumours: a prospective intra-patient evaluation. European Journal of Nuclear Medicine and Molecular Imaging. , In Press (2018).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon