Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détermination de l’interaction tripartite entre deux monomères d’un facteur de transcription MADS-box et d’une protéine de capteur de calcium par essai BiFC-FRET-FLIM
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici une méthode pour visualiser la formation de complexes ternaires entre trois partenaires protéiques à l’aide de protéines marquées par fluorescence par le test FRET-FLIM basé sur BiFC. Cette méthode est précieuse pour étudier les complexes d’interaction protéine-protéine in vivo.
Résumé
Les interactions protéine-protéine font partie intégrante de tous les processus biologiques dans les cellules car elles jouent un rôle crucial dans la régulation, le maintien et la modification des fonctions cellulaires. Ces interactions sont impliquées dans un large éventail de phénomènes tels que la transduction du signal, la réponse des agents pathogènes, les interactions cellule-cellule, les processus métaboliques et de développement. Dans le cas des facteurs de transcription, ces interactions peuvent conduire à l’oligomérisation des sous-unités, à la séquestration dans des contextes subcellulaires spécifiques tels que le noyau, le cytoplasme, etc., ce qui, à son tour, pourrait avoir un effet plus profond sur l’expression des gènes en aval. Ici, nous démontrons une méthodologie pour visualiser l’interaction tripartite in vivo en utilisant le transfert d’énergie par résonance de Förster (FRET) basé sur la complémentation de fluorescence bimoléculaire (BiFC) impliquant l’imagerie à vie de fluorescence (FLIM). Deux des protéines sélectionnées pour cette démonstration interagissent en tant que partenaires BiFC, et leur activité de fluorescence reconstituée est utilisée pour tester FRET-FLIM avec le troisième partenaire. Des plantes Nicotiana benthamiana cultivées en chambre de croissance âgées de quatre à cinq semaines ont été utilisées comme système de plantes modèles pour cette démonstration.
Introduction
Les interactions protéine-protéine (IPP) constituent la base du bon fonctionnement des cellules eucaryotes en régulant divers processus métaboliques et développementaux. Certains IPP sont stables, tandis que d’autres sont de nature transitoire. Les interactions peuvent être classées en fonction du nombre et du type de membres de l’interaction tels que dimérique, trimérique, tétramérique homomérique et hétéromère1. L’identification et la caractérisation des interactions protéiques peuvent mener à une meilleure compréhension des fonctions protéiques et des réseaux de régulation.
Les facteurs de transcription sont des protéines impliquées dans les fonctions régulatrices. Ils régulent le taux de transcription de leurs gènes en aval en se liant à l’ADN. Parfois, l’oligomérisation ou la formation de complexes d’ordre supérieur par les protéines est une condition préalable à l’accomplissement de leurs fonctions2. Les facteurs de transcription mads-box des plantes sont des gènes homéotiques qui régulent divers processus tels que la transition florale, le développement des organes floraux, la fécondation, le développement des graines, la sénescence et le développement végétatif. Ils sont connus pour former des complexes d’ordre supérieur qui se lient à l’ADN3,4. L’étude des réseaux IPP entre les facteurs de transcription et leurs interacteurs fournit des informations sur la complexité sous-jacente à la régulation transcriptionnelle.
L’expression protéique transitoire chez Nicotiana benthamiana a été une approche populaire pour étudier la localisation des protéines ou les interactions protéine-protéine in vivo5. BiFC et FRET sont des méthodes permettant d’étudier les interactions protéine-protéine in vivo à l’aide de systèmes rapporteurs fluorescents6. Il a été démontré qu’une combinaison de ces deux techniques révèle l’interaction entre trois protéines7. Fret est mesuré à l’aide de la technique de photoblanchiment accepteur, d’émission sensibilisée et d’imagerie à vie de fluorescence (FLIM). Le test FRET basé sur FLIM est apparu comme un outil qui fournit une quantification précise et une spécificité spatio-temporelle aux mesures de transfert d’énergie entre deux molécules en fonction de leur durée de vie en fluorescence8. FLIM mesure le temps pendant lequel un fluorophore reste dans un état excité avant d’émettre un photon et est meilleur que les techniques qui utilisent des mesures d’intensité seules9,10. Outre les systèmes hétérologues tels que Nicotiana benthamiana et les pelures épidermiques d’oignons, des rapports plus récents ont démontré l’utilisation de racines d’Arabidopsis et de jeunes plants de riz, etc., pour l’analyse in vivo des interactions protéine-protéine dans des conditions natives11,12.
Outre un système d’expression approprié, la sélection de partenaires en interaction pour les tests BiFC et FRET est également cruciale pour le succès de cette expérience. L’IPP parmi les partenaires utilisés dans la configuration BiFC doit être validé à l’aide de contrôles appropriés avant leur utilisation en tant que partenaire conjugué dans l’expérience FRET13. BiFC utilise la complémentarité structurelle des parties N- et C-terminales de la protéine fluorescente. Une limitation commune dans la plupart, sinon la totalité, des protéines fluorescentes utilisées dans les tests BiFC a été l’auto-assemblage entre les deux fragments non fluorescents dérivés, contribuant à la fluorescence faussement positive et diminuant le rapport signal/bruit (S / N)14. Des développements récents, y compris des mutations ponctuelles ou la position de division de la protéine fluorescente, ont donné lieu à des paires BiFC avec une intensité accrue, une spécificité plus élevée, un rapport S / N élevé15,16. Ces protéines fluorescentes peuvent également être utilisées pour réaliser BiFC en fonction de la pertinence de l’expérience.
Traditionnellement, la CFP et la YFP ont été utilisées comme paire donneur et accepteur dans les expériences FRET17. Cependant, YFP ou m-Citrine se sont avérés être de meilleurs donneurs de FRET (lorsqu’ils sont utilisés avec RFP comme accepteur) en raison du rendement quantique élevé (QY) lors de l’expression native des protéines cibles dans le système racinaire d’Arabidopsis. La sélection des promoteurs (constitutifs versus natifs/endogènes) et du fluorophore joue également un rôle crucial dans la conception d’une expérience BiFC-FRET-FLIM réussie. Il est essentiel de noter que l’efficacité des donneurs de FRET et l’adéquation des paires de FRET ont tendance à changer avec le changement du promoteur et du système biologique utilisé pour l’expression. Le QY du fluorophore, qui se rapporte à sa luminosité, dépend du pH, de la température et du système biologique utilisé. Nous suggérons que ces critères soient soigneusement pris en compte avant de choisir la paire de fluorophores pour l’expérience FRET. Le système biologique, les promoteurs et les protéines utilisées pour ce protocole ont bien fonctionné avec les fluorophores CFP-YFP pour l’expérience BiFC FRET-FLIM.
Dans la présente étude, nous intégrons la fonctionnalité de FLIM pour visualiser l’interaction entre trois molécules de protéines à l’aide de FRET à base de BiFC. Dans cette technique, deux protéines sont marquées avec la protéine YFP fractionnée et la troisième protéine avec la CFP. Comme nous étions intéressés par l’étude de l’interaction d’un homodimère de protéine MADS-box (M) avec une protéine de capteur de calcium (C), ces protéines ont été marquées avec des protéines fluorescentes dans les vecteurs pSITE-1CA et pSITE-3CA18. Deux des partenaires en interaction, dans ce test, ont été marqués avec des parties terminales N et C du YFP dans les vecteurs pSPYNE-35S et pSPYCE-35S19, et leur interaction entraîne la reconstitution du YFP fonctionnel qui agit comme un accepteur FRET au troisième partenaire en interaction, qui est marqué avec CFP (agissant en tant que donneur FRET) (Figure 1 ). Dans ce cas particulier, l’IPP entre deux monomères M et entre M et C a été validé en effectuant BiFC dans trois systèmes différents avec le système levure-deux-hybrides. Ces vecteurs ont été mobilisés en souche Agrobacterium tumifaciens GV3101 par électroporation. La souche GV3101 possède un plasmide Ti désarmé pMP90 (pTiC58DT-ADN) avec une résistance à la gentamicine20. Une souche p19 Agrobacterium a été ajoutée avec toutes les infiltrations pour empêcher le silence transgénique21. Nous recommandons que les trois protéines soient également utilisées dans des conformations opposées pour valider les interactions tripartites.
Dans cette technique, nous avons utilisé FLIM, où d’abord, la durée de vie de fluorescence du donneur (durée de vie du donneur non éteint) est mesurée en l’absence d’accepteur. Après cela, sa durée de vie est mesurée en présence de l’accepteur (durée de vie du donneur trempé). Cette différence dans la durée de vie de la fluorescence du donneur est utilisée pour calculer l’efficacité FRET, qui dépend du nombre de photons présentant une réduction de la durée de vie de la fluorescence. Mentionné ci-dessous est un protocole détaillé pour déterminer la formation d’un complexe ternaire entre trois protéines quelconques en exprimant transitoirement les protéines marquées par fluorescence dans Nicotiana benthamiana et en testant leur interaction par BiFC-FRET-FLIM.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Clonage de gènes dans des vecteurs d’entrée et de destination (Figure2)
- Amplifier la séquence codante (CDS) des gènes d’intérêt (gènes M et C dans notre cas) par PCR et les cloner dans des vecteurs d’entrée appropriés (par exemple, vecteur pENTR/D-TOPO; voir le tableau 1 pour les vecteurs utilisés dans cette expérience).
- Cultivez les clones sur des plaques contenant des antibiotiques. Valider les clones qui sont sélectionnés sur les antibiotiques par restriction digestion et séquençage de l’ADN22,23.
- Mobiliser les CDS reconstitués des clones d’entrée vers les vecteurs de destination (pSPYNE-35S, pSPYCE-35S, pSITE-1CA et pSITE-3CA) et confirmer le transfert des séquences de l’entrée vers les vecteurs de destination par digestion enzymatique de restriction.
REMARQUE : Tous les vecteurs utilisés dans cette expérience sont répertoriés dans le tableau 1. - Enfin, transformer les cellules d’Agrobacterium GV3101 (pMP90 (GentR))avec les vecteurs de destination par électroporation(Figure 3)24.
2. Conditions de croissance des plantes Nicotiana benthamiana
REMARQUE: Cultivez les plantes Nicotiana jusqu’au stade 4-6 feuilles dans des conditions de contrôle.
- Pour faire pousser des plantes Nicotiana, préparez le mélange de sol en mélangeant des mélanges de sol disponibles dans le commerce avec de la tourbe de coco et du compost dans un rapport de 2: 1: 1.
- Étalez une couche de 1 pouce d’épaisseur de ce mélange de sol dans un plateau en plastique pour faire le lit de sol et le saturer d’eau désionisée. Saupoudrer environ 200 graines dans ce lit de sol.
- Transférez-le dans un plateau plus grand contenant 1 cm d’eau stagnante. Couvrez ce plateau avec une pellicule de plastique pour créer une chambre à humidité.
- Transférer cette installation dans une chambre de croissance réglée à 23 °C avec 16 h de lumière et 8 h de cycle sombre avec une intensité lumineuse de 150-170 μmol/m2s.
- Après deux semaines, transférer les jeunes plants dans de petits pots de 3 à 4 pouces contenant un mélange de sol saturé d’eau.
- Placez ces pots dans des plateaux en plastique et transférez-les dans la chambre de croissance pendant quatre semaines supplémentaires.
3. Préparer les souches bactériennes pour l’agro-infiltration
REMARQUE: Pour l’agro-infiltration, les souches bactériennes doivent être fraîchement sous-cultivées et mélangées avec la souche p19 d’Agrobacterium dans des proportions appropriées.
- Préparer des plaques de gélose 2xYT contenant de la rifampicine (100 μg/mL), de la gentamicine (25 μg/mL) et de la kanamycine (50 μg/mL) pour Agrobacterium hébergeant le vecteur pSPYNE-35S et pSPYCE-35S. Pour la souche contenant un vecteur pSITE, utilisez la rifampicine (100 μg/mL), la gentamicine (25 μg/mL) et la spectinomycine (50 μg/mL).
- Strier les souches d’Agrobacterium contenant les plasmides sur ces plaques à l’aide de boucles d’inoculation stériles dans une hotte à écoulement laminaire.
- Incubés à 28 °C pendant 48 h dans l’obscurité.
- Commencez cette procédure en inoculant la souche Agrobacterium GV3101 abritant des constructions BiFC et FRET (préparées en vecteurs pSPYNE-35S, pSPYCE-35S et pSITE) à partir de plaques striées dans 10 mL de bouillon 2xYT contenant des antibiotiques appropriés (Rifampicine (100 μg/mL), gentamicine (25 μg/mL), kanamycine (50 μg/mL) ou spectinomycine (50 μg/mL)).
- De plus, initier une culture de souche p19 d’Agrobacteria en inoculant 10 mL de bouillon 2xYT contenant de la rifampicine (100 μg/mL) et de la kanamycine (50 μg/mL).
REMARQUE: La souche p19 est ajoutée pour empêcher le silence transgénique. - Couvrir la fiole avec une feuille d’aluminium et la conserver dans le shaker de l’incubateur réglé à 28 °C et 170 tr/min pendant 16 h dans l’obscurité.
- Après la croissance pendant la nuit, transférer 1 mL de cette culture dans une cuvette jetable pour mesurer la densité optique (O.D.) des cultures à 600 nm à l’aide d’un spectrophotomètre.
- Mélanger les cultures de Souches BiFC et FRET appropriées contenant des souches de sorte que l’O.D. final de chaque culture soit de 0,5 et celui de p19 de 0,3 dans un volume total de 2 mL.
- Pour atteindre ces ratios, utilisez la formule mentionnée ci-dessous :
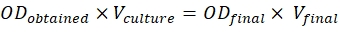
ODobtenu = O.D. de la culture mesurée à 600 nm
Culture V = Volume de la culture requise
ODfinal = 0,5 pour les constructions et 0,3 pour p19
Vfinal = Volume final pour l’infiltration, qui est de 2 mL
REMARQUE : Les combinaisons de construction utilisées dans la présente étude sont précisées dans le tableau 2. - Centrifuger les cultures agrobacterium mélangées à 3 000 x g pendant 5 min à température ambiante et jeter soigneusement le surnageant. Remettre la pastille dans 2 mL de tampon d’infiltration fraîchement préparé (10 mM mes, 100 μM d’acétosyringone et 10 mM MgCl2). Utilisez un mélangeur vortex pour fabriquer une suspension cellulaire homogène.
- Incuber les tubes contenant des cellules remises en suspension dans l’obscurité à température ambiante pendant 3 h.
- Pendant ce temps, étiquetez chaque pot de plantes avec le mélange de construction avec lequel il va être infiltré. Utilisez deux plantes pour chaque mélange d’infiltration.
- Remplissez une seringue sans aiguille de 1 mL avec le mélange agrobactérien. Appuyez doucement mais fermement la seringue sur le côté abaxial de la feuille complètement dilatée tout en soutenant la feuille de l’autre côté. Poussez doucement le piston jusqu’à ce que les solutions se remplissent dans la surface foliaire équivalente à 2-3 fois l’extrémité de la seringue.
- Infiltrez jusqu’à quatre taches sur une feuille et 3-4 feuilles par plante, comme le montre la figure 4.
REMARQUE: Changez les gants ou essuyez les gants avec 70% d’alcool entre les échantillons pour éviter la contamination croisée. - Transférer tous les pots sur un plateau et incuber dans une chambre de croissance dans les mêmes conditions que celles mentionnées à l’étape 2.
- Vérifiez une petite partie de la feuille agroinfiltrée à différents moments à l’aide d’un microscope à fluorescence. Lorsque la fluorescence du YFP et du CFP est détectable dans les cellules, passez au microscope confocal pour le test BiFC-FRET FLIM. Dans cette expérience, l’analyse a été réalisée 3 jours après l’agro-infiltration.
REMARQUE: Définissez la période d’incubation post-agroinfiltration individuellement pour chaque promoteur et combinaison de gènes afin d’éviter la surexpression des protéines chimériques utilisées dans le test BiFC-FRET FLIM. La surexpression des protéines partenaires peut conduire à des interactions faussement positives.
4. Préparer les diapositives pour la visualisation de fluorescence
- Lorsque les plantes sont prêtes pour la visualisation, coupez des échantillons de feuilles carrées, à 5-8 mm de la plaie d’infiltration, et montez-les dans de l’eau distillée sur des lames propres.
REMARQUE: Pour minimiser la fluorescence de fond, nettoyez les lames avec de l’éthanol à 80% suivi d’eau distillée 3 à 4 fois, séchez-les à l’air libre et conservez-les sur une feuille absorbante. - Couvrez l’échantillon de feuilles avec un couvercle propre et scellez à l’aide d’un émail à ongles.
- Visualisez ces échantillons sous un microscope confocal à balayage laser.
5. Analyse FRET-FLIM à l’aide d’un microscope à balayage laser confocal
REMARQUE: Dans cette procédure, la base de la détermination et de la quantification de l’interaction entre deux protéines est la réduction de la durée de vie de fluorescence du partenaire donneur FRET lors de son interaction avec l’accepteur, qui est utilisée pour calculer l’efficacité de FRET. La complexité dans le cas d’une interaction tripartite augmente encore parce que l’accepteur FRET, dans ce cas, n’est pas une molécule unique mais une paire YFP-BiFC divisée, qui devrait d’abord être reconstituée in vivo pour devenir un fluorophore fonctionnel ACCEPTEUR FRET. Pour réaliser FRET-FLIM, il faut déterminer la durée de vie de fluorescence de la molécule donneuse, d’abord seule, puis en présence d’un partenaire FRET.
- Ouvrez l’application FLIM dans le microscope à balayage laser confocal, démarrez la console et utilisez le comptage de photons de reconnaissance de formes pour mesurer la durée de vie de la fluorescence. Sélectionnez le mode de mesure standard « Tous comptages de photons ».
- Analyser des échantillons de deux types de plantes agro-infiltrées : l’une avec le donneur seulement (C-CFP) et l’autre avec le donneur et l’accepteur (C-CFP, avec M-YFP) tous deux.
REMARQUE: Étant donné que l’interaction de la protéine M a déjà été validée avec la protéine C à l’aide de BiFC et Y2H, une bonne efficacité FRET est attendue avec cette paire en interaction. - Ensuite, scannez la feuille agro-infiltrée C-CFP et concentrez-vous sur une cellule montrant une bonne fluorescence CFP. Lancez le mode de balayage laser et réglez le système pour la visualisation CFP et les mesures FLIM (λex laser à impulsions de 440 nm, λem 480-520 nm par des détecteurs hybrides, vitesse de balayage 512 x 512 pixels à 400 Hz).
- Ajustez la mise au point, le zoom et le gain intelligent pour vous concentrer sur la zone à capturer.
- Illuminez l’échantillon à une puissance laser suffisante pour obtenir la capture d’environ 0,1 photon par impulsion. Pour les échantillons à intensité de fluorescence variable, capturez 50 images pour recueillir les photons adéquats nécessaires à la mesure de la durée de vie. La CFP présente deux durées de vie de fluorescence en raison de son adaptation conformationnelle; par conséquent, ajuster les données à l’aide du modèle de reconvolution n-exponentielle tout en gardant la valeur de n égale à 2.
- À ces paramètres, le CFP affiche deux durées de vie de 1,0 et 3,2 ns. Ici, la durée de vie supérieure, 3,2 ns, est utilisée pour tous les calculs ultérieurs25,26.
- Pour calculer l’efficacité FRET à l’aide de FLIM, qui est la mesure du degré d’interaction entre deux protéines, prenez un échantillon de feuilles qui a été co-infiltré avec C-CFP et M-YFP. Recherchez une cellule qui exprime à la fois C-CFP et M-YFP et confirmez leurs modèles d’émission respectifs en les excitant à l’aide d’un laser à impulsions λex 440 nm, λem 480-520 nm et λex 514 nm laser à lumière blanche avec λem 526-550 nm. Scannez et identifiez séquentiellement une cellule qui montre à la fois la fluorescence CFP et YFP.
- Après avoir confirmé la fluorescence des deux protéines, passez à la console FLIM pour mesurer la durée de vie de la CFP en utilisant les mêmes paramètres que ceux que nous avons utilisés précédemment pour mesurer la durée de vie de la C-CFP (étape 5.5).
REMARQUE: Cette cellule exprime également M-YFP qui peut potentiellement interagir avec C-CFP et provoquer une réduction de la durée de vie de C-CFP. - Ajuster le graphique obtenu à l’aide du modèle de reconvolution n-exponentielle, avec n = 2. Une diminution de la durée de vie de la PCP de 3,2 à 2,6 ns a été observée, indiquant un transfert d’énergie de résonance de Förster entre la PCP et la PFN(figure 5A).
- Maintenant, démarrez la console FRET dans le logiciel et calculez l’efficacité FRET en entrant manuellement la durée de vie du donneur non inextinguible dans l’équation fournie dans le logiciel. Et l’efficacité FRET observée est de: 56%.
- Interaction tripartite
- Enfin, pour visualiser les interactions entre trois partenaires, prélevez l’échantillon de feuilles d’une plante qui a été co-infiltrée avec C-CFP, M-YFPn et M-YFPc.
- Scannez l’explante de feuilles à la recherche d’une cellule qui montre à la fois la CFP et la fluorescence YFP reconstituée émanant de l’interaction BiFC entre deux protéines M. Utilisez les mêmes longueurs d’onde laser et d’émission que celles utilisées précédemment.
- Par la suite, éteignez le laser 514 nm et passez à la console FLIM.
REMARQUE: Si le dimère M-YFP interagit avec C-CFP, on devrait voir une réduction de la durée de vie de C-CFP observée lors de son interaction avec M-YFP. Cependant, si le C-CFP n’interagit pas avec le dimère M-YFP, sa durée de vie de fluorescence devrait rester à 3,2 ns. - En utilisant des paramètres similaires à ceux mentionnés ci-dessus, mesurez la durée de vie de la PCP en présence d’une PFE reconstituée. Ajustez le graphique obtenu à l’aide du modèle de reconvolution n-exponentielle, avec n = 2, et passez à la console FRET.
REMARQUE : La durée de vie de la PCP diminue, qui est passée de 3,2 à 2,3 ns. Calculez l’efficacité FRET comme décrit ci-dessus. L’efficacité FRET calculée est de 55%. La réduction de la durée de vie du donneur et une bonne efficacité FRET de 55 % confirment l’interaction tripartite entre deux protéines M et la protéine C in vivo (voir figure 5B).
Access restricted. Please log in or start a trial to view this content.
Résultats
Ce protocole représente une méthode optimisée pour étudier in vivo les interactions tripartites protéine-protéine chez les plantes. Le principe de base du protocole est de combiner deux techniques d’interaction protéique marquées par fluorescence, à savoir BiFC et FRET, pour créer un test permettant de mesurer la formation de complexes ternaires entre trois partenaires protéiques. Ici, nous avons utilisé FLIM pour mesurer la durée de vie de fluorescence du partenaire donneur FRET en présence et e...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le présent protocole démontre l’utilisation du test FRET-FLIM à base de BiFC pour déterminer la formation d’un complexe ternaire entre deux monomères d’une protéine MADS-box et d’une protéine de capteur de calcium. Le protocole est adapté d’un rapport de Y. John Shyu et al. où ils ont développé une méthode FRET basée sur BiFC pour visualiser le complexe ternaire formé entre les hétérodimères de Fos-Jun et NFAT ou p65 en utilisant la méthode d’émission sensibilisée7....
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
NB, GG, SB, KC remercient sincèrement la University Grants Commission (UGC), uGC-BSR, DBT-INSPIRE et le Council for Scientific and Industrial Research (CSIR) pour leurs bourses de recherche. Nous remercions le Département de biotechnologie (DBT), le Gouvernement de l’Inde, le Département des sciences et de la technologie (DST-FIST) et le Gouvernement indien pour leur soutien financier.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1 ml Syringes without needles | Dispovan | - | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Gateway LR Clonase II Enzyme mix | Thermo Fischer Scientific | 11791020 | The vectors used in the study are Gateway based |
| Gentamycin Sulphate | Himedia | CMS461 | |
| Kanamycin Sulphate | Himedia | MB105 | |
| MES hydrate | Sigma-Aldrich | M2933 | |
| MgCl2 | Sigma-Aldrich | M2670 | |
| pENTR/D-TOPO Cloning Kit | Thermo Fischer Scientific | K240020 | The vectors used in the study are Gateway based |
| Phusion high fidelity Taq DNA polymerase | Thermo Fischer Scientific | F530-S | Any High fidelity Polymerase can work |
| Rifampicin | Himedia | CMS1889 | |
| SP8 FALCON Confocal laser scanning microscope | Leica | SP8 FALCON | Any CLSM with FLIM capabilities can be used for this analysis |
| Spectinomycin dihydrochloride pentahydrate | Himedia | TC034 |
Références
- Grove, C. A., Walhout, A. J. M. Transcription factor functionality and transcription regulatory networks. Molecular Biosystem. (4), 309-314 (2008).
- Amoutzias, G. D., Robertson, D. L., Van de Peer, Y., Oliver, S. G. Choose your partners: dimerization in eukaryotic transcription factors. Trends in Biochemical Sciences. 33 (5), 220-229 (2008).
- Arora, R., et al. MADS-box gene family in rice: genome-wide identification, organization and expression profiling during reproductive development and stress. BMC Genomics. 8 (242), (2007).
- Theißen, G., Gramzow, L. Structure and evolution of plant MADS domain transcription factors. Plant Transcription Factors: Evolutionary, Structural and Functional Aspects. , 127-138 (2016).
- Schweiger, R., Schwenkert, S. Protein-protein interactions visualized by bimolecular fluorescence complementation in tobacco protoplasts and leaves. Journal of Visualized Experiments: JoVE. (85), (2014).
- Bracha-Drori, K., et al. Detection of protein-protein interactions in plants using bimolecular fluorescence complementation. Plant Journal. 40 (3), 419-427 (2004).
- Shyu, Y. J., Suarez, C. D., Hu, C. Visualization of ternary complexes in living cells by using a BiFC-based FRET assay. Nature Protocols. 3 (11), 1693-1702 (2008).
- Kwaaitaal, M., Keinath, N. F., Pajonk, S., Biskup, C., Panstruga, R. Combined bimolecular fluorescence complementation and förster resonance energy transfer reveals ternary SNARE complex formation in living plant cells. Plant Physiology. 152 (3), 1135-1147 (2010).
- Margineanu, A., et al. Screening for protein-protein interactions using Förster resonance energy transfer (FRET) and fluorescence lifetime imaging microscopy (FLIM). Scientific Reports. 6, (2016).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (07), 1(2020).
- Long, Y., et al. Optimizing FRET-FLIM labeling conditions to detect nuclear protein interactions at native expression levels in living Arabidopsis roots. Frontiers in Plant Science. 9, 1-13 (2018).
- Burman, N., Chandran, D., Khurana, J. P. A Rapid and highly efficient method for transient gene expression in rice plants. Frontiers in Plant Science. , 11(2020).
- Kudla, J., Bock, R. Lighting the way to protein-protein interactions: Recommendations on best practices for bimolecular fluorescence complementation analyses. Plant Cell. 28 (5), 1002-1008 (2016).
- Shyu, Y. J., Hu, C. D. Fluorescence complementation: an emerging tool for biological research. Trends in Biotechnology. 26 (11), 622-630 (2008).
- Kodama, Y., Hu, C. D. An improved bimolecular fluorescence complementation assay with a high signal-to-noise ratio. BioTechniques. 49 (5), 793-803 (2010).
- Kodama, Y., Hu, C. D. Bimolecular fluorescence complementation (BiFC): A 5-year update and future perspectives. BioTechniques. 53 (5), 285-298 (2012).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends in Biochemical Sciences. 32 (9), 407-414 (2007).
- Chakrabarty, R., et al. pSITE vectors for stable integration or transient expression of autofluorescent protein fusions in plants: Probing Nicotiana benthamiana- Virus Interactions. Molecular Plant-Microbe Interactions. 20 (7), 740-750 (2007).
- Walter, M., et al. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant Journal. 40 (3), 428-438 (2004).
- Hellens, R., Mullineaux, P., Klee, H. A guide to Agrobacterium binary Ti vectors. Trends in Plant Science. 5 (10), 446-451 (2000).
- Van Der Hoorn, R. A. L., Rivas, S., Wulff, B. B. H., Jones, J. D. G., Joosten, M. H. A. J. Rapid migration in gel filtration of the Cf-4 and Cf-9 resistance proteins is an intrinsic property of Cf proteins and not because of their association with high-molecular-weight proteins. Plant Journal. 35 (3), 305-315 (2003).
- Xie, X., et al. Engineering SARS-CoV-2 using a reverse genetic system. Nature Protocols. 16, (2021).
- Xu, J., et al. Optimized plasmid construction strategy for Cas9. Cellular Physiology and Biochemistry. 48, 131-137 (2018).
- Mattanovich, D., et al. Efficient transformation of Agrobacterium spp. by electroporation. Nucleic Acids Research. 17 (16), 6747(1989).
- Rizzo, M. A., Springer, G. H., Granada, B., Piston, D. W. An improved cyan fluorescent protein variant useful for FRET. Nature Biotechnology. 22 (4), 445-449 (2004).
- Tramier, M., et al. Picosecond-hetero-FRET microscopy to probe protein-protein interactions in live cells. Biophysical Journal. 83 (6), 3570-3577 (2002).
- Alvarez, L. A. J., et al. SP8 FALCON: a novel concept in fluorescence lifetime imaging enabling video-rate confocal FLIM. Nature Methods. 20, 2-4 (2019).
- Postma, M., Goedhart, J. Plotsofdata-a web app for visualizing data together with their summaries. PLoS Biology. 17 (3), 1-8 (2019).
- Galperin, E., Verkhusha, V. V., Sorkin, A. Three-chromophore fret microscopy to analyze multiprotein interactions in living cells. Nature Methods. 1 (3), 209-217 (2004).
- Waadt, R., Kudla, J. In plant visualization of protein interactions using bimolecular fluorescence complementation (BiFC). Cold Spring Harbor Protocols. 3 (4), (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon