Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthodologie pour tester les agents de contrôle et les insecticides contre l’agrile du café Hypothenemus hampei
Dans cet article
Résumé
Une méthode utilisant des fruits de café vert (GF) a été développée pour tester la toxicité des insecticides contre l’agrile du café (CBB). Des insecticides ou des substances toxiques ont été appliqués sur des GF désinfectés avant ou après l’infestation de CBB. La mortalité, la répulsion et la capacité de reproduction des insectes, en plus d’autres paramètres, ont été évaluées.
Résumé
Avant de recommander des insecticides pour traiter l’agrile du café (CBB) Hypothenemus hampei, il est utile de connaître la mortalité et la répulsion de ces insecticides contre les insectes adultes ou leur impact sur la production reproductive. Cependant, les méthodes actuellement disponibles évaluent uniquement la mortalité adulte, ce qui limite la sélection de nouveaux insecticides ayant un mode d’action différent. Dans ce travail, différentes méthodes expérimentales ont été examinées pour identifier les divers effets sur le CBB dans des conditions de laboratoire. Pour cela, les fruits du café vert (GF) ont été collectés et désinfectés par immersion dans une solution d’hypochlorite de sodium suivie d’une irradiation par la lumière UV. En parallèle, les adultes CBB d’une colonie ont été désinfectés par immersion dans une solution d’hypochlorite de sodium. Pour évaluer la protection des fruits (préinfestation), les fruits ont été placés dans des boîtes en plastique et les insecticides ont été appliqués. Ensuite, les adultes CBB ont été libérés à un taux de deux CBC par GF. Les GF ont été laissés dans des conditions contrôlées pour évaluer l’infestation de CBB et la survie après 1, 7, 15 et 21 jours. Pour évaluer l’efficacité de l’insecticide après une infestation de CBB (post-infestation), des adultes de CBB ont été relâchés dans les GF dans un rapport de 2:1 pendant 3 h à 21 °C. Les fruits infestés montrant des adultes CBB avec leur abdomen partiellement exposé ont été sélectionnés et placés dans des grilles de 96 puits, et les CBC forant dans les fruits ont été traités directement. Après 20 jours, les fruits ont été disséqués et les étapes biologiques CBB à l’intérieur de chaque fruit ont été enregistrées. Les GF ont servi de substrats qui imitent les conditions naturelles pour évaluer les insecticides toxiques, chimiques et biologiques contre le CBB.
Introduction
L’agrile des baies de café (CBB), Hypothenemus hampei, a été détecté pour la première fois en 1988 en Colombie et est depuis devenu l’espèce de ravageur la plus importante de la culture du café. Les femelles CBB quittent le fruit natal déjà fécondé, à la recherche de nouveaux fruits guidés par les produits chimiques volatils qu’elles émettent 1,2. Un cycle complet est accompli dans les 23 jours3 à une température de 25 °C. Le cycle commence avec la femelle fondatrice pénétrant dans la graine et pondant des œufs dans l’endosperme du fruit. Les larves écloses mangent la graine. Si les fruits sont disséqués à ce stade, il serait possible d’observer à la fois la femelle fondatrice et sa progéniture. Après 14 jours, les larves deviennent des nymphes - généralement, le stade des nymphes dure 5 jours. Au stade adulte, les femelles copulent avec leurs frères et sœurs, et les femelles nouvellement fécondées s’envolent loin des fruits endommagés à la recherche de nouveaux fruits de café pour commencer un nouveau cycle4.
Le processus de pénétration et le résultat de l’alimentation larvaire endommagent la graine de café, diminuant la qualité de la boisson au café et réduisant considérablement les revenus; une infestation supérieure à 5 % dans les plantations de café est généralement considérée comme le seuil économique.
La lutte contre la CBB est fondée sur une stratégie de lutte intégrée contre les ravageurs (LAI), y compris la lutte culturelle et les pratiques agronomiques, les agents biologiques naturels et l’utilisation d’insecticides chimiques, ce qui nécessite des conditions de sécurité et une application en temps opportun4.
Pour évaluer de nouveaux insecticides pour la lutte contre le CBB, des méthodologies peu coûteuses sont nécessaires pour permettre d’obtenir des résultats rapides. Des procédures de laboratoire et de terrain sont actuellement utilisées, y compris des régimes artificiels contenant du café dans lesquels les insecticides sont incorporés 5,6, ou la pulvérisation des insecticides sur du café parchemin sec 7,8,9. En outre, des expériences menées sur le terrain à l’aide de branches de café recouvertes de manchons entomologiques ont été rapportées10,11; cependant, ces méthodes nécessitent un travail intense et de longues périodes d’évaluation.
Une condition ressemblant aux conditions naturelles du champ, qui est également rapide et peu coûteuse, est l’utilisation de fruits de café verts ou mûrs. Cependant, ces fruits doivent être maintenus dans des conditions propices au développement du CBB, en évitant les altérations et les contaminants par les micro-organismes pour maintenir leur qualité et leurs propriétés. À cette fin, différents désinfectants ont été utilisés, ainsi que des procédures impliquant la chaleur et le rayonnement 7,9,12,13,14,15,16.
De plus, les méthodes d’évaluation des insecticides par rapport au CBB nécessitent des simulations de femelles adultes volant à la recherche de fruits ou pénétrant dans ces fruits17,18. Pour cela, des infestations artificielles de fruits ont été effectuées sur le terrain 8,11,19, bien que ce processus nécessite beaucoup de main-d’œuvre et dépende des conditions environnementales.
Nous décrivons ici une méthodologie normalisée pour l’évaluation des produits qui peuvent avoir des effets différents sur le CBB dans des conditions environnementales contrôlées qui ressemblent à des conditions de terrain.
Access restricted. Please log in or start a trial to view this content.
Protocole
REMARQUE: Ce protocole traite de différentes méthodes pour identifier différents effets sur le CBB dans des conditions de laboratoire.
1. Collecte de fruits
- Cueillez des GF avec un âge de développement d’environ 120 à 150 jours après la floraison des arbres dans une plantation de café tôt le matin.
2. Désinfection des fruits20
- Apportez environ 300 GF au laboratoire. Sélectionnez des GF de taille uniforme et saines et retirez les pédoncules.
- Trempez les GF dans une solution de savon (2 mL de savon à vaisselle liquide dans 998 mL d’eau du robinet), puis frottez pour laver les GF. Ensuite, rincez les fruits avec de l’eau, en changeant l’eau trois fois.
- Immerger les GF dans une solution d’hypochlorite de sodium à 0,5 % (100 mL dans 900 mL d’eau du robinet) et incorporer un agitateur à 110 tr/min pendant 15 min. Ensuite, rincez les GF avec de l’eau en remuant dans un shaker et en changeant l’eau trois fois, toutes les 10 minutes.
- Séchez les GF avec des serviettes en papier stériles.
- Placez les GF dans des plateaux (33 cm x 25 cm x 2 cm) et irradiez-les pendant 15 min, en plaçant les GF à une distance de 55 cm de la source UV à l’intérieur d’une station d’écoulement laminaire horizontal compatible UV.
- Pendant la période de 15 minutes, toutes les 5 minutes, déplacez les GF pour assurer l’irradiation du fruit entier.
3. Désinfection par les insectes21
- Utilisez des insectes CBB nouvellement émergés (le jour même) pour mettre en place les essais biologiques.
- Immerger les CBC dans une solution d’hypochlorite de sodium à 0,5%, en les agitant lentement avec une brosse pendant 10 min.
- Filtrer les CBC à travers un chiffon en mousseline et les laver trois fois avec de l’eau distillée stérile.
- Enlevez l’excès d’eau avec des serviettes en papier stériles.
4. Évaluation d’un produit ayant un effet protecteur sur les fruits (préinfestation) (Figure 1)
- Utilisez un groupe de GF par unité expérimentale. Généralement, un groupe de 30 GF est utilisé par unité expérimentale.
- Placez les GF dans des boîtes en plastique (unité expérimentale).
- Appliquer le produit d’essai aux différentes concentrations pour évaluation. Effectuez l’application avec un pulvérisateur portable. Ici, une émulsion d’alcaloïdes à 5% et 6% a été testée.
- Comme contrôle, vaporisez de l’eau sur un groupe de GF.
- Utilisez au moins trois répétitions (unité expérimentale) par traitement, en pulvérisant l’une après l’autre.
- Dans une hotte stérile, relâchez deux adultes CBB par GF (un total de 60 CBC sont introduits dans les boîtes en plastique). Après 30 min, couvrez les boîtes.
- Laissez les boîtes en plastique avec les GF infestés dans une pièce ou un incubateur dans des conditions contrôlées (obscurité, 25 ± 2 °C et humidité relative 71 % ± 5 %).
- Après 1, 7, 15 et 21 jours, comptez le nombre de fruits de foreurs et d’insectes vivants et morts à l’extérieur des fruits dans chaque boîte.
- 20 jours après l’infestation, disséquez chaque GF sous un stéréomicroscope, grossissant 10x.
- Comptez le nombre de graines saines ou de graines endommagées par les insectes dans chaque fruit.
- Compter les différents stades biologiques CBB22 observés et compter le nombre d’insectes morts dans chaque graine pour déterminer la mortalité des insectes par unité expérimentale.
5. Évaluation de l’effet d’un produit après une infestation par le CBB (post-infestation) (figure 3)
- Utilisez des groupes de 200 fruits par traitement.
- Dans une hotte stérile, relâchez les adultes CBB (rapport 2:1 des adultes CBB aux GF) aux GF précédemment désinfectés, ce qui permet à l’infestation de se poursuivre pendant 3 h à 21 ° C.
- Examinez les GF. Après 3 h, la plupart devraient être infestés, avec l’abdomen des CBC encore exposé (position A20), comme le montre la figure 2.
- Sélectionnez 46 GF infestés (position A) et placez-les dans des racks en plastique à 96 puits (unité expérimentale). Les fruits doivent rester dans cette position afin que le traitement puisse être directement pulvérisé sur le CBB perforant le fruit.
- Vaporiser au moins trois fois (trois racks) par traitement, l’un après l’autre, en recouvrant les racks après 30 min.
- Laissez les racks avec les GF infestés dans une pièce ou un incubateur dans des conditions contrôlées (obscurité, 25 ± 2 °C et humidité relative 71 % ± 5 %).
- Après 20 jours, disséquez les GF sous un stéréomicroscope à un grossissement de 10x.
- Comptez le nombre de graines saines ou de graines endommagées par les insectes dans chaque fruit.
- Compter les différents stades biologiquesCBB 22 et le nombre d’insectes morts dans chaque graine pour déterminer la mortalité des insectes par unité expérimentale.
6. Évaluation d’un produit ayant un effet dissuasif sur le CBB
- Suivez les étapes 4.1 à 4.6 décrites pour évaluer un produit ayant un effet protecteur sur les fruits.
- Après avoir relâché les adultes CBB dans les boîtes en plastique, comptez le nombre de CBC qui s’envolent des boîtes et le nombre qui infeste les GF. Ensuite, suivez les étapes 4.7 à 4.11.
- Suivez les étapes 5.1 à 5.5 décrites pour évaluer le produit après l’infestation de CBB.
- Après avoir pulvérisé chaque traitement sur les insectes en position A, comptez le nombre de CBC qui se sont déplacés hors du GF et/ou se sont envolés du GF. Ensuite, suivez les étapes 5.6 à 5.9.
7. Analyse statistique
REMARQUE: Les variables de réponse sont les pourcentages de mortalité au fil du temps et le pourcentage de graines de café saines non infestées.
- Estimer la moyenne et l’écart-type de chaque variable de réponse pour chaque traitement.
- Effectuer une analyse de la variance pour chaque variable de réponse avec un modèle pour un plan complètement aléatoire.
REMARQUE: Le test de comparaison de 5% de Dunnett est effectué pour comparer les traitements au contrôle absolu (contrôle de l’eau). - Lorsque les traitements sont significativement différents du contrôle absolu, utilisez un test de différence la moins significative (LSD) de 5% pour comparer les traitements.
- Évaluer la puissance du test; si elles sont supérieures à 85 %, les hypothèses de normalité et d’homogénéité des variances sont remplies.

Figure 1 : Procédure d’évaluation des effets préinfestants des insecticides sur le CBB. Étapes d’évaluation des effets préinfestation des insecticides sur Hypothenemus hampei (CBB) à l’aide de fruits verts (GF). (A) Sélection des fruits. B) Pulvérisation des insecticides sur les fruits du café. (C) Infestation de fruits de café par le CBB dans un rapport de 2:1 CBB par GF. D) Fruits infestés. E) Incubation des fruits dans des conditions contrôlées. F) Dissection des fruits. (G) Compter la population de CBB à l’intérieur des semences. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Traiter l’infestation de CBB par les fruits du café. Les fruits infestés contiennent des adultes CBB dont l’abdomen est partiellement exposé (position A). Veuillez cliquer ici pour voir une version agrandie de cette figure.
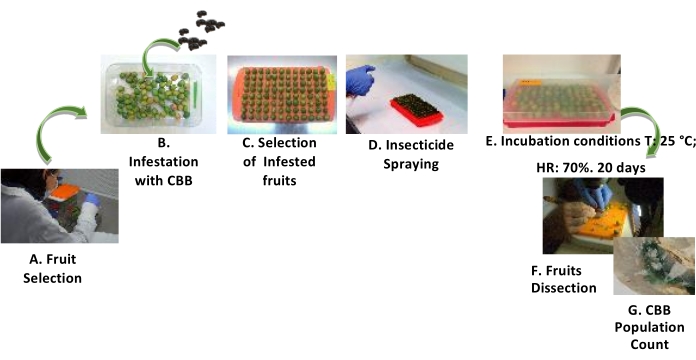
Figure 3 : Procédure d’évaluation des effets posinfestation des insecticides sur le CBB. Étapes d’évaluation des effets post-infestation des insecticides sur le CBB à l’aide de GF. (A) Sélection des fruits. (B) Infestation des fruits par CBB dans un rapport de 2:1 CBB par GF. (C) Sélection des fruits infestés. D) Pulvérisation de l’insecticide sur les fruits. E) Incubation des fruits. F) Dissection des fruits. (G) Compter la population CBB. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les résultats ont montré que les femelles CBB reconnaissaient les fruits, et en fonction des caractéristiques de la surface du fruit et des odeurs émises, les femelles CBB ont commencé à pénétrer ou à porter les fruits dans les 3 h à 21 °C.
L’effet d’un insecticide sur le CBB lorsqu’il est appliqué sur les fruits du café (procédure de préinfestation) après 24 h et au fil du temps est illustré à la figure 4. Les deux insecticides (émulsion ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans ce protocole, la désinfection des fruits ainsi que des insectes sont des étapes critiques. Lorsque les fruits des champs sont utilisés en laboratoire, ils présentent fréquemment une contamination et une déshydratation élevées, car des micro-organismes et des acariens sont présents dans l’épiderme 7,15,16. Par conséquent, l’utilisation de fruits ou d’insectes qui ne sont pas désinfectés entraînera la mort...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun des auteurs n’a de conflit d’intérêts à déclarer.
Remerciements
Les auteurs expriment leurs remerciements à la Fédération nationale des producteurs de café de Colombie, aux assistants du Département d’entomologie (Diana Marcela Giraldo, Gloria Patricia Naranjo), à la station expérimentale Naranjal et à Jhon Félix Trejos.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Beaker with spout, low form 500 mL | BRAND PP | BR87826 | |
| Benchtop Shaker | New Brunswick Scientific Innova 4000 Incubator Shaker | ||
| Dishwashing liquid soap-AXION | Colgate-Palmolive | AXION | |
| Hood; Horizontal Laminar Flow Station | Terra Universal | Powder-Coated Steel, 1930 mm W x 1118 mm D x 1619 mm H, 120 V (https://www.terrauniversal.com/hood-horizontal-laminar-flow-station-9620-64a.html) | |
| Insects CBB | BIOCAFE | (http://avispitas.blogspot.com/p/biocafe.html). | |
| Multi Fold White paper towels | Familia | 73551 | |
| Preval Spray unit | Preval Merck | Z365556-1KT | https://www.sigmaaldrich.com/CO/es/product/sigma/z365556?gclid=Cj0KCQiAweaNBhDEARIsAJ 5hwbfZOy1TWGj6huatFtRQt AzOyHe5-oBiKnOUK2T1exuuk WwJLdvxkvsaAjoYEALw_wcB |
| Reversible Racks 96-Well | heathrowscientific | HEA2345A | https://www.heathrowscientific.com/reversible-racks-96-well-i-hea2345a |
| Scalpel blades N 11 | Merck | S2771-100EA | |
| Scalpel handles N3 | Merck | S2896-1EA | |
| Sodium Hypochloride | The clorox company | Clorox | |
| Stereo Microscope | Zeiss | Stemi 508 | https://www.zeiss.com/microscopy/int/products/stereo-zoom-microscopes/stemi-508.html |
Références
- Mendesil, E., et al. Semiochemicals used in host location by the coffee berry borer, Hypothenemus hampei. Journal of Chemical Ecology. 35 (8), 944-950 (2009).
- Jaramillo, J., et al. Coffee berry borer joins bark beetles in coffee klatch. PLoS ONE. 8 (9), 74277(2013).
- Giraldo-Jaramillo, M., Garcia, A. G., Parra, J. R. Biology, thermal requirements, and estimation of the number of generations of Hypothenemus hampei (Ferrari, 1867) (Coleoptera: Curculionidae) in the state of São Paulo, Brazil. Journal of Economic Entomology. 111 (5), 2192-2200 (2018).
- Benavides, P., Góngora, C., Bustillo, A. IPM Program to Control Coffee Berry Borer Hypothenemus hampei, with Emphasis on Highly Pathogenic Mixed Strains of Beauveria bassiana, to Overcome Insecticide Resistance in Colombia. IntechOpen. , (2012).
- Martínez, C. P., Echeverri, C., Florez, J. C., Gaitan, A. L., Góngora, C. E. In vitro production of two chitinolytic proteins with an inhibiting effect on the insect coffee berry borer, Hypothenemus hampei (Ferrari) (Coleoptera: Curculionidae) and the fungus Hemileia vastatrix the most limiting pests of coffee crops. AMB Express. 2, 1-11 (2012).
- Padilla, B. E., Acuña, Z., Velásquez, C. S., Rubio, G. J. D. Inhibitors of [alpha]-amylases from the coffee berry borer Hypothenemus hampei in different plant species. Revista Colombiana de Entomología. 32 (2), 125-130 (2006).
- Alvarez, J. H., Cortina, H. A., Villegas, J. F. Methods to evaluate antibiosis to Hypothenemus hampei Ferrari in coffee under controlled conditions. Cenicafé. 52 (3), 205-214 (2001).
- Arcila, A., Duarte, A. F., Villalba, D. A., Benavides, P. New Product in the Integrated Management of the Coffee Berry Borer in Colombia. National Coffee Research Center (Cenicafé). , Available from: https://biblioteca.cenicafe.org/handle/10778/477 (2014).
- Jaramillo, J., Montoya, E., Benavides, P., Góngora, C. Beauveria bassiana and Metarhizium anisopliae for the control of coffee brocade in fruits on the ground. Revista Colombiana de Entomología. 41, 95-104 (2015).
- Bastidas, A., Velásquez, E., Benavides, P., Bustillo, A., Orozco, C. Evaluation of preformulated Beauveria bassiana (Bálsam) Vuillemin, for the control of the coffee berry borer. Agronomia. 17, 44-61 (2009).
- Villalba-Gault, D., Bustillo, A., Chaves Cordoba, B. Evaluation of insecticides for the control of the coffee berry borer in Colombia. Cenicafe. 46, 152-163 (1995).
- Bustillo, A. E., Orozco, J., Benavides, P., Portilla, M. Mass production and use of parasitoids for the control of the coffee berry borer in Colombia. Cenicafe. 47 (4), 215-230 (1996).
- Celestino, F. N., Pratissoli, D., Machado, L. C., Santos Junior, H. J. G. D., Mardgan, L., Ribeiro, L. V. Adaptation of breeding techniques of the coffee berry borer [Hypothenemus hampei (Ferrari). Coffee Science. 11 (2), 161-168 (2016).
- Domínguez, L., Parzanese, M. Ultraviolet light in food preservation. Argentine Foods. 52 (2), 70-76 (2012).
- Jaramillo, J., Chabi-Olaye, A., Poehling, H. M., Kamonjo, C., Borgemeister, C. Development of an improved laboratory production technique for the coffee berry borer Hypothenemus hampei, using fresh coffee berries. Entomologia Experimentalis et Applicata. 130 (3), 275-281 (2009).
- Pérez, J., Infante, F., Vega, F. E. Does the coffee berry borer (Coleoptera: Scolytidae) have mutualistic fungi. Annals of the Entomological Society of America. 98 (4), 483-490 (2005).
- Benavides, P., Gil, P., Góngora, C., Arcila, A. Integrated pest management. Cenicafe. Manual of the Colombian coffee grower: Research and technology for the sustainability of coffee growing. Manizales: FNC: Cenicafé. 3, 179-214 (2013).
- Bustillo, P. A review of the coffee berry borer, Hypothenemus hampei (Coleoptera: Curculionidae: Scolytinae), in Colombia. Revista Colombiana de Entomología. 32 (2), 101-116 (2006).
- Arcila, A., Benavides, P., Mejia, J. New Chemical Control Alternative for the Integrated Management of the Coffee Berry Borer. National Coffee Research Center (Cenicafé). , Available from: https://biblioteca.cenicafe.org/handle/10778/557 (2015).
- Tapias, L., Martinez, C., Benavides, P., Gongora, C. Laboratory method to evaluate the effect of insecticides on the coffee berry borer. Cenicafé. 68 (2), 76-89 (2017).
- Bustillo, A. E., Marín, P. How to reactivate the virulence of Beauveria bassiana to control the coffee berry borer. Manejo Integrado de Plagas. 63, (2002).
- Constantino, L. M., et al. morphological and genetic aspects of Hypothenemus obscurus and Hypothenemus hampei (Coleoptera: Curculionidae: Scolytinae). Revista Colombiana de Entomología. 37 (2), 173-182 (2011).
- Estrela, C., et al. Mechanism of action of sodium hypochlorite. Brazilian Dental Journal. 13 (2), 113-117 (2002).
- Diffey, B. L. Solar ultraviolet radiation effects on biological systems. Physics in Medicine and Biology. 36 (3), 299-328 (1991).
- BIOCAFE. , Available from: http://avispitas.blogspot.com/p/biocafe.html (2022).
- Bustillo, A. E., et al. Integrated Management of the Coffee Berry Borer: Hypothenemus hampei Ferrari in Colombia. , Available from: https://biblioteca.cenicafe.org/hangle/10778/848 (1998).
- Portilla, R. Development and evaluation of an artificial diet for the rearing of Hypothenemus hampei. Cenicafé. 50, 24-38 (1999).
- Portilla, R. M., Streett, D. A. New techniques for automated mass production of Hypothenemus hampei on the modified Cenibroca artificial diet. Cenicafé. 57, 37-50 (2006).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon