Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методология тестирования контрольных агентов и инсектицидов против кофейной ягоды Borer Hypothenemus hampei
В этой статье
Резюме
Был разработан метод с использованием плодов зеленого кофе (ГФ) для проверки токсичности инсектицидов против бура кофейной ягоды (CBB). Инсектициды или токсичные вещества применялись к дезинфицируемым ГФ до или после заражения ЦББ. Оценивалась смертность насекомых, репеллентность и репродуктивная способность, в дополнение к другим параметрам.
Аннотация
Прежде чем рекомендовать инсектициды для обработки кофейной ягоды (CBB) Hypothenemus hampei, полезно знать смертность и репеллентность этих инсектицидов против взрослых насекомых или их влияние на репродуктивный выход. Однако имеющиеся в настоящее время методы оценивают только смертность взрослых, ограничивая выбор новых инсектицидов другим способом действия. В этой работе были изучены различные экспериментальные методы для выявления различных эффектов на ЦБД в лабораторных условиях. Для этого плоды зеленого кофе (ГФ) собирали и дезинфицировали погружением в раствор гипохлорита натрия с последующим ультрафиолетовым облучением. Параллельно взрослых CBB из колонии дезинфицировали погружением в раствор гипохлорита натрия. Для оценки защиты плодов (прединфекции) плоды помещали в пластиковые коробки, а инсектициды применяли. Затем взрослые CBB были выпущены со скоростью два CBB на GF. GF оставляли в контролируемых условиях для оценки заражения CBB и выживаемости через 1, 7, 15 и 21 день. Для оценки эффективности инсектицидов после заражения CBB (постинфекцией) взрослых CBB выпускали в ГФ в соотношении 2:1 в течение 3 ч при 21 °C. Зараженные плоды, показывающие взрослых особей CBB с частично обнаженными брюшками, были отобраны и помещены в 96-луночные стойки, а CBB, бурящиеся в плодах, были обработаны напрямую. Через 20 дней плоды были рассечены, и биологические стадии CBB внутри каждого плода были зарегистрированы. GF служили субстратами, которые имитируют природные условия для оценки токсичных, химических и биологических инсектицидов против CBB.
Введение
Кофейный ягодный бур (CBB), Hypothenemus hampei, был впервые обнаружен в 1988 году в Колумбии и с тех пор стал самым важным видом вредителей кофейной культуры. Самки CBB оставляют натальные плоды уже оплодотворенными, ища новые плоды, руководствуясь летучими химическими веществами, которые они выделяют 1,2. Полный цикл выполняется в течение 23 дней3 при температуре 25 °C. Цикл начинается с того, что самка-основатель проникает в семя и откладывает яйца в эндосперм плода. Обездоленные личинки едят семена. Если в этот момент препарировать плоды, то можно будет наблюдать как за самкой-основательницей, так и за ее потомством. Через 14 дней личинки становятся куколками — вообще, стадия куколок длится 5 дней. Во взрослой стадии самки совокупляются со своими братьями и сестрами, а недавно оплодотворенные самки улетают от поврежденных плодов в поисках новых кофейных плодов, чтобы начать новый цикл4.
Как процесс проникновения, так и результат кормления личинками повреждают кофейное семя, снижая качество кофейного напитка и значительно снижая доход; более 5% заражения на кофейных плантациях обычно считается экономическим порогом.
Борьба с ЦБД основана на стратегии комплексной борьбы с вредителями (ИПМ), включая культурный контроль и агрономические методы, природные биологические агенты и использование химических инсектицидов, что требует условий безопасности и своевременного применения4.
Для оценки новых инсектицидов для борьбы с ЦББ необходимы недорогостоящие методологии, позволяющие получать быстрые результаты. В настоящее время используются как лабораторные, так и полевые процедуры, включая искусственные диеты, содержащие кофе, в которые включены инсектициды 5,6, или распыление инсектицидов на сухой пергаментный кофе 7,8,9. Кроме того, сообщалось об экспериментах, проведенных в полевых условиях с использованием ветвей кофейных деревьев, покрытых энтомологическими рукавами,- 10,11; однако эти методы требуют интенсивного труда и длительных периодов оценки.
Условием, напоминающим естественные полевые условия, которое также является быстрым и недорогим, является использование зеленых или спелых кофейных плодов. Однако эти плоды должны содержаться в условиях, подходящих для развития CBB, избегая изменений и загрязнений микроорганизмами для поддержания их качества и свойств. С этой целью были использованы различные дезинфицирующие средства, а также процедуры, связанные с теплом и радиацией 7,9,12,13,14,15,16.
Кроме того, методы оценки инсектицидов в сопоставлении с CBB требуют моделирования взрослых самок, летающих в поисках фруктов или проникающих в эти плоды17,18. Для этого искусственных фруктовых инвазий было проведено в поле 8,11,19, хотя этот процесс трудоемкий и зависит от условий окружающей среды.
Здесь мы описываем стандартизированную методологию оценки продуктов, которые могут оказывать различное воздействие на ЦБД в контролируемых условиях окружающей среды, напоминающих полевые условия.
протокол
ПРИМЕЧАНИЕ: В настоящем протоколе рассматриваются различные методы выявления различных видов воздействия на ЦБД в лабораторных условиях.
1. Коллекция фруктов
- Выбирайте ГФ с возрастом развития ~120-150 дней после цветения с деревьев на кофейной плантации рано утром.
2. Дезинфекция фруктов20
- Принесите в лабораторию около 300 ГФ. Выберите однородные по размеру и здоровые ГФ и извлеките цветоносы.
- Окуните ГФ в мыльный раствор (2 мл жидкого мыла для мытья посуды в 998 мл водопроводной воды), а затем втирайте для мытья ГФ. Затем промойте плоды водой, трижды сменив воду.
- Погружают ГФ в 0,5% раствор гипохлорита натрия (100 мл в 900 мл водопроводной воды) и перемешивают в шейкере при 110 об/мин в течение 15 мин. Затем промойте ГФ водой, помешивая в шейкере и меняя воду три раза, каждые 10 минут.
- Высушите ГФ стерильными бумажными полотенцами.
- Поместите ГФ в лотки (33 см х 25 см х 2 см) и облучите их в течение 15 минут, разместив ГФ на расстоянии 55 см от источника УФ внутри горизонтальной ламинарной проточной станции с УФ-поддержкой.
- В течение 15-минутного периода каждые 5 минут перемещайте ГФ, чтобы обеспечить облучение всего плода.
3. Дезинфекция насекомых21
- Используйте недавно появившихся (в тот же день) насекомых CBB для создания биоанализов.
- Погрузите CBB в 0,5% раствор гипохлорита натрия, медленно перемешивая их щеткой в течение 10 мин.
- Процедите CBB через муслиновую ткань и трижды вымойте их стерильной дистиллированной водой.
- Удалите лишнюю воду стерильными бумажными полотенцами.
4. Оценка продукта, оказывающего защитное действие на плоды (прединфекция) (Рисунок 1)
- Используйте группу ГФ на экспериментальную единицу. Как правило, на экспериментальную единицу используется группа из 30 ГФ.
- Поместите ГФ в пластиковые коробки (экспериментальный блок).
- Применяйте тестируемый продукт в различных концентрациях для оценки. Выполните нанесение с помощью портативного опрыскивателя. Здесь тестировали алкалоидную эмульсию на 5% и 6%.
- В качестве контроля опрыскивайте группу ГФ водой.
- Используйте не менее трех повторений (экспериментальный блок) за обработку, распыляя одно за другим.
- В стерильной вытяжке выпустите двух взрослых CBB на ГФ (в общей сложности 60 CBB вводятся в пластиковые коробки). Через 30 мин накройте коробки.
- Оставьте пластиковые коробки с зараженными ГФ в помещении или инкубаторе в контролируемых условиях (темное, 25 ± 2 °C и относительная влажность 71% ± 5%).
- Через 1, 7, 15 и 21 день подсчитайте количество плодов буры и живых и мертвых насекомых вне плодов в каждой коробке.
- Через 20 дней после заражения рассекают каждый ГФ под стереомикроскопом, увеличение в 10 раз.
- Подсчитайте количество здоровых семян или семян, поврежденных насекомыми в каждом плоде.
- Подсчитайте различные наблюдаемые биологические стадии CBB22 и подсчитайте количество мертвых насекомых в каждом семени, чтобы определить смертность насекомых на экспериментальную единицу.
5. Оценка эффекта продукта после заражения CBB (постинфекция) (рисунок 3)
- Используйте группы по 200 фруктов на обработку.
- В астерильной вытяжке высвобождают CBB взрослых (соотношение CBB взрослых к GFs 2: 1) к ранее продезинфицированным GF, что позволяет заражению продолжаться в течение 3 ч при 21 °C.
- Изучите ГФ. Через 3 ч большинство из них должны быть заражены, при этом брюшная часть КБК все еще обнажается (положение А20), как показано на рисунке 2.
- Выберите 46 зараженных ГФ (позиция А) и поместите их в пластиковые стеллажи из 96 скважин (экспериментальная установка). Плоды должны оставаться в этом положении, чтобы обработку можно было непосредственно распылять на CBB, перфорирующий плод.
- Опрыскивайте не менее трех раз (три стойки) за обработкой, одну за другой, накрывая стойки через 30 мин.
- Оставьте стойки с зараженными ГФ в помещении или инкубаторе в контролируемых условиях (темно, 25 ± 2 °C и относительная влажность 71% ± 5%).
- Через 20 дней рассекните ГФ под стереомикроскопом с 10-кратным увеличением.
- Подсчитайте количество здоровых семян или семян, поврежденных насекомыми в каждом плоде.
- Подсчитайте различные биологические стадииCBB 22 и количество мертвых насекомых в каждом семени, чтобы определить смертность насекомых на экспериментальную единицу.
6. Оценка продукта, оказывающего сдерживающее воздействие на ЦББ
- Выполните шаги 4.1-4.6, описанные для оценки продукта, оказывающего защитное действие на плоды.
- После выпуска взрослых CBB в пластиковые коробки подсчитайте количество CBB, которые вылетают из коробок, и количество, которое заражает GF. Затем выполните шаги 4.7-4.11.
- Выполните шаги 5.1-5.5, описанные для оценки продукта после заражения CBB.
- После распыления каждой обработки на насекомых в положении А подсчитайте количество КББ, которые вышли из ГФ и/или улетели из ГФ. Затем выполните шаги 5.6-5.9.
7. Статистический анализ
ПРИМЕЧАНИЕ: Переменными ответа являются процент смертности с течением времени и процент здоровых неинфекционных семян кофе.
- Оцените среднее и стандартное отклонение каждой переменной ответа для каждого лечения.
- Выполните анализ дисперсии для каждой переменной ответа с помощью модели для полностью рандомизированного проектирования.
ПРИМЕЧАНИЕ: Сравнительный тест Даннетта на 5% проводится для сравнения обработок с абсолютным контролем (контроль воды). - Когда лечение значительно отличается от абсолютного контроля, используйте тест на 5% наименее значимую разницу (ЛСД) для сравнения методов лечения.
- Оцените мощность теста; если больше 85%, то выполняются предположения о нормальности и однородности дисперсий.

Рисунок 1: Процедура оценки прединфекционного воздействия инсектицидов на ЦБД. Этапы оценки прединфекционного воздействия инсектицидов на Hypothenemus hampei (CBB) с использованием зеленых плодов (GFs). А) Выбор фруктов. (B) Распыление инсектицидов на плоды кофе. (C) Заражение плодами кофе CBB в соотношении 2:1 CBB на GF. D) Зараженные фрукты. Е) Инкубация плодов в контролируемых условиях. F) Вскрытие фруктов. G) Подсчет популяции ЦББ внутри семян. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Обработка заражения плодами кофе CBB. Зараженные плоды содержат взрослых особей CBB с частично обнаженными брюшками (позиция A). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
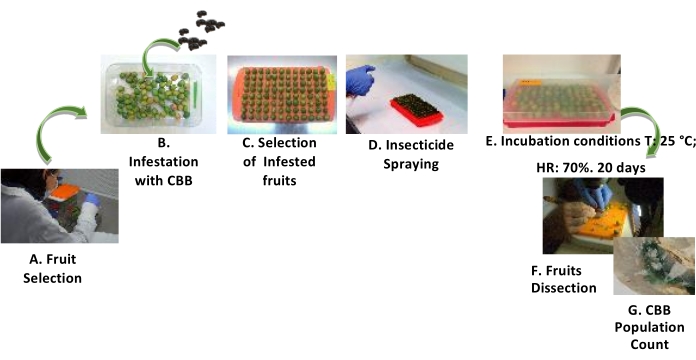
Рисунок 3: Процедура оценки позинфезивного воздействия инсектицидов на ЦБД. Этапы оценки постинфезивного воздействия инсектицидов на ЦББ с использованием ГФ. (А) Селекция плодов. (B) Заражение плодов CBB в соотношении 2:1 CBB на GF. С) Отбор зараженных фруктов. D) распыление инсектицида на плоды. Е) Инкубация плодов. F) Вскрытие фруктов. G) подсчет населения ЦББ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Результаты показали, что самки CBB распознавали плоды, и в зависимости от характеристик поверхности плодов и испускаемых запахов самки CBB начали проникать или выносить плоды в течение 3 ч при 21 °C.
Влияние инсектицида на CBB при нанесении на плоды кофе (процедура прединфекции...
Обсуждение
В этом протоколе дезинфекция плодов, а также насекомых является критическим шагом. Когда плоды с поля используются в лаборатории, они часто показывают высокое загрязнение и обезвоживание, поскольку микроорганизмы и клещи присутствуют в эпидермисе 7,15,16
Раскрытие информации
Ни у одного из авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы выражают благодарность Национальной федерации производителей кофе Колумбии, ассистентам кафедры энтомологии (Диана Марсела Хиральдо, Глория Патрисия Наранхо), Экспериментальной станции Наранжал и Джону Феликсу Трехосу.
Материалы
| Name | Company | Catalog Number | Comments |
| Beaker with spout, low form 500 mL | BRAND PP | BR87826 | |
| Benchtop Shaker | New Brunswick Scientific Innova 4000 Incubator Shaker | ||
| Dishwashing liquid soap-AXION | Colgate-Palmolive | AXION | |
| Hood; Horizontal Laminar Flow Station | Terra Universal | Powder-Coated Steel, 1930 mm W x 1118 mm D x 1619 mm H, 120 V (https://www.terrauniversal.com/hood-horizontal-laminar-flow-station-9620-64a.html) | |
| Insects CBB | BIOCAFE | (http://avispitas.blogspot.com/p/biocafe.html). | |
| Multi Fold White paper towels | Familia | 73551 | |
| Preval Spray unit | Preval Merck | Z365556-1KT | https://www.sigmaaldrich.com/CO/es/product/sigma/z365556?gclid=Cj0KCQiAweaNBhDEARIsAJ 5hwbfZOy1TWGj6huatFtRQt AzOyHe5-oBiKnOUK2T1exuuk WwJLdvxkvsaAjoYEALw_wcB |
| Reversible Racks 96-Well | heathrowscientific | HEA2345A | https://www.heathrowscientific.com/reversible-racks-96-well-i-hea2345a |
| Scalpel blades N 11 | Merck | S2771-100EA | |
| Scalpel handles N3 | Merck | S2896-1EA | |
| Sodium Hypochloride | The clorox company | Clorox | |
| Stereo Microscope | Zeiss | Stemi 508 | https://www.zeiss.com/microscopy/int/products/stereo-zoom-microscopes/stemi-508.html |
Ссылки
- Mendesil, E., et al. Semiochemicals used in host location by the coffee berry borer, Hypothenemus hampei. Journal of Chemical Ecology. 35 (8), 944-950 (2009).
- Jaramillo, J., et al. Coffee berry borer joins bark beetles in coffee klatch. PLoS ONE. 8 (9), 74277 (2013).
- Giraldo-Jaramillo, M., Garcia, A. G., Parra, J. R. Biology, thermal requirements, and estimation of the number of generations of Hypothenemus hampei (Ferrari, 1867) (Coleoptera: Curculionidae) in the state of São Paulo, Brazil. Journal of Economic Entomology. 111 (5), 2192-2200 (2018).
- Benavides, P., Góngora, C., Bustillo, A. IPM Program to Control Coffee Berry Borer Hypothenemus hampei, with Emphasis on Highly Pathogenic Mixed Strains of Beauveria bassiana, to Overcome Insecticide Resistance in Colombia. IntechOpen. , (2012).
- Martínez, C. P., Echeverri, C., Florez, J. C., Gaitan, A. L., Góngora, C. E. In vitro production of two chitinolytic proteins with an inhibiting effect on the insect coffee berry borer, Hypothenemus hampei (Ferrari) (Coleoptera: Curculionidae) and the fungus Hemileia vastatrix the most limiting pests of coffee crops. AMB Express. 2, 1-11 (2012).
- Padilla, B. E., Acuña, Z., Velásquez, C. S., Rubio, G. J. D. Inhibitors of [alpha]-amylases from the coffee berry borer Hypothenemus hampei in different plant species. Revista Colombiana de Entomología. 32 (2), 125-130 (2006).
- Alvarez, J. H., Cortina, H. A., Villegas, J. F. Methods to evaluate antibiosis to Hypothenemus hampei Ferrari in coffee under controlled conditions. Cenicafé. 52 (3), 205-214 (2001).
- . New Product in the Integrated Management of the Coffee Berry Borer in Colombia. National Coffee Research Center (Cenicafé) Available from: https://biblioteca.cenicafe.org/handle/10778/477 (2014)
- Jaramillo, J., Montoya, E., Benavides, P., Góngora, C. Beauveria bassiana and Metarhizium anisopliae for the control of coffee brocade in fruits on the ground. Revista Colombiana de Entomología. 41, 95-104 (2015).
- Bastidas, A., Velásquez, E., Benavides, P., Bustillo, A., Orozco, C. Evaluation of preformulated Beauveria bassiana (Bálsam) Vuillemin, for the control of the coffee berry borer. Agronomia. 17, 44-61 (2009).
- Villalba-Gault, D., Bustillo, A., Chaves Cordoba, B. Evaluation of insecticides for the control of the coffee berry borer in Colombia. Cenicafe. 46, 152-163 (1995).
- Bustillo, A. E., Orozco, J., Benavides, P., Portilla, M. Mass production and use of parasitoids for the control of the coffee berry borer in Colombia. Cenicafe. 47 (4), 215-230 (1996).
- Celestino, F. N., Pratissoli, D., Machado, L. C., Santos Junior, H. J. G. D., Mardgan, L., Ribeiro, L. V. Adaptation of breeding techniques of the coffee berry borer [Hypothenemus hampei (Ferrari). Coffee Science. 11 (2), 161-168 (2016).
- Domínguez, L., Parzanese, M. Ultraviolet light in food preservation. Argentine Foods. 52 (2), 70-76 (2012).
- Jaramillo, J., Chabi-Olaye, A., Poehling, H. M., Kamonjo, C., Borgemeister, C. Development of an improved laboratory production technique for the coffee berry borer Hypothenemus hampei, using fresh coffee berries. Entomologia Experimentalis et Applicata. 130 (3), 275-281 (2009).
- Pérez, J., Infante, F., Vega, F. E. Does the coffee berry borer (Coleoptera: Scolytidae) have mutualistic fungi. Annals of the Entomological Society of America. 98 (4), 483-490 (2005).
- Benavides, P., Gil, P., Góngora, C., Arcila, A. Integrated pest management. Cenicafe. Manual of the Colombian coffee grower: Research and technology for the sustainability of coffee growing. Manizales: FNC: Cenicafé. 3, 179-214 (2013).
- Bustillo, P. A review of the coffee berry borer, Hypothenemus hampei (Coleoptera: Curculionidae: Scolytinae), in Colombia. Revista Colombiana de Entomología. 32 (2), 101-116 (2006).
- New Chemical Control Alternative for the Integrated Management of the Coffee Berry Borer. National Coffee Research Center (Cenicafé) Available from: https://biblioteca.cenicafe.org/handle/10778/557 (2015)
- Tapias, L., Martinez, C., Benavides, P., Gongora, C. Laboratory method to evaluate the effect of insecticides on the coffee berry borer. Cenicafé. 68 (2), 76-89 (2017).
- Bustillo, A. E., Marín, P. How to reactivate the virulence of Beauveria bassiana to control the coffee berry borer. Manejo Integrado de Plagas. 63, (2002).
- Constantino, L. M., et al. morphological and genetic aspects of Hypothenemus obscurus and Hypothenemus hampei (Coleoptera: Curculionidae: Scolytinae). Revista Colombiana de Entomología. 37 (2), 173-182 (2011).
- Estrela, C., et al. Mechanism of action of sodium hypochlorite. Brazilian Dental Journal. 13 (2), 113-117 (2002).
- Diffey, B. L. Solar ultraviolet radiation effects on biological systems. Physics in Medicine and Biology. 36 (3), 299-328 (1991).
- . Integrated Management of the Coffee Berry Borer: Hypothenemus hampei Ferrari in Colombia Available from: https://biblioteca.cenicafe.org/hangle/10778/848 (1998)
- Portilla, R. Development and evaluation of an artificial diet for the rearing of Hypothenemus hampei. Cenicafé. 50, 24-38 (1999).
- Portilla, R. M., Streett, D. A. New techniques for automated mass production of Hypothenemus hampei on the modified Cenibroca artificial diet. Cenicafé. 57, 37-50 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены