Method Article
Ex Vivo Libération d’un peptide lié au gène de la calcitonine du système trigéminovasculaire chez les rongeurs
Dans cet article
Résumé
Le présent protocole décrit le modèle de libération ex vivo de peptides liés au gène de la calcitonine (CGRP) et la stratégie visant à quantifier l’effet des agents pharmacologiques sur la quantité de CGRP libérée par le système trigéminovasculaire chez les rongeurs.
Résumé
Le peptide lié au gène de la calcitonine (CGRP) a été découvert pour la première fois dans les années 1980 en tant que variante d’épissure du gène de la calcitonine. Depuis sa découverte, son rôle dans la physiopathologie de la migraine a été bien établi, d’abord par ses puissantes propriétés vasodilatatrices et ensuite par sa présence et sa fonction de neurotransmetteur dans le système trigéminovasculaire sensoriel. La capacité migraineuse du CGRP a aidé l’industrie pharmaceutique à développer des anticorps monoclonaux et des antagonistes inhibant l’effet du CGRP. Un nouveau paradigme de traitement s’est avéré efficace dans le traitement prophylactique de la migraine. L’un des outils utiles pour mieux comprendre les mécanismes de la migraine est le modèle ex vivo de libération de CGRP par le système trigéminovasculaire. C’est une méthode relativement simple qui peut être utilisée avec divers outils pharmacologiques pour acquérir un savoir-faire afin de développer de nouveaux traitements efficaces contre la migraine. Le présent protocole décrit un modèle de libération de CGRP et la technique permettant de quantifier l’effet des agents pharmacologiques sur la quantité de CGRP libérée par le système trigéminovasculaire chez les rongeurs. Une procédure décrivant l’approche expérimentale de l’euthanasie à la mesure des niveaux de protéines est fournie. L’isolement essentiel du ganglion du trijumeau et du noyau du trijumeau caudalis chez la souris et le rat et la préparation de la dure-mère du rat sont décrits en détail. De plus, des résultats représentatifs des deux espèces (rats et souris) sont présentés. La technique est un outil clé pour étudier les mécanismes moléculaires impliqués dans la physiopathologie de la migraine en utilisant divers composés pharmacologiques et des animaux génétiquement modifiés.
Introduction
La migraine est un trouble neurologique qui, selon l’OMS, toucherait plus de 1 milliard de personnes et est l’une des principales causes d’invaliditédans le monde 1. Ainsi, la migraine a un impact significatif sur les patients et la société. Malgré le succès clinique récent des médicaments antagonistes du CGRP, une grande proportion de patients ont besoin d’options de traitement améliorées 2,3,4,5. L’élucidation de la physiopathologie de la migraine menant à de nouveaux traitements efficaces est nécessaire. La signalisation dans le système trigéminovasculaire composé des méninges, des ganglions du trijumeau (TG) et du noyau caudalis du trijumeau (TNC) est centrale pour la physiopathologie de la migraine 6,7.
Le peptide lié au gène de la calcitonine (CGRP) neuropeptide à 37 acides aminés a été découvert pour la première fois au début des années 1980 lorsque Amara et ses collègues ont démontré que le transcrit ARN primaire du gène de la calcitonine pouvait être traité pour donner un ARNm codant pour le CGRP en plus de la calcitonine 8,9. La recherche ultérieure a suggéré un lien avec la physiopathologie de la migraine10. CGRP est un neurotransmetteur avec de puissantes propriétés vasodilatatrices 11,12,13,14,15,16,1 7, et il est largement distribué dans le système nerveux central et périphérique 13,14,18,19,20,21,22 . L’implication du CGRP dans la migraine a été soulignée avec la découverte d’une augmentation des taux de CGRP dans la circulation extracérébrale pendant les crises de migraine chez l’homme23, et que la perfusion de CGRP provoque une douleur migraineuse chez les patients24. Deux ans plus tard, la première étude de preuve de concept de l’efficacité de l’antagoniste du CGRP olcegepant dans le traitement de la migraine a été publiée25.
Le CGRP est abondant dans le système trigéminovasculaire comme démontré dans le TG 21,26, fibres nerveuses sensorielles innervant la dure-mère27,28,29, et TNC30. Dans le système trigéminovasculaire, le CGRP se trouve dans les neurones de petite à moyenne taille de la TG, dans les fibres C non myélinisées, et est exprimée dans près de 50% de la population neuronale de la TG. Le récepteur CGRP est exprimé principalement dans les gros neurones et se trouve dans les fibres Aδ myélinisées31,32. Le CGRP est libéré par les neurones lors d’une stimulation chimique ou électrique33,34. Les études des voies menant à la libération de CGRP et de l’emplacement de cette activation sont cruciales pour comprendre la physiopathologie de la migraine. Au cours des 5 dernières décennies, les études précliniques ont contribué à acquérir des connaissances approfondies sur la signalisation liée à la migraine et ont contribué au développement de nouveaux traitements35. De nombreuses méthodes tenant compte de l’implication vasculaire et neurogène ont été modifiées et appliquées dans la recherche sur la migraine. On peut citer les modèles in vivo et in vitro de réponses artérielles à des composés biologiques ou à des traitements pharmacologiques17,36,37, et la neurostimulation électrique38,39. De plus, les neurones activés dans le TNC peuvent être détectés par l’expression c-Fos 40,41,42 et les enregistrements électrophysiologiques dans cette zone 43,44. Les deux méthodes mesurent les signaux nociceptifs transmis au cerveau par la tête, par exemple, la dure-mère. L’utilisation d’un seul modèle préclinique ne présente pas une image complète de la physiopathologie de la migraine. Par conséquent, il est important de combiner différents modèles couvrant autant d’aspects de la physiopathologie de la migraine que possible. Le développement continu de nouveaux modèles couvrira divers aspects des mécanismes de la migraine et, avec le temps, le mystère de la physiopathologie de la migraine sera découvert.
Ici, un protocole détaillé est présenté de la méthode de libération CGRP, réalisée ex vivo dans des TG et TNC isolés de souris après stimulation chimique. La libération de CGRP peut également être étudiée dans la dure-mère des rats. Ainsi, dans le protocole expérimental pour les rats, la dure-mère est décrite avec TG et TNC. La base de la méthode de libération du CGRP a été décrite pour la première fois en 1999, où Ebersberger et ses collègues ont mené des recherches pionnières et ont constaté que le CGRP était libéré de la dure-mère après stimulation chimique et électrique des afférences durales chez le rat45. Plus tard, cette approche a été étendue à la version CGRP du TG46 et du TNC47. Par la suite, la méthode a été modifiée pour s’appliquer à la TG et au TNC chez la souris. Jusqu’à présent, la libération de CGRP de la dure-mère a été difficile chez la souris.
Protocole
Toutes les procédures de soins aux animaux et d’expérimentation ont été effectuées conformément au guide communautaire pour le soin et l’utilisation des animaux (2010/63/UE). Des souris C57BL/6JBomTac mâles, âgées de 10 semaines, et des rats Sprague Dawley mâles, âgés de 10 semaines, ont été utilisés pour démontrer ce protocole.
1. Préparation du liquide interstitiel synthétique
- Préparer le liquide interstitiel synthétique (SIF) selon la recette suivante : 108 mM NaCl, 3,48 mM KCl, 3,50 mM MgSO4, 26 mM NaHCO 3, 11,70 mMNaH2PO4, 1,50 mM CaCl2, 9,60 mM Na-gluconate, 5,50 mM glucose et7,60 mM saccharose (voir tableau des matières).
REMARQUE: Le SIF peut varier en fonction de la cible de stimulation, par exemple, une solution sans calcium peut être utilisée lors de l’étude des canaux calciques. - Ajuster le pH à 7,4 et stabiliser le pH par gazage de carbogène (5 % de CO2 et 95 % d’O2)46.
2. Euthanasie
- Anesthésier les souris adultes et les rats avec un mélange de 70% de CO2 et 30% d’O2. Décapitater les souris à l’aide d’une paire de ciseaux et les rats à l’aide d’une guillotine (voir le tableau des matériaux).
REMARQUE : Utilisez une souche et un âge qui correspondent à l’objectif de la recherche. Les mâles et les femelles peuvent être utilisés dans ce modèle. - Séparez la tête du corps au niveau C3-C4 de la moelle épinière.
NOTE: L’euthanasie peut également être réalisée avec une injection intrapéritonéale de pentobarbital (100-150 mg / kg).
3. Dissection
- Préparez le tissu de rat en suivant les étapes ci-dessous.
- Enlevez la peau et le muscle autour de la tête et du cou à l’aide d’une paire de ciseaux (Figure 1A).
- Utilisez une tondeuse et des ciseaux pour séparer les mâchoires inférieures de la tête (figure 1B-C).
- Ouvrez la moelle épinière en insérant une tondeuse osseuse caudale dans la partie dorsale des vertèbres et retirez la partie dorsale des vertèbres pour exposer la moelle épinière et le tronc cérébral (figure 1D).
- Couper la partie caudale du crâne par les bords des os occipital et interpariétal pour enlever ces structures osseuses exposant le cervelet (Figure 1E).
REMARQUE: Il est important de ne pas endommager le tronc cérébral et la moelle épinière lors de la coupe et de l’enlèvement des vertèbres. - Isoler le TNC (Sp5C) qui coule caudalement à environ 13-16 mm du bregma de chaque côté en coupant la partie dorsolatérale du tronc cérébral avec des ciseaux à ressort. Immergez le CTN gauche et droit dans le SFI (Figure 1E-I).
NOTE: La description correspond à des rats adultes. - Couper la tête à mi-sagitalement pour diviser le crâne en deux à l’aide d’une scie (figure 1J-L).
- Retirez délicatement le cerveau sans toucher la dure-mère attachée au crâne à l’aide d’une spatule et en coupant le nerf trijumeau à l’endroit où il pénètre dans le tronc cérébral (figure 1M-P).
- Pour isoler le TG, coupez-le, y compris ses branches autour des bordures visuelles. Couper la branche mandibulaire où elle pénètre dans le foramen ovale. Coupez les branches ophtalmiques et maxillaires entrant dans le crâne car elles ne sont pas divisées macroscopiquement. Lors de la dissection du TG, retirez la dure-mère qui recouvre le TG (Figure 1Q-T).
- Immergez les moitiés crâniennes et les TG dans SIF.
- Préparez le tissu de souris en suivant les étapes ci-dessous.
- Enlevez la peau et les muscles autour de la tête et du cou à l’aide de petits ciseaux (figure 2A-B).
- Ouvrez la moelle épinière en insérant une paire de petits ciseaux caudale dans la partie dorsale des vertèbres et retirez la partie dorsale des vertèbres pour exposer la moelle épinière et le tronc cérébral (figure 2C).
REMARQUE: Il est important de ne pas endommager la moelle épinière lors de la coupe et de l’enlèvement des vertèbres. - Couper le crâne par les bords des os occipital et interpariétal pour enlever ces structures osseuses exposant le cervelet (Figure 2D-F).
- Ensuite, coupez l’os pariétal à mi-sagital et retirez l’os pour exposer le cerveau (Figure 2G-I).
- Retirez délicatement le cervelet à l’aide d’une spatule pour exposer le tronc cérébral (figure 2J).
- Isoler la partie du tronc cérébral contenant du TNC à l’aide de ciseaux à ressort (Figure 2K-N). Immergez le tronc cérébral avec TNC dans SIF (Figure 2O).
- Retirez le cerveau et coupez le nerf trijumeau à l’endroit où il pénètre dans le tronc cérébral (Figure 2P-Q).
- Pour isoler le TG, coupez-le, y compris ses branches autour des bordures visuelles. Couper la branche mandibulaire où elle pénètre dans le foramen ovale. Coupez les branches ophtalmiques et maxillaires entrant dans le crâne car elles ne sont pas divisées macroscopiquement. Lors de la dissection du TG, retirez la dure-mère qui le recouvre (figure 2R-S).
- Immerger les TG dans le FSI (figure 2T).
4. Lavage
- Lavez les moitiés de crâne, les CTN et les TG dans le SIF pendant 30 minutes tout en remplaçant le SIF toutes les 5 minutes à température ambiante.
REMARQUE : Les étapes de lavage peuvent être effectuées tout en conservant le mouchoir en papier dans des contenants en plastique munis d’un couvercle en tulle pour faciliter l’échange des SIF (figure 3A-B). - Préparez le tissu de rat en suivant les étapes ci-dessous.
- Transférer les moitiés de TNC dans des bouchons de tubes microcentrifugés séparés contenant 350 μL de SIF (figure 3C).
- Transférer les TG dans des bouchons de tubes de microcentrifugeuses - un TG par bouchon de tube de microcentrifugeuse contenant 350 μL de SIF (figure 3C).
- Placez les moitiés du crâne sur des plates-formes faites d’argile ou d’une plaque de culture à 6 puits et remplissez le crâne avec 400 μL de SIF (figure 3C).
- Préparez le tissu de souris en suivant les étapes ci-dessous.
- Transférer le tronc cérébral contenant du TNC dans un bouchon de tube de microcentrifugeuse contenant 250 μL de SIF (figure 3D).
- Transférer les deux TG dans un bouchon de tube de microcentrifugeuse contenant 250 μL de SIF (figure 3D).
REMARQUE : Placez deux TG par bouchon de tube de microcentrifugeuse lorsque vous utilisez du tissu de souris.
- Placer les crânes de rats et les capsules de tubes microcentrifugeuses avec du tissu de rat et de souris dans un incubateur humidifié à 37 °C. Remplacez SIF à l’aide d’une pipette toutes les 5 minutes pendant 20 min.
REMARQUE: Il est important de ne pas toucher le tissu lors de l’ajout et du retrait du SIF.
5. Dépistage des drogues
- Déterminez les niveaux de libération du CGRP basal.
- Après le dernier lavage, ajouter 250 μL de SIF à la souris TG et TNC. Ajouter 350 μL à la TG et au TNC du rat et 400 μL à chaque crâne de rat.
- Après 10 minutes d’incubation, prélever 200 μL de l’échantillon dans un tube microcentrifuge et ajouter 50 μL de tampon EIA 10x (fourni avec la trousse d’immunodosage enzymatique CGRP, voir Tableau des matériaux) pour permettre la mesure de la libération basale de CGRP (étape 6). Jetez le liquide restant.
REMARQUE : Le temps d’incubation doit être le même pour tous les échantillons. - Conserver immédiatement les échantillons à -20 °C.
- Après échantillonnage des niveaux de libération de CGRP basaux, suivre l’une des trois méthodes suivantes : (A) stimulation unique (étape 5.2); (B) Stimulation concentration-réponse (étape 5.3); et (C) Inhibition de la stimulation (étape 5.4) (Figure 4).
NOTE: La substance d’essai et les concentrations utilisées dépendent de l’objectif de l’étude.
- Effectuez une stimulation unique en suivant les étapes ci-dessous.
- Ajouter le composé d’essai ou le véhicule dans le tissu et laisser reposer pendant 10 minutes (volume : 250 μL pour le TG et le TNC de souris, 350 μL pour le TG et le TNC du rat, et 400 μL pour chaque crâne de rat).
- Après 10 minutes d’incubation, prélever 200 μL de l’échantillon dans un tube à microcentrifugation avec 50 μL de tampon EIA 10x. Jeter le liquide restant et conserver immédiatement les échantillons à -20 °C.
REMARQUE : Le temps d’incubation doit être le même pour tous les échantillons.
- Effectuez une stimulation concentration-réponse en suivant les étapes ci-dessous.
- Diluer la substance d’essai ou le véhicule aux concentrations souhaitées. Ajouter la substance d’essai à des concentrations croissantes en commençant par la concentration la plus faible.
NOTE: La substance d’essai et les concentrations utilisées dépendent de l’objectif de l’étude. Par exemple, des supercinnamaldéhydes de 1 μM, 10 μM et 100 μM ont été utilisés pour la présente étude. - Ajouter la concentration la plus faible (1 μM pour la présente étude) de la substance d’essai et du véhicule correspondant à deux préparations tissulaires identiques et incuber pendant 10 min (volume : 250 μL pour le tissu de souris, 350 μL pour le TG et le TNC du rat, et 400 μL pour chaque crâne de rat).
- Après 10 minutes d’incubation, prélever 200 μL de l’échantillon dans un tube à microcentrifugation avec 50 μL de tampon EIA 10x.
- Jeter le liquide restant et ajouter la deuxième concentration la plus faible (10 μM pour la présente étude) dans le tissu.
- Conserver immédiatement les échantillons à -20 °C.
- Répéter cette procédure avec les concentrations restantes (100 μM pour la présente étude).
- Diluer la substance d’essai ou le véhicule aux concentrations souhaitées. Ajouter la substance d’essai à des concentrations croissantes en commençant par la concentration la plus faible.
- Effectuer l’inhibition de la stimulation en suivant les étapes ci-dessous.
- Ajouter le bloqueur ou le véhicule au tissu et incuber pendant 10 min (volume : 250 μL pour le tissu de souris, 350 μL pour le TG et le TNC du rat, et 400 μL pour chaque crâne de rat).
NOTE: Le bloqueur et la concentration utilisés dépendent de l’objectif de l’étude. Par exemple, 3 μM de glibenclamide ont été utilisés pour le résultat représentatif de la figure 5. - Après 10 min d’incubation, prélever un échantillon de 200 μL dans un tube microcentrifuge avec 50 μL de tampon EIA 10x. Jeter le liquide restant et conserver immédiatement les échantillons à -20 °C.
- Ajouter l’agoniste ou l’agoniste + bloqueur (voir tableau des matières) au tissu et incuber pendant 10 min.
NOTE: L’agoniste, le bloqueur et les concentrations utilisés dépendent de l’objectif de l’étude. Dans la présente étude, 3 μM de glibenclamide et 1 μM de capsaïcine ont été utilisés, Figure 5. - Après 10 min d’incubation, prélever un échantillon de 200 μL dans un tube microcentrifuge avec 50 μL de tampon EIA 10x. Jeter le liquide restant et conserver immédiatement les échantillons à -20 °C.
- Ajouter le bloqueur ou le véhicule au tissu et incuber pendant 10 min (volume : 250 μL pour le tissu de souris, 350 μL pour le TG et le TNC du rat, et 400 μL pour chaque crâne de rat).
- Effectuez un contrôle positif pour l’expérience.
- S’il y a lieu, ajouter un témoin positif (p. ex. 1 à 10 μM de capsaïcine, voir le tableau des matières) au tissu à la fin du protocole et prélever un échantillon de 200 μL dans un tube à microcentrifugation contenant 50 μL de tampon EIA 10x après une période d’incubation de 10 minutes.
REMARQUE: Il est avantageux d’inclure un contrôle positif pour s’assurer que la configuration et les tissus fonctionnent. La capsaïcine 48,49,50 ou le stimulus dépolarisant du potassium (40-60 mM de KCl)46,47,49 sont couramment utilisés pour provoquer la libération de CGRP par le système trigéminovasculaire. 40-60 mM de KCl SIF sont préparés sous forme de SIF, sauf que le NaCl est échangé contre KCl sur une base équimolaire.
- S’il y a lieu, ajouter un témoin positif (p. ex. 1 à 10 μM de capsaïcine, voir le tableau des matières) au tissu à la fin du protocole et prélever un échantillon de 200 μL dans un tube à microcentrifugation contenant 50 μL de tampon EIA 10x après une période d’incubation de 10 minutes.
6. Analyse des concentrations de CGRP
- Mesurer la quantité de CGRP libérée à l’aide d’une trousse d’immunodosage enzymatique (EIA) en suivant le protocole du fabricant (voir le tableau des matériaux).
- Mesurer la densité optique à 410 nm à l’aide d’un photomètre à plaques. Si un autre kit EIA CGRP est utilisé, mesurez la densité optique à la longueur d’onde indiquée dans le protocole du fabricant.
REMARQUE : Les échantillons doivent être dilués pour correspondre à la courbe standard. - Effectuer une analyse des données.
- Présenter les données sous forme de concentrations absolues ou normaliser la libération basale de CGRP par le tissu spécifique.
Résultats
Cette technique est un outil pour étudier les mécanismes moléculaires liés au CGRP impliqués dans la migraine. Il a l’avantage d’évaluer la libération de CGRP à différents niveaux du système trigéminovasculaire et peut être appliqué à la fois sur des souris et des rats de type sauvage et transgénique en combinaison avec divers composés pharmacologiques. Ici, des expériences de concentration-réponse et de blocage sur des rats et des résultats concentration-réponse de souris de type sauvage et transgéniques sont présentés.
La méthode de libération du CGRP a été utilisée pour étudier l’effet du glibenclamide, inhibiteur du canal KATP, sur la libération de CGRP par la TG et la dure-mère chez des rats trijumeaux allodyniques (STA) spontanés femelles. Tout d’abord, la concentration optimale de capsaïcine a été déterminée à l’aide d’un plan d’étude concentration-réponse. L’exposition à la capsaïcine a induit une libération importante de CGRP de la dure-mère et de la TG par rapport au véhicule (figure 5). Dans la dure-mère, la libération maximale de CGRP a été trouvée à 1 μM de capsaïcine, et dans TG, la libération maximale de CGRP a été trouvée à 10 μM de capsaïcine (figure 5A-B). Sur la base des expériences concentration-réponse, 1 μM de capsaïcine et 3 μM de glibenclamide ont été utilisés pour les expériences de blocage. Le glibenclamid n’a montré aucun effet sur la libération basale de CGRP par la dure-mère (P = 0,441) et la TG (P = 0,881) lorsqu’il a été analysé avec une ANOVA51 unidirectionnelle. Le glibenclamide a significativement réduit la libération de CGRP induite par la capsaïcine dans la dure-mère de 40 % (P = 0,031) et la TG de 39 % (P = 0,003) par rapport à la capsaïcine avec le véhicule lorsqu’elle est analysée avec une ANOVA unidirectionnelle (Figure 5C-D)51.
Chez la souris, le protocole a été utilisé pour examiner l’implication du canal ionique potentiel récepteur transitoire ankyrine 1 (TRPA1) dans un modèle murin GTN de migraine, où l’hypersensibilité induite par GTN dépendait entièrement des canaux TRPA1. On a constaté que le supercinnamaldéhyde (SCA), agoniste TRPA1, libérait du CGRP d’une manière dose-dépendante du TG avec 1 μM, 10 μM et 100 μM d’ACS, ce qui a entraîné une augmentation de 9 % (P = 0,23), de 51 % (P = 0,011) et de 69 % (P = 0,0097) de CGRP par rapport au véhicule, respectivement lorsqu’il est analysé avec une ANOVA bidirectionnelle. Ce rejet était absent chez la TG des souris nulles Trpa1 où l’exposition à 1 μM, 10 μM et 100 μM d’ACS a entraîné une variation de 11 % (P > 0,99), -13 % (P > 0,99) et 9 % (P = 0,97) % des rejets de CGRP par rapport au véhicule, respectivement lorsqu’elle était analysée avec une ANOVA bidirectionnelle. La stimulation ultérieure avec 10 μM de capsaïcine (témoin positif) montre que tous les échantillons de tissus pourraient libérer du CGRP (Figure 6)50.
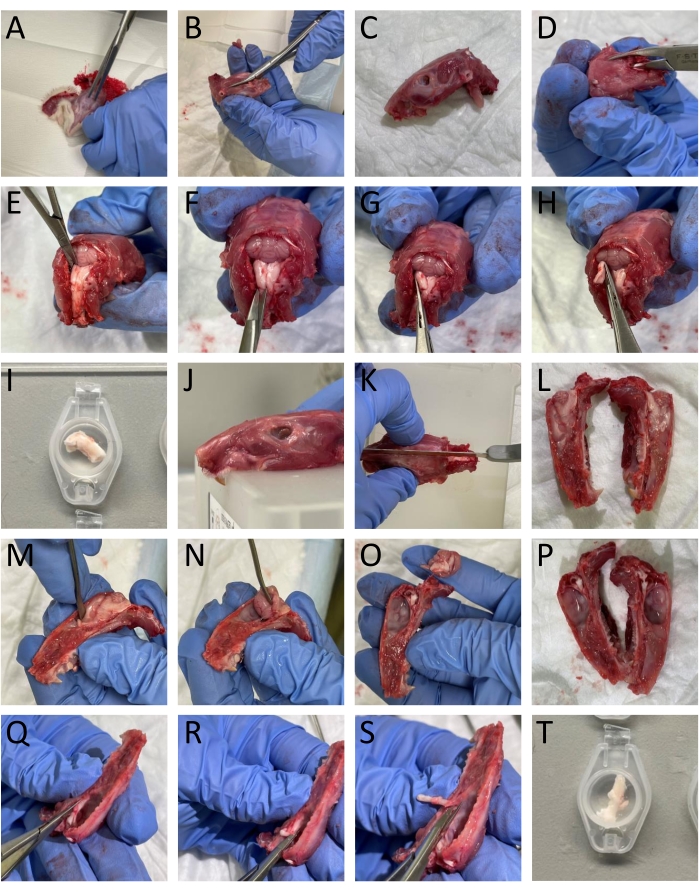
Figure 1 : Dissection étape par étape de tissus de rats. Les détails (A-T) sont fournis dans la section protocole (étape 3.1). Veuillez cliquer ici pour voir une version agrandie de cette figure.
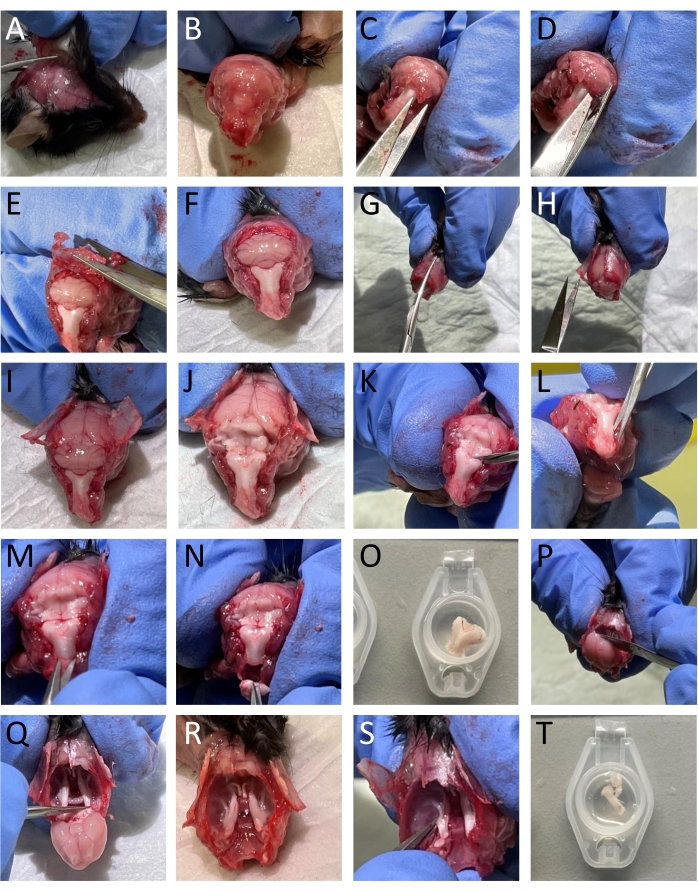
Figure 2 : Dissection étape par étape de tissus de souris. Les détails (A-T) sont fournis dans la section du protocole (étape 3.2). Veuillez cliquer ici pour voir une version agrandie de cette figure.
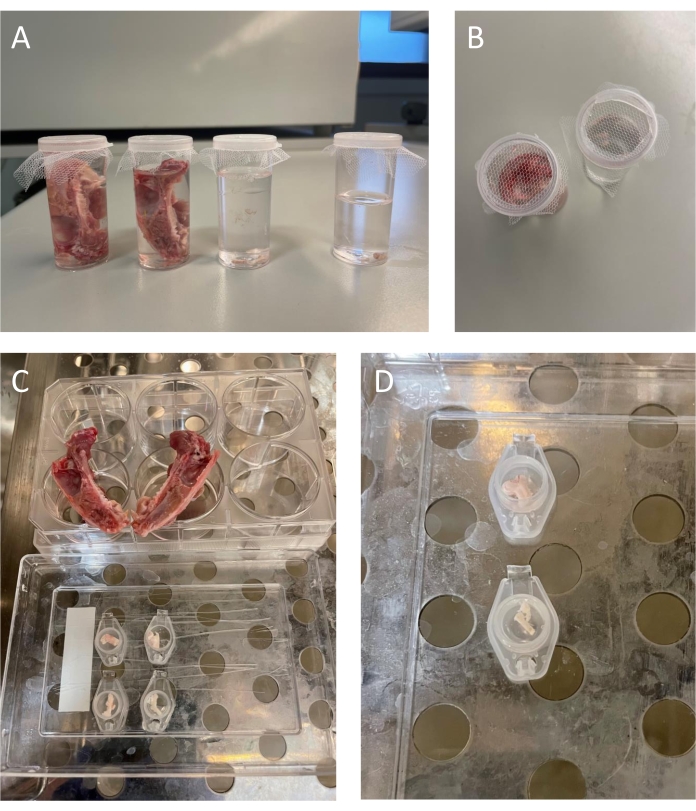
Figure 3 : Lavage et incubation des tissus de rongeurs. (A-B) Tissu fraîchement isolé dans des récipients en plastique avec SIF. Les conteneurs sont recouverts de tulle pour permettre un changement facile de SIF. (C) Tissu de rat - Deux moitiés crâniennes avec dure-mère recouvrant les parois internes du crâne placées sur une plaque de culture à 6 puits. Le noyau caudal du trijumeau droit et gauche dans des couvercles de tubes de microcentrifugation séparés (rangée supérieure de couvercles). Les deux ganglions du trijumeau dans les couvercles individuels des tubes de microcentrifugeuses (rangée inférieure de couvercles). (D) Tissu de souris - Partie du tronc cérébral contenant le noyau du trijumeau caudalis dans un couvercle séparé du tube de microcentrifugation (en haut). Deux ganglions trijumeaux de souris se trouvent dans un couvercle de tube microcentrifuge (en bas). Veuillez cliquer ici pour voir une version agrandie de cette figure.
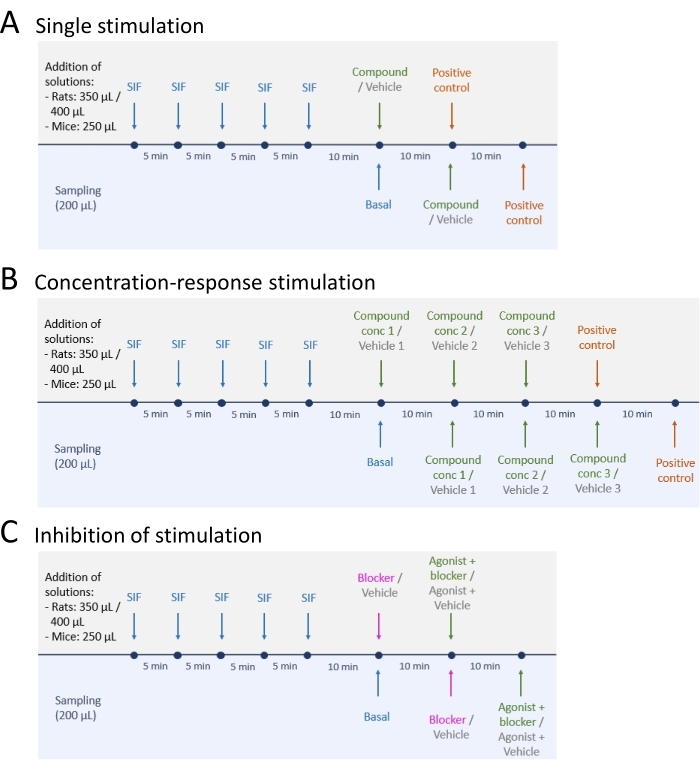
Figure 4 : Plans d’étude pour la diffusion du PRMC. Trois protocoles différents pour effectuer des expériences de libération CGRP. Les médicaments doivent être dilués dans du liquide interstitiel synthétique (SIF). (A) Stimulation unique. (B) Stimulation concentration-réponse. (C) Inhibition d’une stimulation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
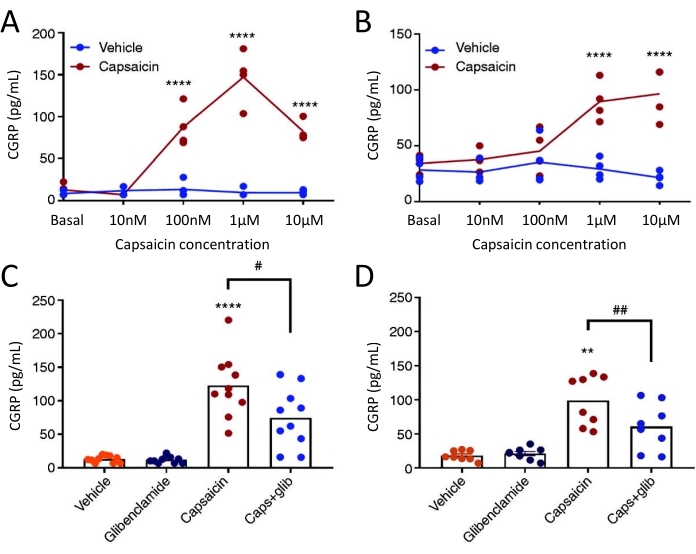
Figure 5 : Le glibenclamide inhibe la libération de CGRP induite par la capsaïcine par la dure-mère du rat et le ganglion trijumeau. Les concentrations de CGRP provenant de ganglions trijumeaux et de dure-mère isolés chez des rats trijumeaux allodyniques (STA) spontanés femelles (215-318 g) provenant à l’origine de l’Université Thomas Jefferson52 ont été mesurés avec des kits d’EIA CGRP humains commerciaux. (A-B) Libération de CGRP par (A) la dure-mère et (B) le ganglion du trijumeau après augmentation des concentrations de capsaïcine (10 nM, 100 nM, 1 μM et 10 μM) (n = 4). Les données sont présentées sous forme de points individuels et ont été analysées avec une ANOVA bidirectionnelle. p < 0,0001 (C-D) Niveaux de CGRP libérés par (C) la dure-mère et (D) le ganglion trijumeau après 10 minutes d’exposition au véhicule, 3 μM de glibenclamide (glib), 1 μM de capsaïcine et 1 μM de capsaïcine + 3 μM de glib (n = 6-11). Les données sont présentées sous forme de points individuels et de valeurs moyennes et ont été analysées avec une ANOVA unidirectionnelle. *par rapport au véhicule. #capsaïcine par rapport à capsaïcine + glib. #P < 0,05, ** et ##P < 0,01, ****P < 0,0001. Les analyses ont été suivies du test de comparaison multiple de Bonferroni. Un niveau significatif de α = 0,05 a été utilisé pour tous les tests. Ce chiffre a été modifié à partir de Christensen et al. 51. Veuillez cliquer ici pour voir une version agrandie de cette figure.
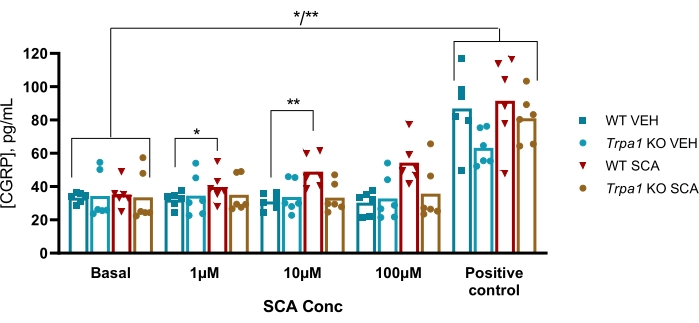
Figure 6 : L’exposition aux ACR entraîne la libération de CGRP dépendante du TRPA1 par le ganglion trijumeau de souris. Les concentrations de CGRP libérées par les ganglions trijumeaux isolés de souris mâles WT et Trpa1 null (Trpa1tm1/Dpc)53 (8-10 semaines) ont été mesurées avec des trousses d’EIA CGRP chez le rat après exposition au supercinnamaldéhyde (SCA) à 1 μM, 10 μM et 100 μM et à la capsaïcine à 10 μM comme témoin positif (n = 6). Les données de chaque souris sont présentées sous forme de points individuels et les barres indiquent les valeurs moyennes. Statistiques : La comparaison entre l’ACS et le véhicule à chaque concentration et entre le témoin basal et le témoin positif a été effectuée avec une ANOVA répétée bidirectionnelle. Un niveau significatif de α = 0,05. *P < 0,05, **P < 0,01. Ce chiffre a été modifié à partir de Christensen et al. 50. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La méthode décrite a été développée à la suite d’études montrant l’importance du CGRP dans la physiopathologie de la migraine. Il est bien adapté pour étudier les mécanismes impliqués dans la libération de CGRP par le système trigéminovasculaire, ce qui est crucial pour la signalisation de la douleur dans la région de la tête. La quantité de CGRP obtenue dans ce modèle mesure directement la libération de CGRP par les nerfs trijumeaux innervant la dure-mère, la TG et le TNC. La quantité de libération de CGRP est quantitativement plus grande 45,54 que la libération mesurée dans le plasma après thermocoagulation chez l’homme, stimulation du trijumeau chez le chat 39,55,56 et pendant les crises de migraine23. Une explication pourrait être que le CGRP est dilué et dégradé dans le sang54. Cependant, il est à noter que la stimulation directe avec des produits chimiques pourrait être supérieure à l’activation physiopathologique. D’autres avantages sont qu’il est possible de localiser la libération à partir de trois sites différents dans le système trigéminovasculaire et qu’il peut être utilisé avec une manipulation pharmacologique et dans les tissus de rongeurs génétiquement modifiés.
Dernièrement, de nombreux modèles précliniques de rongeurs se concentrent sur l’administration systémique de substances et les lectures ultérieures liées à la douleur ou à la migraine en utilisant les tests de von Frey57,58, grimaçant59,60,61 ou aversion légère 62,63,64. Ces méthodes sont utiles pour comprendre les propriétés analgésiques et analgésiques de différentes substances. Cependant, ces approches ne donnent aucune information sur les tissus cibles spécifiques impliqués. Dans la méthode actuelle, le système trigéminovasculaire est divisé en trois structures: la dure-mère, la TG et le TNC. Cela permet l’exposition locale de chaque structure et l’évaluation du lieu d’action d’une substance spécifique. Cela a été utilisé dans une étude de 2011, où le rôle des canaux calciques voltage-dépendants chez le rat a été exploré, et l’inhibition de ces canaux s’est avérée différente dans les trois structures de la voie trijuminovasculaire47. Lors de la dissection des structures du système nerveux, l’axotomie est inévitable. Il a été démontré que l’axotomie modifie la transcription de divers gènes65. Ces changements transcriptionnels sont trop lents pour impacter les résultats de cette méthode, mais les changements de phosphorylation ne peuvent être exclus par rapport aux situations in vivo 46. Bien que des neuropeptides tels que le CGRP soient formés dans le soma cellulaire, la libération et l’action des neuropeptides se situent généralement au niveau des terminaisons nerveuses centrales ou périphériques. Ainsi, les études des neurones intacts, y compris les terminaux, sont intéressantes lors de l’étude de la libération de neuropeptides. Par conséquent, des méthodes d’étude des cultures de neurones à partir de ganglions isolés ont été établies pour servir de modèle aux terminaux. Cependant, les cultures de cellules neuronales sont sujettes à plusieurs problèmes car la dissociation mécanique peut détruire les neurones dans une culture46. Le délai plus long associé à la culture des cellules rend cette méthode sensible aux changements transcriptomiques dus à l’axotomie et aux conditions de culture65. De plus, l’ajout de facteurs de croissance et la culture sur les revêtements de surface ont altéré les propriétés neuronales en tant qu’émetteur et expression des récepteurs66,67,68,69. Ces problèmes sont évités lors de l’étude de ganglions intacts fraîchement isolés au lieu de cultures de cellules neuronales.
L’un des défis de la méthode de libération ex vivo du CGRP est la dissection précise du tissu nécessaire pour obtenir des résultats reproductibles. La dissection particulièrement précise du TNC est difficile car il s’agit d’une structure dans le tronc cérébral sans frontières visibles. De plus, la dure-mère est fragile et l’ablation du cerveau doit être effectuée avec soin pour assurer une structure intacte. Ces obstacles peuvent entraîner des variations de la taille des tissus et, par conséquent, des niveaux de CGRP basaux et induits par la stimulation. Cependant, cette variation peut s’expliquer par la normalisation de la version CGRP de base. Il convient également de noter que lors de l’isolement du TNC à partir de souris, toute la partie inférieure du tronc cérébral est isolée et non la partie plus spécifique contenant du TNC comme cela a été fait chez le rat. En général, il peut être avantageux d’utiliser du tissu de rat, car cela permet de mesurer la libération de CGRP par la dure-mère et une dissection plus précise du TNC. En outre, la taille du tissu permet également l’utilisation d’un rat comme contrôle du véhicule, car un rat produit deux moitiés crâniennes, deux TG et deux TNC où un morceau du tissu est utilisé pour la stimulation de la substance et l’autre pour le véhicule. Lors de l’utilisation de souris, deux animaux sont nécessaires pour une expérience car les deux TG sont regroupés dans un échantillon, et les CTN sont disséquées comme un seul tronc cérébral. Par conséquent, deux TG et un tronc cérébral sont utilisés pour la stimulation de la substance, et deux TG et un tronc cérébral d’une autre souris sont utilisés pour le contrôle du véhicule. Il en résulte l’utilisation de deux fois plus de souris que de rats pour obtenir le même nombre de réplications. Pour réduire le nombre de souris utilisées, une méthode de mesure de la libération de CGRP à partir de tranches du tronc cérébral a été suggérée49. C’est un avantage que la méthode ait été modifiée pour permettre l’utilisation de souris. Cela permet l’utilisation de nombreuses souches de souris transgéniques déjà disponibles, un outil utile pour étudier, par exemple, les voies de signalisation. Un témoin positif à la fin d’une expérience doit être inclus pour s’assurer que le tissu utilisé dans l’expérience peut libérer du CGRP. Le témoin positif pourrait être la capsaïcine agoniste TRPV1 ou le stimulus dépolarisant potassium (KCl), qui se sont avérés libérer CGRP du système trigéminovasculaire chez la souris et le rat 46,47,48,49,50. En outre, la méthode a également été adaptée pour mesurer la libération d’autres peptides pertinents comme le peptide hypophysaire activant l’adénylate cyclase (PACAP) - un autre peptide d’un grand intérêt dans la recherche sur la migraine70.
La méthode fournit un outil utile pour étudier la libération de CGRP à partir de tissus cibles spécifiques chez les rats et les souris. C’est une méthode relativement rapide qui évite les problèmes associés à la culture des neurones. Le protocole de la méthode peut facilement être modifié pour étudier la relation concentration-réponse ou l’inhibition d’une réponse par divers composés pharmacologiques. La méthode de libération ex vivo du CGRP est l’une des nombreuses méthodes précliniques utiles pour étudier le rôle du CGRP et d’autres mécanismes liés à la libération de CGRP dans la physiopathologie de la migraine.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par la Fondation Candys.
matériels
| Name | Company | Catalog Number | Comments |
| 6-well culture plate | NUNC | 140675 | |
| Calcium chloride dihydrate | Merck | 1.02382.1000 | For SIF buffer |
| Caps for plastic containers | ThermoFisher Scientific | 536617 | |
| Capsaicin | Merck | M2028 | |
| CGRP kits | AH Diagnostics | A05482.96 | |
| CO2 | Strandmøllen | 4.6 | For carbogen gassing of SIF |
| Delicate Bone Trimmer | Fine Science Tools | 16109-14 | |
| Glibenclamide | Tocris | 911 | |
| Glucose | Merck | G7021 | For SIF buffer |
| Guillotine for rats | Scandidact | NS-802 | |
| Magnesium sulfate heptahydrate | Merck | M5921 | For SIF buffer |
| Microcenrifuge tubes + lids/caps | VWR | 700-5239 | |
| Mini Hacksaw | BAHCO | 208 | |
| O2 | Strandmøllen | 4.5 | For carbogen gassing of SIF |
| Pentobarbital | Glostrup pharmacy | NA | Magistral formula |
| Plastic containers | ThermoFisher Scientific | 536455 | |
| Plate photometer - Infinite M200 | Tecan | NA | Infinite M200 is discontinued. A Infinite 200 PRO is available at Tecan. Software: SW Magellan v.6.3 |
| Potassium chloride | Merck | P9333 | For SIF buffer |
| Scissor | Allgaier Instruments | 307-156-170 | |
| Small scissor | Allgaier Instruments | 04-520-115 | |
| Sodium bicarbonate | Merck | S6014 | For SIF buffer |
| Sodium chloride | Merck | S9888 | For SIF buffer |
| Sodium dihydrogen phosphate monohydrate | Merck | 1.06346.1000 | For SIF buffer |
| Sodium gluconate | Merck | S2054 | For SIF buffer |
| Spatula | Bochem Lab Supply | 3018 | |
| Spring scissor | Fine Science Tools | 15024-10 | |
| Sucrose | Merck | 84097 | For SIF buffer |
| Supercinnamaldehyde | Merck | S3322 | |
| Tulle (fabrics) | NA | NA | Bought in the local fabrics store |
Références
- GBD 2016 Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: A systematic analysis for the Global Burden of Disease Study. The Lancet. 390 (10100), 1211-1259 (2017).
- Dodick, D. W. CGRP ligand and receptor monoclonal antibodies for migraine prevention: Evidence review and clinical implications. Cephalalgia: An International Journal of Headache. 39 (3), 445-458 (2019).
- Sacco, S., et al. European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. The Journal of Headache and Pain. 20 (1), 6 (2019).
- Moreno-Ajona, D., Pérez-Rodríguez, A., Goadsby, P. J. Gepants, calcitonin-gene-related peptide receptor antagonists: what could be their role in migraine treatment. Current Opinion in Neurology. 33 (3), 309-315 (2020).
- Khan, S., Olesen, A., Ashina, M. CGRP, a target for preventive therapy in migraine and cluster headache: Systematic review of clinical data. Cephalalgia: An International Journal of Headache. 39 (3), 374-389 (2019).
- Edvinsson, L., Haanes, K. A., Warfvinge, K., Krause, D. N. CGRP as the target of new migraine therapies - successful translation from bench to clinic. Nature Reviews Neurology. 14 (6), 338 (2018).
- Goadsby, P. J., et al. Pathophysiology of migraine: A disorder of sensory processing. Physiological Reviews. 97 (2), 553-622 (2017).
- Amara, S. G., Jonas, V., Rosenfeld, M. G., Ong, E. S., Evans, R. M. Alternative RNA processing in calcitonin gene expression generates mRNAs encoding different polypeptide products. Nature. 298 (5871), 240-244 (1982).
- Rosenfeld, M. G., et al. Production of a novel neuropeptide encoded by the calcitonin gene via tissue-specific RNA processing. Nature. 304 (5922), 129-135 (1983).
- Edvinsson, L., Goadsby, P. J. Discovery of CGRP in relation to migraine. Cephalalgia: An International Journal of Headache. 39 (3), 331-332 (2019).
- Brain, S. D., Williams, T. J., Tippins, J. R., Morris, H. R., MacIntyre, I. Calcitonin gene-related peptide is a potent vasodilator. Nature. 313 (5997), 54-56 (1985).
- Fisher, L. A., et al. Stimulation of noradrenergic sympathetic outflow by calcitonin gene-related peptide. Nature. 305 (5934), 534-536 (1983).
- Hanko, J., Hardebo, J. E., Kåhrström, J., Owman, C., Sundler, F. Calcitonin gene-related peptide is present in mammalian cerebrovascular nerve fibres and dilates pial and peripheral arteries. Neuroscience Letters. 57 (1), 91-95 (1985).
- Uddman, R., Edvinsson, L., Ekblad, E., Håkanson, R., Sundler, F. Calcitonin gene-related peptide (CGRP): perivascular distribution and vasodilatory effects. Regulatory Peptides. 15 (1), 1-23 (1986).
- Edvinsson, L. Functional role of perivascular peptides in the control of cerebral circulation. Trends in Neurosciences. 8, 126-131 (1985).
- Edvinsson, L., Ekman, R., Jansen, I., Ottosson, A., Uddman, R. Peptide-containing nerve fibers in human cerebral arteries: Immunocytochemistry, radioimmunoassay and in vitro pharmacology. Annals of Neurology. 21 (5), 431-437 (1987).
- Edvinsson, L., Fredholm, B. B., Hamel, E., Jansen, I., Verrecchia, C. Perivascular peptides relax cerebral arteries concomitant with stimulation of cyclic adenosine monophosphate accumulation or release of an endothelium-derived relaxing factor in the cat. Neuroscience Letters. 58 (2), 213-217 (1985).
- Brain, S. D., Grant, A. D. Vascular actions of calcitonin gene-related peptide and adrenomedullin. Physiological Reviews. 84 (3), 903-934 (2004).
- Skofitsch, G., Jacobowitz, D. M. Calcitonin gene-related peptide: Detailed immunohistochemical distribution in the central nervous system. Peptides. 6 (4), 721-745 (1985).
- Suzuki, N., Hardebo, J. E., Owman, C. Origins and pathways of cerebrovascular nerves storing substance P and calcitonin gene-related peptide in rat. Neuroscience. 31 (2), 427-438 (1989).
- Uddman, R., Edvinsson, L., Ekman, R., Kingman, T., McCulloch, J. Innervation of the feline cerebral vasculature by nerve fibers containing calcitonin gene-related peptide: trigeminal origin and co-existence with substance P. Neuroscience Letters. 62 (1), 131-136 (1985).
- Warfvinge, K., Edvinsson, L. Distribution of CGRP and CGRP receptor components in the rat brain. Cephalalgia: An International Journal of Headache. 39 (3), 342-353 (2019).
- Goadsby, P. J., Edvinsson, L., Ekman, R. Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Annals of Neurology. 28 (2), 183-187 (1990).
- Lassen, L. H., et al. CGRP may play a causative role in migraine. Cephalalgia: An International Journal of Headache. 22 (1), 54-61 (2002).
- Olesen, J., et al. Calcitonin gene-related peptide receptor antagonist BIBN 4096 BS for the acute treatment of migraine. New England Journal of Medicine. 350 (11), 1104-1110 (2004).
- Eftekhari, S., et al. Localization of CGRP, CGRP receptor, PACAP and glutamate in trigeminal ganglion. Relation to the blood-brain barrier. Brain Research. 1600, 93-109 (2015).
- Keller, J. T., Marfurt, C. F. Peptidergic and serotoninergic innervation of the rat dura mater. Journal of Comparative Neurology. 309 (4), 515-534 (1991).
- Edvinsson, L., et al. Innervation of the human middle meningeal artery: immunohistochemistry, ultrastructure, and role of endothelium for vasomotility. Peptides. 19 (7), 1213-1225 (1998).
- Lennerz, J. K., et al. Calcitonin receptor-like receptor (CLR), receptor activity-modifying protein 1 (RAMP1), and calcitonin gene-related peptide (CGRP) immunoreactivity in the rat trigeminovascular system: Differences between peripheral and central CGRP receptor distribution. Journal of Comparative Neurology. 507 (3), 1277-1299 (2008).
- Eftekhari, S., Edvinsson, L. Calcitonin gene-related peptide (CGRP) and its receptor components in human and rat spinal trigeminal nucleus and spinal cord at C1-level. BMC Neuroscience. 12, 112 (2011).
- Eftekhari, S., et al. Differential distribution of calcitonin gene-related peptide and its receptor components in the human trigeminal ganglion. Neuroscience. 169 (2), 683-696 (2010).
- Eftekhari, S., Warfvinge, K., Blixt, F. W., Edvinsson, L. Differentiation of nerve fibers storing CGRP and CGRP receptors in the peripheral trigeminovascular system. The Journal of Pain. 14 (11), 1289-1303 (2013).
- Spitzer, M. J. S., Reeh, P. W., Sauer, S. K. Mechanisms of potassium- and capsaicin-induced axonal calcitonin gene-related peptide release: Involvement of L- and T-type calcium channels and TRPV1 but not sodium channels. Neuroscience. 151 (3), 836-842 (2008).
- Evans, A. R., Nicol, G. D., Vasko, M. R. Differential regulation of evoked peptide release by voltage-sensitive calcium channels in rat sensory neurons. Brain Research. 712 (2), 265-273 (1996).
- Gupta, S., Villalón, C. M. The relevance of preclinical research models for the development of antimigraine drugs: Focus on 5-HT 1B/1D and CGRP receptors. Pharmocology & Therapeutics. 128 (1), 170-190 (2010).
- Williamson, D. J., Hargreaves, R. J., Hill, R. G., Shepheard, S. L. Intravital microscope studies on the effects of neurokinin agonists and calcitonin gene-related peptide on dural vessel diameter in the anaesthetized rat. Cephalalgia: An International Journal of Headache. 17 (4), 518-524 (1997).
- Gupta, S., Bhatt, D. K., Boni, L. J., Olesen, J. Improvement of the closed cranial window model in rats by intracarotid infusion of signalling molecules implicated in migraine. Cephalalgia: An International Journal of Headache. 30 (1), 27-36 (2010).
- Knight, Y. E., Edvinsson, L., Goadsby, P. J. Blockade of calcitonin gene-related peptide release after superior sagittal sinus stimulation in cat: a comparison of avitriptan and CP122, 288. Neuropeptides. 33 (1), 41-46 (1999).
- Goadsby, P. J., Edvinsson, L., Ekman, R. Release of vasoactive peptides in the extracerebral circulation of humans and the cat during activation of the trigeminovascular system. Annals of Neurology. 23 (2), 193-196 (1988).
- Tassorelli, C., Joseph, S. A. Systemic nitroglycerin induces Fos immunoreactivity in brainstem and forebrain structures of the rat. Brain Research. 682 (1-2), 167-181 (1995).
- Ramachandran, R., et al. A naturalistic glyceryl trinitrate infusion migraine model in the rat. Cephalalgia: An International Journal of Headache. 32 (1), 73-84 (2012).
- Hoskin, K. L., Zagami, A. S., Goadsby, P. J. Stimulation of the middle meningeal artery leads to Fos expression in the trigeminocervical nucleus: a comparative study of monkey and cat. Journal of Anatomy. 194, 579-588 (1999).
- Charbit, A. R., Akerman, S., Goadsby, P. J. Comparison of the Effects of Central and Peripheral Dopamine Receptor Activation on Evoked Firing in the Trigeminocervical Complex. Journal of Pharmacology and Experimental Therapeutics. 331 (2), 752-763 (2009).
- Koulchitsky, S., Fischer, M., Messlinger, K. Calcitonin gene-related peptide receptor inhibition reduces neuronal activity induced by prolonged increase in nitric oxide in the rat spinal trigeminal nucleus. Cephalalgia: An International Journal of Headache. 29 (4), 408-417 (2009).
- Ebersberger, A., Averbeck, B., Messlinger, K., Reeh, P. W. Release of substance P, calcitonin gene-related peptide and prostaglandin E2 from rat dura mater encephali following electrical and chemical stimulation in vitro. Neuroscience. 89 (3), 901-907 (1999).
- Eberhardt, M., et al. Calcitonin gene-related peptide release from intact isolated dorsal root and trigeminal ganglia. Neuropeptides. 42 (3), 311-317 (2008).
- Amrutkar, D. V., Ploug, K. B., Olesen, J., Jansen-Olesen, I. Role for voltage gated calcium channels in calcitonin gene-related peptide release in the rat trigeminovascular system. Neuroscience. 172, 510-517 (2011).
- Gupta, S., et al. Evidence for CGRP re-uptake in rat dura mater encephali. British Journal of Pharmacology. 161 (8), 1885-1898 (2010).
- Kageneck, C., Nixdorf-Bergweiler, B. E., Messlinger, K., Fischer, M. J. M. Release of CGRP from mouse brainstem slices indicates central inhibitory effect of triptans and kynurenate. Journal of Headache and Pain. 15 (1), 1-9 (2014).
- Christensen, S. L., et al. CGRP-dependent signalling pathways involved in mouse models of GTN- cilostazol- and levcromakalim-induced migraine. Cephalalgia: An International Journal of Headache. 41 (14), 1413-1426 (2021).
- Christensen, S. L., et al. ATP sensitive potassium (KATP) channel inhibition: A promising new drug target for migraine. Cephalalgia: An International Journal of Headache. 40 (7), 650-664 (2020).
- Oshinsky, M. L., et al. Spontaneous trigeminal allodynia in rats: A model of primary headache. Headache. 52 (9), 1336 (2012).
- Kwan, K. Y., et al. TRPA1 contributes to cold, mechanical, and chemical nociception but is not essential for hair-cell transduction. Neuron. 50 (2), 277-289 (2006).
- Eltorp, C., Jansen-Olesen, I., Hansen, A. J. Release of calcitonin gene-related peptide (CGRP) from guinea pig dura mater in vitro is inhibited by sumatriptan but unaffected by nitric oxide. Cephalalgia: An International Journal of Headache. 20 (9), 838-844 (2000).
- Zagami, A. S., Goadsby, P. J., Edvinsson, L. Stimulation of the superior sagittal sinus in the cat causes release of vasoactive peptides. Neuropeptides. 16 (2), 69-75 (1990).
- Goadsby, P. J., Edvinsson, L. The trigeminovascular system and migraine: studies characterizing cerebrovascular and neuropeptide changes seen in humans and cats. Annals of Neurology. 33 (1), 48-56 (1993).
- Bates, E. A., et al. Sumatriptan alleviates nitroglycerin-induced mechanical and thermal allodynia in mice. Cephalalgia: An International Journal of Headache. 30 (2), 170-178 (2010).
- Pradhan, A. A., et al. Characterization of a novel model of chronic migraine. Pain. 155 (2), 269-274 (2014).
- Mogil, J. S., Pang, D. S. J., Silva Dutra, G. G., Chambers, C. T. The development and use of facial grimace scales for pain measurement in animals. Neuroscience and Biobehavioral Reviews. 116, 480-493 (2020).
- Sotocinal, S. G., et al. The rat grimace scale: A partially automated method for quantifying pain in the laboratory rat via facial expressions. Molecular Pain. 7, 55 (2011).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7 (6), 447-449 (2010).
- Mahmoudi, J., et al. Cerebrolysin attenuates hyperalgesia, photophobia, and neuroinflammation in a nitroglycerin-induced migraine model in rats. Brain Research Bulletin. 140, 197-204 (2018).
- Farajdokht, F., Babri, S., Karimi, P., Mohaddes, G. Ghrelin attenuates hyperalgesia and light aversion-induced by nitroglycerin in male rats. Neuroscience Letters. 630, 30-37 (2016).
- Kuburas, A., et al. PACAP Induces Light Aversion in Mice by an Inheritable Mechanism Independent of CGRP. Journal of Neuroscience. 41 (21), 4697-4715 (2021).
- Buschmann, T., et al. Expression of Jun, Fos, and ATF-2 proteins in axotomized explanted and cultured adult rat dorsal root ganglia. Neuroscience. 84 (1), 163-176 (1998).
- Lee, Y. J., Zachrisson, O., Tonge, D. A., McNaughton, P. A. Upregulation of bradykinin B2 receptor expression by neurotrophic factors and nerve injury in mouse sensory neurons. Molecular and Cellular Neuroscience. 19 (2), 186-200 (2002).
- Hari, A., Djohar, B., Skutella, T., Montazeri, S. Neurotrophins and extracellular matrix molecules modulate sensory axon outgrowth. International Journal of Developmental Neuroscience. 22 (2), 113-117 (2004).
- Skoff, A. M., Resta, C., Swamydas, M., Adler, J. E. Nerve Growth Factor (NGF) and Glial Cell Line-Derived Neurotrophic Factor (GDNF) regulate substance P release in adult spinal sensory neurons. Neurochemical Research. 28 (6), 847-854 (2003).
- Lindsay, R. M., Harmar, A. J. Nerve growth factor regulates expression of neuropeptide genes in adult sensory neurons. Nature. 337 (6205), 362-364 (1989).
- Edvinsson, J. C. A., et al. Differences in pituitary adenylate cyclase-activating peptide and calcitonin gene-related peptide release in the trigeminovascular system. Cephalalgia: An International Journal of Headache. 40 (12), 1296-1309 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon