Method Article
Détection multigénique du polymorphisme mononucléotidique dans le cancer gastrique basée sur une plate-forme de séquençage à semi-conducteur ionique
Dans cet article
Erratum Notice
Résumé
Ce protocole propose des procédures de laboratoire holistiques nécessaires à la détection des polymorphismes mononucléotidiques dans des échantillons de cancer gastrique sur la base d’une plateforme de séquençage à semi-conducteurs ioniques. Les séquences cibles, les adaptateurs de ligature, l’amplification et la purification de la bibliothèque, ainsi que les critères de contrôle de la qualité sont également décrits en détail.
Résumé
Le cancer gastrique est une tumeur hétérogène courante. La plupart des patients ont un cancer gastrique avancé au moment du diagnostic et ont souvent besoin d’une chimiothérapie. Bien que le 5-fluorouracile (5-FU) soit largement utilisé pour le traitement, sa sensibilité thérapeutique et sa tolérance aux médicaments doivent encore être déterminées, ce qui souligne l’importance d’une administration individualisée. La pharmacogénétique peut guider la mise en œuvre clinique d’un traitement individualisé. Les polymorphismes mononucléotidiques (SNP), en tant que marqueur génétique, contribuent à la sélection des schémas et des dosages de chimiothérapie appropriés. Certains SNP sont associés au métabolisme du folate, la cible thérapeutique du 5-FU. La méthylènetétrahydrofolate réductase (MTHFR) rs1801131 et rs1801133, la dihydrofolate réductase (DHFR) rs1650697 et rs442767, la méthionine synthase (MTR) rs1805087, la gamma-glutamyl hydrolase (GGH) rs11545078 et la famille des porteurs de solutés 19 membre 1 (SLC19A1) rs1051298 ont été étudiées dans différents types de cancers et de médicaments antitumoraux antifolates, qui ont une importance potentielle de prévision et d’orientation pour l’application du 5-FU. La technologie de séquençage semi-conducteur de nouvelle génération à torrent d’ions peut détecter rapidement les SNP liés au cancer gastrique. Chaque fois qu’une base est étendue dans une chaîne d’ADN, un H+ sera libéré, provoquant des changements locaux de pH. Le capteur ionique détecte les changements de pH et convertit les signaux chimiques en signaux numériques, réalisant ainsi le séquençage par synthèse. Cette technique a une faible exigence d’échantillon, un fonctionnement simple, un faible coût et une vitesse de séquençage rapide, ce qui est bénéfique pour guider la chimiothérapie individualisée par les SNP.
Introduction
Le cancer gastrique est un lourd fardeau dans le domaine de la santé publique mondiale. Selon les Statistiques mondiales sur le cancer 2020, publiées par le Centre international de recherche sur le cancer (CIRC), le cancer de l’estomac est le cinquième cancer le plus diagnostiqué et la quatrième cause de décès lié au cancer. À l’échelle mondiale, l’incidence du taux normalisé selon l’âge en Asie de l’Est est la plus élevée chez les hommes et les femmes1. L’apparition du cancer gastrique est insidieuse, ce qui signifie que les patients ne présentent souvent aucun symptôme évident et spécifique à un stade précoce. Parmi tous les patients atteints d’un cancer gastrique, dans les pays où le dépistage n’est pas systématique, 80 à 90 % des patients sont soit diagnostiqués à un stade avancé, lorsque la tumeur ne peut pas être opérée, soit récidivants dans les 5 ans suivant l’opération2.
Pour le cancer gastrique avancé ou métastatique, la chimiothérapie est le traitement principal, ce qui peut améliorer le taux de survie et la qualité de vie des patients. Pour le traitement initial des patients atteints d’un cancer gastrique métastatique, un régime à base de platine-fluoropyrimidine est le principal choix pour un régime chimiothérapeutique de première intention3. La fluoropyrimidine comprend principalement le 5-fluorouracile (5-FU) et les dérivés oraux de la fluoropyrimidine, tels que la capécitabine et le tegafur. La principale cible du 5-FU est les enzymes liées au métabolisme des folates, qui inhibent la synthèse de l’ADN et ralentissent la croissance du tissu tumoral. Les effets indésirables des médicaments limitent leur utilité, la diarrhée, la mucite, la myélosuppression et le syndrome main-pied étant parmi les effets secondaires les plus fréquents. Il a été rapporté que la réponse thérapeutique et les effets indésirables des médicaments sont étroitement liés à des facteurs de la voie métabolique du folate. Notamment, la mutation homozygote de rs1801131 a été identifiée comme un indicateur du syndrome main-pied (p = 4,1 x 10-6, OR = 9,99, IC à 95 % : 3,84-27,8)4. Bien que les fluoropyrimidines soient largement utilisées dans la chimiothérapie anticancéreuse, leur chimiorésistance est une urgence courante, entraînant un échec thérapeutique dans le traitement du cancer gastrique. Par exemple, le taux de réponse global n’est que de 10 % à 15 % chez les patients atteints d’un cancer colorectal avancé traités avec seulement5-FU. De plus, les fluoropyrimidines ont une toxicité qui ne peut être ignorée. Les réactions toxiques induites par le 5-FU comprennent principalement la diarrhée, le syndrome main-pied, la stomatite, la neutropénie, la thrombocytopénie, la neurotoxicité et même la mort6. Une toxicité sévère liée au traitement se produit chez 10 à 30 % des patients traités par les fluoropyrimidines, et une toxicité mortelle se produit chez 0,5 à 1 % de ces patients7.
Une étude sur la qualité de vie de patients atteints d’un cancer gastrique avancé a révélé que le taux de réponse était inférieur à 50 % chez ceux qui ont reçu une chimiothérapie à base de 5-FU8. Par conséquent, il est particulièrement important de comprendre les facteurs liés à la sensibilité de la chimiothérapie à base de 5-FU pour un traitement précis afin de maximiser le taux de réponse et l’efficacité tout en minimisant la toxicité. Étant donné que le 5-FU est étroitement lié au métabolisme du folate, les variantes génétiques des enzymes dans la voie métabolique du folate peuvent être l’un des facteurs. Environ 90 % de la variation de la séquence humaine est attribuée à des mutations d’une seule base dans l’ADN, connues sous le nom de polymorphismes nucléotidiques simples (SNP)9. Lorsque les SNP modifient les propriétés enzymatiques du métabolisme de l’acide folique, cela peut entraîner des différences individuelles en termes d’efficacité, de toxicité et de chimiorésistance au fluorouracile chez les patients atteints de cancer gastrique.
La méthylènetétrahydrofolate réductase (MTHFR) est principalement utilisée pour convertir le 5,10-méthylènetétrahydrofolate (5,10-MTHF) en 5-méthyltétrahydrofolate. Le 5-FdUMP, un métabolite du 5-FU, forme un ternaire inactif avec le 5,10-MTHF et la thymidylate synthase (TS), inhibant l’activité du TS et entraînant une carence en dTMP10. L’accumulation de 5,10-MTHF peut renforcer l’effet inhibiteur du 5-FU sur le TS, qui est corrélé avec l’activité du MTHFR. MTHFR rs1801131 et rs1801133 sont les polymorphismes les plus courants, qui sont liés à une activité enzymatique plus faible (une diminution de 75% pour rs1801133 et de 30% pour rs181131) et à l’accumulation de 5,10-MTHF11.
La dihydrofolate réductase (DHFR) est l’enzyme clé du métabolisme du folate et de la synthèse de l’ADN. Le DHFR réduit le dihydrofolate, à l’aide du NADPH, en tétrahydrofolate (THF) qui est utilisé pour transporter l’unité à un carbone. Les SNP du DHFR peuvent affecter son expression, modifier l’activité et l’abondance du THF, et affecter davantage le métabolisme du folate et la sensibilité au 5-FU. La mutation ponctuelle DHFR rs1650697 se produit dans le principal promoteur du gène DHFR , ce qui augmente l’expression de DHFR12. Une étude a révélé que rs442767 est associé à l’efficacité et à la toxicité des médicaments antitumoraux antifolates, tels que le pemetrexed et le méthotrexate. En ce qui concerne le SNP rs442767, un génotype GT signifie l’hérédité d’un allèle G et d’un allèle T au même locus sur les chromosomes homologues de chaque parent. De même, les génotypes GG et TT désignent l’hérédité de deux allèles G ou de deux allèles T, en conséquence. Par rapport au génotype GT+TT, le GG est lié à une diminution de la survie sans événement et à une augmentation du risque13. Cela suggère que rs442767 peut avoir une certaine influence potentielle sur le 5-FU.
La méthionine synthase (MTR) catalyse la reméthylation de l’homocystéine en méthionine, qui joue un rôle important dans le métabolisme du folate. MTR rs1805087 est le polymorphisme le plus courant du gène MTR . MTR rs1805087 substitue la glycine à l’acide aspartique sur le site potentiellement fonctionnel de la protéine, ce qui peut diminuer l’activité de MTR. Les sujets avec l’allèle G avaient une augmentation du taux plasmatique de folate et une diminution du taux plasmatique d’homocystéine14. Au contraire, une étude a montré que rs1805087 n’a pas d’association statistiquement significative avec l’efficacité du 5-FU. Mais cette étude s’est concentrée sur le cancer colorectal et la taille de l’échantillon était petite. La relation entre rs1805087 et l’efficacité du 5-FU chez les patients atteints de cancer gastrique reste à explorer15.
La gamma-glutamyl hydrolase (GGH) est une enzyme lysosomale qui régule les concentrations intracellulaires de folate. L’acide ptéroylglutamique est le synonyme de l’acide folique qui est composé de ptérine, d’acide p-aminométhylbenzoïque et d’acide glutamique. Il existe deux formes d’acide folique dans les organismes, le folate monoglutamate et le folate polyglutamé. Le polyglutamate de THF est converti enzymatiquement en folate monoglutamique par la GGH, libérant successivement soit du mono-glutamate (mono-Glu), soit du di-glutamate (di-Glu)16. Une étude sur l’expression de la GGH chez des patients atteints d’un cancer gastrique localement avancé a montré qu’une expression élevée de la GGH pouvait réduire le 5,10-MTHF et le TS, ce qui signifie que seule une petite dose de 5-FU est nécessaire pour obtenir l’effet inhibiteur du TS chez ces patients17. La GG est un biomarqueur pronostique chez les patients atteints d’un cancer gastrique localement avancé traités par chimiothérapie adjuvante postopératoire à base de S-1, un promédicament de la 5-FU, et joue un rôle important dans le maintien de l’homéostasie intracellulaire de l’acide folique18. GGH rs11545078 est une variante faux-sens et modifie Thr-127 en Ile-127. Une étude portant sur la spécificité du substrat de la GGH suggère que le rs11545078, par rapport au type sauvage, entraîne un Km plus élevé et une efficacité catalytique plus faible pour le méthotrexate et que la structure est similaire à celle de l’acide folique19. Ensemble, l’exploration de la relation entre rs11545078 et les résultats cliniques du 5-FU est une stratégie prometteuse pour comprendre la résistance aux médicaments.
La famille des porteurs de solutés 19 membre 1 (SLC19A1), également appelée transporteur de folate réduit, est une protéine transmembranaire facilitatrice typique qui importe des folates réduits que les cellules de mammifères n’ont pas la capacité de synthétiser de novo, ce qui est reconnu pour estimer la réponse de la tumeur au 5-FU20. Cependant, seules quelques études ont été réalisées concernant l’association entre le 5-FU et le polymorphisme SLC19A1 21. Chez les patients atteints d’un cancer du poumon non à petites cellules recevant du pemetrexed, un analogue du folate, le rs1051298 sur le gène SLC19A1 a contribué à augmenter le risque de toute réaction indésirable au médicament et à diminuer la survie globale22,23. SLC19A1 rs1051298, une variante de la région 3' non traduite sur le métabolisme de l’acide folique, peut aider à expliquer certaines des différences individuelles concernant le traitement par 5-FU. Ici, l’objectif est d’évaluer l’association entre rs1051298 et la résistance au 5-FU chez les patients atteints d’un cancer gastrique.
Un kit, basé sur le séquençage à semi-conducteurs, est utilisé pour la détection qualitative de gènes in vitro (Figure 1), qui peut détecter 7 SNP sélectionnés dans 5 gènes, les mutations rs1801131 et rs1801133 du gène MTHFR , les mutations rs1650697 et rs442767 du gène DHFR , la mutation rs1805087 du gène MTR , la mutation rs11545078 du gène GGH et rs1051298 du SLC19A1 gène dans des échantillons de tissus tumoraux de patients atteints de cancer gastrique. Tout d’abord, l’acide nucléique de l’échantillon a été extrait et le fragment cible a été spécifiquement amplifié par PCR. Un adaptateur de séquençage universel a été ajouté aux deux extrémités du fragment d’ADN pour construire une banque qui peut être utilisée pour le séquençage. Ensuite, l’amplification de la bibliothèque de séquençage par PCR pour former un modèle de séquençage a été effectuée. Le modèle positif a été enrichi pour répondre aux exigences de séquençage. À l’aide du système de séquençage des semi-conducteurs, en fixant le brin d’ADN dans le minuscule trou de la puce semi-conductrice. L’ADN polymérase prend l’ADN simple brin comme matrice et synthétise le brin d’ADN complémentaire selon le principe de l’appariement des bases complémentaires. Chaque fois qu’une base est étendue dans une chaîne d’ADN, un proton sera libéré, provoquant des changements locaux de pH. Un capteur ionique détecte les changements de pH et convertit les signaux chimiques en signaux numériques, de sorte que les bases peuvent être interprétées en temps réel, et enfin la séquence de bases de chaque segment d’ADN peut être obtenue. L’analyse bioinformatique a permis de faire correspondre ces séquences à la carte de référence du génome humain. Lorsque les gènes liés au cancer gastrique mutent, leurs séquences de base d’ADN correspondantes changent, afin d’obtenir l’information sur la mutation des gènes apparentés.
Le résultat peut afficher l’état de la mutation génétique et fournir une référence aux cliniciens pour sélectionner les types et les doses appropriés de médicaments de chimiothérapie et prédire la résistance aux médicaments pour les patients atteints de cancer gastrique. Cependant, les résultats des tests ne sont fournis qu’à titre de référence clinique et ne sont pas recommandés comme seule base pour le traitement individualisé des patients. Les cliniciens doivent porter un jugement complet en fonction de l’état du patient, des indications médicamenteuses, des réactions au traitement et d’autres indicateurs des tests de laboratoire.
Protocole
Tous les protocoles et les échantillons de tissus du cancer gastrique (étape 1), obtenus par endoscopie ou chirurgie digestive haute, utilisés dans cette étude ont été examinés et approuvés par le comité d’éthique médicale le 24 juillet 2023 (NFEC-2023-298). De plus, ce protocole est conçu exclusivement pour illustrer la détection multigénique dans le cancer gastrique sans s’engager dans des comparaisons de cohortes, il n’impose donc aucun critère spécifique pour inclure ou exclure des patients. Les patients/participants ont donné leur consentement éclairé écrit pour participer à cette étude.
1. Préparation de blocs intégrés du cancer gastrique
- Configurez le système d’enrobage de tissus, composé d’un réservoir de paraffine et d’un distributeur, ainsi que de plaques chaudes et froides, en suivant les directives opérationnelles prescrites.
- Extrayez le tissu préparé pour l’enrobage du déshydrateur et déposez-le dans la fente de stockage du centre d’enrobage.
- Sélectionnez les moules d’enrobage appropriés en fonction de la taille du tissu, versez suffisamment de paraffine fondue pour couvrir le tissu, puis positionnez le moule sur la plaque chaude.
- Récupérez le tissu des cassettes et placez la muqueuse gastrique perpendiculairement à la base du moule d’enrobage pour vous assurer que le plan de section transversale traverse toutes les couches de tissus. Alignez le tissu dans le moule.
- Placez la cassette sur le dessus du moule, suivie d’un versement secondaire de paraffine, en remplissant le moule.
- Placez le moule encastré sur la plaque froide et, après la solidification de la paraffine, détachez les blocs encastrés des moules.
2. Extraction de l’acide nucléique à partir d’échantillons
- Utilisez des kits d’extraction et de purification des acides nucléiques pour extraire les acides nucléiques d’échantillons de tissus contenant de la paraffine.
- Utilisez un quantificateur d’acide nucléique pour quantifier l’acide nucléique extrait. Il est recommandé que la concentration en acides nucléiques soit supérieure à 2 ng/μL.
REMARQUE : Les matériaux utilisés ici sont disponibles dans le tableau des matériaux.
3. Préparation à la bibliothèque de séquençage
- Préparation avant l’expérience
- Allumez la lampe UV dans l’établi ultra-propre, stérilisez pendant 30 min. Ensuite, éteignez la lampe UV et allumez le ventilateur pour aérer pendant 10 min.
- Sortez l’acide nucléique du réfrigérateur à -20 ± 5 °C, vérifiez et enregistrez l’ID de l’échantillon, le code-barres des acides nucléiques et le numéro d’étiquette spécifique attribué à l’échantillon. Placez-le sur le support du tube de centrifugation pour la dissolution à température ambiante (RT) après vérification, et centrifugez-le pendant 10 s, avec une tension fixe de 2 500 x g en veille.
- Amplification par PCR d’un fragment cible
- Prenez la solution de réaction de capture de fragments, l’amorce d’amplification du cancer gastrique et l’amorce d’amplification de fusion du kit de détection multigénique de l’articulation du cancer gastrique sur mesure et mettez-les sur de la glace pour les faire fondre. Secouez-les et mélangez-les après les avoir fondus, centrifugez-les pendant 10 s et préparez de l’eau sans nucléases. Le tableau 1 présente des informations détaillées sur les amorces.
REMARQUE : Le kit n’est pas encore disponible dans le commerce, contactez authotrs pour plus de détails. - Préparez un tube de réaction PCR de 0,2 mL, ajoutez les réactifs dans le tube à tour de rôle conformément au tableau supplémentaire 1, en tourbillonnant et en mélangeant pendant 5 s, puis en centrifugant instantanément pendant 10 s, avec une valeur fixe de 2 500 x g, de sorte qu’il n’y ait pas de gouttes évidentes sur la paroi et le couvercle du tube. Les échantillons d’ARN doivent être transcrits en ADNc, puis utilisés pour la construction ultérieure d’une bibliothèque. Les produits d’ADNc doivent être ajoutés dans les tubes à tour de rôle conformément au tableau supplémentaire 2.
- Placez chaque tube de réaction sur le thermocycleur. Pour les échantillons d’ADN, exécutez le programme d’amplification comme indiqué dans le tableau 2. Pour les produits d’ADNc, exécutez le programme d’amplification comme indiqué dans le Tableau 3.
- Prenez la solution de réaction de capture de fragments, l’amorce d’amplification du cancer gastrique et l’amorce d’amplification de fusion du kit de détection multigénique de l’articulation du cancer gastrique sur mesure et mettez-les sur de la glace pour les faire fondre. Secouez-les et mélangez-les après les avoir fondus, centrifugez-les pendant 10 s et préparez de l’eau sans nucléases. Le tableau 1 présente des informations détaillées sur les amorces.
- Digestion de la séquence d’amorçage
- Retirez l’enzyme de digestion de l’amorce et mettez-la sur de la glace pour la faire fondre. Après l’amplification, retirez les tubes de réaction ci-dessus, ajoutez 2 μL d’enzyme de digestion d’amorce dans chaque tube et assurez-vous que le volume total est de 22 μL.
- Vortex et mélanger la solution réactionnelle dans le tube PCR et centrifuger instantanément pendant 10 s, avec une valeur fixe de 2 500 x g.
- Placez chaque tube de réaction sur le thermocycleur et exécutez le programme comme indiqué dans le tableau 4.
- Ligature de l’adaptateur
- Mettez l’adaptateur de connexion des réactifs sur de la glace pour le dissoudre. Préparez un tube de microcentrifugation de 1,5 ml, puis mélangez chaque composant conformément au tableau 5 et marquez-le comme mélange adaptateur X.
REMARQUE : Les réactifs de connexion de l’adaptateur comprennent des adaptateurs P1 et des adaptateurs spécifiques X, numérotés de 1 à 48. Ceux-ci sont conçus pour marquer de manière unique divers échantillons. Lors de l’ajout d’un adaptateur spécifique, n’ouvrez qu’un seul tube à la fois pour éviter la contamination croisée de l’adaptateur spécifique. Le mélange d’adaptateur spécifique dilué peut être stocké à -20 ± 5 °C en veille. Dans les flux de travail de séquençage, les échantillons ne sont pas traités individuellement, mais plusieurs échantillons, chacun étiqueté avec un adaptateur spécifique, sont combinés dans une bibliothèque unifiée, pour le séquençage. Cette méthode permet de différencier ultérieurement les échantillons en fonction de leurs séquences d’adaptateur spécifiques. - Retirez le produit d’amorçage digéré (22 μL) du thermocycleur. Ajouter les réactifs dans le tube à tour de rôle selon le tableau 6, en tourbillonnant et en mélangeant pendant 5 s. Centrifugeuse à basse vitesse pendant 10 s, avec une position fixe de 2 500 x g, de sorte qu’il n’y ait pas de chute évidente sur la paroi et le couvercle du tube.
- Placez le tube de réaction sur le thermocycleur. Pour les échantillons d’ADN, exécutez le programme d’amplification comme indiqué au tableau 7. Pour les produits d’ADNc, exécutez le programme d’amplification comme indiqué dans le Tableau 8.
- Mettez l’adaptateur de connexion des réactifs sur de la glace pour le dissoudre. Préparez un tube de microcentrifugation de 1,5 ml, puis mélangez chaque composant conformément au tableau 5 et marquez-le comme mélange adaptateur X.
- Purification du produit de ligature et amplification
- Sortez à l’avance les billes magnétiques de purification de l’ADN du réfrigérateur à 2-8 °C, tourbillonnez-les uniformément et centrifugez-les instantanément pendant 10 s, avec une tension fixe de 2 500 x g. Équilibrez les billes magnétiques à RT pendant 30 min.
- Préparez un tube de microcentrifugation à faible adsorption de 1,5 mL et transférez le produit de la réaction de ligature dans le tube correspondant.
- Ajouter 45 μL de billes magnétiques purifiées d’ADN dans chaque tube, tourbillonner et bien mélanger, centrifuger instantanément pendant 10 s et incuber à RT pendant 5 min.
- Placez le tube sur une grille magnétique pendant 3 min. Jetez le surnageant et évitez de pipeter les billes.
- Transférez 300 μL d’éthanol à 75 % nouvellement préparé dans le tube de microcentrifugation et faites pivoter doucement les tubes 4x à 180°. Une fois que la solution est claire, jetez rapidement le surnageant. Évitez de pipeter les billes. Répétez la procédure de lavage 1x plus.
- Retirez les tubes de microcentrifugation de 1,5 mL du support magnétique et centrifugez-les brièvement (10 s, avec une tension fixe de 2 500 x g). Remettez les tubes dans le support magnétique et pipetez le liquide restant. Assurez-vous qu’il n’y a pas de liquide résiduel sur la paroi du tube.
- Ouvrez le capuchon de chaque tube de microcentrifugation de 1,5 mL et séchez les billes à RT pendant 5 min. Faites attention à l’état sec-humide des billes. Une fois les billes magnétiques séchées, vérifiez qu’il n’y a pas de taches d’eau sur la surface. Prolongez le temps de séchage de manière appropriée si les billes magnétiques sont trop humides. Fermez immédiatement le couvercle si des fissures apparaissent sur les perles et passez à l’étape suivante pour amplifier et purifier la bibliothèque.
- Amplification et purification de la bibliothèque
- Mettez les réactifs liés à la PCR sur de la glace pour les dissoudre à l’avance, agitez-les et centrifugez-les pendant 10 s. Retirez le tube de microcentrifugation de 1,5 mL du support d’aimant, pipetez les régents PCR dans le tube conformément au tableau 9 et fermez le capuchon et le vortex pendant 5 secondes. Centrifugez brièvement (10 s) pour éviter toute goutte de liquide évidente sur la paroi et le couvercle du tube.
- Transférez le produit ci-dessus dans un nouveau tube PCR. Incuber l’échantillon sur un thermocycleur. Pour les échantillons d’ADN, exécutez le programme d’amplification comme indiqué dans le tableau 10. Pour les produits d’ADNc, exécutez le programme d’amplification comme indiqué dans le Tableau 11.
- Préparez un nouveau tube de microcentrifugation à faible adsorption de 1,5 ml. Centrifuger le tube PCR pendant 10 s après l’incubation. Transférez le produit du tube PCR dans le tube EP.
- Ajoutez 25 μL de billes magnétiques purifiées d’ADN dans chaque tube. Vortex et bien mélanger, centrifuger à basse vitesse et incuber à RT pendant 5 min.
- Placez les tubes sur une grille magnétique pendant 3 minutes et attendez que la solution devienne claire. Transférez le surnageant dans de nouveaux tubes de microcentrifugation. Évitez de pipeter les billes.
- Ajoutez 60 μL de billes magnétiques purifiées d’ADN dans chaque tube. Vortex et bien mélanger, centrifuger à basse vitesse et incuber à RT pendant 5 min.
- Placez les tubes sur une grille magnétique pendant 3 minutes et attendez que la solution devienne claire. Jetez le surnageant. Évitez de pipeter les billes.
- Transférez 300 μL d’éthanol à 75 % nouvellement préparé dans les tubes et faites pivoter doucement les tubes 4x à 180°. Une fois que la solution est claire, pipetez rapidement et jetez le surnageant. Évitez de pipeter les billes. Répétez la procédure de lavage 1 fois.
- Retirez les tubes de microcentrifugation de 1,5 mL du support magnétique et centrifugez-les brièvement (10 s). Réinsérez les tubes dans le rack magnétique et pipetez le liquide restant. Assurez-vous qu’il n’y a pas de liquide résiduel sur la paroi du tube.
- Ouvrez les bouchons des tubes de 1,5 mL et séchez les billes à RT pendant 5 min. Faites attention à l’état sec-humide des billes. Une fois les perles magnétiques séchées, il n’y a pas de tache d’eau à la surface. Prolongez le temps de séchage de manière appropriée si les billes magnétiques sont trop humides. Fermez immédiatement le couvercle si des fissures apparaissent sur les billes.
- Pipeter 50 μL d’éluant dans les tubes, tourbillonner et bien mélanger. Centrifugez brièvement (5 s, avec une tension fixe de 2 500 x g) et placez les tubes à RT pendant 5 min.
- Placez les tubes sur une grille magnétique pendant 3 minutes et attendez que la solution devienne claire. Retirez délicatement le liquide dans un nouveau tube et marquez le nom de la bibliothèque.
- Conservez temporairement la bibliothèque dans un réfrigérateur à une température comprise entre 2 et 8 °C et attendez la détermination quantitative ou conservez la bibliothèque au réfrigérateur à une température de -20 ± 5 °C pour un stockage à long terme.
4. Quantification de la bibliothèque construite
- Utilisez le quantificateur d’acides nucléiques pour quantifier la bibliothèque. Si la concentration de la banque est ≥ 0,2 ng/μL, elle est qualifiée. Sinon, reconstruisez la bibliothèque.
- Mélangez un volume égal d’ADN (ou d’ARN) et quantifiez la solution. Selon le résultat quantitatif, diluer la solution mixte à 100 pmol/L à l’aide de la formule suivante.
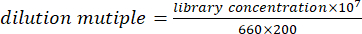
REMARQUE : Une alternative consiste à diluer la bibliothèque à 100 pmol/L selon la formule, puis à quantifier par PCR quantitative fluorescente. Mélangez les banques d’ADN (ou d’ARN) de manière égale en fonction des résultats quantitatifs de l’instrument PCR. - Mélangez une banque d’ADN de 100 pmol/L et une banque d’ARN dans un rapport de 4:1. Utilisez la solution mixte de banque d’ADN et d’ARN pour le séquençage informatique.
5. Séquençage
- Effectuez le séquençage en vous référant au manuel du kit universel de réaction de séquençage24,25 (méthode de séquençage à semi-conducteur).
6. Contrôle de la qualité des échantillons
- Contrôle de qualité positif de l’ADN du cancer gastrique : Prenez le contrôle positif de l’ADN du cancer de l’estomac et effectuez le test selon les instructions du kit. Le contrôle est fourni avec le kit. Le résultat montre que les mutants des gènes MTHFR, DHFR, MTR, GGH et SLC19A1 sont détectés.
- Contrôle de qualité négatif de l’ADN du cancer gastrique : Prenez le contrôle négatif de l’ADN du cancer gastrique et effectuez le test selon les instructions du kit. Le contrôle est fourni avec le kit. Le résultat montre que les types sauvages de gènes MTHFR, DHFR, MTR, GGH et SLC19A1 sont détectés.
REMARQUE : Assurez-vous que les critères sont respectés dans les deux cas, sinon une nouvelle détection est nécessaire.
7. Analyse des données
- Exécutez le plug-in correspondant (le logiciel Variant Caller, le logiciel d’analyse de couverture et le logiciel Ion Reporter) dans le logiciel Torrent Suite pour obtenir les résultats d’analyse des échantillons. Jugez les résultats de la détection de l’échantillon en fonction des résultats d’analyse du plug-in.
Résultats
La détermination des résultats d’essai repose sur la valeur de jugement positif, qui est également reconnue comme l’intervalle de référence. Utilisez la méthode de séquençage des semi-conducteurs pour détecter les échantillons cliniques collectés. Lorsque la valeur de la fréquence de mutation des gènes MTHFR, DHFR, MTR, GGH et SLC19A1 est ≥ 5 %, le résultat de la détection est le mutant du gène correspondant. Lorsque la valeur de la fréquence de mutation est < 5 %, le résultat de la détection est le type sauvage du gène26 correspondant.
Les critères suivants peuvent être utilisés pour déterminer si les résultats de la détection sont crédibles. Tout d’abord, si la couverture moyenne des résultats de séquençage de l’ADN est de ≥ 500 et que les lectures cartographiées des résultats de séquençage de l’ARN sont ≥ de 20000, les résultats des tests sont crédibles27. Sinon, il est recommandé de refaire le test. Deuxièmement, la couverture moyenne du contrôle de la qualité positif de l’ADN du cancer gastrique est de ≥ 500, et le résultat du test doit être conforme aux mutations rs1801131 et rs1801133 du gène MTHFR , aux mutations rs1650697 et rs442767 du gène DHFR , à la mutation rs1805087 du gène MTR , à la mutation rs11545078 du gène GGH et à la mutation rs1051298 du SLC19A1 gène comme positif. Sinon, il est recommandé de refaire le test. Troisièmement, la couverture moyenne du contrôle de la qualité négative de l’ADN du cancer gastrique est de ≥ 500, et les résultats de la détection devraient montrer que tous les sites dans la plage de détection de ce kit sont de type sauvage. Sinon, il est recommandé de refaire le test. Enfin, la concentration de la banque est inférieure à 0,2 ng/μL, ce qui peut être dû à la dégradation de l’ADN ou de l’ARN dans l’échantillon, ou au non-respect du processus expérimental ou à l’utilisation de réactifs périmés pendant l’expérience. Les conditions ci-dessus peuvent entraîner une baisse ou un échec de la qualité du séquençage. Il est recommandé de reconstruire la bibliothèque.
Avec ce kit, une série d’étapes est suivie pour construire une bibliothèque de séquençage à partir d’échantillons cliniques. La banque est ensuite séquencée sur une plate-forme de séquençage de semi-conducteurs ioniques, ANNOVAR étant utilisé pour annoter les résultats. Après le séquençage, un document est utilisé pour résumer les types de mutants pour chaque échantillon. L’absence d’un type mutant indiquait que l’échantillon ne subissait pas cette mutation spécifique. Le tableau supplémentaire3 en fournit un exemple typique. Le tableau 12 comprend des informations de base sur les SNP détectés ici. Analyse de chaque SNP à l’aide d’annotations basées sur des filtres dans diverses bases de données, telles que 1000 Genomes Project (1000g2015aug ; https://www.internationalgenome.org/ ; Tableau 13) et l’Exome Aggregation Consortium (ExAC ; https://gnomad.broadinstitute.org/ ; Tableau 14), peut révéler que différents SNP sont significativement présents dans différentes populations.
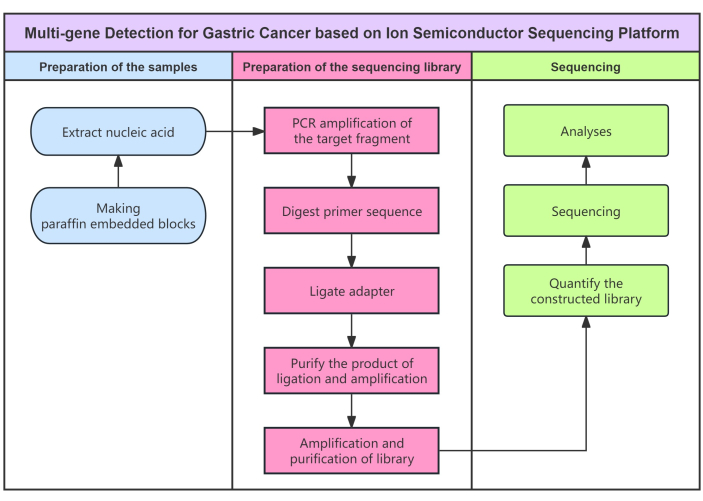
Figure 1 : Organigramme du protocole. Organigramme de la détection multigénique du cancer gastrique à l’aide de la méthode de séquençage à semi-conducteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Chromosome | Emplacement | Intervalle de conception de l’amorce | Amorce gauche | Apprêt droit | |
| CHR1 | 11854475 | chr1:11854175-11854775 | ACAGGATGGG GAAGTCACAG | AAACCGGAAT GGTCACAAAG | |
| 11856377 | chr1:11856077-11856677 | CTTCAGGTCA GCCTCAAAGC | TCCCTGTGGT CTCTTCATCC | ||
| CHR5 | 79950780 | chr5:79950480-79951080 | CGCCGCACAT AGTAGGTTCT | CTTCCTCCTC CAGCCCTATC | |
| 79951495 | chr5:79951195-79951795 | CTTGGGTCAC CTGCACAGTA | ATTTTGAAGC ACCCAAGCTG | ||
| CHR1 | 237048499 | chr1:237048199-237048799 | GTCAAAGGCC AGTCCCTTCT | Le CTCCCTTCAC CAACTGTGCT | |
| CHR8 | 63938763 | chr8:63938463-63939063 | CAGTGAAGTT CAGCGGCAT | TATTTTCCTGT GTGGGGCAC | |
| Câble CHR21 | 46934825 | chr21:46934525-46935125 | Le ATGGCTTTTC | TCCTTGGTGC TCTTGCTTTT | |
Tableau 1 : Amorces utilisées pour les sept SNP sélectionnés dans cinq gènes. Cette feuille affiche les informations sur l’emplacement des amorces des SNP associées à la résistance au 5-FU dans le cancer gastrique.
| Température | Heure | Non. de cycles |
| 99 °C | 2 minutes | 1 cycle |
| 99 °C | 15 s | 22 cycles |
| 60 °C | 4 minutes | |
| 10 °C | Tenir | 1 cycle |
Tableau 2 : Programme de cycle thermique pour l’amplification de l’ADN. Les conditions de réaction thermique telles que la température, le temps et les cycles sont indiquées.
| Pas | Température | Heure | Non. de cycles |
| Activer les enzymes | 99 °C | 2 minutes | 1 cycle |
| Dénaturer | 99 °C | 15 s | 30 cycles |
| Recuit et extension | 60 °C | 4 minutes | |
| Préserver | 10 °C | Tenir | 1 cycle |
Tableau 3 : Programme de cycle thermique pour l’amplification de l’ADNc. Les conditions de réaction thermique telles que la température, le temps et les cycles sont indiquées.
| Température | Heure | Non. de cycles |
| 50 °C | Durée : 10 minutes | 1 cycle |
| 55 °C | Durée : 10 minutes | 1 cycle |
| 60 °C | Durée : 20 minutes | 1 cycle |
| 10 °C | Tenir | 1 cycle |
Tableau 4 : Programme du cycle thermique pour la digestion de la séquence d’amorces. Les conditions de réactions thermiques telles que la température, le temps et les cycles sont illustrées.
| Composant | Volume |
| Adaptateur P1 | 1,5 μL |
| Adaptateur spécifique X | 1,5 μL |
| Eau sans nucléases | 3 μL |
| Volume total du système de réaction | 6 μL |
| X : Indique le numéro de l’adaptateur spécifique |
Tableau 5 : Séquence d’ajout des réactifs pour la préparation du mélange d’adaptateurs. Ajoutez les réactifs dans le tube dans l’ordre indiqué ici.
| Composant | Volume |
| Tampon de connexion | 4 μL |
| Adaptateur mélange X | 2 μL |
| ADN ligase | 2 μL |
| Volume total du système de réaction | 30 μL |
Tableau 6 : Séquence d’ajout de réactifs dans la production d’amorces digérées. Ajoutez les réactifs dans le tube dans l’ordre indiqué ici.
| Température | Heure | Non. de cycles |
| 22 °C | Durée : 30 minutes | 1 cycle |
| 72 °C | Durée : 10 minutes | 1 cycle |
| 10 °C | Tenir | 1 cycle |
Tableau 7 : Programme de cycle thermique pour la connexion de l’adaptateur à l’ADN. Les conditions de réactions thermiques telles que la température, le temps et les cycles sont illustrées.
| Température | Heure | Non. de cycles |
| 22 °C | Durée : 30 minutes | 1 cycle |
| 68 °C | Durée : 5 minutes | 1 cycle |
| 72 °C | Durée : 5 minutes | 1 cycle |
| 10 °C | Tenir | 1 cycle |
Tableau 8 : Programme de cycle thermique pour la connexion de l’adaptateur à l’ADNc. Les conditions de réactions thermiques telles que la température, le temps et les cycles sont illustrées.
| Composant | Volume |
| Solution réactionnelle d’amplification de bibliothèque | 50 μL |
| Mélange d’amorces de bibliothèque | 2 μL |
| Volume total du système de réaction | 52 μL |
Tableau 9 : Séquence d’ajout des réactifs d’amplification. Ajoutez les réactifs dans le tube dans l’ordre indiqué ici.
| Température | Heure | Non. de cycles |
| 98 °C | 2 minutes | 1 cycle |
| 98 °C | 15 s | 5 cycles |
| 60 °C | 1 minute | |
| 10 °C | Tenir | 1 cycle |
Tableau 10 : Programme de cycle thermique pour l’amplification de la bibliothèque d’ADN. Les conditions de réactions thermiques telles que la température, le temps et les cycles sont illustrées.
| Température | Heure | Non. de cycles |
| 98 °C | 2 minutes | 1 cycle |
| 98 °C | 15 s | 5 cycles |
| 64 °C | 1 minute | |
| 10 °C | Tenir | 1 cycle |
Tableau 11 : Programme de cycle thermique pour l’amplification de la banque d’ADNc. Les conditions de réactions thermiques telles que la température, le temps et les cycles sont illustrées.
| rs1801131 | Réf. 1801133 | Réf. 1650697 | rs442767 | RS1805087 | Réf. 11545078 | Réf. 1051298 | |
| Ref | T | G | Un | G | Un | G | G |
| Alt | G | Un | G | T | G | Un | Un |
| Func.ref GeneWithVer | exonique | exonique | UTR5 | en amont | exonique | exonique | UTR3 |
| Gène.réf GeneWithVer | MTHFR | MTHFR | DHFR | DHFR | MTR | REGH | SLC19A1 |
| GeneDetail .refGeneWithVer | . | . | NG_023304.1 : g.5020T>G | . | . | . | NM_001205206.1 : c.*64C>T ; NM_001205207.1 : c.*746C>T ; NM_194255.2 :c. *746C>T |
| ExonicFunc .refGeneWithVer | non synonyme ; SNV | non synonyme ; SNV | . | . | non synonyme ; SNV | non synonyme ; SNV | . |
| AAChange.ref GeneWithVer | MTHFR :NM_00 1330358.1 :exo n8 :c.A1409C :p. E470A ; MTHFR : NM_005957.4 : exon8 :c.A1286 C :p.E429A | MTHFR :NM_00 1330358.1 :exo n5 :c.C788T :p. A263V ; MTHFR :N M_005957.4 :e xon5 :c.C665T : p.A222V | . | . | MTR : NM_0012 91939.1 :Exon2 5 :c.A2603G :p. D868G ; MTR :N M_001291940. 1 :exon25 :c.A1 535G :p.D512G ; MTR : NM_0002 54.2 :exon26 :c. A2756G :p.D91 9G | GUES : NM_003878 .2 :exon5 :c.C452T : p.T151I | Jin |
| cytoBand | 1p36.22 | 1p36.22 | 5q14.1 | 5q14.1 | 1Q43 | 8Q12.3 | 21Q22.3 |
Tableau 12 : Informations pertinentes sur les SNP. Annoter les échantillons à l’aide d’ANNOVAR.
| MTHFR | DHFR | MTR | REGH | SLC19A1 | ||||
| rs1801131 | Réf. 1801133 | Réf. 1650697 | rs442767 | RS1805087 | Réf. 11545078 | Réf. 1051298 | ||
| 1000g2015aug_all | 0.249401 | 0.245407 | 0.76857 | 0.290136 | 0.218251 | 0.085463 | 0.524361 | |
| 1000g2015aug_afr | 0.1513 | 0.09 | 0.9349 | 0.0318 | 0.2844 | 0.056 | 0.5772 | |
| 1000g2015aug_amr | 0.1513 | 0.4741 | 0.755 | 0.3991 | 0.1772 | 0.0403 | 0.4323 | |
| 1000g2015aug_eas | 0.2192 | 0.2956 | 0.6607 | 0.5853 | 0.1052 | 0.0873 | 0.5635 | |
| 1000g2015aug_eur | 0.3131 | 0.3648 | 0.7555 | 0.3191 | 0.173 | 0.0924 | 0.4493 | |
| 1000g2015aug_sas | 0.4172 | 0.1186 | 0.6779 | 0.228 | 0.3211 | 0.1483 | 0.5552 | |
Tableau 13 : Annotation basée sur le filtre des SNP dans le projet 1000 Genomes.
| MTHFR | DHFR | MTR | REGH | SLC19A1 | |||
| rs1801131 | Réf. 1801133 | Réf. 1650697 | rs442767 | RS1805087 | Réf. 11545078 | Réf. 1051298 | |
| ExAC_ALL | 0.295 | 0.3037 | . | . | 0.2091 | 0.0936 | . |
| ExAC_AFR | 0.1588 | 0.1124 | . | . | 0.2666 | 0.0545 | . |
| ExAC_AMR | 0.1555 | 0.5141 | . | . | 0.1864 | 0.0361 | . |
| ExAC_EAS | 0.2148 | 0.3052 | . | . | 0.1132 | 0.0824 | . |
| ExAC_FIN | 0.3128 | 0.2227 | . | . | 0.1892 | 0.0581 | . |
| ExAC_NFE | 0.3191 | 0.345 | . | . | 0.1919 | 0.0969 | . |
| ExAC_OTH | 0.304 | 0.3062 | . | . | 0.2108 | 0.0973 | . |
| ExAC_SAS | 0.4153 | 0.1409 | . | . | 0.316 | 0.165 | . |
Tableau 14 : Annotation des SNP à l’aide d’un filtre dans le Consortium d’agrégation de l’exome.
Tableau supplémentaire 1 : Séquence d’ajout de réactifs pour l’amplification de l’ADN. Ajoutez les réactifs dans le tube dans l’ordre indiqué ici. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 2 : Séquence d’ajout de réactifs pour l’amplification de l’ADNc. Ajoutez les réactifs dans le tube dans l’ordre indiqué ici. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 3 : Exemple de résultats de séquençage d’échantillons cliniques. Seules les mutations présentes dans les spécimens seront consignées dans les documents. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les experts cliniques s’accordent à dire que les patients, même avec le même type et le même stade de cancer gastrique, peuvent avoir des réponses nettement différentes à une approche de traitement identique. Des années de recherche ont révélé aux scientifiques que les variations individuelles sont principalement attribuées à la nature du cancer gastrique en tant que population cellulaire hétérogène, polymorphe et diversement différenciée, entraînant d’importantes disparités individuelles dans les réponses au traitement28. Par conséquent, l’acquisition d’échantillons de cancer gastrique par endoscopie ou chirurgie digestive haute et d’échantillons de sang, associée à un séquençage à haut débit pour l’analyse génétique, permet un traitement personnalisé du cancer gastrique. Cette stratégie est conçue pour améliorer l’efficacité du traitement clinique et réduire le risque d’effets secondaires toxiques graves. Les progrès de la technologie de séquençage des semi-conducteurs ioniques ont fait du traitement personnalisé une réalité pratique29.
Voici quelques limites de cette méthode de test. Le kit utilisé ici est principalement destiné au diagnostic in vitro , il est donc limité à la détection de la mutation de rs1801131 et rs1801133 du gène MTHFR , rs1650697 et rs442767 du gène DHFR , rs1805087 du gène MTR , rs11545078 du gène GGH et rs1051298 de SLC19A1. La mutation dans d’autres sections ne peut pas être détectée. En raison de l’hétérogénéité significative du tissu tumoral, différents sites d’échantillonnage peuvent affecter les résultats de détection. Pour les échantillons de tissus enrobés de paraffine stockés pendant une durée plus longue, l’ADN et l’ARN peuvent être dégradés dans une certaine mesure, ce qui affecte les résultats des tests. La collecte, le transport et le traitement déraisonnables des échantillons, ainsi qu’un fonctionnement et un environnement expérimentaux inadéquats peuvent entraîner des résultats faussement négatifs ou faussement positifs. Le résultat de la détection ne peut être garanti si la concentration en acide nucléique est inférieure à 2 ng/μL. Les résultats des tests du kit sont uniquement à titre de référence clinique. Le choix d’un traitement personnalisé pour les patients doit être envisagé en combinaison avec leurs symptômes/signes, leurs antécédents médicaux, d’autres tests de laboratoire et leurs réactions au traitement. Des résultats négatifs ne peuvent pas exclure complètement l’existence d’une mutation du gène cible. Les résultats négatifs peuvent également être causés par un nombre insuffisant de cellules tumorales dans l’échantillon, une dégradation excessive de l’acide nucléique ou une concentration du gène cible dans le système de réaction d’amplification inférieure à la limite de détection.
Certains indices de performance du kit utilisé sont tels que décrits. Sensibilité analytique : Pour les échantillons d’ADN, la quantité minimale détectable d’acide nucléique total dans ce kit est de 10 ng, et un taux de mutation de 5 % peut être détecté. Pour les échantillons d’ARN, la quantité minimale détectable d’acide nucléique total dans ce kit est de 10 ng. Taux de coïncidence positive et négative : Le taux de coïncidence positive et négative atteint 100 %. Limite de détection (LOD) : Un total de 14 références LOD, numérotées L1-L14, peuvent être utilisées. L1-L11 est une référence LOD des gènes MTHFR, DHFR, MTR, GGH et SLC19A1 , et leurs résultats de détection devraient être que les types de mutation des sites de gènes correspondants sont positifs et que les taux de coïncidence sont de 100%. Répétabilité : Au total, cinq matériaux de référence répétitifs, numérotés R1-R5, peuvent être utilisés. R1 est un matériel de référence répétitif fortement positif (mutation rs67376798 du gène DPYD ). R2, qui contient cette mutation en plus petit nombre, est un matériel de référence répétitif faiblement positif (mutation rs67376798 du gène DPYD ), R3 est un matériel de référence répétitif négatif (6 sites des gènes DPYD, MTHFR et ABCB1 sont détectés comme de type sauvage). Chaque échantillon de référence doit être testé 10 fois, afin de s’assurer que les résultats de ces évaluations répétées correspondent à leurs classifications prédéfinies. Volume de données : Le volume effectif de données des échantillons d’ADN et d’ARN doit être contrôlé au-dessus de 0,05 M. La profondeur de séquençage des échantillons d’ADN doit être contrôlée au-dessus de 500, et les lectures cartographiées des échantillons d’ARN doivent être contrôlées au-dessus de 20000. Test d’interférence : Ce kit n’est pas affecté par les substances d’interférence endogènes (triglycérides et albumine) et les substances d’interférence exogènes (formol et alcool déshydraté).
Certaines précautions doivent être observées pendant l’expérience. Le kit utilisé ici ne peut être utilisé que pour des tests in vitro. Veuillez lire attentivement ce manuel avant l’expérience et l’utiliser pendant la période de validité. Les composants du kit en différents lots ne peuvent pas être utilisés de manière interchangeable. Il est recommandé d’utiliser des consommables jetables pour ce kit afin d’éviter toute contamination. Lors de l’utilisation de ce kit, il est recommandé d’utiliser une tête d’aspiration avec un élément filtrant. Afin d’éviter tout danger biologique potentiel dans l’échantillon, l’échantillon d’essai doit être considéré comme une matière infectieuse afin d’éviter tout contact avec la peau et les muqueuses. Il est recommandé de manipuler les échantillons dans une enceinte de biosécurité qui peut empêcher l’écoulement des aérosols. Les tubes à essai et les ventouses utilisés dans l’opération doivent être stérilisés avant d’être jetés. L’exploitation et l’élimination des échantillons doivent répondre aux exigences des lois et règlements pertinents : Directives générales pour la biosécurité des laboratoires biomédicaux microbiens et Règlement sur la gestion des déchets médicaux du ministère de la Santé30,31. Le personnel expérimental doit recevoir une formation professionnelle, opérer en stricte conformité avec les instructions et séparer strictement les zones en fonction du processus expérimental. Des instruments et des équipements spéciaux doivent être utilisés à chaque étape de l’opération expérimentale, et les objets à chaque étape de chaque zone ne doivent pas être utilisés de manière interchangeable. Le personnel expérimental doit séparer strictement les zones en fonction du processus expérimental. Des instruments et des équipements spéciaux doivent être utilisés à chaque étape de l’opération expérimentale. Prenez des mesures de protection au besoin, comme des gants, des vêtements de travail, etc. L’élimination des déchets doit être conforme aux réglementations nationales en vigueur.
Bien que cet article se concentre sur les sept SNP dans cinq gènes liés au cancer gastrique, le séquençage dans les applications pratiques ne se limite pas à ces cinq gènes seuls. Cet article établit définitivement une corrélation significative entre les sept SNP et la sensibilité à la chimiothérapie 5-FU dans le cancer gastrique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude est soutenue par l’étude Exploring the Mechanism and Role of the ERK2/Snai1/AGPS/PUFA-PL Pathway in Gastric Cancer Cell’s Resistance to Apatinib-Induced Ferroptosis (numéro d’article : 82172814), soutenue par la Fondation nationale des sciences de la nature de Chine ; Étude du rôle et du mécanisme du facteur de transcription 1 à doigts de zinc dans la modulation de la résistance des cellules cancéreuses gastriques à la ferroptose induite par l’apatinib via la voie des phospholipides de l’éther polyinsaturé (numéro d’article : 2022A1515010267), soutenu par le Comité provincial du Guangdong pour le financement de la recherche fondamentale et appliquée ; et la recherche et l’application d’un réactif pour le diagnostic de la chimiosensibilité au 5-FU pour le cancer gastrique (numéro d’article : 201903010072), projets scientifiques et technologiques à Guangzhou.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL DNA LoBind Tubes | Eppendorf | 30108051 | |
| 50 mL tubes | Greiner Bio-One | 227261 | |
| Amplification primer of gastric cancer | Thermo Fisher | The primers are sythesized by Thermo Fshier according to the sequence in Table 1. | |
| Deparaffinization | Qiagen | 19093 | |
| DNA purification magnetic beads | Bechkman | A63881 | |
| Ethyl alcohol | Guangzhou Chemical Reagent Factory Thermo Fisher Scientific | http://www.chemicalreagent.com/ | |
| Ion AmpliSeq Library Kit 2.0 | Thermo Fisher | 4480441 | |
| Nuclease-Free Water | Life Technologies | AM9932 | |
| PCR tubes | Axygen | PCR-02D-C | |
| PCR tubes | Axygen | PCR-02D-C | |
| Pipette tips | Quality Scientific Products | https://www.qsptips.com/products/standard_pipette_tips.aspx | |
| PureLink RNA Mini Columns | Thermo Fisher | A29839 | |
| RecoverAll Total Nucleic Acid Isolation Kit | Thermo Fisher | AM1975 | |
| Tabletop mini centrifuge | SCILOGES | S1010E | |
| Thermal Cycler | Life Technologies | 4375786 | |
| Ultramicro nucleic acid analyzer | BEIJING ORIENTAL SCIENCE & TECHNOLOGY DEVELOPMENT LTD. | BD-1000 |
Références
- Sung, H., et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
- Wagner, A. D., et al. Chemotherapy for advanced gastric cancer. Cochrane Database Syst Rev. 8, (2017).
- Shah, M. A., et al. Immunotherapy and targeted therapy for advanced gastroesophageal cancer: Asco guideline. J Clin Oncol. 41 (7), 1470-1491 (2023).
- Loganayagam, A., et al. Pharmacogenetic variants in the dpyd, tyms, cda and mthfr genes are clinically significant predictors of fluoropyrimidine toxicity. Br J Cancer. 108 (12), 2505-2515 (2013).
- Giacchetti, S., et al. Phase iii multicenter randomized trial of oxaliplatin added to chronomodulated fluorouracil-leucovorin as first-line treatment of metastatic colorectal cancer. J Clin Oncol. 18 (1), 136-147 (2000).
- Hoff, P. M., et al. Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: Results of a randomized phase iii study. J Clin Oncol. 19 (8), 2282-2292 (2001).
- Meulendijks, D., et al. Clinical relevance of dpyd variants c.1679t>g, c.1236g>a/hapb3, and c.1601g>a as predictors of severe fluoropyrimidine-associated toxicity: A systematic review and meta-analysis of individual patient data. Lancet Oncol. 16 (16), 1639-1650 (2015).
- Sadighi, S., Mohagheghi, M. A., Montazeri, A., Sadighi, Z. Quality of life in patients with advanced gastric cancer: A randomized trial comparing docetaxel, cisplatin, 5-fu (tcf) with epirubicin, cisplatin, 5-fu (ecf). BMC Cancer. 6, 274(2006).
- Collins, F. S., Brooks, L. D., Chakravarti, A. A DNA polymorphism discovery resource for research on human genetic variation. Genome Res. 8 (12), 1229-1231 (1998).
- Ladner, R. D. The role of dutpase and uracil-DNA repair in cancer chemotherapy. Curr Protein Pept Sci. 2 (4), 361-370 (2001).
- Capitain, O., et al. The influence of fluorouracil outcome parameters on tolerance and efficacy in patients with advanced colorectal cancer. Pharmacogenomics J. 8 (4), 256-267 (2008).
- Askari, B. S., Krajinovic, M. Dihydrofolate reductase gene variations in susceptibility to disease and treatment outcomes. Curr Genomics. 11 (8), 578-583 (2010).
- Ceppi, F., et al. DNA variants in dhfr gene and response to treatment in children with childhood b all: Revisited in aieop-bfm protocol. Pharmacogenomics. 19 (2), 105-112 (2018).
- Sharp, L., Little, J. Polymorphisms in genes involved in folate metabolism and colorectal neoplasia: A huge review. Am J Epidemiol. 159 (5), 423-443 (2004).
- Yousef, A. M., et al. The association of polymorphisms in folate-metabolizing genes with response to adjuvant chemotherapy of colorectal cancer. Cancer Chemother Pharmacol. 82 (2), 237-243 (2018).
- Schneider, E., Ryan, T. J. Gamma-glutamyl hydrolase and drug resistance. Clin Chim Acta. 374 (1-2), 25-32 (2006).
- Moran, R. G. Roles of folylpoly-gamma-glutamate synthetase in therapeutics with tetrahydrofolate antimetabolites: An overview. Semin Oncol. 26 (2), 24-32 (1999).
- Maezawa, Y., et al. High gamma-glutamyl hydrolase and low folylpolyglutamate synthetase expression as prognostic biomarkers in patients with locally advanced gastric cancer who were administrated postoperative adjuvant chemotherapy with s-1. J Cancer Res Clin Oncol. 146 (1), 75-86 (2020).
- Cheng, Q., et al. A substrate specific functional polymorphism of human gamma-glutamyl hydrolase alters catalytic activity and methotrexate polyglutamate accumulation in acute lymphoblastic leukaemia cells. Pharmacogenetics. 14 (8), 557-567 (2004).
- Zhang, Q., et al. Recognition of cyclic dinucleotides and folates by human slc19a1. Nature. 612 (7938), 170-176 (2022).
- Ulrich, C. M., et al. Polymorphisms in folate-metabolizing enzymes and response to 5-fluorouracil among patients with stage ii or iii rectal cancer (int-0144; swog 9304). Cancer. 120 (21), 3329-3337 (2014).
- Zhang, X., et al. Discovery of novel biomarkers of therapeutic responses in han chinese pemetrexed-based treated advanced nsclc patients. Front Pharmacol. 10, 944(2019).
- Corrigan, A., et al. Pharmacogenetics of pemetrexed combination therapy in lung cancer: Pathway analysis reveals novel toxicity associations. Pharmacogenomics J. 14 (5), 411-417 (2014).
- Ion 520 & ion 530 ext kit - chef user guide. Thermofisherscientific. , Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2FMAN0015805_Ion520_530ExTKit_UG.pdf (2023).
- Ion genestudio s5 instrument user guide. Thermofisherscientific. , Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2FMAN0017528_Ion_GeneStudio_S5_Instrument_UG.pdf (2023).
- Parkin, N. T., et al. Multi-laboratory comparison of next-generation to sanger-based sequencing for hiv-1 drug resistance genotyping. Viruses. 12 (7), 694(2020).
- Ziller, M. J., Hansen, K. D., Meissner, A., Aryee, M. J. Coverage recommendations for methylation analysis by whole-genome bisulfite sequencing. Nat Methods. 12 (3), 230-232 (2015).
- Lordick, F., et al. Unmet needs and challenges in gastric cancer: The way forward. Cancer Treat Rev. 40 (6), 692-700 (2014).
- Kumar, K. R., Cowley, M. J., Davis, R. L. Next-generation sequencing and emerging technologies. Semin Thromb Hemost. 45 (7), 661-673 (2019).
- Chinese Centres for Disease Control and Prevention. Ministry of Health of the People's Republic of China. WS 233-2002. Chinese Centres for Disease Control and Prevention. , 1-64 (2002).
- China Environmental Protection Industry. Medical waste management regulations. China Environmental Protection Industry. (1), 6-10 (2004).
Erratum
Formal Correction: Erratum: Multi-Gene Single Nucleotide Polymorphism Detection in Gastric Cancer Based on Ion Semiconductor Sequencing Platform
Posted by JoVE Editors on 6/05/2024. Citeable Link.
This corrects the article 10.3791/66058
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon