1. renseignements requis lors de l’appariement des animaux comprennent souche/stock de l’animal en utilisant la nomenclature appropriée, dates de naissance pour l’éleveur mâle et femelle ainsi que la date d’installation. Tenue de dossiers précis est impératif avec les colonies reproductrices.
2. sex determination des souris et des rats est faite en comparant les distances ano-génitales. Chez les femelles, la distance entre l’anus et les organes génitaux externes est plus courte que c’est pour les hommes. La présence d’un sac scrotal chez les animaux mâles est un autre indicateur de sexe.
3. sélection et mise en place le système d’accouplement
Remarque : Il existe deux régimes d’accouplements qui peuvent être utilisés.
- Pro-oestrus/oestrus chronométré accouplement : cette méthode s’appuie sur éplucher les femmes avec les hommes au point de réceptivité maximale et de la fertilité.
- Le cycle oestral doivent être surveillé chez les femelles, soit par examen visuel des organes génitaux externes pour les modifications qui sont indicatifs du proestrus et œstrus, soit par la cytologie des sécrétions vaginales (voir ci-dessous).
- Quand une femme est considérée comme en pro-oestrus ou oestrus, elle est jumelé avec un mâle à la fin de la journée, car les animaux s’accouplent généralement pendant la nuit.
- Le lendemain matin, la femelle est examinée d’un bouchon copulatoire (voir ci-dessous). Si aucune fiche n’est présent, la femelle peut rester avec le mâle pendant la journée et vérifié d’un bouchon copulatoire à la fin de la journée. Par ailleurs, s’il est établi qu’elle n’est plus dans le pro-oestrus ou oestrus, elle est supprimée de la cage de reproduction.
- Random chronométré accouplement : cette méthode est basée sur le fait, le cycle oestral de rongeurs est très court, longue de 4-5 jours.
- Pour cette méthode, accouplements peuvent être mis en place en tout temps, et les femelles sont ensuite vérifiées pour bouchons copulateurs chaque matin et soir jusqu'à ce qu’une fiche est observée.
- Une femelle est appariée avec un mâle dans la soirée.
- Elle est vérifiée pour un bouchon copulatoire au début et à la fin de chaque jour jusqu'à ce qu’une fiche est observée. Il faut généralement 3 jours ou plus d’une fiche à considérer lors de l’utilisation de cette méthode.
4. prédiction de grossesse
Étant donné que la palpation des chiots est difficile jusqu'à ce que plus tard au cours de la grossesse, autour de jour 10-12, systèmes à ultrasons commercial pour rongeurs ont été développés ; Cependant, peu d’installations de recherche sur les animaux ont cette technologie. Par conséquent, visualisation des bouchons copulateurs, observation des changements vaginaux ou cytologie vaginale sont utilisées pour aider à prédire quand une femme a conçu une litière (voir ci-dessous). Toutefois, aucune de ces méthodes sont en mesure de confirmer la grossesse. Dès qu’une fiche de copulation est constatée, la femelle doit être surveillée pour des signes de la grossesse, tels que prise de poids.
5. déterminer la phase du cycle oestral
- Inspection visuelle
Remarque : Pour enfichage chronométré des souris et des rats, l’observation visuelle du vagin pour les modifications qui sont révélateurs du proestrus et oestrus est la méthode la plus rapide pour déterminer le stade du cycle oestral et ne nécessite aucun équipement spécial.
- Lors de l’évaluation du cycle oestral utilisant la méthode visuelle, il est important de procéder à l’inspection visuelle dans la même région en ce qui concerne l’éclairage de la pièce, comme la source de lumière peut changer la couleur perçue des tissus vaginaux et compliquent l’évaluation. Par exemple, la teinte pourpre fondues par lumières LED rend plus difficile la détection visuelle.
- Pour évaluer la phase du cycle oestral par observation visuelle, chaque souris doivent être maintenue manuellement par la queue, avec les pattes de devant se reposer sur un couvercle de cage.
- L’ouverture du vagin de chaque femme est évaluée selon la condition du tissu qui entoure la zone vaginale et la taille de l’orifice vaginal. 2
- Au cours du proestrus, l’ouverture du vagin est large et se caractérise par un gonflement du tissu environnant. Le tissu est de couleur rose et très humide. Il y a souvent des rides ou des stries le long des arêtes ventrales et dorsales de l’ouverture.
- Pendant le œstrus, le gonflement des tissus entourant l’orifice vaginal est réduit, et les tissus ne sont pas aussi humide et rose.
- Au cours du métoestrus l’orifice vaginal est minime et il n’y a enflure négligeable.
- Au cours de strus, il n’y a pas de gonflement des tissus autour de la zone vaginale, et l’ouverture du vagin est petit et fermé.
- Cytologie vaginale
Comme les souris et les rats sont polyœstrien, la longueur du cycle oestral est très courte, allant de 4 à 5 jours. Il est parfois nécessaire d’identifier les quatre stades de œstrus : pro-oestrus, oestrus, métoestrus et dioestrus. La cytologie vaginale est une méthode très précise pour déterminer ces étapes. Il y a également deux méthodes de prélèvement d’échantillons : la méthode non invasive de lavage vaginal et la méthode invasive d’écouvillonnage du canal vaginal.
- Lavage vaginal
- Matériaux nécessaires sont stériles 200 µl pipettes conseils, ampoules latex, stérile double distillée (ddH20) et nettoyer les lames de verre.
- Placer une ampoule de latex à l’extrémité d’une pointe 200 µl stérile. Aspirer environ 100 µl de ddH stérile2O dans la pipette.
- Soulever la souris hors de la cage et lui mettre sur le dessus de cage métallique bar avec sa queue vers vous.
- Saisir la queue fermement et élever l’arrière-train de la souris. La souris auront désormais uniquement les pattes avant, saisir le couvercle.
- Si la souris urine, attendez que la miction s’arrête. Si l'on urine à gauche à l’entrée du canal vaginal, l’ouverture peut être rincé avec une petite giclée de ddH2O. changement la pointe qui a été utilisée pour le rinçage.
- Placer l’extrémité de la pointe de rempli d’O2ddH lors de l’ouverture du canal vaginal sans pénétrer l’orifice.
- Appuyer légèrement sur l’ampoule pour expulser un quart à la moitié du volume d’eau (environ 25-50 µl) lors de l’ouverture du canal vaginal. Le liquide va spontanément aspirer dans le canal sans insertion de pointe. Relâcher lentement la pression exercée sur l’ampoule. Le fluide se retirera vers la pointe.
- Éviter de libérer la pression trop vite pour éviter l’aspiration de liquide dans l’ampoule. Une astuce filtrée peut être utile à cette fin.
- Répétez l’étape précédente 4 - 5 fois en utilisant la même astuce, ampoule et fluide pour obtenir un nombre suffisant de cellules dans un seul échantillon.
- Placer le liquide sur lame de verre et laisser le frottis à sécher à température ambiante.
- Utiliser une pipette de nouveau pour chaque souris.
- Une fois sec, ces frottis de œstrus peuvent être souillés immédiatement ou stockés et colorées à une date ultérieure. Coloration de Wright-Giemsa est plus couramment utilisée pour colorer les diapositives. Cette tache est disponible dans le commerce comme une tache d’une étape qui ne nécessite pas de fixation de la lame pour empêcher les cellules de lavage pendant le processus de coloration. La diapositive est placée dans la tache pendant 45 à 60 secondes, selon les instructions du fabricant.
- Les diapositives sont alors examiné sous un microscope et les cellules vus correspondent à la phase du cycle : 1) si la femelle est dans le pro-oestrus, les cellules sont considérés comme des grappes de ronde, bien formée nucléées des cellules épithéliales avec un noyau qui taches plus foncées que le cytoplasme ; 2) si la femelle est en oestrus, la plupart des cellules est des cellules épithéliales squameuses cornéocytaire qui n’ont pas un noyau, sont angulaires en apparence et apparaissent en grappes denses ; 3) si la femelle est dans métoestrus, les cellules sont typiquement globules blancs (spécifiquement neutrophiles avec quelques cellules épithéliales squameuses cornéocytaire présents) avec coloration sombre des noyaux qui sont formés comme les deux saucisses reliés entre eux ; 4) durant le dioestrus, les cellules présentes sont normalement globules blancs avec la présence de quelques cellules épithéliales nucléées...
- Vaginal pistonnage
- Matériaux nécessaires sont stériles cotons-tiges avec une pointe de diamètre 2 mm, lames de microscope de verre propre et stérile de sérum physiologique.
- Mouillez un coton-tige avec du sérum physiologique.
- Insérez l’extrémité de l’applicateur dans le vagin de la souris sobre.
- Doucement tourner et rouler la pointe contre la paroi vaginale. Retirer délicatement l’écouvillon.
- Cellules sont transférées à une lame de verre sèche en faisant rouler l’écouvillon sur la diapositive.
- Une fois que la lame est sèche, il peut être coloré avec tache Wright-Giemsa.
Pistonnage est considéré comme une procédure stressante, et -quand a souligné-souris peuvent avoir perturbé cycles oestraux. Stimulation vaginale et cervicale causée par écouvillonnage peut induire la Pseudo-grossesse. Des prélèvements répétés de la muqueuse vaginale peuvent causer des dommages si elle n’est pas effectuée doucement, avec retenue appropriée et avec les tampons de coton taille corriger. 3, 4
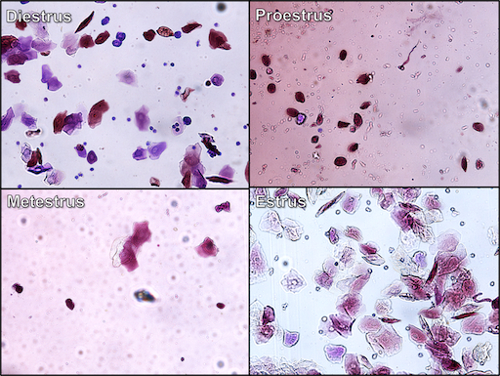
La figure 2. La cytologie vaginale--cycle de différentes étapes de l’oestrus rongeurs
6. visualiser un bouchon copulatoire
Cette fiche se compose de sperme et les sécrétions vaginales et persiste dans le vagin pour postcopulation de 12 à 24 heures. La présence du bouchon confirme l’accouplement, mais ne garantit pas que la femelle est enceinte. Si la femelle branchée est enceinte, le premier jour de la gestation est considéré comme étant le jour après que le bouchon se trouve.
- Soulever la souris hors de la cage et la placent sur le dessus de cage métallique bar avec sa queue vers vous.
- Position de la souris en appuyant juste au-dessus de la queue se cambrer le dos pour permettre la meilleure présentation de l’orifice vaginal.
- Observer son ouverture vaginale pour une masse blanchâtre. Le bouchon copulatoire ne peut être visuellement évident mais peut être confirmé par l’utilisation d’une sonde émoussée.
- À l’aide de la pointe de la sonde, l’insérer doucement dans l’orifice vaginal. La présence d’un bouchon copulatoire n’entravera l’avancement de la sonde à 0,5 cm de l’orifice vaginal.
- La sonde doit être désinfectée avec de l’alcool et sécher complètement avant chaque utilisation.
La femelle ayant des portées, la date de naissance, la taille de la portée, le nombre né, le nombre de sevrés, le rapport de masculinité chiots, et le ratio des génotypes devrait tous être enregistré. Si les génotypes au sein d’une portée ne correspondent pas à des génotypes des parents, un nouvel essai doit être fait pour vérifier le génotype vrai.
7. le sevrage
Gestation pour souris et rats est d’environ 21 jours. Les jeunes sont sevrés à l’âge de 21 à 28 jours. Les souris et les rats peuvent se reproduire dès l’âge de 8 semaines, donc il est impératif que les chiots sont séparés par sexe à un âge précoce. Élevage intensif nécessite que les chiots de chaque portée être sevré au jour 20 pour empêcher les chiots plus âgés d’être présent lors de la prochaine portée est né. Pour l’élevage extensif, les chiots peuvent être laissés avec sa mère depuis 20 jours, souvent jusqu'à 28 jours d’âge. Cela peut être très bénéfique pour les nombreuses souches génétiquement modifiés, car les chiots n’est peut-être pas aussi vigoureux comme des animaux de type sauvage ou.
Mâles et femelles est séparées au moment du sevrage. Lorsque cela est possible, récemment sevrés ne doivent pas être logés séparément. Si une litière contient seulement un chiot d’un sexe donné, tentatives devraient être faites pour abriter ce chiot avec d’autres personnes du même sexe. Options de logement possibles sont : 1) un seul chiot femelle peut-être rester avec la mère, sinon dans une cage d’élevage intensif ; 2) un seul petit de sexe féminin ou masculin peut être placé avec les autres programmes potentiellement indésirables de même-sexe dans une litière différente du même âge ; 3) si les parents sont un couple monogame, la femelle peut être enlevée de la cage pour permettre à un seul petit mâle être logé avec le père ; et 4) un chiot mâle unique peut-être être hébergé avec les frères et sœurs femelles vers le haut à l’âge de 5 semaines. Le sexe des chiots devrait être vérifié une semaine après le sevrage pour éviter les portées non désirées de chiots mal distincts.
Rats et les souris sevrés doivent vérifier quotidiennement pour s’assurer qu’ils sont en plein essor. Bien que la Guide pour le soin et l’utilisation des animaux de laboratoire5 affirme qu’aliments doivent être présentés aux animaux de manière à éviter qu’il ne soit souillé par les excréments et l’urine, souris nouvellement sevrés devraient bénéficier d’une petite quantité de nourriture (un granulés par la souris) placé dans un plat en verre (Pétri) sur le plancher de la cage. Cela encouragera les animaux à la transition pour avoir chow rongeur comme leur seule source d’alimentation. Même pour les animaux qui sont trouvent sur des étagères qui fournissent de l’eau pour les cages à travers un système d’arrosage automatique, une bouteille d’eau peuvent être ajoutée à la cage si les souris semblent être déshydraté.
| Nom |
Type de colonie |
Description |
| IC |
Tel |
Albino |
| Swiss-Webster |
Tel |
Albino |
| BALB/c |
Consanguines |
Albino |
| FVB |
Consanguines |
Albino |
| C57BL/6 |
Consanguines |
Couleur de la robe noire |
| C3H |
Consanguines |
Couleur de la robe brun |
| S/N/2 |
Consanguines |
Couleur de la robe marron/gris |
| Athymiques nus (nu/nu) |
Consanguines |
Sans poils |
| SCID |
Consanguines |
Sévère combinée immunodéficientes souris-différentes couleurs |
Le tableau 1. Couramment utilisé des souris taches et des stocks.
| Nom |
Type de colonie |
Description |
| Sprague-Dawley |
Tel |
Albino |
| Wistar |
Tel |
Albino |
| Fisher 344 |
Consanguines |
Albino |
| Lewis |
Consanguines |
Albino |
| Long Evans |
Consanguines |
Capuchon, noir et blanc |
Le tableau 2. Les stocks et les souches de rats couramment utilisés















