1. Le informazioni necessarie per l'accoppiamento degli animali includono il ceppo /stock dell'animale che utilizza la nomenclatura corretta, le date di nascita per il maschio e la femmina dell'allevatore e la data di installazione. Una registrazione accurata è imperativa con le colonie riproduttive.
2. La determinazione del sesso di topi e ratti viene effettuata confrontando le distanze anogenitali. Nelle femmine, la distanza tra l'ano e i genitali esterni è più breve di quanto non sia per i maschi. La presenza di un sacco scrotale negli animali maschi è un altro indicatore sessuale.
3. Selezione e impostazione dello schema di accoppiamento
NOTA: è possibile utilizzare due schemi di accoppiamento.
- Accoppiamento temporizzate proestro/estro: questo metodo si basa sull'accoppiamento delle femmine con i maschi nel punto di massima ricettività e fertilità.
- Il ciclo estrale deve essere monitorato nelle femmine sia mediante esame visivo dei genitali esterni per i cambiamenti indicativi di proestro ed estro, sia mediante citologia delle secrezioni vaginali (vedi sotto).
- Quando una femmina è determinata ad essere in estro o estro, è accoppiata con un maschio alla fine della giornata, poiché gli animali generalmente si accoppiano di notte.
- La mattina seguente, la femmina viene esaminata per un tappo copulatorio (vedi sotto). Se non è presente alcuna spina, la femmina può rimanere con il maschio durante il giorno e controllata per una spina copulatoria alla fine della giornata. In alternativa, se si determina che non è più in estro o estro, viene rimossa dalla gabbia di riproduzione.
- Accoppiamento casuale a tempo: questo metodo si basa sul fatto che il ciclo estrale dei roditori è molto breve, lungo 4-5 giorni.
- Per questo metodo, gli accoppiamenti possono essere impostati in qualsiasi momento e le femmine vengono quindi controllate per i tappi copulatori ogni mattina e sera fino a quando non viene osservata una spina.
- Una femmina è accoppiata con un maschio la sera.
- Viene controllata per una spina copulatoria all'inizio e alla fine di ogni giorno fino a quando non viene osservata una spina. Di solito ci vogliono 3 o più giorni per vedere una spina quando si utilizza questo metodo.
4. Prevedere la gravidanza
Poiché la palpazione dei cuccioli è difficile fino a più tardi durante la gravidanza, intorno al giorno 10-12, sono stati sviluppati sistemi ad ultrasuoni commerciali per roditori; tuttavia, poche strutture di ricerca sugli animali hanno questa tecnologia. Pertanto, la visualizzazione di tappi copulatori, l'osservazione dei cambiamenti vaginali o la citologia vaginale sono comunemente usati per aiutare con la previsione di quando una femmina ha concepito una cucciolata (vedi sotto). Tuttavia, nessuno di questi metodi è in grado di confermare la gravidanza. Una volta osservato un tappo copulatorio, la femmina deve essere monitorata per segni di gravidanza, come l'aumento di peso.
5. Determinazione dello stadio del ciclo estrale
- Ispezione visiva
NOTA: Per l'accoppiamento a tempo di topi e ratti, l'osservazione visiva della vagina per i cambiamenti indicativi di proestro ed estro è il metodo più rapido per determinare la fase del ciclo estrale e non richiede attrezzature speciali.
- Quando si valuta il ciclo estrale utilizzando il metodo visivo, è importante eseguire l'ispezione visiva nella stessa area rispetto all'illuminazione della stanza, poiché la fonte di luce può cambiare il colore percepito dei tessuti vaginali e rendere difficile la valutazione. Ad esempio, la tonalità viola proiettata dalle luci a LED rende più difficile il rilevamento visivo.
- Per valutare lo stadio del ciclo estrale mediante osservazione visiva, ogni topo deve essere trattenuto manualmente dalla coda, con le zampe posteriori appoggiate su un coperchio della gabbia.
- L'apertura vaginale di ogni femmina viene valutata in base alle condizioni del tessuto che circonda l'area vaginale e alle dimensioni dell'apertura vaginale. 2
- Durante il proestro, l'apertura vaginale è ampia ed è caratterizzata da gonfiore del tessuto circostante. Il tessuto è di colore rosa e molto umido. Spesso ci sono rughe o striature lungo i bordi dorsale e ventrale dell'apertura.
- Durante l'estro, il gonfiore dei tessuti che circondano l'apertura vaginale è ridotto e i tessuti non sono così umidi e rosa.
- Durante il metestro l'apertura vaginale è minima e c'è un gonfiore trascurabile.
- Durante il diestro, non c'è gonfiore dei tessuti intorno all'area vaginale e l'apertura vaginale è piccola e chiusa.
- Citologia vaginale
Poiché sia i topi che i ratti sono poliestri, la durata del ciclo di estro è molto breve, che va da 4-5 giorni. A volte è necessario identificare tutti e quattro gli stadi dell'estro: proestro, estro, metestro e diestro. La citologia vaginale è un metodo molto accurato per determinare queste fasi. Esistono anche due metodi di raccolta del campione: il metodo non invasivo della lavanda vaginale e il metodo invasivo del tampone vaginale del canale.- Lavanda vaginale
- I materiali necessari sono punte sterili per pipette da 200 μl, bulbi in lattice, acqua sterile a doppio distillato (ddH20) e vetrini puliti.
- Posizionare un bulbo di lattice all'estremità di una punta sterile da 200 μl. Aspirare circa 100 μl di ddH2O sterile nella pipetta.
- Solleva il topo dalla gabbia e mettilo sulla parte superiore della gabbia della barra di filo con la coda verso di te.
- Afferrare saldamente la coda ed elevare i quarti posteriori del topo. Il mouse avrà ora solo le zampe anteriori che afferrano il coperchio.
- Se il topo urina, attendere che la minzione si fermi. Se dovesse essere lasciata urina all'ingresso del canale vaginale, l'apertura può essere risciacquata con un piccolo spruzzo di ddH2O. Cambia la punta che è stata utilizzata per il risciacquo.
- Posizionare l'estremità della punta riempita di ddH2O all'apertura del canale vaginale senza penetrare nell'orifizio.
- Premere delicatamente il bulbo per espellere da un quarto a metà del volume d'acqua (~ 25-50 μl) all'apertura del canale vaginale. Il liquido aspira spontaneamente nel canale senza inserimento della punta. Rilasciare lentamente la pressione esercitata sulla lampadina. Il fluido si ritirerà di nuovo nella punta.
- Evitare di rilasciare la pressione troppo rapidamente per impedire l'aspirazione del fluido nella lampadina. Un suggerimento filtrato può essere utile per questo scopo.
- Ripetere il passaggio precedente 4-5 volte utilizzando la stessa punta, bulbo e fluido per ottenere un numero sufficiente di cellule in un singolo campione.
- Posizionare il fluido su un vetrino e lasciare asciugare completamente lo striscio a temperatura ambiente.
- Utilizzare una nuova pipetta per ogni mouse.
- Una volta asciutti, questi strisci estrali possono essere macchiati immediatamente o conservati e macchiati in un secondo momento. La colorazione Wright-Giemsa è più comunemente usata per macchiare le diapositive. Questa macchia è disponibile in commercio come una macchia in un solo passaggio che non richiede la fissazione del vetrino per evitare che le cellule si lavano durante il processo di colorazione. La diapositiva viene posizionata nella macchia per 45-60 secondi, secondo le istruzioni del produttore.
- I vetrini vengono poi esaminati al microscopio, e le cellule viste corrispondono allo stadio del ciclo: 1) se la femmina è in proestro, le cellule sono viste come gruppi di cellule epiteliali nucleate rotonde e ben formate con un nucleo che si colora più scuro del citoplasma; 2) se la femmina è in estro, la maggior parte delle cellule sono cellule epiteliali squamose cornificate che mancano di un nucleo, sono di aspetto angolare e si presentano in gruppi densamente imballati; 3) se la femmina è in metestro, le cellule sono tipicamente globuli bianchi (in particolare neutrofili con alcune cellule epiteliali squamose cornificate presenti) con nuclei macchiati di scuro che hanno la forma di due salsicce collegate tra loro; 4) durante il diestro, le cellule presenti sono normalmente globuli bianchi con la presenza di poche cellule epiteliali nucleate.
- Tamponi vaginali
- I materiali necessari sono applicatori sterili con punta in cotone con punta di 2 mm di diametro, vetrini per microscopi in vetro pulito e soluzione fisiologica sterile.
- Bagnare un applicatore con punta di cotone con soluzione salina.
- Inserire la punta dell'applicatore nella vagina del mouse trattenuto.
- Girare delicatamente e rotolare la punta contro la parete vaginale. Rimuovere con attenzione il tampone.
- Le cellule vengono trasferite in un vetrino asciutto facendo rotolare il tampone attraverso il vetrino.
- Una volta che la diapositiva è asciutta, può essere macchiata con la macchia Wright-Giemsa.
Il tampone è considerato una procedura stressante e, quando sono stressati, i topi possono avere cicli estrali interrotti. La stimolazione vaginale e cervicale causata dal tampone può indurre pseudogravidanza. Tamponi ripetuti della mucosa vaginale possono causare danni se non eseguiti delicatamente, con la dovuta moderazione e con i tamponi di cotone di dimensioni corrette. 3,4
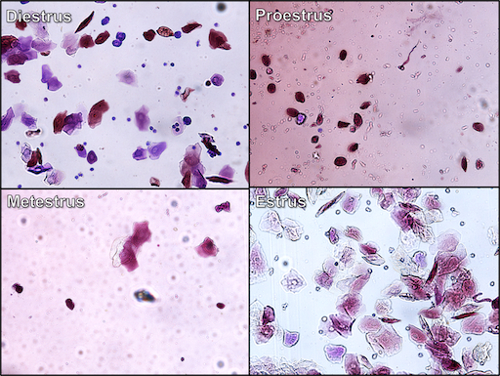
Figura 2. Citologia vaginale - diverse fasi del ciclo dell'estro del roditore
6. Visualizzazione di una spina copulatoria
Questo tappo è costituito da liquido vaginale e sperma e persiste nella vagina per 12-24 ore di postcopulazione. La presenza della spina conferma l'accoppiamento, ma non garantisce che la femmina sia incinta. Se la femmina collegata è incinta, il primo giorno di gestazione è considerato il giorno dopo la scoperta della spina.
- Solleva il topo dalla gabbia e posizionalo sulla parte superiore della gabbia della barra metallica con la coda verso di te.
- Posizionare il mouse applicando una pressione appena sopra la coda per inarcare la schiena per consentire una migliore presentazione dell'apertura vaginale.
- Osserva la sua apertura vaginale per una massa biancastra. La spina copulatoria potrebbe non essere visivamente evidente, ma può essere confermata con l'uso di una sonda smussata.
- Utilizzando la punta della sonda, inserirla delicatamente nell'apertura vaginale. La presenza di un tappo copulatorio impedirà l'avanzamento della sonda entro 0,5 cm dall'apertura vaginale.
- La sonda deve essere disinfettata con alcool e asciugata completamente prima di ogni utilizzo.
Poiché la femmina ha cucciolate, la data di nascita, le dimensioni della cucciolata, il numero di nati, il numero di svezzati, il rapporto tra cuccioli maschi e femmine e il rapporto tra genotipi dovrebbero essere tutti registrati. Se i genotipi all'interno di una cucciolata non corrispondono ai genotipi dei genitori, è necessario ripetere il test per verificare il vero genotipo.
7. Svezzamento
La gestazione per topi e ratti è di circa 21 giorni. I giovani vengono svezzati a 21-28 giorni di età. Sia i topi che i ratti possono riprodursi già a 8 settimane di età, quindi è imperativo che i cuccioli siano separati per sesso in tenera età. L'allevamento intensivo richiede che i cuccioli di ogni cucciolata siano svezzati al giorno 20 per evitare che i cuccioli più grandi siano presenti quando nasce la cucciolata successiva. Per l'allevamento non adintensivo, i cuccioli possono essere lasciati con la madre oltre i 20 giorni di età, spesso fino a 28 giorni di età. Questo può essere molto utile per molti ceppi geneticamente modificati, in quanto i cuccioli potrebbero non essere vigorosi come gli animali non ingegneri o selvatici.
I cuccioli maschi e femmine sono separati allo svezzamento. Quando possibile, i cuccioli appena svezzati non dovrebbero essere alloggiati da solo. Se una cucciolata contiene solo un cucciolo di un dato sesso, si dovrebbe tentare di ospitare questo cucciolo con altri dello stesso sesso. Le possibili opzioni di alloggio sono: 1) un singolo cucciolo femmina può rimanere con la madre se non in una gabbia di riproduzione intensiva; 2) un singolo cucciolo femmina o maschio può essere collocato con altri cuccioli dello stesso sesso di una cucciolata diversa della stessa età; 3) se i genitori sono una coppia monogama, la femmina può essere rimossa dalla gabbia per permettere ad un singolo cucciolo maschio di essere alloggiato con il padre; e 4) un singolo cucciolo maschio può essere ospitato con fratelli femmine fino a 5 settimane di età. Il sesso dei cuccioli dovrebbe essere verificato una settimana dopo lo svezzamento per prevenire cucciolate indesiderate da cuccioli impropriamente segregati.
Topi e ratti svezzati dovrebbero essere controllati quotidianamente per assicurarsi che stiano prosperando. Sebbene la Guida per la cura e l'uso degli animalida laboratorio5 affermi che il cibo deve essere presentato agli animali in modo tale da evitare che venga sporcato da feci e urina, ai topi appena svezzati dovrebbe essere fornita una piccola quantità di cibo (un pellet per topo) posto in una capsula di vetro (capsula di Petri) sul pavimento della gabbia. Ciò incoraggerà gli animali a passare ad avere il chow dei roditori come unica fonte di cibo. Anche per gli animali che sono alloggiati su rack che forniscono acqua alle gabbie attraverso un sistema di irrigazione automatico, una bottiglia d'acqua può essere aggiunta alla gabbia se i topi sembrano essere disidratati.
| Nome |
Tipo di colonia |
Descrizione |
| ICR · |
Allevato |
Albino |
| Svizzera-Webster |
Allevato |
Albino |
| Balb/c |
Innato |
Albino |
| FVB · |
Innato |
Albino |
| C57BL/6 · |
Innato |
Colore del mantello nero |
| C3H |
Innato |
Colore del mantello marrone |
| DBA/2 |
Innato |
Colore mantello marrone/grigio |
| Nudi atimici (nu/nu) |
Innato |
Glabro |
| SCID |
Innato |
Topi immunodefici combinati gravi - vari colori del mantello |
Tabella 1. Macchie e scorte di topo comunemente usate.
| Nome |
Tipo di colonia |
Descrizione |
| Sprague-Dawley |
Allevato |
Albino |
| Wistar · |
Allevato |
Albino |
| Fisher 344 · |
Innato |
Albino |
| Lewis |
Innato |
Albino |
| Lungo Evans |
Innato |
Incappucciato, bianco e nero |
Tabella 2. Ceppi e scorte di ratto comunemente usati.















