1. As informações necessárias ao emparelhar animais incluem cepa/estoque do animal utilizando nomenclatura adequada, datas de nascimento para o criador macho e fêmea, e a data de configuração. A manutenção precisa do registro é imperativa com colônias de reprodução.
2. A determinação sexual de ratos e ratos é feita comparando as distâncias anogenitais. No feminino, a distância entre o ânus e a genitália externa é menor do que para os machos. A presença de um saco escrotal em animais machos é outro indicador sexual.
3. Selecionar e configurar o esquema de acasalamento
NOTA: Existem dois esquemas de acasalamento que podem ser usados.
- Proestrus/estrus cronometrado acasalamento: Este método depende da comparação entre fêmeas com machos no ponto de máxima receptividade e fertilidade.
- O ciclo estrous deve ser monitorado nas fêmeas, seja por exame visual da genitália externa para alterações que sejam indicativas de proestrus e estrous, ou por citologia de secreções vaginais (veja abaixo).
- Quando uma fêmea é determinada a estar em proestrus ou estrus, ela é emparelhada com um macho no final do dia, como os animais geralmente acasalam à noite.
- Na manhã seguinte, a fêmea é examinada para um plugue copulatório (veja abaixo). Se não houver plugue, a fêmea pode permanecer com o macho durante o dia e verificar se há um plugue copulatório no final do dia. Alternativamente, se for determinado que ela não está mais em proestrus ou estrus, ela é removida da gaiola de reprodução.
- Acasalamento cronometrado aleatório: Este método baseia-se no fato de que o ciclo edênuo dos roedores é muito curto, de 4 a 5 dias de duração.
- Para este método, os acasalamentos podem ser configurados a qualquer momento, e as fêmeas são então verificadas por plugues copulatórios todas as manhãs e noites até que um plugue seja observado.
- Uma fêmea é emparelhada com um macho à noite.
- Ela é verificada para um plugue copulatório no início e no final de cada dia até que um plugue seja observado. Geralmente leva 3 ou mais dias para um plugue ser visto ao usar este método.
4. Prever a gravidez
Como a palpação de filhotes é difícil até mais tarde durante a gravidez, por volta do dia 10-12, sistemas comerciais de ultrassom para roedores foram desenvolvidos; no entanto, poucas instalações de pesquisa animal têm essa tecnologia. Portanto, a visualização de plugues copulatórios, a observação de alterações vaginais ou citologia vaginal são comumente usadas para auxiliar na previsão de quando uma fêmea concebeu uma ninhada (veja abaixo). No entanto, nenhum desses métodos é capaz de confirmar a gravidez. Uma vez observada uma ficha copulatória, a fêmea deve ser monitorada para sinais de gravidez, como ganho de peso.
5. Determinando o estágio do ciclo estrous
- Inspeção Visual
NOTA: Para o acasalamento cronometrado de ratos e ratos, a observação visual da vagina para alterações que são indicativas de proestrus e estrus é o método mais rápido para determinar o estágio de ciclo estrous, e não requer nenhum equipamento especial.
- Ao avaliar o ciclo estrous utilizando o método visual, é importante realizar a inspeção visual na mesma área no que diz respeito à iluminação do quarto, pois a fonte de luz pode alterar a cor percebida dos tecidos vaginais e dificultar a avaliação. Por exemplo, a tonalidade roxa lançada por luzes LED dificulta a detecção visual.
- Para avaliar o estágio do ciclo estrous por observação visual, cada rato deve ser contido manualmente pela cauda, com as previs descansando sobre uma tampa da gaiola.
- A abertura vaginal de cada fêmea é avaliada com base na condição do tecido ao redor da área vaginal e do tamanho da abertura vaginal. 2
- Durante o proestrus, a abertura vaginal é larga e é caracterizada pelo inchaço do tecido circundante. O tecido é rosa na cor e muito úmido. Muitas vezes há rugas ou estrias ao longo das bordas dorsal e ventral da abertura.
- Durante os estrus, o inchaço dos tecidos ao redor da abertura vaginal é reduzido, e os tecidos não são tão úmidos e rosados.
- Durante o metestrus a abertura vaginal é mínima e há um inchaço insignificante.
- Durante diestrus, não há inchaço dos tecidos ao redor da área vaginal, e a abertura vaginal é pequena e fechada.
- Citologia vaginal
Como tanto os ratos quanto os ratos são poliestrosos, o comprimento do ciclo estrus é muito curto, variando de 4 a 5 dias. Às vezes é necessário identificar todos os quatro estágios de estrous: proestrus, estrus, metestrus e diestrus. Citologia vaginal é um método muito preciso para determinar esses estágios. Há também dois métodos de coleta de amostras: o método não invasivo de lavage vaginal, e o método invasivo de swabbing do canal vaginal.- Lavage vaginal
- Os materiais necessários são pontas estéreis de 200 μl de pipetas, lâmpadas de látex, água dupla destilada estéril (ddH20) e lâminas de vidro limpas.
- Coloque uma lâmpada de látex na extremidade de uma ponta estéril de 200 μl. Elasenhe aproximadamente 100 μl de ddH2O estéril na pipeta.
- Levante o rato para fora da gaiola, e coloque-a no topo da gaiola da barra de arame com a cauda em sua direção.
- Segure firmemente a cauda e eleve os traseiros do mouse. O mouse agora terá apenas as patas dianteiras segurando a tampa.
- Se o rato urinar, espere até que a urinação pare. Caso haja urina na entrada do canal vaginal, a abertura pode ser enxaguada com um pequeno esguicho de ddH2O. Troque a ponta que foi usada para enxaguar.
- Coloque a ponta preenchida com ddH2O na abertura do canal vaginal sem penetrar no orifício.
- Deprimir suavemente a lâmpada para expelir um quarto a metade do volume de água (~25-50 μl) na abertura do canal vaginal. O líquido aspirará espontaneamente no canal sem inserção de ponta. Solte lentamente a pressão exercida sobre a lâmpada. O fluido vai se retirar de volta para a ponta.
- Evite liberar pressão muito rapidamente para evitar a aspiração de fluido na lâmpada. Uma ponta filtrada pode ser útil para este fim.
- Repita a etapa anterior 4-5 vezes usando a mesma ponta, lâmpada e fluido para obter um número suficiente de células em uma única amostra.
- Coloque o fluido na lâmina de vidro e deixe a mancha secar completamente à temperatura ambiente.
- Use uma nova pipeta para cada mouse.
- Uma vez secas, essas manchas estrous podem ser manchadas imediatamente ou armazenadas e manchadas posteriormente. A coloração wright-Giemsa é mais comumente usada para manchar os slides. Esta mancha está disponível comercialmente como uma mancha de uma etapa que não requer fixação do slide para evitar que as células se lavem durante o processo de coloração. O slide é colocado na mancha por 45-60 segundos, de acordo com as instruções do fabricante.
- Os slides são então examinados sob um microscópio, e as células vistas correspondem ao estágio do ciclo: 1) se a fêmea estiver em proestrus, as células são vistas como aglomerados de células epiteliais redondas e bem formadas com um núcleo que mancha mais escuro que o citoplasma; 2) se a fêmea está em estrus, a maioria das células são células epiteliais escamosas cornificadas que não têm um núcleo, são angulares na aparência e ocorrem em aglomerados densamente embalados; 3) se a fêmea estiver em metestrus, as células são tipicamente glóbulos brancos (especificamente neutrófilos com algumas células epiteliais escamosas cornificadas presentes) com núcleos manchados de escuro que têm a forma de duas salsichas ligadas; 4) durante diestrus, as células presentes são normalmente glóbulos brancos com a ocorrência de algumas células epiteliais nucleadas..
- Swabbing vaginal
- Os materiais necessários são aplicadores estéreis com ponta de algodão com ponta de 2 mm de diâmetro, lâminas de microscópio de vidro limpo e soro fisiológico estéril.
- Molhe um aplicador de ponta de algodão com soro fisiológico.
- Insira a ponta do aplicador na vagina do mouse contido.
- Vire suavemente e role a ponta contra a parede vaginal. Remova cuidadosamente o cotonete.
- As células são transferidas para uma lâmina de vidro seca rolando o cotonete através do escorregador.
- Uma vez que o slide está seco, ele pode ser manchado com a mancha Wright-Giemsa.
A limpeza é considerada um procedimento estressante, e quando ratos estressados podem ter interrompido ciclos estrous. Estimulação vaginal e cervical causada por swabbing pode induzir pseudopregnancy. Cotonetes repetidos da mucosa vaginal podem causar danos se não forem realizados suavemente, com a devida contenção e com os cotonetes de algodão de tamanho correto. 3,4
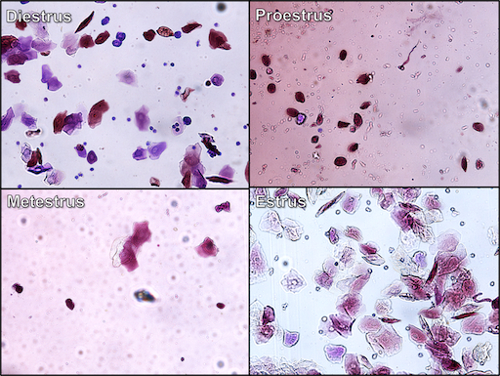
Figura 2. Citologia vaginal - diferentes estágios do ciclo de estrus de roedores
6. Visualização de um plugue copulatório
Este plugue consiste em fluido vaginal e sêmen, e persiste na vagina por 12-24 h póscopulação. A presença do plugue confirma o acasalamento, mas não garante que a fêmea esteja grávida. Se a fêmea plugada estiver grávida, o primeiro dia de gestação é considerado um dia após a ção do plugue.
- Levante o rato para fora da gaiola e coloque-a no topo da gaiola da barra de arame com a cauda em sua direção.
- Posicione o mouse aplicando pressão logo acima da cauda para arquear a parte de trás para permitir uma melhor apresentação da abertura vaginal.
- Observe sua abertura vaginal para uma massa esbranquiçada. O plugue copulatório pode não ser visualmente óbvio, mas pode ser confirmado com o uso de uma sonda sem cortes.
- Usando a ponta da sonda, insira-a suavemente na abertura vaginal. A presença de um plugue copulatório impedirá o avanço da sonda dentro de 0,5 cm da abertura vaginal.
- A sonda deve ser desinfetada com álcool e seca completamente antes de cada uso.
Como a fêmea tem ninhadas, a data de nascimento, o tamanho da ninhada, o número nascido, o número desmamado, a razão entre filhotes machos e fêmeas e a razão dos genótipos devem ser todos registrados. Se os genótipos dentro de uma ninhada não correspondem aos genótipos dos pais, o reteste deve ser feito para verificar o genótipo verdadeiro.
7. Desmamar
A gestação para ratos e ratos é de aproximadamente 21 dias. Os jovens são desmamados aos 21-28 dias de idade. Tanto camundongos quanto ratos podem procriar até 8 semanas de idade, portanto é imperativo que os filhotes sejam separados por sexo em uma idade precoce. A reprodução intensiva exige que os filhotes de cada ninhada sejam desmamados no dia 20 para evitar que os filhotes mais velhos estejam presentes quando a próxima ninhada nascer. Para a reprodução não intensiva, os filhotes podem ficar com a mãe após 20 dias de idade, muitas vezes até 28 dias de idade. Isso pode ser muito benéfico para muitas cepas geneticamente modificadas, já que os filhotes podem não ser tão vigorosos quanto animais não silvestres ou selvagens.
Filhotes machos e fêmeas são separados no desmamar. Sempre que possível, filhotes recém-desmamados não devem ser alojados de forma singly. Se uma ninhada contém apenas um filhote de um determinado sexo, devem ser feitas tentativas de abrigar este filhote com outros do mesmo sexo. As opções de moradia possíveis são: 1) um único filhote fêmea pode permanecer com a mãe se não estiver em uma gaiola de reprodução intensiva; 2) Um único filhote feminino ou masculino pode ser colocado com outros filhotes do mesmo sexo de uma ninhada diferente da mesma idade; 3) se os pais são um par monogâmico, a fêmea pode ser removida da gaiola para permitir que um único filhote macho seja alojado com o pai; e 4) um único filhote macho pode ser alojado com irmãos do sexo feminino até 5 semanas de idade. O sexo dos filhotes deve ser verificado uma semana após a morte para evitar que ninhadas indesejadas sejam filhotes segregados incorretamente.
Os ratos e ratos desmasmamento devem ser verificados diariamente para garantir que eles estão prosperando. Embora o Guia de Cuidado e Uso de Animais de Laboratório5 adquira que os alimentos devem ser apresentados aos animais de forma a evitar que sejam sujos por fezes e urina, os camundongos recém-desmamados devem receber uma pequena quantidade de alimento (uma pelota por rato) colocado em uma placa de vidro (placa de petri) no chão da gaiola. Isso incentivará os animais a fazer a transição para ter a comida de roedores como sua única fonte de alimento. Mesmo para animais que estão alojados em racks que fornecem água para as gaiolas através de um sistema de rega automática, uma garrafa de água pode ser adicionada à gaiola se os ratos parecerem estar desidratados.
| Nome |
Tipo colônia |
Descrição |
| ICR |
Outbred |
Albino |
| Swiss-Webster |
Outbred |
Albino |
| Balb/c |
Inato |
Albino |
| FVB |
Inato |
Albino |
| C57BL/6 |
Inato |
Cor do casaco preto |
| C3H |
Inato |
Cor do casaco marrom |
| DBA/2 |
Inato |
Cor do casaco marrom/cinza |
| Nus atímicos (nu/nu) |
Inato |
Calvo |
| SCID |
Inato |
Cores severas combinadas de ratos deficientes imunológicos-várias cores de casaco |
Mesa 1. Manchas e estoques de rato comumente usados.
| Nome |
Tipo colônia |
Descrição |
| Sprague-Dawley |
Outbred |
Albino |
| Wistar |
Outbred |
Albino |
| Fisher 344 |
Inato |
Albino |
| Lewis |
Inato |
Albino |
| Longo Evans |
Inato |
Encapuzado, preto e branco |
Mesa 2. Cepas e estoques de ratos comumente usados.















