A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקת פעילות של ליגנד Protozoacidal-ממוסס פפטידים נגד גוט הטרמיטים פרוטוזואה במבחנה (תרבות פרוטוזואה) ו In vivo (Microinjection לתוך טרמיטים במעי האחורי)
* These authors contributed equally
In This Article
Summary
אנו מציגים הליכי הוכחת כי ligands להיקשר הממברנה את פני השטח של תאית לעכל פרוטוזואה במעיים של טרמיטים Formosan תת קרקעי באמצעות מיקרוסקופ פלואורסצנטי כי ligands יחד עם פפטידים ממס להרוג אלה פרוטוזואה במבחנה (תרבות פרוטוזואה אנאירובי) ו In vivo (זריקה לתוך במעי האחורי טרמיטים).
Abstract
אנחנו מפתחים גישה חדשנית לשלוט טרמיטים תת קרקעי שיוביל הסתמכות מופחתת על השימוש בחומרי הדברה כימיים. טרמיטים תת קרקעי תלויים פרוטוזואה ב hindguts של עובדים ביעילות לעכל עץ. פפטידים ממס הוכחו להרוג מגוון של טפילים protozoan (Mutwiri et al. 2000) וכן גם פרוטוזואה במעיים של טרמיטים התת Formosan, Coptotermes formosanus (Husseneder ו קולייר 2009). פפטידים ממס הם חלק של מערכת החיסון ספציפי של אאוקריוטים, ולהרוס את קרום של מיקרואורגניזמים (Leuschner ואת עמי 2004). פפטידים ממס רוב אינם צפויים לפגוע אאוקריוטים גבוה יותר, משום שהם אינם משפיעים על נייטרלי חשמלית כולסטרול המכילים קרום התא של אאוקריוטים גבוה יותר (Javadpour et al. 1996). פעולה פפטיד ממס יכול להיות ממוקד סוגי תאים מסוימים על ידי תוספת של ליגנד. לדוגמה, דיווחה הנזל et al. (2007) כי פפטידים ממס מצומדות עם תאים סרטניים ligands קרום קולטן יכול לשמש כדי להרוס תאים סרטן השד, בעוד פפטידים ממס לבד או עם מצומדות הלא ספציפית פפטידים לא היו יעילים. פפטידים ממס גם להיות מצומדת להורמונים אדם אשר נקלטות על ידי רצפטורים על תאים סרטניים להרס ממוקד של הערמונית ותאי סרטן האשכים (Leuschner ואת עמי 2004).
במאמר זה אנו מציגים שיטות השתמשו כדי להדגים את פעילות protozoacidal של פפטיד ממס (Hecate) מצמידים את ליגנד heptapeptide הנקשרת קרום פני השטח של פרוטוזואה מהבטן של טרמיטים התת Formosan. טכניקות אלו כוללות כריתה של המעי מעובדים טרמיטים, תרבות אנאירובי של המעיים פרוטוזואה (Pseudotrichonympha grassii, Holomastigotoides hartmanni,
Spirotrichonympha leidyi), אישור מיקרוסקופיים כי ליגנד מסומן עם פלורסנט לצבוע נקשר במעי טרמיטים פרוטוזואה אחרים חופשיים החיים פרוטוזואה אך לא חיידקים או רקמת המעי. כמו כן, אנו מראים כי ליגנד אותו מצמידים את פפטיד ממס ביעילות הורג בטן טרמיטים פרוטוזואה במבחנה (תרבות פרוטוזואה) ו in vivo (microinjection לתוך במעי האחורי של עובדים), אך הוא bacteriacidal פחות הפפטיד ממס לבד. אובדן מוביל פרוטוזואה למוות של טרמיטים פחות משבועיים.
בעתיד, נוכל להנדס גנטית מיקרואורגניזמים שיכולים לשרוד במעי האחורי טרמיטים ולהתפשט דרך מושבה טרמיטים כמו "סוסים טרויאניים" להביע ליגנד-ממוסס פפטידים כי יהרוג את פרוטוזואה במעי טרמיטים ולאחר מכן להרוג את הטרמיטים במושבה . ליגנד-ממוסס פפטידים גם יכול להיות שימושי עבור פיתוח תרופות נגד טפילים protozoan.
Protocol
ניסוי 1: מיצוי של המעיים טרמיטים פרוטוזואה בתנאים אנאירוביים
- השתמש בתיבת אוהד (מעבדות מתחנחן) בתיבת כפפה כל הזמן להסתובב באוויר באמצעות יבוש ו-D-זרז סוג Stak הפקיסטנים לשלוט לחות רמות החמצן ולחסל בטמפרטורות אחידה. מלאו את תא הכפפות עם זרם מתמשך של חנקן במשך 20 דקות עד 30. צג רמות החמצן עם חיישן חמצן (C בריבוע, Inc) עבור 1 ח השתמש חנקן להגיע ולתחזק בתנאים אנאירוביים בעת הצורך.
- הכן טרייגר U מדיה (טרייגר 1934) ולהתאים את ה-pH 7.0. Sparge התקשורת מעוקרים לסנן בתא הכפפות בתערובת של מימן 2.5%, דו תחמוצת הפחמן של 5% ו - 92.5% חנקן עבור h 1 להסיר שאריות חמצן.
- Silanize כל החומרים כולל שקופיות מיקרוסקופ, microcentrifuge צינורות, טפטפות, כלי זכוכית וכו 'השתמשו בניסויים באמצעות Sigmacote למנוע ספיחה של פרוטוזואה או פפטידים על משטחים (Sigmacote, Sigma, # SL-2, http://www.sigmaaldrich.com/ etc / medialib / docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf).
- מאז הבטן טרמיטים פרוטוזואה הם אורגניזמים אנארוביים בהחלט לא חייב להיות חשוף לחמצן. לכן השלבים הבאים מבוצעים בתנאים אנאירוביים בתיבת כפפה (ראה 1.1). לצלול עם מלקחיים את כל הגוף של עובד טרמיטים באתנול 70% בעדינות מערבולת של כ 10 עבור להסיר מזהמים על פני השטח.
- הסר את העובד מן אתנול ולאפשר לו להתייבש על Kimwipe נקי למשך כ 20 שניות השתמש סטרילית קנס שקצהו מלקחיים להחזיק את הבטן העובד לתפוס את קצה הבטן עם זוג נוסף של מלקחיים כדי משוך בעדינות את הבטן כלפי מעלה או כלפי מטה בזווית של 45 מעלות. אם הבטן נמשך בזווית ישרה עם כוח רב מדי היא עלולה להתפרק. מקום 10 אומץ על ירידה של 100 μl התקשורת טרייגר U בשקופית מיקרוסקופ.
- פירס אומץ עם זוג סטרילי בדיקות לנתח בסדר לשחרר את פרוטוזואה בעדינות להעביר את תוכן המעיים עם פיפטה 200 μl לתוך צינור microcentrifuge 1 מ"ל מכיל 900 μl טרייגר U התקשורת. לאחר המאפשר שקיעה של שברי קיר הבטן (5 ים), 900 העברה של μl supernatant אל צינור טריים.
- העברת 10 μl של התרבות פרוטוזואה לשקופית מיקרוסקופ sigmacoted ולבדוק את מצבו של פרוטוזואה במיקרוסקופ בהגדלה 200 X.
- הכן תרבויות השליטה pyriformis Tetrahymena אירובית פרוטוזואה, אמבה sp., Euglena sp. ו הסנדלית sp. (החברה קרוליינה אספקה ביולוגית, Burlington, NC), כמו גם תרבות הלילה של Escherichia coli בתקשורת תרבות המומלץ על ידי הספק.
ניסוי 2: ליגנד הוסף בשילוב עם פלורסנט לצבוע את פרוטוזואה וחיידקים התרבויות לבדוק מחייב את הקרומים פני קירות התא
השתמשנו בעבר להציג phage ספריות (ניו אינגלנד Biolabs Inc, Ipswich, MA) כדי לזהות רצפי 19 heptapeptide אשר נקלטות על ידי פרוטוזואה (פרוטוקולים זמינים http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdf). ליגנד עם רצף הפפטיד (ALNLTLH) הראו כי דמיון גליקופרוטאינים המשוערת ידוע מן הקרום Trypanosoma brucei היה מסונתז ו מצמידים את בטרמינל C-פלורסנט בדיקה (EDANS, 5 - ((2-Aminoethyl) אמינו) נפטלין-1-sulfonic חומצה, λmax = 341 ננומטר, λem = 471 ננומטר) באמצעות סינתזה פפטיד מצב מוצק (SSPS) באמצעות שרף NovaTag EDANS (EMD Biosciences). כאן אנו מראים כי ליגנד נקשר פרוטוזואה שהיו מבודדים מהבטן טרמיטים ושאר חיות עצמית פרוטוזואה, אך לא חיידקים.
- תרבות פרוטוזואה כמתואר Exp. 1. תקן פרוטוזואה עם פורמלדהיד 10% ב 4 ° C למשך 12 ח
- צנטריפוגה הפתרון פרוטוזואה (30 XG, 10 דקות), לבטל את supernatant ולשטוף גלולה המכילה את פרוטוזואה קבוע פעמיים 1ml טרייגר U התקשורת. Re-להשעות גלולה של 1 מ"ל טרייגר U התקשורת. כמו כן, לתקן אחרים פרוטוזואה, וא coli חיידקים שולטת.
- דגירה מיקרואורגניזמים קבוע עבור שעות 1-2 עם פתרון של ליגנד מסונתז מצמידים את EDANS צבע פלואורסצנטי (מוכן במים) בריכוז סופי של 50 מיקרומטר. ליגנד מתמוסס טוב יותר במים מאשר טרייגר U התקשורת.
- שים לב מיקרואורגניזמים תחת מיקרוסקופ פלואורסצנטי בהגדלה 400 X מקסימום ספיגת ב 341 ננומטר פליטה באזור כחול ב 471 ננומטר.
ניסוי 3: בדיקת פעילות protozoacidal של ליגנד מצמידים את פפטיד ממס במבחנה (תרבות פרוטוזואה)
המצומד של ליגנד לבין ממס פפטיד Hecate (Mutwiri et al. 2000) היה מסונתז בעבר במתקן חלבון LSU.
- Silanize החומרים ולהכין בטן טרמיטים תרבות פרוטוזואה בתא הכפפות אנאירוביים המתוארים Exp. 1.
- הכן תרבויות של מיקרואורגניזמים aerobe השליטה (למשל, החיידק לבין חופשית חיים מינים פרוטוזואה pyriformis ט ').
- בסביבה אנאירובי של תא הכפפות, פיפטה 6 aliquots של μl 198 של התרבות פרוטוזואה לתוך צינורות 0.5 מ"ל Eppendorf. הוסף 2 μl של פתרון 100 מיקרומטר של הפפטיד ליגנד-ממוסס למחצית aliquots (ריכוז בסוף 1 מיקרומטר) של התרבות טרמיטים פרוטוזואה במעיים. הוסף 2 μl מים החצי השני של aliquots (שולטת).
- על benchtop, להכין aliquots דומה של E. coli ו - ט ' pyriformis עם 1 פפטיד ממס מיקרומטר פפטיד ליגנד-ממס, או מים.
- לאחר h 1, להעביר 10 μl של כל תרבות פרוטוזואה על השקופיות. השווה את ההישרדות של מטופלים פרוטוזואה לזה של שולט מתחת למיקרוסקופ בהגדלה של X 200.
- לאחר 1 שעה, צלחת 100 μl של כ. 10 דילול -4 של E. coli תרבויות על BHI ו לדגור על 37 מעלות צלזיוס למשך הלילה. השווה את מספר יחידות המושבה להרכיב על הצלחות.
ניסוי 4: הזרקת ליגנד מצמידים את צבע ניאון לתוך במעי האחורי טרמיטים
- משוך מחטים (דגם GD-1, 1 X 900 מ"מ) באמצעות חולץ PC-10 זכוכית Narishige micropipette עם רמת החום כפולה הבמה (65 ו -48) כדי לקבל קצה גודל של 20-30 מיקרומטר. אשר את גודל טיפ על ידי מדידת אותו תחת מיקרוסקופ באמצעות מיקרומטר.
- מלא מחט עם CA. 30 μl של 50 מיקרומטר של ליגנד מסומן fluorescently המרחפים במים באמצעות מזרק המצורף. מלאו אחר מחט עם מים עבור הפקד. צרף micropipette (0.5 קיבולת μl ו 32 מ"מ אורך, מדעי החברה דראמונד) למחזיק ב micromanipulator. צרף מחט לבעל הזרקת מערכת micromanipulator שנייה. הגדרת פרמטרים הזרקת הראשונית אורך כ 1 הדופק s ו 10-12 הזרקת psi. מראש את המחט לאט לתוך micropipette ו להזריק את הפתרון באמצעות שהונעה במהירות גבוהה במערכת הזרקה אלקטרונית עם בקרת דופק אורך המצורפת זרימת גז חנקן מבוקר, אשר מבטיח כי נפח קבוע מוזרק reproducibly. לאחר ההזרקה, להסיר את micropipette ולהקליט את אורך הפתרון מוזרק באמצעות קליפר Vernier. חשב את נפח מוזרק מן הפרמטרים הידועים של micropipette. התאם את הלחץ של גז חנקן אורך הפולס לגרש 0.3 פתרון μl הזרקת יחיד.
- לסחוט את הקצה של הבטן עובדת טרמיטים עם מלקחיים רכה כדי להסיר להציג הפרשות פי הטבעת. לשתק עובד על ידי טרמיטים מצמרר אותם על קרח למשך 5 דקות.
- הפוך את מקלטי לקיום עובדים טרמיטים ידי ניתוק 100 טיפים פיפטה μl באמצעות להב סכין המנתחים. חותכים את קצה לאורך של 10-12 מ"מ ולהשתמש בהתאם לגודל של טרמיטים.
- צרף את האפרכסת micromanipulator. המקום עובד על צלחת פטרי בצד הגבי שלה לשאוב ראש הפועל הראשון לתוך השפופרת בעזרת משאבת יניקה חנקן כך הסופית של בולט העובד מהמקלט.
- החזקת מקלט טרמיטים, בזהירות לקדם את המחט מלא באמצעות micromanipulator כדי להכניס אותו לתוך פי הטבעת עובד. הזרק 0.3 μl של הפתרון (ליגנד מסומן fluorescently או מים שולטת).
- מניחים את העובדים הזריקו ליגנד או מים לתוך נפרד בצלחות פטרי עם נייר סינון רטוב ולשמור אותם על 26 ± 2 ° C עם 78% לחות יחסית
- אומץ לעקור מן טרמיטים מוזרק לאסוף את פרוטוזואה לאחר 24 שעות, כפי שמוצג לעיל Exp. 1. תקן ולבחון את פרוטוזואה כפי שמוצג Exp. 2.
ניסוי 5: בדיקת פעילות protozoacidal של ליגנד מצמידים את פפטיד ממס in vivo (זריקה לתוך טרמיטים במעי האחורי)
- Silanize חומרים כמתואר Exp. 1.
- הכן פתרון 500 מיקרומטר של הפפטיד ליגנד-ממוסס במים.
- בצע את שלבים 3.1) עד 3.4) כדי להכין כוס מחטים, מקלטי ועובדי טרמיטים.
- בעקבות בשיטות המתוארות 3.5) להזריק 0.3 μl של פתרון ליגנד-ממוסס פפטיד (טיפול) או מים (שליטה) לתוך במעי האחורי של 20 עובדים טרמיטים.
- החזק טרמיטים במשך 24 שעות, אומץ לעקור מן מספר עובדים ולבחון תוכן המעיים מתחת למיקרוסקופ כמתואר 3.6). ו 3.7).
- ברגע מותו של פרוטוזואה במעי טרמיטים הוא אישר, לשמור טרמיטים שטופלו הנותרים בקרות בצלחות פטרי עם נייר סינון לח לצפות התמותה היומי.
נציג תוצאות:
ניסוי 1: בדרך כלל במעי הקדמי, midgut ו במעי האחורי מתקבלים בחתיכה אחת, כאשר ההליך מלווה נכונה (איור 1 א). פרוטוזואה מתגוררים בצפיפות גבוהה בחלקים אנאירובי של במעי האחורי ניתן שפורסמו על ידי פירסינג במעי האחורי עם מלקחיים (1b איור 1 & 2). פרוטו הגדולמינים ZOA במעיים של טרמיטים התת Formosan הוא ציר בצורת P. grassii, אשר 200-300 מיקרומטר ארוך 150 מיקרומטר רחב ניתן לראות בעין בלתי מזוינת. המין השני בגודלו הוא בצורת אגס ח hartmanni (50-140 מיקרומטר ארוך 30-80 מיקרומטר רחב). המין הקטן ביותר הוא בצורת חרוט ס leidyi (15-50 מיקרומטר ארוך 8-30 מיקרומטר רחב;. לאל et al 1983). מינים פרוטוזואה מוצגות באיור 2.
בתנאים אופטימליים תרבות שלושה מינים של פרוטוזואה מבודד במעיים של טרמיטים Formosan תת קרקעי יישאר בריא ושלם עבור 72 שעות לפחות ב אנאירובי טרייגר U התקשורת (איור 3a). עם זאת, אם התנאים אינם אופטימליים תרבות פרוטוזואה ימותו מהר. אם יש שאריות חמצן בתקשורת, תנועת פרוטוזואה תיפסק מיד. אם הלחץ האוסמוטי גבוה מדי או שלמות הממברנה נפגעת קרום פני השטח של הבליטה יהיה פרוטוזואה החוצה הקרע התאים (איור 3 ב). אם הלחץ האוסמוטי נמוך מדי או הקרומים נמצאים בסכנה, פרוטוזואה אתכווץ ולהתכווץ (איור 3c).
ניסוי 2: אנו מאשרים כי ליגנד מצמידים בדיקה ניאון מחויב כל שלושה מינים של פרוטוזואה מ במעי האחורי של טרמיטים תת קרקעי Formosan בצפיפות לזיהוי. מחייב ליגנד מתרחש על פני התא כולו (איור 4). אתרי הקישור מרוכזים באזור הקדמי של פרוטוזואה על axostyle (גיליון microtubules) ואת גרעין ב פ grassii.
ראינו כמה autofluorescence אחידה של חלקיקים עץ מעובדים על ידי פרוטוזואה. עם זאת, autofluorescence הוא בדרך כלל קל להבחין בין מחייב ספציפיות של ליגנד, שכן אין autofluorescence של פני השטח, axostyle ואת גרעין (איור 4).
אנחנו גם זוהה הקרינה בכל חופשית חיים מינים נבדק פרוטוזואה אירובית (איור 5), אשר טוען כי ליגנד נקשר מבנים הגנרית פרוטוזואה. עם זאת, לא מחייב ליגנד נצפתה E. coli.
ניסוי 3: אחת של הפפטיד מיקרומטר ליגנד-ממוסס כל נהרגו שלושה מינים של פרוטוזואה מהבטן של עובדים Formosan טרמיטים תת קרקעי ועל חופשי חיים ט pyriformis במבחנה בתוך פחות מ -10 דקות, בעוד שולטת נשאר בחיים. איור 6 מציג את אובדן הדרגתי של שלמות הממברנה של המעי טרמיטים פרוטוזואה שטופלו פפטיד ליגנד-ממס. ממברנות בליטה ו הקרע, פרוטוזואה להצטמק ולמות. ההבדל לא נצפתה במספר E. coli מושבות בין הטיפולים של הפפטיד ליגנד-ממס ומים. הפפטיד ממס עם ליגנד לא, עם זאת, הקטינה את מספר ה coli מושבות משמעותית (איור 7). הדבר מצביע על כך מצורף של ליגנד במידה מסוימת מגינה מפני מיקרואורגניזמים היעד הלא תמוגה.
ניסוי 4: כאשר 0.3 μl 50 מיקרומטר של ליגנד מסומן fluorescently הוזרק במעי האחורי של עובדים טרמיטים, מחייב פ grassii, ש leidyi וה ' hartmanni אושרה באמצעות מיקרוסקופ פלואורסצנטי דומה Exp. 2 (איור 4). רקמת מעי הטרמיטים לא הראו פלואורסצנטי.
ניסוי 5: הזרקה של 0.3 מיקרומטר 500 μl ליגנד-ממוסס פפטיד נהרגו כל שלושה מינים של פרוטוזואה במעיים של טרמיטים Formosan תת קרקעי בתוך 24 שעות. טרמיטים מתו בתוך 10 ימים לאחר ההפסד של פרוטוזואה הסימביוטי שלהם. בעבר, מוזרק Husseneder ו קולייר (2009) ריכוז זהה של הפפטיד ממס לתוך הקרביים טרמיטים. ללא ליגנד המצורף, זה לקח יותר זמן עד פרוטוזואה במעיים (72 ח) ו טרמיטים מתו (שישה שבועות). הדבר מצביע על כך ליגנד מגביר את היעילות של פפטידים protozoacidal ממס, ככל הנראה על ידי איגוד פפטידים ממוסס את פרוטוזואה.
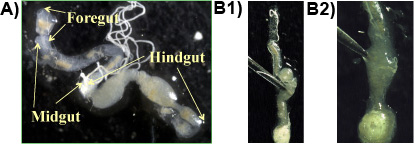
באיור 1. : Formosan בטן טרמיטים תת קרקעי בשקופית המציגה את הסעיפים העיקריים של המעי (הקדמי, באמצע, במעי האחורי); ב 1 & 2: במעי האחורי הוא דקר עם מלקחיים כדי לשחרר את תוכן המעי המכיל את פרוטוזואה.

איור 2. שלושה מינים של להלקות פרוטוזואה שנמצא במעי האחורי של טרמיטים התת Formosan: א) Pseudotrichonympha grassii, ב) Holomastigotoides hartmanni, ג) Spirotrichonympha leidyi.

איור 3. פרוטוזואה בתרבות, א) בריא פרוטוזואה, ב) פרוטוזואה עם ממברנות בולטות, ג) מצומקים פרוטוזואה.

איור 4. מחייב אישור של ליגנד מצמידים בדיקה ניאון טרמיטים בטןפרוטוזואה (מלמעלה למטה: פ grassii, ה hartmanni, ש leydi), שטופלו ליגנד מסומן fluorescently בקרות מטופל (מראה autofluorescence).

איור 5. ליגנד מחייב חופשי חיים פרוטוזואה אירובית, א) Tetrahymena, ב) אמבה, ג) Euglena, ו ד) הסנדלית.
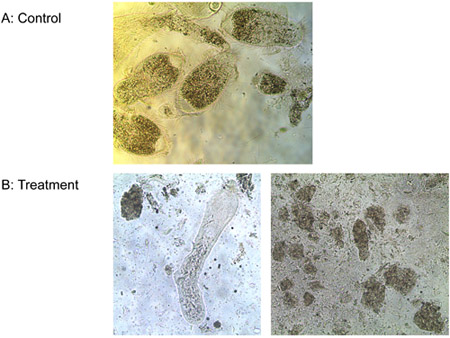
איור 6. טיפול פרוטוזואה עם מים) (control) ו ב) 1 מיקרומטר ליגנד-ממוסס פפטיד.
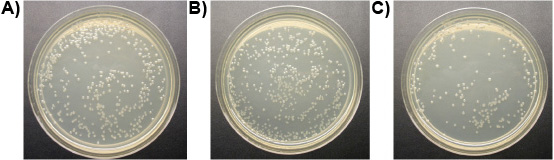
איור 7. E. מושבות coli על צלחות (10 דילול -4): א) המטופלים עם מים (שליטה), ב) המטופלים עם 1 מיקרומטר ליגנד-ממוסס פפטיד, ג) המטופלים עם 1 מיקרומטר פפטיד ממס.
Access restricted. Please log in or start a trial to view this content.
Discussion
ליגנד-ממוסס פפטידים שימשו בהצלחה למקד באפקטיביות ולהשמיד תאים סרטניים (הנזל Leuschner 2004, הנזל et al. 2007). על פי תפיסה זו, פיתחנו ליגנד heptapeptide שקושר אל פני השטח של פרוטוזואה במעיים של טרמיטים Formosan תת קרקעי ו מצמידים אותו פפטיד ממס במטרה להשמיד אלה מחייבים לעכל תאית symbionts ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
אנו מודים לד"ר אליסון ריצ'רד, המנהל לשעבר של המתקן פפטיד LSU לסינתזה ליגנד פלורסנט, המרכז למחקר Interdisciplinaray ביוטכנולוגיה, UF לסינתזה ליגנד-ממוסס את הפפטיד, ואת מתקן מיקרוסקופ Socolovsky עבור מתן גישה מיקרוסקופ פלואורסצנטי. המימון ניתן על ידי תוכנית SERDP פיתוח גישוש (SEED) של משרד ההגנה, משרד האנרגיה ואת הסוכנות להגנת הסביבה, ביוטכנולוגיה AgCenter תוכנית הבינתחומי צוות לבין מדינת לואיזיאנה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
References
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved