È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Testing Protozoacidal di Ligand-litica Peptidi Contro Gut Termite protozoi In vitro (Cultura protozoi) e In vivo (Microiniezione in Termite hindgut)
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Vi presentiamo le procedure per dimostrare che ligandi si legano alla membrana superficiale della cellulosa digestione protozoi nell'intestino delle termiti di Formosa sotterraneo usando la microscopia a fluorescenza e che ligandi accoppiato con peptidi litici uccidere questi protozoi In vitro (Anaerobica cultura protozoi) e In vivo (Iniezione nel hindgut termite).
Abstract
Stiamo sviluppando un nuovo approccio per il controllo delle termiti sotterranee che avrebbe portato alla ridotta dipendenza l'uso di pesticidi chimici. Termiti sotterranee dipendono da protozoi del hindguts dei lavoratori di digerire in modo efficiente legno. Peptidi litici hanno dimostrato di uccidere una varietà di protozoi parassiti (Mutwiri et al. 2000) e anche protozoi nell'intestino della termite Formosa sotterraneo, Coptotermes formosanus (Husseneder e Collier 2009). Peptidi litici sono parte del sistema immunitario aspecifico degli eucarioti, e distruggere le membrane di microrganismi (Leuschner e Hansel 2004). La maggior parte dei peptidi litici non sono suscettibili di nuocere eucarioti superiori, perché non influiscono sul elettricamente neutro colesterolo contenenti le membrane delle cellule di eucarioti superiori (Javadpour et al. 1996). Azione del peptide litica può essere mirata a specifici tipi cellulari con l'aggiunta di un legante. Per esempio, Hansel et al. (2007) ha riferito che peptidi litici coniugati con ligandi dei recettori di membrana di cellule di cancro potrebbero essere utilizzati per distruggere le cellule tumorali del seno, mentre peptidi litici da solo o coniugato con non specifici peptidi non sono stati efficaci. Peptidi litici inoltre sono stati coniugati con ormoni umani che si legano ai recettori sulle cellule tumorali per la distruzione mirata delle cellule del cancro alla prostata e ai testicoli (Leuschner e Hansel 2004).
In questo articolo presentiamo le tecniche utilizzate per dimostrare l'attività protozoacidal di un peptide litico (Ecate), accoppiato ad un ligando eptapeptide che si lega alla membrana superficiale di protozoi dall'intestino di termiti sotterranee Formosa. Queste tecniche includono estirpazione dell'intestino dai lavoratori delle termiti, la cultura anaerobica di budello protozoi (Pseudotrichonympha grassii, Holomastigotoides hartmanni,
Spirotrichonympha leidyi), la conferma microscopici che il legante marcato con un colorante fluorescente si lega l'intestino termite protozoi e altri protozoi a vita libera ma non di batteri o tessuto intestinale. Abbiamo anche dimostrato che il legante stesso accoppiato ad un peptide litici uccide in modo efficiente intestino termite protozoi in vitro (cultura protozoi) e in vivo (microiniezione in hindgut dei lavoratori), ma è meno bacteriacidal che il peptide litica da sola. La perdita di protozoi porta alla morte delle termiti in meno di due settimane.
In futuro, saremo geneticamente ingegnere microrganismi che possono sopravvivere nel hindgut termiti e diffondere attraverso una colonia di termiti come "cavalli di Troia" per esprimere ligando-litica peptidi che avrebbero ucciso i protozoi nell'intestino delle termiti e successivamente uccidere le termiti nella colonia . Ligando-litica peptidi potrebbe anche essere utile per lo sviluppo di farmaci contro protozoi parassiti.
Protocollo
Esperimento 1: Estrazione del budello termiti protozoi in condizioni anaerobiche
- Utilizzare una casella di fan (Laboratori Coy) in un vano portaoggetti per far circolare sempre aria attraverso un disseccante e il tipo D catalizzatore Stak-Paks per controllare l'umidità ei livelli di ossigeno e di eliminare le temperature irregolari. Riempire il vano portaoggetti con un flusso continuo di azoto per 20 a 30 min. Monitorare i livelli di ossigeno con un sensore di ossigeno (C-squared, Inc.) per 1 h. Utilizzare l'azoto per raggiungere e mantenere condizioni anaerobiche, quando necessario.
- Preparare Trager U media (Trager 1934) e aggiustare il pH a 7,0. Sparge il setto filtrante sterilizzati nel vano portaoggetti con una miscela di 2,5% di idrogeno, anidride carbonica del 5% e del 92,5% di azoto per 1 ora per rimuovere residui di ossigeno.
- Silanize tutti i materiali tra cui vetrini da microscopio, tubi microcentrifuga, pipette, vetreria, ecc utilizzati negli esperimenti utilizzando Sigmacote per prevenire l'assorbimento di protozoi o peptidi alle superfici (Sigmacote, Sigma, # SL-2, http://www.sigmaaldrich.com/ etc / mediaLib / docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf).
- Dal intestino termite protozoi sono organismi strettamente anaerobici non devono essere esposti all'ossigeno. Pertanto le seguenti operazioni vengono eseguite in condizioni anaerobiche in una scatola di guanti (vedi 1.1). Con una pinza immergere tutto il corpo di un lavoratore termiti nel 70% di etanolo e ruotare lentamente per circa 10 s per rimuovere i contaminanti di superficie.
- Rimuovere il lavoratore dal etanolo e lasciare asciugare su un Kimwipe pulita per circa 20 s. Utilizzare una sterile punta sottile pinza per tenere l'addome lavoratore e afferrare la punta del ventre con un altro paio di pinze per tirare dolcemente l'intestino verso l'alto o verso il basso in un angolo di 45 gradi. Se l'intestino è tirato in un angolo retto e con troppa forza si rischia di spezzarsi. Place 10 coraggio in una goccia di 100 ul Trager supporti a U su un vetrino da microscopio.
- Pierce il coraggio con un paio di sterili sonde multa dissezione per rilasciare il protozoi e delicatamente trasferire il contenuto intestinale con una pipetta 200 ul in una provetta 1 ml contenente 900 microlitri Trager U media. Dopo aver lasciato per la sedimentazione di frammenti di parete intestinale (5 s), il trasferimento di 900 l di supernatante in una nuova provetta.
- Trasferire 10 ml di cultura protozoi di un vetrino da microscopio sigmacoted e verificare lo stato di protozoi sotto un microscopio a 200 ingrandimenti X.
- Preparare colture di controllo del pyriformis aerobica Tetrahymena protozoi, Amoeba sp., Euglena sp. E Paramecium sp. (Supply Company Carolina biologica, Burlington, Carolina del Nord), così come una cultura durante la notte di Escherichia coli nei terreni di coltura raccomandato dal fornitore.
Esperimento 2: ligando Aggiungi accoppiato con un colorante fluorescente per i protozoi ei batteri culture di prova per il legame alla superficie di membrane e pareti cellulari
In precedenza avevamo usato librerie phage display (New England Biolabs Inc, Ipswich, MA) per identificare 19 eptapeptide sequenze che si legano ai protozoi (protocolli disponibili http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdf). Un ligando con una sequenza di peptidi (ALNLTLH) che ha mostrato somiglianze con glicoproteine putativo noto dalla membrana Trypanosoma brucei è stato sintetizzato e accoppiato ad un C-terminale sonda fluorescente (EDANS, 5 - ((2-amminoetil) ammino) naftalen-1-solfonico acido, λmax = 341 nm, λem = 471 nm) mediante sintesi del peptide stato solido (SSP), utilizzando la resina EDANS NovaTag (EMD Biosciences). Qui mostriamo che il ligando si lega al protozoi, che sono stati isolati da nell'intestino delle termiti e altri protozoi a vita libera, ma non ai batteri.
- Cultura protozoi come descritto nella Exp. 1. Fissare i protozoi con il 10% di formaldeide a 4 ° C per 12 h.
- Centrifugare la soluzione protozoi (30 xg, 10 min), scartare il surnatante e lavare il pellet contenente i protozoi fissa due volte in 1 ml Trager U media. Risospendere il pellet in 1 ml Trager U media. Inoltre, fissare altri protozoi, ed E. coli per i controlli.
- Incubare i microrganismi fissata per 1-2 ore con una soluzione di legante sintetizzato accoppiato al EDANS colorante fluorescente (preparato in acqua) ad una concentrazione finale di 50 micron. Il ligando si scioglie meglio in acqua di Trager U media.
- Osservare i microrganismi al microscopio a fluorescenza a 400 ingrandimenti X ad un massimo di assorbanza a 341 nm e una emissione nella regione blu a 471 nm.
Esperimento 3: Test attività protozoacidal del ligando accoppiato ad un peptide litica in vitro (cultura protozoi)
Un coniugato del ligando e il peptide litiche Ecate (Mutwiri et al. 2000) è stato sintetizzato in precedenza presso l'impianto di proteine LSU.
- Silanize materiali e la preparazione dell'intestino cultura termite protozoi nel vano portaoggetti anaerobica unos descritto nel Exp. 1.
- Preparare le culture di microrganismi aerobi controllo (ad esempio, E. coli e le specie protozoi a vita libera pyriformis T.).
- In ambiente anaerobico del vano portaoggetti, pipetta 6 aliquote di 198 ml di cultura protozoi in provette Eppendorf da 0,5 ml. Aggiungere 2 ml di una soluzione 100 mM di ligando-litici peptide alla metà delle aliquote (concentrazione finale 1 micron) della cultura intestino termite protozoi. Aggiungere 2 ml di acqua per l'altra metà delle aliquote (controlli).
- Sul bancone, preparare aliquote simili di E. coli e T. pyriformis con 1 litici peptide microM, ligando-litica peptide o acqua.
- Dopo 1 ora, trasferire 10 ml di ogni cultura protozoi alle diapositive. Confrontare la sopravvivenza dei trattati protozoi a quella dei controlli al microscopio a 200 ingrandimenti X.
- Dopo 1 ora, piatto 100 l di ca. Diluizione 10 -4 della E. culture coli su BHI e incubare a 37 ° C durante la notte. Confrontare il numero di unità formanti colonie sulle piastre.
Esperimento 4: L'iniezione del ligando accoppiato ad un colorante fluorescente nel hindgut termite
- Tirare aghi (modello GD-1, 1 x 900 mm) utilizzando un PC-10 di vetro Narishige estrattore micropipetta con un livello di calore a doppio stadio (65 e 48) per ottenere una dimensione di punta di 20-30 micron. Confermare la dimensione punta misurando sotto un microscopio con un micrometro.
- Riempire un ago con ca. 30 ml di 50 micron di ligando fluorescente segnato in sospensione in acqua tramite una siringa collegata. Riempire un altro ago con acqua per il controllo. Allega una micropipetta (0,5 microlitri e 32 mm di lunghezza, Drummond Azienda scientifico) ad un titolare di un micromanipolatore. Inserire un ago al titolare del sistema di iniezione in un micromanipolatore secondo. Impostare i parametri di iniezione iniziale di circa 1 s lunghezza dell'impulso e 10-12 iniezione psi. Avanzare l'ago lentamente nella micropipetta e iniettare la soluzione con un pedale-driven ad alta velocità, sistema di iniezione elettronica con un controllo lunghezza dell'impulso collegato a un flusso controllato di gas di azoto, che assicura un volume costante è riproducibile iniettato. Dopo l'iniezione, rimuovere la micropipetta e registrare la lunghezza della soluzione iniettata utilizzando un calibro a corsoio. Calcolare il volume iniettato dai parametri noti della micropipetta. Regolare la pressione del gas azoto e la lunghezza degli impulsi di espellere 0,3 ul di soluzione in una singola iniezione.
- Stringere la fine di un addome lavoratore termite con una pinza morbido per rimuovere eventuali escrementi presenti nel retto. Immobilizzare lavoratore termite da loro agghiacciante in ghiaccio per 5 min.
- Fai ricevitori per tenere i lavoratori termite, tagliando 100 puntali microlitri utilizzando un bisturi. Tagliare la punta ad una lunghezza di 10 - 12 mm e utilizzare in base alle dimensioni delle termiti.
- Collegare il ricevitore al micromanipolatore. Mettere un lavoratore in una capsula di Petri sul lato dorsale e aspirare il primo operaio in testa il destinatario utilizzando una pompa di aspirazione di azoto in modo che il capolinea del lavoratore sporge dal ricevitore.
- Tenendo il termite nel ricevitore, con attenzione avanzare l'ago riempito con il micromanipolatore per inserirla nel ano lavoratore. Iniettare 0,3 ml di soluzione (ligando marcato fluorescente o acqua per i controlli).
- Luogo i lavoratori iniettati con legante o acqua in tre diverse capsule di Petri con carta da filtro umida e tenerli a 26 ± 2 ° C con il 78% di umidità relativa
- Estirpare coraggio da termiti iniettato e raccogliere i protozoi dopo 24 ore, come indicato sopra nella Exp. 1. Fissare e osservare i protozoi come mostrato in Esp. 2.
Esperimento 5: Test attività protozoacidal del ligando accoppiato ad un peptide litica in vivo (iniezione in termite hindgut)
- Silanize materiali come descritto nella Exp. 1.
- Preparare una soluzione 500 mM del ligando-litica peptide in acqua.
- Seguire i punti 3,1) attraverso 3,4) per preparare gli aghi di vetro, ricevitori e lavoratori termite.
- Seguendo i metodi descritti in 3.5) iniettare 0,3 ml di soluzione di ligando-litiche peptide (trattamento) o acqua (controllo) nel hindgut di 20 lavoratori termiti.
- Tenere termiti per 24 h, coraggio estirpare dai lavoratori diversi e osservare contenuto intestinale sotto il microscopio, come descritto in 3.6). e 3,7).
- Non appena una morte di protozoi nell'intestino termite è confermata, tenere rimanenti termiti trattati ed i controlli in piastre di Petri con carta da filtro umida e osservare mortalità giornaliera.
Rappresentante dei risultati:
Esperimento 1: Di solito, foregut, dell'intestino e hindgut sono ottenuti in un unico pezzo, quando la procedura è seguita correttamente (Figura 1a). I protozoi risiedono in alta densità nelle porzioni anaerobica dei hindgut e può essere rilasciato da perforando la hindgut con una pinza (figura 1b 1 & 2). La più grande protospecie Zoa nell'intestino della termite sotterranea Formosa è il mandrino a forma di P. grassii, che è 200-300 micron di lunghezza e 150 micron di larghezza e può essere visto ad occhio nudo. La specie più grande secondo è la pera a forma di H. hartmanni (50-140 micron di lunghezza e 30-80 micron di larghezza). La più piccola specie è il cono a forma di S. leidyi (15-50 micron di lunghezza e 8-30 micron di larghezza;. Lai et al 1983). Le specie di protozoi sono mostrati nella Figura 2.
In condizioni ottimali la cultura delle tre specie di protozoi isolati dall'intestino di termiti sotterranee Formosan rimarrà vivo e in salute per almeno 72 h in anaerobica Trager U media (Figura 3a). Tuttavia, se le condizioni non sono ottimali cultura protozoi morirà rapidamente. Se ci sono residui di ossigeno nei media, il movimento di protozoi cesserà immediatamente. Se la pressione osmotica è troppo alta o l'integrità della membrana è compromessa la membrana superficiale del rigonfiamento si protozoi fuori e la rottura delle cellule (Figura 3b). Se la pressione osmotica è troppo bassa o membrane sono compromesse, protozoi si accartocciano e si restringono (Figura 3c).
Esperimento 2: Abbiamo confermato che il ligando accoppiato ad una sonda fluorescente legato a tutte e tre le specie di protozoi dal hindgut di Formosa termiti sotterranee a densità rilevabile. Legame con il ligando si verifica sulla superficie della cellula intera (Figura 4). Siti di legame sono concentrati nella regione anteriore del protozoi sulla axostyle (un foglio di microtubuli) e nucleo in P. grassii.
Abbiamo osservato alcuni autofluorescenza irregolare di particelle di legno ingerito dai protozoi. Tuttavia, autofluorescenza è di solito facile da discernere dal legame specifico del ligando, poiché non vi è autofluorescenza della superficie, la axostyle e il nucleo (Figura 4).
Abbiamo anche rilevato fluorescenza in tutte le specie testate aerobica protozoi a vita libera (Figura 5), il che suggerisce che il ligando si lega alle strutture generiche ai protozoi. Tuttavia, nessun legame con il ligando è stato osservato per E. coli.
Esperimento 3: Un mM di ligando-litica peptide ucciso tutti e tre specie di protozoi dall'intestino dei lavoratori Formosan termiti sotterranee e la vita libera T. pyriformis in vitro in meno di 10 minuti, mentre i controlli rimasto in vita. La Figura 6 mostra la progressiva perdita dell'integrità della membrana dell'intestino termite protozoi trattati con ligando-litica peptide. Membrane rigonfiamento e rottura, avvizzire e morire protozoi. Nessuna differenza è stata osservata nel numero di E. colonie di Escherichia tra i trattamenti di ligando-litica peptide e acqua. Peptide litica senza ligando, tuttavia, ha ridotto il numero di E. colonie di Escherichia notevolmente (Figura 7). Ciò suggerisce che l'attaccamento del ligando in qualche modo protegge i microrganismi non bersaglio da lisi.
Esperimento 4: Quando 0,3 microlitri 50 micron del ligando fluorescente marcato è stato iniettato nel hindgut dei lavoratori termiti, l'associazione a P. grassii, S. leidyi e H. hartmanni è stata confermata tramite microscopia a fluorescenza simile a Exp. 2 (Figura 4). Tessuto intestinale termite non ha mostrato fluorescenza.
Esperimento 5: Iniezione di 0,3 microlitri 500 micron ligando-litica peptide ucciso tutti e tre specie di protozoi nell'intestino di Formosa termiti sotterranee entro 24 ore. Le termiti sono morti entro 10 giorni dopo la perdita del loro protozoi simbiotica. In precedenza, Husseneder e Collier (2009) iniettato la stessa concentrazione di peptidi litici in budella delle termiti. Senza il ligando attaccato, ha preso più tempo prima che i protozoi nell'intestino (72 h) e le termiti erano morti (sei settimane). Ciò suggerisce che il ligando aumenta l'efficienza protozoacidal di peptidi litici, molto probabilmente legando i peptidi litici ai protozoi.
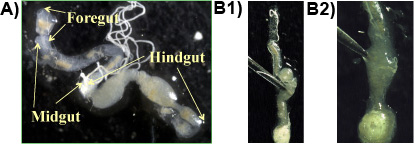
Figura 1. a: Formosa intestino termite sotterranea di una diapositiva che mostra le principali sezioni dell'intestino (anteriore, medio, hindgut), b 1 e 2: hindgut è trafitto con una pinza per liberare il contenuto dell'intestino che contiene il protozoi.

Figura 2. Le tre specie di protozoi flagellati trovato nel hindgut delle termiti di Formosa sotterraneo: a) Pseudotrichonympha grassii, b) Holomastigotoides hartmanni, ec) Spirotrichonympha leidyi.

Figura 3. Protozoi nella cultura, a) sana protozoi, b) con membrane protozoi sporgenti, c) avvizzite protozoi.

Figura 4. La conferma del legame del ligando accoppiato ad una sonda fluorescente per termite intestinoprotozoi (dall'alto verso il basso: P. grassii, H. hartmanni, S. Leydi), trattati con ligando fluorescente marcata e controlli non trattati (mostrando autofluorescenza).

Figura 5. Di legame a vita libera protozoi aerobica, a) Tetrahymena, b) Amoeba, c) Euglena, e d) Paramecium.
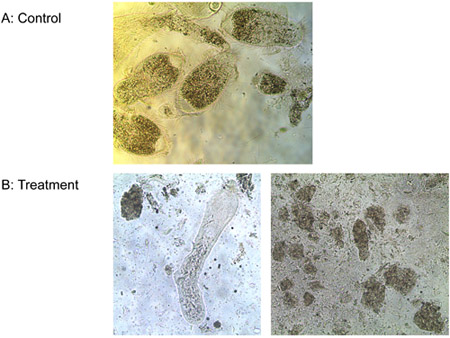
Figura 6. Il trattamento di protozoi con a) acqua (controllo) e b) 1 mM ligando-litica peptide.
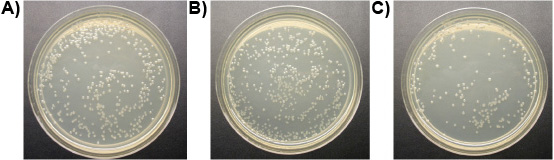
Figura 7. E. coli colonie su piastre (10 diluizione -4): a) trattati con acqua (controllo), b) trattate con 1 mM ligando-litica peptide, c) trattati con 1 mM peptide litica.
Access restricted. Please log in or start a trial to view this content.
Discussione
Ligando-litica peptidi sono stati utilizzati con successo per raggiungere in modo efficace e distruggere le cellule tumorali (Hansel e Leuschner 2004, Hansel et al. 2007). Sulla base di questo concetto, abbiamo sviluppato un ligando eptapeptide che si lega alla superficie di protozoi nell'intestino delle termiti di Formosa sotterranee e accoppiato a un peptide litica con l'obiettivo di distruggere queste obbligare cellulosa digerire simbionti nell'intestino delle termiti per raggiungere termite cont...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Ringraziamo il Dr. Allison Richard, ex direttore della struttura peptide LSU per la sintesi ligando fluorescente, il Centro per la Ricerca Interdisciplinaray Biotecnologie, UF per il ligando-litica sintesi del peptide, e l'impianto Microscopio Socolovsky per dare accesso al microscopio a fluorescenza. Il finanziamento è stato fornito dal Programma di Sviluppo SERDP esplorativi (SEED) del Dipartimento della Difesa, Dipartimento di Energia e Agenzia di Protezione Ambientale, il Programma AgCenter squadra Biotecnologie interdisciplinare e lo stato della Louisiana.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
Riferimenti
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon