É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Atividade de testes Protozoacidal Ligand-lítica Peptídeos Contra Gut Termite Protozoa In vitro (Cultura Protozoa) e In vivo (Microinjeção em Termite intestino grosso)
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresentamos os procedimentos para demonstrar que ligantes se ligam à superfície da membrana de celulose de digestão destes protozoários no intestino de cupins subterrâneos Formosan por microscopia de fluorescência e que juntamente com peptídeos ligantes líticas matar protozoários In vitro (Cultura protozoários anaeróbios) e In vivo (Injecção no intestino posterior de cupins).
Resumo
Estamos desenvolvendo uma nova abordagem para controle de cupins subterrâneos que levam a dependência reduzida sobre o uso de pesticidas químicos. Cupins subterrâneos são dependentes de protozoários do hindguts de trabalhadores de forma eficiente digerir madeira. Peptídeos líticas têm sido mostrados para matar uma variedade de protozoários parasitas (Mutwiri et al. 2000) e também protozoários no intestino do cupim subterrâneo Formosan, Coptotermes formosanus (Husseneder e Collier 2009). Líticas peptídeos são parte do sistema imune inespecífica dos eucariotos, e destruir as membranas de microrganismos (Leuschner e Hansel, 2004). Peptídeos mais lítica não são susceptíveis de prejudicar eucariotos superiores, porque eles não afetam o eletricamente neutro membranas contendo colesterol das células de eucariotos superiores (Javadpour et al. 1996). Ação peptídeo lítico pode ser direcionada para tipos específicos de células pela adição de um ligante. Por exemplo, Hansel et al. (2007) relataram que os peptídeos líticas conjugado com câncer de células ligantes do receptor de membrana pode ser usada para destruir as células do câncer de mama, enquanto peptídeos líticas isoladamente ou conjugados com os não-específicas peptídeos não foram eficazes. Líticas peptídeos também foram conjugados aos hormônios humanos que se ligam a receptores nas células tumorais para a destruição específica de células cancerosas da próstata e testicular (Leuschner e Hansel, 2004).
Neste artigo apresentamos as técnicas utilizadas para demonstrar a atividade protozoacidal de um peptídeo lítico (Hecate) acoplado a um ligante que se liga a heptapéptido a membrana de superfície de protozoários no intestino do cupim subterrâneo Formosan. Essas técnicas incluem a extirpação do intestino de cupins trabalhadores, a cultura anaeróbica de intestino protozoários (Pseudotrichonympha grassii, Holomastigotoides hartmanni,
Spirotrichonympha leidyi), a confirmação microscópica que o ligante marcadas com um corante fluorescente se liga ao intestino de cupins protozoários e outros protozoários de vida livre, mas não a bactérias ou tecido do intestino. Nós também demonstramos que o ligante mesmo acoplado a um peptídeo lítico eficiente mata intestino de cupins protozoários in vitro (cultura de protozoários) e in vivo (microinjeção no intestino posterior dos trabalhadores), mas é menos do que o bactericida peptídeo lítico sozinho. A perda de protozoários leva à morte dos cupins em menos de duas semanas.
No futuro, iremos modificar geneticamente microorganismos que podem sobreviver no intestino posterior de cupins e espalhar através de uma colônia de cupins como "Cavalos de Tróia" para expressar-ligante líticas peptídeos que mataria o protozoário no intestino de cupins e, posteriormente, matar os cupins na colônia . Ligante-lítica peptídeos também podem ser úteis para o desenvolvimento de medicamentos contra parasitas protozoários.
Protocolo
Experimento 1: Extração de intestino de cupins protozoários em condições anaeróbias
- Use uma caixa de ventilador (Laboratories Coy) em uma caixa de luva constantemente circular o ar através de um dessecante e D catalisador tipo Stak-Paks para controle de umidade e níveis de oxigênio e eliminar a temperaturas irregulares. Preencher o porta-luvas com um fluxo contínuo de nitrogênio por 20 a 30 min. Monitorar os níveis de oxigênio com um sensor de oxigênio (C-quadrado, Inc.) para 1 h. Uso de nitrogênio para alcançar e manter condições anaeróbicas, quando necessário.
- Prepare Trager U media (Trager 1934) e ajustar o pH para 7,0. Sparge o meio filtrante esterilizada no porta-luvas com uma mistura de hidrogênio 2,5%, de dióxido de carbono de 5% e 92,5% de nitrogênio por 1 h para remover os resíduos de oxigênio.
- Silanizadas todos os materiais, incluindo lâminas de microscópio, tubos de microcentrífuga, pipetas, copos etc utilizados nos experimentos usando Sigmacote para evitar a adsorção de protozoários ou peptídeos em superfícies (Sigmacote, Sigma, # SL-2, http://www.sigmaaldrich.com/ etc / medialib / docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf).
- Desde intestino de cupins protozoários são organismos estritamente anaeróbios que não deve ser exposto ao oxigênio. Portanto, as seguintes etapas são realizadas sob condições anaeróbicas em uma caixa de luva (ver 1.1). Com uma pinça de submergir todo o corpo de um trabalhador de cupins em etanol 70% e rode suavemente por cerca de 10 s para remover os contaminantes de superfície.
- Remover o trabalhador a partir do etanol e deixe secar em um Kimwipe limpa para cerca de 20 s. Use uma solução estéril de ponta fina pinça para segurar o trabalhador abdômen e agarra a ponta do abdômen com um par de pinças para puxar suavemente o intestino cima ou para baixo em um ângulo de 45 graus. Se o intestino é puxado em um ângulo reto e com muita força, é provável que quebre. Coloque 10 guts em uma queda de 100 l media Trager U em uma lâmina de microscópio.
- Pierce as entranhas com um par de sondas estéreis fina dissecação para liberar os protozoários e gentilmente transferir o conteúdo do intestino com uma pipeta de 200 mL em um tubo de microcentrífuga de 1 ml contendo 900 mL Trager U mídia. Depois de permitir a sedimentação dos fragmentos de parede do intestino (5 s), 900 mL de transferência do sobrenadante para um novo tubo.
- Transferência de 10 ml de cultura de protozoários para uma lâmina de microscópio sigmacoted e verificar a condição de protozoários ao microscópio com 200 X de ampliação.
- Prepare culturas controle do pyriformis Tetrahymena aeróbica protozoários, Amoeba sp., Euglena sp. E Paramecium sp. (Carolina Biological Supply Company, Burlington, NC), bem como uma cultura overnight de Escherichia coli nos meios de cultura recomendados pelo fornecedor.
Experimento 2: Adicionar ligante acoplado com um corante fluorescente para os protozoários e as bactérias culturas para testar para a ligação com as membranas de superfície e paredes celulares
Nós usamos anteriormente bibliotecas phage display (New England Biolabs Inc, Ipswich, MA) para identificar seqüências de 19 heptapéptido que se ligam a protozoários (protocolos disponíveis em http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdf). Um ligante com uma seqüência de peptídeos (ALNLTLH) que mostrava semelhanças com glicoproteínas putativa conhecida da membrana Trypanosoma brucei foi sintetizado e acoplado a um C-terminal fluorescentes sonda (EDANS, 5 - ((2-aminoetil) amino) naftaleno-1-sulfônico ácido, λmax = 341 nm, λem = 471 nm) através de síntese de estado sólido peptídeo (SSPS), utilizando o EDANS resina NovaTag (EMD Biosciences). Aqui demonstramos que o ligante se liga ao protozoários que foram isoladas do intestino de cupins e outros protozoários de vida livre, mas não para bactérias.
- Cultura do protozoário, como descrito no experimento. 1. Fix protozoários com formol a 10% a 4 ° C por 12 h.
- Centrifugar a solução protozoários (30 xg, 10 min), desprezar o sobrenadante e lavar o pellet contendo os protozoários fixos duas vezes em 1ml Trager U mídia. Re-suspender o sedimento em 1 ml Trager U mídia. Além disso, corrigir outros protozoários, e E. bactéria Escherichia para controles.
- Incubar os microrganismos fixos por 1-2 h com solução de ligante sintetizado acoplado ao EDANS corante fluorescente (preparada em água) a uma concentração final de 50 mM. O ligante se dissolve melhor na água do que Trager U mídia.
- Observe os microorganismos sob um microscópio de fluorescência em 400 X ampliação em um máximo de absorbância a 341 nm e uma emissão na região azul em 471 nm.
Experimento 3: Teste de atividade protozoacidal do ligante acoplado a um peptídeo lítico in vitro (cultura de protozoários)
A conjugada do ligante e do peptídeo lítico Hecate (Mutwiri et al. 2000) foi previamente sintetizado no Centro de Proteína LSU.
- Silanizadas materiais e preparar a cultura cupim gut protozoários no porta-luvas uma anaeróbias descritos no Exp. 1.
- Prepare culturas de microrganismos aeróbios de controle (por exemplo, E. coli e as espécies de vida livre protozoário T. pyriformis).
- No ambiente anaeróbio do porta-luvas, pipeta seis alíquotas de 198 mL de cultura de protozoários em tubos de 0,5 ml Eppendorf. Adicione 2 mL de uma solução de M-100 de ligante peptídeo lítico a metade das alíquotas (concentração de 1 mM final) da cultura do intestino de cupins protozoários. Adicione 2 mL de água para a outra metade das alíquotas (controles).
- Na bancada, prepare alíquotas semelhantes de E. coli e T. pyriformis com um peptídeo lítico peptídeo M, ligando-líticas ou água.
- Após 1 h, a transferência de 10 ml de cada cultura protozoários aos slides. Compare a sobrevivência dos protozoários tratados ao de controles em um microscópio com 200 X de ampliação.
- Após 1 h, 100 mL placa de aprox. 10 -4 diluição do E. culturas coli em BHI e incubar a 37 ° C durante a noite. Compare o número de unidades formadoras de colônias nas placas.
Experiência 4: Injeção do ligante acoplado a um corante fluorescente no intestino posterior para o cupim
- Puxar agulhas (Modelo GD-1, 1 X 900 mm) usando um PC-10 Narishige vidro extrator micropipeta com um nível de dupla fase de calor (65 e 48) para obter um tamanho da ponta de 20-30 mM. Confirmar o tamanho da ponta, medindo-lo sob um microscópio utilizando um micrômetro.
- Preencher uma agulha com ca. 30 mL de 50 mM de ligante fluorescente marcados em suspensão na água usando uma seringa anexado. Encha uma outra agulha com água para o controle. Anexar uma micropipeta (0,5 mL de capacidade e 32 mm de comprimento, Drummond Companhia Científica) a um detentor de um micromanipulador. Coloque uma agulha para o titular sistema de injeção em um micromanipulador segundo. Definir os parâmetros de injeção inicial de cerca de 1 comprimento do pulso e 10-12 s injeção psi. Antecedência a agulha lentamente na micropipeta e injetar a solução com um pedal-driven de alta velocidade do sistema de injeção eletrônica com um controle comprimento de pulso ligado a um fluxo controlado de gás nitrogênio, o que garante que um volume constante é reproduzível injetado. Após a injeção, remova a micropipeta e gravar o comprimento da solução injetada usando um paquímetro Vernier. Calcular o volume injetado a partir dos parâmetros conhecidos da micropipeta. Ajustar a pressão de gás nitrogênio e do comprimento de pulso para expulsar 0,3 mL de solução em uma única injeção.
- Aperte o fim de um abdômen trabalhador cupins com uma pinça macio para remover qualquer presente excreta no reto. Imobilizar trabalhador cupins pelo frio-los no gelo por 5 min.
- Faça receptores para a realização de trabalhadores de cupins, cortando 100 ponteiras mL usando uma lâmina de bisturi. Cortar a ponta para um comprimento de 10-12 mm e usar de acordo com o tamanho de cupins.
- Anexar o receptor para o micromanipulador. Coloque um trabalhador em uma placa de Petri de lado dorsal e aspire a cabeça primeiro trabalhador para o receptor usando uma bomba de sucção de azoto de modo que o término do trabalhador se projeta a partir do receptor.
- Segurando o cupim no receptor, cuidadosamente antecedência a agulha cheia usando o micromanipulador para inseri-lo no ânus trabalhador. Injetar 0,3 mL da solução (ligante fluorescente marcado ou água para controles).
- Colocam os trabalhadores injetados com ligante ou água em pratos separados petri com papel de filtro úmido e mantê-los em 26 ± 2 ° C com 78% RH
- Extirpar entranhas da cupins injetado e recolher os protozoários após 24 h, como mostrado acima na Exp. 1. Fix e observar os protozoários, como mostrado na Exp. 2.
Experiência 5: Teste de atividade protozoacidal do ligante acoplado a um peptídeo lítico in vivo (injecção de cupins hindgut)
- Silanizadas materiais, conforme descrito no experimento. 1.
- Prepare uma solução M 500 do peptídeo ligante-lítica na água.
- Siga os passos 3.1) através de 3.4) para preparar as agulhas de vidro, os receptores e os trabalhadores de cupins.
- Seguindo os métodos descritos em 3.5) injetar 0,3 mL de solução de ligante-lítica de peptídeos (tratamento) ou água (controle) no intestino posterior de 20 trabalhadores de cupins.
- Segure cupins por 24 h, coragem extirpar de vários trabalhadores e observar conteúdo estomacal sob o microscópio, como descrito em 3.6). e 3.7).
- Assim a morte de protozoários no intestino de cupins é confirmado, manter restantes cupins tratados e controles em placas de Petri com papel de filtro úmido e observar mortalidade diária.
Resultados representativos:
Experimento 1: Normalmente, intestino anterior, intestino médio e intestino posterior são obtidas numa só peça, quando o procedimento é seguido corretamente (Figura 1a). Os protozoários residem em alta densidade nas porções anaeróbia do intestino grosso e pode ser liberado pela perfuração do intestino grosso com uma pinça (Figura 1b 1 e 2). O maior protoespécies zoa no intestino do cupim subterrâneo Formosan é o P. fusiformes grassii, que é de 200-300 mM de comprimento e 150 m de largura e pode ser visto a olho nu. A espécie é a segunda maior H. pear-shaped hartmanni (50-140 mM de comprimento e 30-80 m de largura). A menor espécie é o S. em forma de cone leidyi (15-50 mM de comprimento e 30/08 m de largura;. Lai et al 1983). As espécies de protozoários são mostrados na Figura 2.
Sob condições de cultivo ideal das três espécies de protozoários isolada do intestino de cupins subterrâneos Formosa permanecerão vivos e saudáveis por pelo menos 72 h em media U Trager anaeróbia (Figura 3a). No entanto, se as condições de cultura não são ideais protozoários vai morrer rápido. Se houver resíduos de oxigênio na mídia, o movimento de protozoários cessará imediatamente. Se a pressão osmótica é muito alta ou a integridade da membrana fica comprometida a membrana da superfície da protuberância vai para fora e protozoários a ruptura de células (Figura 3b). Se a pressão osmótica é muito baixo ou membranas são comprometidos, protozoários irá murchar e encolher (Figura 3c).
Experimento 2: Nós confirmamos que o ligante acoplado a uma sonda fluorescente ligado a todas as três espécies de protozoários do intestino posterior de Formosan cupins subterrâneos em densidades detectável. Ligação do ligante ocorre na superfície de células inteiras (Figura 4). Sítios de ligação estão concentradas na região anterior do protozoário no axostyle (uma folha de microtúbulos) e núcleo em P. grassii.
Observamos alguns autofluorescência irregular de partículas de madeira ingerida pelo protozoário. No entanto, autofluorescência é geralmente fácil de discernir de ligação específica do ligante, uma vez que não há autofluorescência da superfície, o axostyle eo núcleo (Figura 4).
Nós também detectada fluorescência em todas as testadas de vida livre aeróbica espécies de protozoários (Figura 5), o que sugere que o ligante se liga a estruturas genéricas para protozoários. No entanto, nenhuma ligação do ligante foi observado para E. coli.
Experimento 3: Um mM de ligante-lítica de peptídeos matou todos os três espécies de protozoários do intestino de cupins de Formosa trabalhadores subterrâneos e T. de vida livre pyriformis in vitro em menos de 10 min, enquanto os controles permaneceram vivos. A Figura 6 mostra a perda progressiva da integridade da membrana do intestino de cupins protozoários tratados com ligante-lítica de peptídeos. Membranas bojo e ruptura, shrivel protozoários e morrer. Não foi observada diferença no número de E. colônias coli entre os tratamentos do ligante-lítica de peptídeos e água. Peptídeo lítico sem ligante, entretanto, reduziu o número de E. colônias coli consideravelmente (Figura 7). Isto sugere que a fixação do ligante, em certa medida protege os microorganismos não-alvo de lise.
Experiência 4: 0,3 mL Quando 50 mM do ligante marcado fluorescente foi injetado no intestino posterior dos trabalhadores de cupins, a ligação a P. grassii, S. leidyi e H. hartmanni foi confirmado através de microscopia de fluorescência semelhante ao Exp. 2 (Figura 4). Cupim tecido intestinal não mostrou fluorescência.
Experiência 5: A injeção de 0,3 mL 500 mM ligante-lítica de peptídeos matou todas as três espécies de protozoários no intestino de cupins subterrâneos Formosan dentro de 24h. Cupins morreram dentro de 10 dias após a perda de seus protozoários simbióticos. Anteriormente, Husseneder e Collier (2009) injetaram a mesma concentração de peptídeo lítico em tripas de cupins. Sem o ligante ligado, demorou mais tempo até que os protozoários no intestino (72 h) e os cupins foram mortos (seis semanas). Isto sugere que o ligante aumenta a eficiência protozoacidal de peptídeos lítico, muito provavelmente pela ligação dos peptídeos líticas para o protozoário.
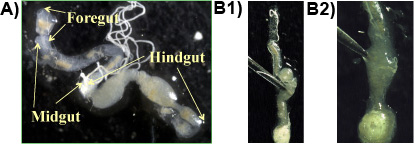
Figura 1. a: Formosa do intestino de cupins subterrâneos em um slide mostrando as principais seções do intestino (frente, médio, intestino grosso); b 1 e 2: intestino posterior é perfurada com uma pinça para liberar o conteúdo do intestino contendo os protozoários.

Figura 2. As três espécies de protozoários flagelados encontrados no intestino posterior do cupim subterrâneo Formosan: a) Pseudotrichonympha grassii, b) Holomastigotoides hartmanni, e c) Spirotrichonympha leidyi.

Figura 3. Protozoários na cultura, uma saudável) protozoários, b) Protozoa com membranas abaulamento, c) encolhidas protozoários.

Figura 4. Confirmação da ligação do ligante acoplado a uma sonda fluorescente para cupim gutprotozoários (de cima para baixo: P. grassii, H. hartmanni, S. Leydi), tratados com ligante fluorescente marcado e controles não tratados (mostrando autofluorescência).

Figura 5. Ligação do ligando a protozoários de vida livre aeróbica, a) Tetrahymena, b) Amoeba, c) Euglena, e d) Paramecium.
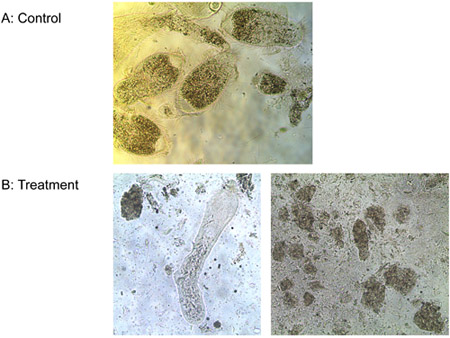
Figura 6. Tratamento de protozoários com água) (controle) e b) 1 mM ligante-lítica de peptídeos.
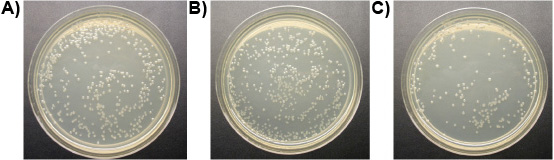
Figura 7. E. colônias coli em placas (10 diluição -4): a) tratados com água (controle), b) tratados com 1 mM ligante-lítica de peptídeos, c) tratados com 1 mM peptídeo lítico.
Access restricted. Please log in or start a trial to view this content.
Discussão
Ligante-lítica de peptídeos têm sido usados com sucesso para efetivamente atacar e destruir as células cancerosas (Hansel e Leuschner 2004, Hansel et al. 2007). Com base neste conceito, foi desenvolvido um ligante heptapéptido que se liga à superfície de protozoários no intestino de cupins subterrâneos Formosan e acoplado a um peptídeo lítico com o objetivo de destruir estes obrigam-celulose digerir simbiontes no intestino de cupins para alcançar cupins controle (Husseneder e Collier 2009).
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Agradecemos ao Dr. Allison Richard, ex-diretor da unidade peptídeo LSU para a síntese do ligante fluorescentes, o Centro de Pesquisa Interdisciplinaray Biotecnologia, UF para a síntese de peptídeos ligante-líticas, ea instalação de Microscópio Socolovsky para fornecer acesso a microscópios de fluorescência. O financiamento foi fornecido pelo Programa de Desenvolvimento SERDP exploratória (SEED) do Departamento de Defesa, Departamento de Energia e Agência de Proteção Ambiental, a Biotecnologia AgCenter Programa Equipe Interdisciplinar eo estado de Louisiana.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
Referências
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados