Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Testen Protozoacidal Aktivität von Ligand-lytische Peptide gegen Termite Gut Protozoen In-vitro- (Protozoen Kultur) und In vivo (Mikroinjektion in Termite Enddarm)
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir präsentieren Verfahren für den Nachweis, dass Liganden binden an die Oberfläche Membran der Zellulose-Verdauung Protozoen im Darm von Termiten Formosan unterirdischen mit Fluoreszenz-Mikroskopie und dass Liganden mit lytischen Peptiden gekoppelt töten diese Protozoen In-vitro- (Anaerobe Protozoen Kultur) und In vivo (Injektion in den Termiten Enddarm).
Zusammenfassung
Wir entwickeln einen neuartigen Ansatz zur unterirdischen Termiten, die zu verringerten Vertrauen auf den Einsatz von chemischen Pflanzenschutzmitteln führen würde. Subterranean Termiten sind abhängig von Protozoen in der hindguts der Arbeitnehmer auf effizient verdauen Holz. Lytische Peptide haben gezeigt, dass eine Vielzahl von einzellige Parasiten (Mutwiri et al. 2000) zu töten, und auch im Darm von der Formosa unterirdischen Termite, Coptotermes formosanus (Husseneder und Collier 2009) Protozoen. Lytische Peptide sind Teil des unspezifischen Immunsystems von Eukaryoten, und zerstören die Membranen von Mikroorganismen (Leuschner und Hänsel 2004). Die meisten lytische Peptide sind nicht geeignet, höheren Eukaryonten schaden, weil sie keinen Einfluss auf die elektrisch neutralen Cholesterin-haltigen Zellmembranen von höheren Eukaryonten (Javadpour et al. 1996). Lytische Peptid Aktion kann auf bestimmte Zelltypen durch die Zugabe eines Liganden ausgerichtet sein. Zum Beispiel berichtete Hansel et al. (2007), dass lytischen Peptiden konjugiert mit Krebs Zellmembran-Rezeptor-Liganden verwendet werden könnten, um Brustkrebszellen zerstört werden, während lytische Peptide allein oder konjugiert mit nicht-spezifische Peptide wurden nicht wirksam. Lytische Peptide wurden auch konjugiert menschlichen Hormonen, die an Rezeptoren binden auf Tumorzellen für die gezielte Zerstörung von Prostata-und Hodenkrebs-Zellen (Leuschner und Hänsel 2004).
In diesem Artikel präsentieren wir Techniken verwendet, um die protozoacidal Aktivität eines lytischen Peptids (Hecate) gekoppelt an ein Heptapeptid Liganden, der an der Oberfläche der Membran aus dem Darm der Formosa-Termite unterirdischen Protozoen bindet demonstrieren. Diese Techniken umfassen Ausrottung der Darm von Termiten Arbeiter, Protozoen anaerobe Kultur des Darms (Pseudotrichonympha grassii, Holomastigotoides hartmanni,
Spirotrichonympha leidyi), mikroskopische Bestätigung, dass der Ligand mit einem fluoreszierenden Farbstoff markiert, um den Termitendarm bindet Protozoen und andere frei lebende Protozoen, aber nicht um Bakterien oder Darmgewebe. Wir zeigen auch, dass der gleiche Wirkstoff gekoppelt an eine lytische Peptid effizient tötet Termitendarm in vitro (Protozoen Kultur) und in vivo (Mikroinjektion in Enddarm der Arbeitnehmer) Protozoen, ist aber weniger bacteriacidal als die lytische Peptid allein. Der Verlust der Protozoen führt zum Tod der Termiten in weniger als zwei Wochen.
In Zukunft werden wir genetisch Ingenieur Mikroorganismen, die in der Termite Enddarm und die Ausbreitung durch eine Termitenkolonie als "Trojanische Pferde" zu Ligand-lytische Peptide, die in der Termitendarm Protozoen zu töten und anschließend zu töten die Termiten in der Kolonie würde ausdrücken können überleben . Ligand-lytische Peptide auch nützlich sein könnte für die Entwicklung von Medikamenten gegen einzellige Parasiten.
Protokoll
Versuch 1: Extraktion von Termitendarm unter anaeroben Bedingungen Protozoen
- Verwenden Sie ein Fan-Box (Coy Laboratories) in einer Glove-Box ständig zirkulieren Luft durch ein Trockenmittel und Typ D Katalysator Stak-Paks gegen Feuchtigkeit und Sauerstoff zu kontrollieren und zu beseitigen unebene Temperaturen. Füllen Sie das Handschuhfach mit einem kontinuierlichen Strom von Stickstoff für 20 bis 30 min. Monitor-Sauerstoff mit einem Sauerstoff-Sensor (C-squared, Inc.) für 1 h Verwenden Sie Stickstoff zu erreichen und aufrechtzuerhalten anaeroben Bedingungen, wenn nötig.
- Bereiten Trager U-Medien (Trager 1934) und pH-Wert auf 7,0. Sparge den Filter sterilisiert Medien im Handschuhfach mit einer Mischung von 2,5% Wasserstoff, 5% Kohlendioxid und 92,5% Stickstoff 1 h Sauerstoff zu entfernen.
- Silanisieren allen Materialien einschließlich Objektträger, Mikrozentrifugenröhrchen, Pipetten, Gläser etc. in den Versuchen mit Sigmacote verwendet werden, um die Adsorption von Protozoen zu verhindern oder Peptide auf Oberflächen (Sigmacote, Sigma, # SL-2, http://www.sigmaaldrich.com/ etc / mediaLib / docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf).
- Da Termitendarm Protozoen strikt anaeroben Organismen sind, müssen sie nicht dem Sauerstoff ausgesetzt werden. Deshalb sind die folgenden Schritte unter anaeroben Bedingungen in einer Glove-Box (siehe 1.1) durchgeführt. Mit einer Pinzette tauchen den ganzen Körper eine Termite Arbeiter in 70% Ethanol und schwenken Sie für ca. 10 s auf Verunreinigungen zu entfernen.
- Entfernen Sie die Arbeiter aus dem Ethanol und lassen auf eine saubere Kimwipe für etwa 20 s. trocken Verwenden Sie eine sterile spitzen Pinzette an den Arbeitnehmer Bauch halten und sichern Sie sich die Spitze des Bauches mit einem anderen Paar Pinzette vorsichtig den Darm nach oben oder unten in einem Winkel von 45 Grad. Wenn der Darm an einer geraden Winkel und mit zu viel Kraft gezogen wird, ist es wahrscheinlich, auseinander zu brechen. Platz 10 guts in einem Tropfen von 100 ul Trager U Medien auf einen Objektträger.
- Pierce den Mumm mit einem Paar sterile feinen Sezieren Sonden zur Freigabe der Protozoen und sanft Übertragung der Darminhalt mit 200 ul Pipette in ein 1 ml Mikrozentrifugenröhrchen mit 900 ul Trager U-Medien. Nach Berücksichtigung der Sedimentation Darmwand Fragmente (5 s), Transfer 900 ul des Überstandes in ein frisches Röhrchen.
- Transfer 10 ul der Protozoen Kultur zu einer sigmacoted Objektträger und den Zustand der unter dem Mikroskop bei 200-facher Vergrößerung Protozoen.
- Bereiten Kontroll-Kulturen der aeroben Protozoen Tetrahymena pyriformis, Amoeba sp., Euglena sp. Und Paramecium sp. (Carolina Biological Supply Company, Burlington, NC) sowie einer Übernachtkultur von Escherichia coli in den Kulturmedien durch den Lieferanten zu empfehlen.
Experiment 2: Add-Liganden mit einem Fluoreszenzfarbstoff gekoppelt die Protozoen und die Bakterienkulturen zur Bindung an die Oberfläche Membranen und Zellwände Test
Wir haben bereits Phagen-Display-Bibliotheken (New England Biolabs Inc., Ipswich, MA) verwendet zu 19 Heptapeptid-Sequenzen, die Protozoen (Protokolle zur Verfügung zu http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdf) binden zu identifizieren. Ein Ligand mit einer Peptidsequenz (ALNLTLH), die Ähnlichkeiten mit vermeintlichen Glykoproteine aus der Trypanosoma brucei Membran bekannt zeigte, wurde synthetisiert und gekoppelt mit einem C-terminalen fluoreszierende Sonde (EDANS, 5 - ((2-Aminoethyl) amino) naphthalin-1-sulfonsäure Säure, lmax = 341 nm, λem = 471 nm) über Solid-State-Peptid-Synthese (SSP) mit der EDANS NovaTag Harz (EMD Biosciences). Hier zeigen wir, dass der Ligand an den Protozoen, die aus der Termitendarm und andere frei lebende Protozoen, aber nicht die Bakterien isoliert wurden, bindet.
- Kultur der Protozoen wie in Exp. 1. Fix Protozoen mit 10% Formaldehyd bei 4 ° C für 12 h
- Centrifuge die Protozoen-Lösung (30 xg, 10 min), den Überstand verwerfen und waschen das Pellet mit den festen zweimal in 1 ml Trager U Medien Protozoen. Re-suspend das Pellet in 1 ml Trager U-Medien. Auch fix andere Protozoen, und E. coli-Bakterien für die Kontrollen.
- Inkubieren der festen Mikroorganismen für 1-2 h mit einer Lösung von synthetisierten Liganden gekoppelt an den Fluoreszenzfarbstoff EDANS (hergestellt in Wasser) in einer Endkonzentration von 50 uM. Der Ligand löst in Wasser besser als Trager U-Medien.
- Beachten Sie die Mikroorganismen unter einem Fluoreszenzmikroskop bei 400-facher Vergrößerung bei einem Absorptionsmaximum bei 341 nm und einer Emission im blauen Bereich bei 471 nm.
Versuch 3: Testen protozoacidal Aktivität des Liganden gekoppelt an eine lytische Peptid in vitro (Protozoen Kultur)
Ein Konjugat des Liganden und die lytische Peptid Hecate (Mutwiri et al. 2000) war zuvor bei der LSU Protein-Fazilität synthetisiert.
- Silanisieren Materialien und bereiten Termitendarm Protozoen Kultur in der anaeroben Handschuh Box eins beschrieben in Exp. 1.
- Bereiten Kulturen der aeroben Bekämpfung von Mikroorganismen (zB E. coli und die frei lebenden Einzeller Arten T. pyriformis).
- In der anaeroben Umgebung des Handschuhfachs, Pipette 6 Aliquots von 198 ul von Protozoen Kultur in 0,5 ml Eppendorf-Röhrchen. Add 2 ul einer 100 uM Lösung von Ligand-lytische Peptid auf die Hälfte der Aliquots (Endkonzentration 1 M) der Termitendarm Protozoen Kultur. Add 2 l Wasser, die andere Hälfte der Aliquots (Kontrollen).
- Auf dem Labortisch, bereiten ähnliche Aliquots von E. coli und T. pyriformis mit 1 uM lytische Peptid-Ligand-lytische Peptid oder Wasser.
- Nach 1 h Transfer 10 ul jeder Protozoen Kultur, um die Folien. Vergleichen Sie die Überlebensrate der behandelten Protozoen auf, dass der Kontrollen unter dem Mikroskop bei 200-facher Vergrößerung.
- Nach 1 h, Platte 100 ul von rd. 10 -4 Verdünnung der E. coli Kulturen auf BHI und bei 37 ° C über Nacht. Vergleichen Sie die Zahlen der koloniebildenden Einheiten auf den Tellern.
Experiment 4: Die Injektion des Liganden gekoppelt mit einem fluoreszierenden Farbstoff in in der Termite Enddarm
- Pull Nadeln (Model GD-1, 1 X 900 mm) mit einem Narishige PC-10 Glasmikropipette Abzieher mit einem zweistufigen Wärme-Ebene (65 und 48) eine Spitze Größe von 20-30 &mgr; m zu erhalten. Bestätigen Sie die Größe der Spitze durch die Messung unter dem Mikroskop mit einem Mikrometer.
- Füllen Sie eine Nadel mit ca. 30 ul 50 uM von fluoreszenzmarkierten Liganden suspendiert in Wasser mit einer angehängten Spritze. Füllen Sie eine andere Nadel mit Wasser für das Steuerelement. Befestigen einer Mikropipette (0,5 ul Kapazität und 32 mm Länge, Drummond Scientific Company) mit einer Halterung in einem Mikromanipulator. Bringen Sie eine Nadel, um das Einspritzsystem Halter in einem zweiten Mikromanipulator. Set ersten Injektion Parameter auf ca. 1 s Impulsdauer und 10-12 psi Injektion. Schieben Sie die Nadel langsam in die Mikropipette und injizieren Sie die Lösung mit einem Pedal-angetriebenen Hochgeschwindigkeits-elektronisches Einspritzsystem mit einer Pulslänge Kontrolle angebracht, um eine kontrollierte Stickstoffgasstrom, was bedeutet, dass ein konstantes Volumen reproduzierbar injiziert wird gewährleistet. Nach der Injektion, entfernen Sie die Mikropipette und notieren Sie die Länge der injizierten Lösung mit einem Messschieber. Berechnen Sie das injizierte Volumen aus den bekannten Parametern der Mikropipette. Passen Sie den Druck von Stickstoffgas und die Pulslänge bis 0,3 ul-Lösung in einer einzigen Injektion zu vertreiben.
- Squeeze Ende einer Termite Arbeiter Bauch mit weichen Pinzette keine Ausscheidungen in den Enddarm zu entfernen. Immobilisieren Termite Arbeiter durch Kühlen auf Eis für 5 min.
- Machen Empfängern zur Aufnahme von Termiten Arbeiter durch Abschneiden 100 ul Pipettenspitzen mit einem Skalpell. Schneiden Sie die Spitze auf eine Länge von 10 bis 12 mm und verwenden Sie je nach Größe der Termiten.
- Befestigen Sie den Empfänger an den Mikromanipulator. Einen Arbeiter auf einer Petrischale auf seiner dorsalen Seite und saugen den Arbeiter mit dem Kopf voran in den Hörer mit einem Stickstoff-Saugpumpe, so dass die Endstation der Arbeiter ragt aus dem Empfänger.
- Halten Sie die Termiten in den Empfänger sorgfältig Voraus gefüllt Nadel mit dem Mikromanipulator, um es in Arbeiter Anus einzufügen. Inject 0,3 ul der Lösung (fluoreszenzmarkierten Liganden oder Wasser für Kontrollen).
- Legen Sie die Arbeiter mit Liganden oder Wasser in separate Petrischalen injiziert mit feuchtem Filterpapier und halten sie bei 26 ± 2 ° C mit 78% RH
- Auszurotten Mumm von der injizierten Termiten und sammeln die Protozoen nach 24 h, wie oben gezeigt in Exp. 1. Fix und beobachten Sie die Protozoen wie in Exp gezeigt. 2.
Experiment 5: Testen protozoacidal Aktivität des Liganden gekoppelt an eine lytische Peptid in vivo (Injektion in Termiten Enddarm)
- Silanisieren Materialien wie in Exp. 1.
- Bereiten Sie eine 500 uM Lösung des Liganden-lytische Peptid in Wasser.
- Führen Sie die Schritte 3,1) durch 3,4) auf Glas Nadeln, Empfänger und Termiten Arbeiter vorzubereiten.
- Nach dem Verfahren in 3.5 beschrieben) injizieren 0,3 ul der Ligand-lytische Peptid-Lösung (Behandlung) oder Wasser (Kontrolle) in den Enddarm von 20 Termite Arbeiter.
- Halten Termiten für 24 h, auszurotten guts von mehreren Arbeitnehmern und beobachten Darminhalt unter dem Mikroskop wie in 3.6 beschrieben). und 3,7).
- Sobald ein Tod in der Termitendarm Protozoen bestätigt wird, halten verbleibenden behandelten Termiten und steuert in Petrischalen mit feuchtem Filterpapier und beobachten Sterblichkeit täglich.
Repräsentative Ergebnisse:
Experiment 1: In der Regel Vorderdarm, Mitteldarm und Enddarm sind in einem Stück erhalten, wenn das Verfahren korrekt ist (Abbildung 1a) gefolgt. Die Protozoen wohnen in hoher Dichte in der anaeroben Teile der Enddarm und kann durch Einstechen in die Enddarm mit einer Pinzette (Abbildung 1b 1 & 2) freigesetzt werden. Die größte protozoa Arten im Darm von der Formosa unterirdischen Termite ist der spindelförmige P. grassii, die 200-300 mu m lang und 150 &mgr; m breit ist und mit dem bloßen Auge gesehen werden. Die zweitgrößte Arten ist die birnenförmige H. hartmanni (50 bis 140 mu m lang und 30-80 &mgr; m breit). Die kleinste Art ist das kegelförmige S. leidyi (15-50 &mgr; m lang und 8-30 &mgr; m breit;. Lai et al 1983). Die Protozoen Arten sind in Abbildung 2 dargestellt.
Unter optimalen Kulturbedingungen die drei Arten von Protozoen aus dem Darm von Termiten Formosan unterirdischen isoliert bleiben lebendig und gesund für mindestens 72 h in anaeroben Trager U-Medien (Abbildung 3a). Allerdings, wenn Kultur nicht optimal sind Protozoen schnell sterben. Wenn es Sauerstoff Rückstände in den Medien sind, wird die Bewegung der Protozoen sofort einzustellen. Wenn osmotische Druck ist zu hoch oder Membranintegrität der Oberfläche Membran der Protozoen wird wölben und die Zellen Bruch (Abb. 3b) gefährdet ist. Wenn osmotische Druck ist zu niedrig oder Membranen sind gefährdet, wird Protozoen schrumpfen und schrumpfen (Abbildung 3c).
Experiment 2: Wir haben bestätigt, dass der Ligand an eine fluoreszierende Sonde gebunden, alle drei Arten von aus dem Enddarm von Formosa unterirdischen Termiten in nachweisbaren Dichten Protozoen gekoppelt. Ligandenbindung erfolgt auf der gesamten Zelloberfläche (Abbildung 4). Bindungsstellen sind im vorderen Bereich des auf der axostyle (ein Blatt von Mikrotubuli) und Kern in P. Protozoen konzentriert grassii.
Wir beobachteten einige lückenhaft Autofluoreszenz von Holzspänen durch die Protozoen aufgenommen. Allerdings ist Autofluoreszenz in der Regel leicht von spezifischen Bindung des Liganden zu erkennen, da es keine Autofluoreszenz der Oberfläche, die axostyle und den Zellkern (Abbildung 4).
Wir haben auch erkannt Fluoreszenz in allen getesteten frei lebenden aeroben Protozoen Spezies (Abbildung 5), was bedeutet, dass der Ligand Strukturen allgemein, um Protozoen bindet schlägt. Es wurde jedoch kein Ligandenbindung für E. beobachtet coli.
Versuch 3: Ein uM von Ligand-lytische Peptid tötete alle drei Arten von aus dem Darm von Formosa unterirdischen Termite Arbeitnehmer und der frei lebenden T. Protozoen pyriformis in vitro in weniger als 10 min, während Kontrollen am Leben geblieben. Abbildung 6 zeigt den fortschreitenden Verlust der Membran-Integrität der Termitendarm Protozoen behandelt mit Ligand-lytische Peptid. Membranen Ausbuchtung und Bruch, Protozoen schrumpfen und sterben. Es wurde kein Unterschied in der Anzahl der E. beobachtet coli-Kolonien zwischen den Behandlungen von Ligand-lytische Peptid und Wasser. Lytische Peptid ohne Ligand, aber die Zahl der E. coli-Kolonien erheblich (Abbildung 7). Dies deutet darauf hin, dass die Bindung des Liganden zu einem gewissen Grad schützt nicht Zielmikroorganismen von Lyse.
Experiment 4: Wenn 0,3 ul 50 uM der fluoreszenzmarkierten Liganden in den Enddarm von Termiten Arbeiter injiziert wurde, die Bindung an P. grassii, S. leidyi und H. hartmanni wurde über Fluoreszenzmikroskopie ähnlich Exp bestätigt. 2 (Abbildung 4). Termite Darmgewebe nicht fluoreszieren.
Experiment 5: Injektion von 0,3 ul 500 uM Ligand-lytische Peptid tötete alle drei Arten von im Darm von Termiten Formosan unterirdischen innerhalb von 24h Protozoen. Termiten starben innerhalb von 10 Tagen nach Verlust ihrer symbiotischen Protozoen. Zuvor injiziert Husseneder und Collier (2009) die gleiche Konzentration an lytische Peptid in Termiten Mut. Ohne den beigefügten Liganden, dauerte es mehr Zeit, bis die in den Darm (72 h) Protozoen und die Termiten tot waren (sechs Wochen). Dies deutet darauf hin, dass der Ligand protozoacidal Effizienz der lytische Peptide, wahrscheinlich durch die Bindung des lytischen Peptiden an der Protozoen erhöht.
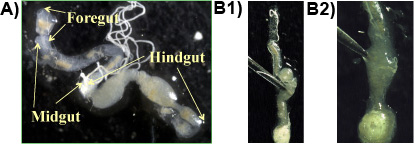
Abbildung 1. a: Formosan unterirdischen Termitendarm auf einer Folie, die die wichtigsten Abschnitte des Darms (Vorder-, Mittel-, Enddarm); b 1 & 2: Enddarm ist mit einer Pinzette durchbohrte den Darminhalt mit den Protozoen freizugeben.

Abbildung 2. Die drei Arten von Flagellaten Protozoen im Enddarm der Formosa-Termite unterirdischen gefunden: a) Pseudotrichonympha grassii, b) Holomastigotoides hartmanni und c) Spirotrichonympha leidyi.

Abbildung 3. Protozoen in Kultur, Protozoen a) Gesunde, b) Protozoen mit prall gefüllten Membranen, c) vertrocknet Protozoen.

Abbildung 4. Bestätigung der Bindung des Liganden an einen fluoreszierenden Sonde gut Termiten gekoppeltProtozoen (von oben nach unten: P. grassii, H. hartmanni, S. Leydi), behandelt mit fluoreszenzmarkierten Liganden und unbehandelten Kontrollen (Es werden Autofluoreszenz).

Abbildung 5. Ligandenbindung an frei lebenden aeroben Protozoen, a) Tetrahymena, b) Amoeba, c) Euglena, und d) Paramecium.
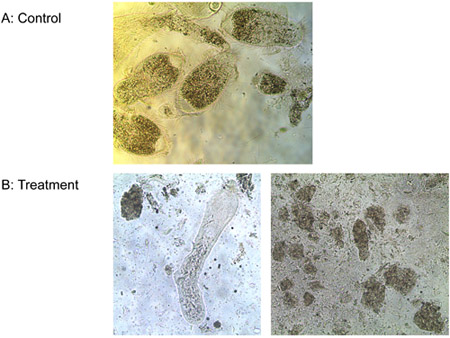
Abbildung 6. Die Behandlung der mit a) Wasser (Kontrolle) und b) 1 nM Ligand-lytische Peptid Protozoen.
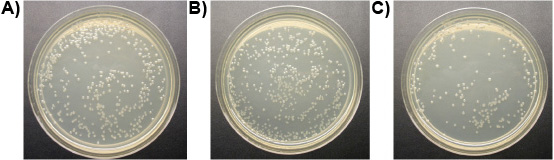
Abbildung 7. E. coli-Kolonien auf den Platten (10 -4 Verdünnung): a) mit Wasser (Kontrolle), b) behandelt Behandelt mit 1 uM Ligand-lytische Peptid, c) Behandelt mit 1 uM lytische Peptid.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Ligand-lytische Peptide wurden erfolgreich verwendet, um effektiv anzugreifen und zu zerstören Krebszellen (Hänsel und Leuschner 2004, Hansel et al. 2007). Basierend auf diesem Konzept entwickelten wir ein Heptapeptid Liganden, der an der Oberfläche bindet Protozoen im Darm von Formosa unterirdischen Termiten und gekoppelt an einen lytische Peptid mit dem Ziel, diese zu verpflichten Zellulose-Verdauung Symbionten im Darm von Termiten zu zerstören, um Termiten zu erreichen Steuerung (Husseneder und Collier 2...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Wir danken Dr. Allison Richard, ehemaliger Direktor des LSU-Peptid-Anlage für das fluoreszierende Liganden Synthese, die Interdisciplinaray Center for Biotechnology Research, UF für den Liganden-lytische Peptid-Synthese und die Socolovsky Mikroskop-Anlage für den Zugang zur Fluoreszenz-Mikroskopen. Die Finanzierung wurde durch die SERDP Exploratory Development Program (SEED) des Department of Defense, Department of Energy and Environmental Protection Agency, der Biotechnologie AgCenter Interdisziplinäres Team Programm und den Bundesstaat Louisiana zur Verfügung gestellt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
Referenzen
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten