このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
原虫シロアリ腸に対するリガンド - 溶解性ペプチドのProtozoacidal活性を試験する in vitroで(原生動物文化)と in vivoで(シロアリ後腸へのマイクロインジェクション)
要約
我々はリガンドが原虫溶解ペプチドと結合した蛍光顕微鏡とそのリガンドを用いたイエシロアリシロアリの腸内原生動物殺すセルロース消化これらの表面の膜に結合実証するための手順を提示 in vitroで(嫌気性原生動物の文化)と in vivoで(シロアリの後腸への注射)。
要約
我々は、化学農薬の使用に関する依存度が下がるにつながる地下のシロアリ駆除への新しいアプローチを開発しています。地下のシロアリは、効率的に木材を消化するために労働者のhindgutsで原生動物に依存しています。溶解性ペプチドは寄生原虫(Mutwiri ら、2000)の様々なを殺すために示され、また、イエシロアリ、Coptotermesイエシロアリ (Hussenederとコリア2009)の腸内原生動物されています。溶解性ペプチドは、真核生物の非特異的な免疫システムの一部であり、微生物(ロイシュナーとヘンゼル2004)の膜を破壊する。彼らは高等真核生物(Javadpour ら 1996)の電気的に中性のコレステロール含有細胞膜に影響しないので、ほとんどの溶解性ペプチドは、高等真核生物を害するおそれがないです。細胞溶解性ペプチドの作用は、リガンドの添加により、特定の細胞種をターゲットとすることができます。単独で、または共役非特異的ペプチドと溶解性ペプチドが効果的ではなかったしながら例えば、ヘンゼルら (2007)は、癌細胞の膜受容体のリガンドと結合した細胞溶解性ペプチドは、乳がん細胞を破壊するために使用することができることを報告した。溶解性ペプチドはまた、前立腺及び精巣の癌細胞(ロイシュナーとヘンゼル2004)の標的破壊するための腫瘍細胞の受容体に結合するヒトのホルモンへのコンジュゲートされている。
この記事では、イエシロアリの腸からの原虫の表面の膜に結合するヘプタペプチドリガンドに結合した細胞溶解性ペプチド(ヘカテ)のprotozoacidal活性を示すために使用されるテクニックを紹介。これらの技術は、シロアリの労働者からの腸管の摘出、原生動物腸内の嫌気培養を(Pseudotrichonympha grassii、Holomastigotoides hartmanni、含まれています
Spirotrichonympha leidyi)、蛍光色素でマークされたリガンドが出ていて、細菌や腸の組織に原生動物原生動物と自由生活他のシロアリの腸内に結合することを顕微鏡を確認。我々はまた、細胞溶解性ペプチドに結合した同一のリガンドを効率的に体外 (原虫培養) および in vivo(労働者の腸へのマイクロインジェクション) の原虫シロアリの腸を殺す、それだけで細胞溶解性ペプチドよりもbacteriacidalであることを示している。 2週間未満でシロアリの死への原虫リードの損失。
将来的には、我々は遺伝的にシロアリ腸内原生動物を殺し、その後、コロニーのシロアリを殺すリガンド溶解性ペプチドを発現するために"トロイの木馬"のようなシロアリのコロニーによって、シロアリの後腸と広がりの中で生き残ることができる微生物をエンジニアリングされます。リガンド溶解性ペプチドはまた、原虫に対する薬剤の開発に有用である可能性があります。
プロトコル
実験1:シロアリの腸の抽出は、嫌気的条件下で原生動物
- 常に湿度と酸素濃度を制御し、不均一な温度を排除するために乾燥剤とタイプD触媒Stak -パクシを通して空気を循環させるためにグローブボックス内でファンボックスを(コイラボラトリーズ)を使用してください。 20〜30分間窒素の連続的な流れとグローブボックスを埋める。 1時間の酸素センサー(C -の二乗、(株))で酸素濃度をモニター必要に応じて嫌気的条件に到達し、維持するために窒素を使用してください。
- トレーガーUメディア(トレーガー1934)を準備し、pHを7.0に調整する。 2.5%の水素、5%の二酸化炭素と酸素の残留物を除去するために1時間の92.5%窒素の混合物でグローブボックス内のフィルター滅菌媒体を散布する。
- の吸着を防ぐためにSigmacoteを用いた実験で使用した顕微鏡スライド、マイクロチューブ、ピペット、ガラス製品などを含むすべての材料をSilanize原生動物または表面へのペプチド(Sigmacote、シグマ、#SL - 2、http://www.sigmaaldrich.com/ ETC / medialibの/ docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf)。
- 原生動物シロアリの腸は厳密に嫌気性菌であるため、彼らは酸素にさらされてはならない。したがって、次の手順は、グローブボックス(1.1参照)における嫌気性条件下で行われる。鉗子の水没70%エタノールおよび表面の汚染物質を取り除くために、約10秒間静かに渦のシロアリ労働者の全身を持つ。
- エタノールから労働者を削除し、約20秒のためのきれいなキムワイプで乾燥させる労働者の腹部を保持し、ゆっくりと45度の角度で上方または下方に腸を引っ張るために鉗子の別のペアで腹部の先端をつかむために無菌の先の細いピンセットを使用してください。腸がまっすぐ斜めにしすぎる力で引っ張られている場合、それは離れて動かなくしてしまうでしょう。顕微鏡スライド上に100μlのトレーガーUメディアのドロップで10勇気を置きます。
- ピアース解放するために無菌の微細な解剖プローブのペアを持つ勇気原生動物と穏やかに900μlのトレーガーUメディアを含む1 mlのマイクロ遠心チューブに200μlのピペットを用いて腸の内容を転送します。腸壁の断片(5秒)の沈降を可能にした後、転送を新しいチューブに上清の900μlの。
- sigmacoted顕微鏡スライドに原生文化の10μlを移し、200 Xの倍率での顕微鏡下で原生動物の状態を確認してください。
- 好気性原生動物テトラヒメナpyriformis、アメーバ属、 ユーグレナ属、およびゾウリムシ SPのコントロール培地を準備します。サプライヤーが推奨する培養培地で(ノースカロライナ生物供給会社、バーリントン、ノースカロライナ州)と同様に大腸菌の一晩培養。
実験2:表面の膜と細胞壁に結合することをテストするための原生動物や細菌の培養に蛍光色素を結合した追加リガンド
我々は以前(http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdfで利用可能なプロトコル)原虫にバインド19ヘプタペプチド配列を同定するために、ファージディスプレイライブラリー(New England Biolabs社株式会社、イプスウィッチ、MA)を使用。 トリパノソーマの細胞膜から知られている推定上の糖タンパク質との類似点を示したペプチド配列(ALNLTLH)と配位子が合成され、C末端蛍光プローブ(EDANS、5に結合された- ((2 -アミノエチル)アミノ)ナフタレン-1 -スルホン酸EDANS NovaTag樹脂(EMD Biosciences)を用いて固体状態のペプチドの合成(SSPS)を経由して酸、λmax= 341 nmの、λem= 471 nm)を。ここでは、リガンドは、シロアリ腸内原生動物と自由生活その他からではなく、細菌に分離されている原生動物に結合することを示している。
- 文化は、経験で説明原生動物。 1。 12時間4℃で10%のホルムアルデヒド° Cで原生動物修正
- 原生動物溶液(30 × gで、10分)遠心し、上清を廃棄し、固定された1ミリリットルトレーガーUメディアで二回原生動物を含むペレットを洗浄する。ペレットを1mlトレーガーUメディアで再懸濁する。また、原生動物、他の修正、およびE.コントロール用の大腸菌の細菌。
- 50μMの最終濃度で蛍光色素EDANS(水で調製)に結合した合成リガンドの溶液で1〜2時間の固定微生物をインキュベートする。リガンドは、トレーガーUメディアよりも水に良く溶解する。
- 341 nmでの吸光度の最大値および471 nmの青色領域の発光の400 Xの倍率で、蛍光顕微鏡下で微生物を観察。
実験3:in vitroでの細胞溶解性ペプチド(原虫文化)に結合したリガンドのprotozoacidal活動をテストする
リガンドと細胞溶解性ペプチドヘカテ(Mutwiri ら、2000)の共役は、以前はLSUのタンパク質の施設で合成した。
- 材料をSilanizeと嫌気グローブボックス内でシロアリの腸内原生動物文化を準備sは、経験で説明しています。 1。
- 好気性菌の制御の微生物(例えば、 大腸菌および自由生活性原生動物種T.のpyriformis)の文化を準備します。
- グローブボックスの嫌気性環境で、0.5ミリリットルのエッペンドルフチューブに原虫文化198μlのピペット6アリコート。シロアリ腸内原生動物文化のアリコートの半分(最終濃度1μM)にリガンド - 細胞溶解性ペプチドの100μMの溶液2μlを添加する。アリコートの他の半分(コントロール)に水2μlを添加する。
- ベンチトップで、E.の同様のアリコートを準備大腸菌やT. 1μMの細胞溶解性ペプチド、リガンド-細胞溶解性ペプチドまたは水でpyriformis。
- 1時間後、スライドに各原虫の文化の10μlを移す。 200 ×の倍率での顕微鏡下のコントロールのように原虫治療の生存率を比較する。
- 1時間後、約のプレートを100μl。 E.の10 -4希釈37℃で一晩BHIとインキュベート上で大腸菌の培養。プレート上でコロニー形成単位の数値を比較。
実験4:シロアリ後腸内に蛍光色素に結合したリガンドのインジェクション
- 20から30ミクロンのチップサイズを取得するためにデュアルステージの熱のレベル(65および48)とナリシゲのPC - 10ガラスマイクロピペットプラーを使用して針(モデルGD - 1、1 X 900 mm)を引き出します。マイクロメータを用いて顕微鏡下でそれを測定することにより、チップサイズを確認してください。
- CAを使用すると、ワン針を埋める。蛍光マーク配位子の50μMの30μlのは、付属のシリンジを使用して水に懸濁した。制御のために水で別の針を埋める。マイクロマニピュレータのホルダーにマイクロピペット(0.5μlの容量と32 mmの長さ、ドラモンドサイエンティフィック社)を取り付けます。第二マイクロマニピュレータのインジェクションシステムホルダーに針を取り付けます。約1秒のパルス長10〜12 psiの注入に初期注入パラメータを設定します。マイクロピペットにゆっくり針を進め、一定のボリュームが再現性良く注入されるように制御された窒素ガスの流量、に接続されたパルスの長さのコントロールとペダル駆動型高速電子注入システムを使用してソリューションを注入する。注入後、マイクロピペットを削除し、ノギスを用いて注入溶液の長さを記録。マイクロピペットの既知のパラメータから注入量を計算する。単回注射に0.3μlのソリューションを追放するために窒素ガスの圧力とパルスの長さを調整します。
- 直腸内の任意の排泄物の存在を削除する、ソフトピンセットでシロアリワーカー腹部の端をつまんで。 5分間氷上で冷却によってシロアリの労働者を固定化する。
- 手術用メスの刃を用いて100μlのピペットチップをカットすることでシロアリの労働者を保持するための受信機を作る。 10の長さに先端カット - 12 mmをし、シロアリの大きさに応じて使用してください。
- マイクロマニピュレータに受信機を取り付けます。その背側のペトリ皿に労働者を配置し、窒素の吸引ポンプを使用して受信機に最初のワーカーの頭を吸引除去するように受信機からの労働者の突出末端。
- 受信機でシロアリを持って慎重に作業者の肛門に挿入するためにマイクロマニピュレーターを用いて充填した針を進める。解決策(コントロールの蛍光マークリガンドまたは水)0.3μlを注入する。
- 湿らせたろ紙を持つ別々のペトリ皿にリガンドまたは水を注入した労働者を配置し、26でそれらを保つ± 2 ° C、78%RH
- 注入されたシロアリから内臓を摘出すると経験上に上記のように24時間後に原虫の収集。 1。修正して、経験に示すように、原生動物を観察。 2。
実験5:in vivoでの細胞溶解性ペプチド(シロアリ後腸に注入する)に結合したリガンドのprotozoacidal活動をテストする
- 経験で説明したように材料をSilanize。 1。
- 水のリガンド細胞溶解性ペプチドの500μM溶液を調製します。
- ガラス針、レシーバとシロアリの労働者を準備する)3.4を介してステップ3.1)に従ってください。
- 3.5で説明する方法に従って)20シロアリの労働者の後腸にリガンド - 細胞溶解性ペプチドの溶液(処理)または水(対照)0.3μlを注入する。
- いくつかの労働者から24時間のシロアリ、根絶勇気を持って、3.6で説明したように)顕微鏡下で腸の内容を観察。および3.7)。
- シロアリ腸内原生動物の死亡が確認されるとすぐに、湿ったろ紙をペトリ皿に残っている治療シロアリとコントロールを維持し、毎日の死亡率を観察。
代表的な結果:
実験1:通常、前腸、中腸と後腸は、プロシージャが(図1a)を正しく実行されたときに一体的に得られる。後腸の嫌気部分に高密度に存在する原生動物や鉗子(図1b 1&2)で後腸を貫通することによって解放することができます。最大のプロトイエシロアリの腸内のzoonの複数形の種は、紡錘状のPです。 200から300μm長および150μm幅であり、肉眼で見ることができますgrassii、。二番目に大きい種は、洋ナシの形Hである。 hartmanni(50〜140μmの長さ30〜80μm幅)。最小種は円錐形のSですleidyi(15-50μm長と80〜30μm幅、。ライら 1983)。原虫種は、図2に示します。
最適な培養条件下でイエシロアリシロアリの腸内から分離された原虫類3種の嫌気性トレーガーUメディア(図3a)で少なくとも72時間のために生きていると健康なままになります。しかし、培養条件が最適でない場合原虫が速く死んでしまう。メディアでの酸素の残基がある場合は、原生動物の動きは、即座に停止します。浸透圧が高すぎる、または膜完全性である場合、原生動物意志の膨らみの表面の膜外および細胞の破裂を(図3b)危険にさらされます。浸透圧が低すぎるまたは膜が損なわれている場合は、原生動物では(図3c)縮ませると縮小されます。
実験2:我々はリガンドが検出可能な濃度でイエシロアリシロアリの後腸から原虫のすべての3つの種にバインドされている蛍光プローブに結合されていることを確認。リガンド結合は、セル全体の表面(図4)で発生します。結合部位は、軸桿(微小管のシート)とP.における核の原虫の前方領域に集中しているgrassii。
私たちは、原生動物によって摂取木材粒子のいくつかの斑状の自家蛍光を観察した。面、軸桿と核(図4)のない自己蛍光がないのでしかし、自家蛍光は、通常、リガンドの特異的結合から見分けるのは簡単です。
我々はまた、リガンドは原生動物への一般的な構造に結合することを示唆しているすべてのテストされた自由生活性好気性の原生種の蛍光(図5)、検出された。しかし、リガンドの結合は、E.は観察されなかった大腸菌 。
実験3:リガンド-細胞溶解性ペプチドの一つμMは、イエシロアリの労働者の腸と自由生活Tから原虫のすべての3つの種を殺した未満で10分のin vitroでのpyriformis、コントロールが生きて滞在しながら。図6は、リガンド - 細胞溶解性ペプチドで処理原虫シロアリの腸の膜の完全性の進行性の喪失を示しています。膜が膨らみ、破裂、原生動物縮ませると死ぬ。差はE.の数では観察されなかったリガンド-細胞溶解性ペプチドと水の治療の間に大腸菌のコロニー。ないリガンドと細胞溶解性ペプチドは、しかしながら、E.の数を削減かなり大腸菌のコロニー(図7)。これは、ある程度の配位子の添付ファイルは、溶解から、非標的微生物を保護示唆している。
実験4:蛍光マークリガンドの0.3μlの50μMがPに結合し、シロアリの労働者の後腸に注入したgrassii、S. leidyiとH. hartmanniは Expに類似した蛍光顕微鏡を介して確認された。 2(図4)。シロアリの腸組織は、蛍光表示されませんでした。
実験5:0.3μlの500μMリガンド - 細胞溶解性ペプチドの注入は、24時間以内にイエシロアリシロアリの腸内原生動物のすべての3つの種を殺した。シロアリは彼らの共生原生動物の喪失後10日以内に死亡した。以前は、Hussenederとコリアー(2009)シロアリの腸内に細胞溶解性ペプチドの同じ濃度を注入した。腸内原生動物(72時間)とシロアリが(6週)死んでいたまでは添付の配位子がなければ、より多くの時間がかかりました。これは、リガンドが原虫に溶解性ペプチドを結合することによって、最も可能性が高い、溶解性ペプチドのprotozoacidal効率を高めることを示唆している。
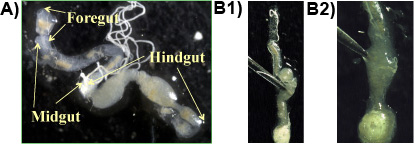
図1。 :腸のメインセクション(船首、中期、後腸)を示すスライド上にイエシロアリの腸内、B 1&2:後腸は、原生動物を含む腸内のコンテンツを解放するためにピンセットで穴を開けている。

図2。イエシロアリの後腸に見られる鞭毛原虫類3種:)Pseudotrichonympha grassii、B)Holomastigotoides hartmanni、およびc)Spirotrichonympha leidyi。

図3。文化の中で原生動物、B、原虫)健康)隆起膜、cで原虫)原虫しなびた。

図4。リガンドの結合の確認には、腸をシロアリに蛍光プローブに結合さ、蛍光マークリガンドと未処理コントロール(自家蛍光を示す)で処理:(P. grassii、H. hartmanni、S. leydi上から下へ)原生動物。

図5。自由生活性好気性は原生動物へのリガンド結合、) テトラヒメナ 、b)のアメーバ 、C) ユーグレナ 、およびd) ゾウリムシ 。
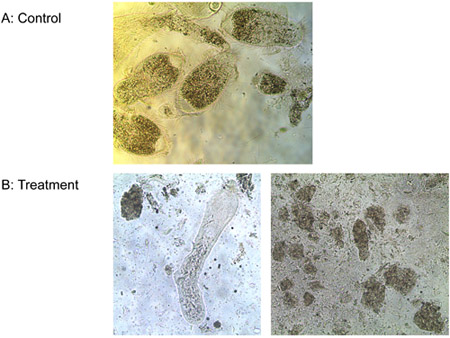
図6。 )水(対照)とb)1μMのリガンド - 細胞溶解性ペプチドと原虫の治療。
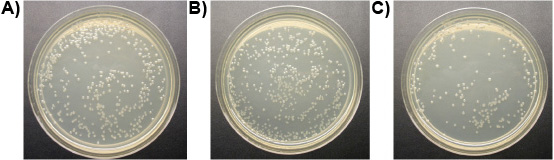
図7。E.プレート上の大腸菌コロニー(10 -4希釈):)水(対照)、Bで処理した)、1μMリガンド-細胞溶解性ペプチド、Cで処理)は1μM細胞溶解性ペプチドで処理した。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
リガンド溶解性ペプチドは、正常に効果的にがん細胞を(ヘンゼルとロイシュナー2004年ヘンゼルら、2007)をターゲットと破壊するために使用されている。このコンセプトに基づいて、我々は、イエシロアリシロアリの腸内で原生動物や、これらの嫌気セルロース消化シロアリを達成するためにシロアリの腸内共生生物を破壊することを目的と細胞溶解性ペプチドに結合の表面に結合?...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
我々は、博士アリソンリチャード、蛍光リガンドの合成、バイオテクノロジー研究のためのInterdisciplinarayセンター、リガンド - 細胞溶解性ペプチドの合成のためのUF、および蛍光顕微鏡へのアクセスを提供するためのSocolovsky顕微鏡施設のLSUのペプチドの施設の元ディレクターに感謝する。資金調達は、国防総省のSERDP未踏開発プログラム(SEED)、エネルギーと環境保護庁の省、バイオテクノロジーAgCenter学際的なチームのプログラムとルイジアナ州の状態で提供されていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
参考文献
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved