A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת התפלגות מרחבית של γH2AX הבאים בקרינה מייננת
In This Article
Summary
ניתוח מיקרוסקופי של γH2AX מוקדים, אשר הטופס הבא זירחון של H2AX ב Ser-139 בתגובה פעמיים גדיל הדנ"א נשבר, הפך להיות כלי רב ערך בביולוגיה קרינה. כאן השתמשנו נוגדנים מונו מפוגל היסטון H3 ב ליזין 4 כסמן epigenetic של euchromatin פעיל לתעתוק, כדי להעריך את הפריסה המרחבית של היווצרות γH2AX קרינה הנגרמת בתוך הגרעין.
Abstract
תגובה מולקולרית מוקדם הדנ"א הכפול גדיל הפסקות (DSBs) הוא זירחון של שאריות סר 139-מוטיב בתוך הטרמינל SQEY של 1,2 H2AX היסטון. זירחון זה של H2AX מתווכת על ידי phosphatidyl inosito-3-kinase (PI3K) משפחה של חלבונים, אטקסיה telangiectasia מוטציה (ATM), ה-DNA למקטע החלבון קינאז קטליטי ATM ו RAD3 הקשורות (ATR) 3. צורת פוספורילציה של H2AX, המכונה γH2AX, מתפשט לאזורים סמוכים של הכרומטין מהאתר של DSB, ויוצרים מוקדים נפרדים, שהם דמיינו בקלות באמצעות מיקרוסקופ immunofluorecence 3. ניתוח quantitation של γH2AX מוקדים כבר בשימוש נרחב על מנת להעריך היווצרות DSB ותיקון, בעיקר בתגובה לקרינה מייננת ו להערכת היעילות של קרינה שונים שינוי תרכובות תרכובות ציטוטוקסיות 4.
לאור רגישות וספציפיות מעולה של סמן זה דה נובו של DSBs, זה סיפק תובנות חדשות על תהליכים של נזק לדנ"א ותיקון בהקשר של הכרומטין. לדוגמה, ביולוגיה קרינה הפרדיגמה המרכזית היא כי ה-DNA גרעיני היא מטרה קריטית לגבי רגישות לקרינה. ואכן, הסכמה כללית בתחום כבר במידה רבה כדי להציג הכרומטין כתבנית הומוגנית עבור נזק לדנ"א ותיקון. אולם, עם השימוש γH2AX כסמן המולקולרי של DSBs, פער γ-קרינה-Induced היווצרות מוקדים γH2AX ב euchromatin ו heterochromatin נצפתה 5-7. לאחרונה, השתמשנו פאנל של נוגדנים או מונו, די או תלת מפוגל היסטון H3 ב ליזין 9 (H3K9me1, H3K9me2, H3K9me3) אשר טביעות epigenetic של heterochromatin המכונן ועל ההשתקה תעתיק וליזין 4 (H3K4me1, H3K4me2, H3K4me3 ), אשר מתואמים היטב פעיל לתעתוק euchromatic האזורים, כדי לחקור את הפריסה המרחבית של γH2AX בעקבות קרינה מייננת 8. בהתאם לרעיונות הרווחת לגבי ביולוגיה הכרומטין, הממצאים שלנו מצביעים על קשר הדוק בין היווצרות γH2AX ו שעתוק פעיל 9. כאן אנו להדגים שיטה immunofluorescence שלנו עבור איתור quantitation של γH2AX מוקדים שאינם חסיד תאים, עם דגש מיוחד על שיתוף לוקליזציה עם סמנים epigenetic אחרים, ניתוח תמונה-3D דוגמנות.
Protocol
תא הכנה
- האדם erythroleukemic K562 התאים גדלים בינוני 1640 RPMI בתוספת 10% (v / v) בסרום שור עוברית 20 מ"ג / מ"ל גנטמיצין בסביבה humidified 5% CO 2 ב 37 ° C.
- כ 18 שעות לפני מכתים לשטוף התאים גדל באופן אקספוננציאלי (אופטימלי בבית 5 x 10 5 תאים / מ"ל) עם פוספט בופר סליין (PBS), resuspend בתקשורת צח ולחזור 37 מעלות צלזיוס, 5% CO 2.
- לשטוף את התאים פעמיים עם PBS על ידי צנטריפוגה בסל"ד כ 1500 למשך 5 דקות resuspend בתקשורת טריים.
- ספירת תאים ולהתאים את צפיפות התאים של כ 5 x 10 5 תאים / מ"ל.
תאים ניתן לספור באמצעות שיטה אוטומטית (למשל Sysmex או קולטר דלפק עם גודל מסנן בין 5 עד 20 מיקרון) או באמצעות השיטה trypan הדרה כחולה haemocytometer. מספר עודף של תאים (> 800 תאים / ס"מ 2) עלול להוביל מכתים לא אחידה.
הקרנת והכתים immunofluorescence
- להרכיב קליפים cytospin, כרטיסי לסנן שקופיות עם תיוג מתאים.
כאשר הרכבת המנגנון cytospin להבטיח את החור כרטיס עולה בקנה אחד עם מסנן המשפך.
- חשיפת תאים לקרינת-γ או קרני רנטגן (2Gy בדוגמה זו).
כדי למנוע היווצרות של מוקדי במהלך הקרנה, לשמור על התאים על קרח למשך 5 עד 10 דקות לפני ובמהלך ההקרנה.
הקרנה לאחר דגירה התאים ב 37 מעלות צלזיוס, 5% CO 2 עבור הזמן הנדרש (עבור רמות השיא γH2AX 30 דקות עד 1 שעה, 1 שעה בדוגמה זו).
- לשטוף את התאים פעמיים עם קר PBS על ידי צנטריפוגה ו resuspend ב PBS טריים.
- לוותר על 100-150 μL ההשעיה התא לתוך משפך כל cytospin ספין ב 500 סל"ד במשך 5 דקות.
- הפרד את השקופיות cytospins ולאפשר לתאים אוויר יבש בינוני למשך כ 15 דקות.
אל תתנו תאים יבשים לחלוטין כמו מורפולוגיה הסלולר עלול להתפורר.
- צייר עיגול סביב התאים עם עט הידרופובי.
- תקן תאים עם paraformaldehyde 4% במשך 5 דקות בטמפרטורת החדר (RT).
מניסיוננו, קיבוע עם paraformaldehyde עדיפה על תיקון עם אתנול או מתנול. תאים השעיה דורשים קיבוע במשך 5 דקות ב RT בעוד פעמים קיבעון יותר (15 עד 20 דקות) יש צורך קיבעון אופטימלי של תאים חסיד.
אנו מוצאים כי מיד מכתים מניבה תוצאות טובות יותר מאשר לאחסן את השקופיות קבוע ב -20 ° C, אשר בדרך כלל התוצאות הקרינה רקע גבוה.
- לשטוף את התאים פעמיים עם PBS במשך 5 דקות כל אחד.
- Permeabilize התאים עם 0.1% Triton X-100 ב RT במשך 5 דקות.
בהשוואה Tween-80 אנחנו בדרך כלל רואים טוב יותר אותות בתאי permeabilized עם טריטון X-100. בהתאם לסוג תא זה עשוי להיות נחוץ כדי לשנות את זמן permeabilisation. לדוגמה, K562 תאים permeabilization במשך 5 דקות ב RT מספיק ואילו בתאים חסיד permeabilization 15 דקות נדרש.
- שטפו תאים שלוש פעמים עם PBS במשך 5 דקות כל אחד.
- בלוק תאים BSA 1% למשך דקה 30 (3 x 10 דקות) ב RT.
החוקרים השוו את היעילות באמצעות חסימת בסרום (הנגזרות מאותו המין כמו נוגדנים משני) ו בסרום שור אלבומין PBS. BSA היה יעיל יותר לצמצום אי - מחייב של נוגדנים ספציפיים משנית לעומת בסרום. השווינו פעמים חסימה שונות, לילה חוסמים בשעה 4 ° C לעומת 3 x 10 דקות ו - 3 x 20 צעדים חסימת דקות בטמפרטורת החדר, וקבע כי חסימת עבור 3 x 10 דקות היה אופטימלי.
- הוסף 50 μL של הנוגדן הראשוני (1: 500 בדילול של 1% BSA) על כל שקופית.
דגירה עם נוגדן ראשוני ב RT במשך 60 דקות התוצאות מכתים רקע מופחת לעומת הדגירה לילה בשעה 4 ° C.
- כדי להכתים סמנים שונים בו זמנית להשתמש נוגדנים וגדל מינים שונים (לדוגמא אנטי γH2AX ו הארנב עכבר אנטי מפוגל H3K4 בדוגמה זו).
- דגירה עם נוגדנים העיקרי עבור 90 דקות RT על פלטפורמת נדנדה ב 250 סל"ד.
Incubations כל מבוצעות שוקת מכתים humidified.
- שטפו תאים שלוש פעמים עם PBS במשך 5 דקות כל אחד.
- הוסף 50 μL של (1: 1000 מדולל BSA 1%) נוגדנים משני כל שקופית.
כדי כתם על סמנים שונים בשקופית אותו להשתמש נוגדנים משני עם דמינים ifferent סגוליות (על פי הנוגדן הראשוני) ואת פליטת הקרינה באורך גל (למשל אנטי עכבר Alexa 488 (ירוק) ואנטי ארנב Alexa-546 (אדום) בדוגמה זו).
- דגירה תאים עבור 60 דקות RT על פלטפורמת נדנדה ב 250 סל"ד.
מומלץ דגירה התאים בתא חשוך ולח, כדי למנוע דהייה וייבוש של נוגדן המשני.
- שטפו תאים שלוש פעמים עם PBS במשך 5 דקות כל אחד.
- הוסף 50 μL של (1:500 מדולל PBS) TOPRO-3 כדי שקופית.
- לשטוף שקופיות עם PBS במשך 5 דקות 3X.
- הסר לחות עודפת משקופיות ולהוסיף אנטי לדעוך פתרון.
מומלץ לא לייבש התאים לחלוטין לפני הוספת אנטי לדעוך פתרון.
- Coverslip, חותם עם לכה מסמר לעזוב שקופיות לילה בחושך בטמפרטורת החדר.
מומלץ להשתמש coverslips ספציפי confocal # 1.5 (0.16-19 מיקרון עבה) ו לק ברור.
בעוד הנחת coverslip בשקופית, יש להיזהר כדי למנוע היווצרות של בועות אוויר.
תמונה הרכישה
- מיקרוסקופ LSM510 Zeiss Meta Confocal משמש לרכוש תמונות באמצעות ה-GFP רגיל (ירוק, 488 ננומטר), PI (אדום 543 ננומטר) לייזרים אדום רחוק (כחול 633 ננומטר).
תמונות שנרכשו באמצעות מיקרוסקופ confocal לחשוף ברזולוציה מרחבית טובה יותר.
מאז בגודל של γH2AX מוקדי עשוי להיות נמוך מ -0.5 μicrons, מומלץ לרכוש תמונות עם לפחות בגודל 0.5 μicron צעד לאורך ציר Z-.
63 טבילה x שמן העדשה המטרה היא המועדפת לעומת הגדלה או גבוה או נמוך יותר. עבור תאים הדמיה רבים עבור מוקדי לספור עדיף להשתמש במהירות סריקה של 8 וגודל תמונה של 1024 x 1024 פיקסלים. כדי להמחיש את הקשר המרחבי בין חלבונים שונים גרעיני מומלץ להשתמש מהירות סריקה של 6 עם גודל תמונה של 2048 x 2048 פיקסלים.
כאשר הדמיה של ערוצים מרובים הרכישה סריקה קו מומלץ לעומת סריקה מסגרת. זה ימנע הלבנת רזולוציה גבוהה יותר מושגת. סריקה סדרתית משמש כדי למנוע דימום דרך בין ערוצים.
מוקדים לספור
ניתוח תמונה והספירה מוקדים יכול להתבצע באמצעות חבילות תוכנה שונות (inlcuding Metamorph, Image-J ו Imaris). נוהל ספירת מוקדים באמצעות Metamorph מתואר כאן.
- פתח γH2AX ערימות התמונה ישירות מתפריט קובץ או באמצעות האפשרות לבנות מספר ערימות.
- עבור תהליך התפריט ובחרו חשבון מחסנית.
- בחרו הקרנה מקסימלי ובחר את המטוסים להיכלל ולחץ על אישור.
- שמור את התמונה והתוצאה כמו Tiff γH2AX. קובץ ופתח את TOPRO-3 (כחול) התמונה.
- עבור אזורים לבחור כלי ציור האזור לצייר אזורים סביב גרעינים.
- לחץ על התמונה Tiff γH2AX ועבור אל תפריט תהליך ובחר מסננים מורפולוגיים.
- בחרו Top-Hat ובחר תמונה γH2AX כתמונת המקור.
- החל Top-Hat לסנן התמונה המתקבלת תהיה תמונה בינארית עם פחות רעש וגם וריאציה מופחתת בעוצמה מוקדים.
יש להקפיד בבחירת Top-Hat ערכים. ערכים אופטימליים ניתן להשיג על ידי השוואה ויזואלית של תמונות לפני ואחרי החלת מסננים.
- עבור אל תפריט תהליך ובחר תמונה הסף.
- בחר סף כולל ובחר את ערכי הסף נמוך יותר.
זה בדרך כלל ערכי הסף המשפיעים מספר מוקדים. לכן, נדרשת תשומת לב רבה בעת בחירת ערכי הסף. זו יכולה להיות מושגת הטובה ביותר במספר מוקדים לספור באמצעות ערכי סף שונים בתאים שנחשפו נמוך מ 2 Gy של קרינה γ ולאחר מכן השווה מספרים מוקדים עם ספירה ידנית (לפי העין). ערך הסף האופטימלי הוא זה ממזער את הכללת הרקע למקסימום הכללת מוקדים.
- בחר את התמונה TOPRO-3 ועבור אל תפריט האזורים ובחר באפשרות העברת אזורים. בחר את מקור התמונה כפי TOPRPO-3 ו - היעד כפי-Top Hat ולחץ על אישור.
- ברגע האזורים הגרעין מועברים תמונה Top-Hat ללכת לתפריט למדוד ולבחור Morphometry ניתוח משולב.
- ב מוקפץ מקור לבחור חלון תמונה Hat-Top ולמדוד לפי אזור.
- בחר למדוד כל האזורים ולחץ על אמצעי כדי להשיג את מספר מוקדים בכל גרעינים המקביל תמונה Top-Hat.
- המספרים מוקדים מאזור זה ניתן לייצא לתוך קובץ MS-Excel באמצעות האפשרות יומן נתונים.
3Dשחזור של תמונות
כדי ליצור תמונת 3D מתוך ערימה באמצעות Metamorph:
- עבור אל תפריט מחסנית ולבחור מחדש 3D.
- בחר את זווית הסיבוב (למשל 160 °, 320 °).
- בחר את סוג השיקום 3D-מקסימלית.
- בחרו את המטוס של הסיבוב (אופקי או אנכי).
- בחרו את המרחק Z-כיול.
עדיף להשתמש המשתמש שצוין Z-מרחק (האופטימלי הוא 0.5 μicrons).
- בחרו אישור כדי ליצור שחזור 3D.
הקו ניתוח לסרוק
ניתוח קו סריקה באמצעות Metamorph:
- פתח או תמונה מטוס בודד או קובץ מוערמים.
- עבור הפקודה כלי למדוד ברים לבחור סריקה וניתוח קו.
- צייר קו על פני התא הזה באופן אוטומטי לחשוף את עוצמת הקרינה במרחק של סמן אחד לאורך הנתיב של הקו.
כדי להבהיר את היחס המרחבי של הכרומטין סמנים שונים, למשל, γH2AX מוקדים ו מתילציה היסטון, עדיף לצייר קווים אשר תוחלת אזורים כי הן צפופים ועניים סמנים אלה.
נציג נתונים
לצורך הפגנה זו השתמשנו נוגדנים γH2AX מוקדים כדי H3K4me, כדי להעריך את הפריסה המרחבית של DSBs כדי הקובע epigenetic של פעיל לתעתוק euchromatin. כפי שמוצג בתרשים 1, בעקבות הקרנה עם 2Gy, נוצר γH2AX מוקדים בעיקר באזורים שהיו משעמם עבור מכתים הן H3K4me ועל ה-DNA כתם TOPRO-3 (אזורים בהירים DNA מוכתם מעידים על heterochromatin).
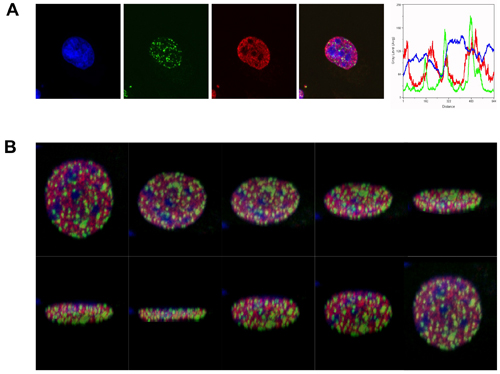
באיור 1. ΓH2AX מוקדים טופס בעיקר euchromatin בתגובה לקרינה מייננת. (א) ויזואליזציה של immunofluorescence γH2AX מוקדים (ירוק) ב K562 תאים אנושיים erythroleukemic, 1 שעה לאחר ההקרנה-γ (2 Gy). γH2AX מוקדים מוצגים ביחס H3K4me, המייצג באופן פעיל לתעתוק euchromatin (אדום). DNA הוא תווית עם TOPRO-3 (כחול). התמונה הממוזגת (כחול, אדום וירוק) מדגים את הדרה γH2AX מוקדים מאזורים heterochromatic. קו סריקה וניתוח (לעומת עוצמת הקרינה למרחק) מציין את ההפצה היחסית של סמנים במטוס אחד. (ב) פרוסות על המטוסים שונה לשחזור 3D של התמונה הממוזג שתוארו לעיל.
Disclosures
Acknowledgements
התמיכה של המכון האוסטרלי גרעיני מדע והנדסה הוא הודה. TCK היה זכה בפרסים AINSE. המעבדה לרפואה epigenomic נתמכת הבריאות הלאומי המועצה למחקר רפואי של אוסטרליה (566,559). עבודה זו ממומנת על ידי ה-CRC עבור ביו הדמיה ופיתוח בע"מ, הוקמה ונתמכת תחת מרכזי שיתופית של ממשלת אוסטרליה מחקר (CRC) בתוכנית. LM נתמך על ידי מלבורן מחקר (אוניברסיטת מלבורן) ו ביו הדמיה מלגות CRC משלים. התמיכה של מונש Micro Imaging (ד"ר סטיבן קודי ואת היתר קרמייקל) היה שלא יסולא בפז עבור עבודה זו.
Materials
| Name | Company | Catalog Number | Comments | |
| Roswell Park Memorial Institute -1640 (RPMI-1640) | Growth medium | Invitrogen | 22400071 | RPMI-1640, pH 7.4 medium supplemented with 10% (v/v) fetal bovine, 2mM L-glutamine, 20μg/ml gentamicin, 20mM (HEPES) N-2-Hydroxyethylpiperazine-N’-2-Ethanesulfonic Acid |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F2442 | ||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7906 | BSA (1%) is used to block any non-specific antibody binding. Primary and secondary antibodies are diluted in BSA. | |
| PBS (without Ca2+ and Mg2+) | Invitrogen | 17-517Q | ||
| Trypan blue | Sigma-Aldrich | T6146 | Used to distinguish between live and dead cells. | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | Triton X-100 (0.1%) used to permeabilise cells. |
| Paraformaldehyde | Reagent | Sigma-Aldrich | 158127 | Paraformaldehyde (4%) used to fix cells. |
| Mouse monoclonal anti-phospho histone-H2AX antibody | Primary Antibody | EMD Millipore | 16193 | Dilution of primary antibody (1:500), in 1% BSA. |
| HistoneH3 (Mono-methyl K4) | Primary Antibody | Abcam | AB8895 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) | Secondary Antibody | Invitrogen | 11029 | Dilution of secondary antibody (1:500), in 1% BSA. |
| Alexa Fluor 546 goat anti-rabbit IgG (H+L) | Secondary Antibody | Invitrogen | 11035 | |
| TOPRO3 | DNA Stain | Invitrogen | T3605 | TOPRO3 is a DNA dye with an Abs/Em of 642/661 nm. DAPI could be used if the confocal microscope is equipped with a 405 nm laser. |
| ProLong Gold | Anti-fade solution | Invitrogen | P36930 | This glycerol based mounting medium must be used with an oil based lense that matches its refractive index. |
| Polylysine slides | Menzel-Glaser | |||
| Coverslips (22x50mm) | Coverslips | Menzel-Glaser | CS2250100 | |
| Tissue Culture Flask, Vented Cap | Culture Flask | BD Biosciences | 353112 | |
| Shandon Cytospin 4 | Thermo Fisher Scientific, Inc. | |||
| Cytofunnels | Shandon, Inc. | |||
| Filter Cards | Shandon, Inc. | 353025 | ||
| Coplin Jar, glass | Grale Scientific P/L | 1771-OG | ||
| Staining Trough | Grale Scientific P/L | V1991.99 | ||
| PAP Pen | Zymed Laboratories, Inc. | 008877 | ||
| Gammacell 1000 Elite Irradiator | Gamma Irradiator | Nordion International Inc. | ||
| Zeiss LSM 510 Meta Confocal | Confocal Microscope | Equipped with 3 lasers: 488 nm, 543 nm and 633 nm. | ||
| Metamorph | Software for Imaging analysis | Molecular Devices |
References
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J Cell Biol. 146 (5), 905-916 (1999).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Bonner, W. M. . Nat Rev Cancer. 8 (12), 957-967 (2008).
- Dickey, J. S. H2AX: functional roles and potential applications. Chromosoma. 118 (6), 683-692 (2009).
- Kim, J. A., Kruhlak, M., Dotiwala, F., Nussenzweig, A., Haber, J. E. Heterochromatin is refractory to gamma-H2AX modification in yeast and mammals. J Cell Biol. 178 (2), 209-218 (2007).
- Cowell, I. G. gammaH2AX foci form preferentially in euchromatin after ionising-radiation. PLoS One. 2 (10), e1057-e1057 (2007).
- Kinner, A., Wu, W., Staudt, C., &, I. l. i. a. k. i. s., G, . Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Res. 36 (17), 5678-5694 (2008).
- Vasireddy, R. S., Karagiannis, T. C., El-Osta, A. gamma-radiation-induced gammaH2AX formation occurs preferentially in actively transcribing euchromatic loci. Cell Mol Life Sci. 67 (2), 291-294 (2010).
- Goodarzi, A. A. ATM signaling facilitates repair of DNA double-strand breaks associated with heterochromatin. Mol Cell. 31 (2), 167-177 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved