Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation de la distribution spatiale des rayonnements ionisants suivantes γH2AX
Dans cet article
Résumé
L'analyse microscopique des γH2AX foyers, qui forment la suite de la phosphorylation de H2AX à Ser-139, en réponse à l'ADN des cassures double brin, est devenu un outil précieux dans la radiobiologie. Ici nous avons utilisé un anticorps mono-méthylé histone H3 lysine à 4 comme un marqueur épigénétique de la transcription euchromatine active, afin d'évaluer la distribution spatiale du rayonnement induit par la formation γH2AX au sein du noyau.
Résumé
Une réponse précoce moléculaires de l'ADN double-brin (CDB) est la phosphorylation de la Ser-139 résidus dans le motif de SQEY terminale de l'histone H2AX 1,2. Cette phosphorylation de H2AX est médiée par la phosphatidyl-inosito 3-kinase (PI3K) famille de protéines, de l'ataxie télangiectasie muté (ATM), sous-unité kinase ADN-protéines catalytiques et ATM et RAD3 liés (ATR) 3. La forme phosphorylée de H2AX, dénommé γH2AX, se répand dans les régions adjacentes de la chromatine sur le site de l'ORD, formant des foyers distincts, qui sont facilement visualisés par microscopie à 3 immunofluorecence. Analyse et quantification de γH2AX foyers a été largement utilisé pour évaluer la formation et la réparation ORD, en particulier en réponse aux rayonnements ionisants et pour évaluer l'efficacité de rayonnement différents composés et modifiant composés cytotoxiques 4.
Compte tenu de la spécificité et la sensibilité exquise de ce marqueur de novo de CDB, il a fourni de nouvelles perspectives dans le processus d'endommagement de l'ADN et la réparation dans le contexte de la chromatine. Par exemple, en radiobiologie le paradigme central est que l'ADN nucléaire est la cible critique à l'égard de la sensibilité aux rayonnements. En effet, le consensus général dans le domaine a été largement pour voir la chromatine comme un modèle homogène pour dommages à l'ADN et la réparation. Cependant, avec l'utilisation de γH2AX comme marqueur moléculaire de la CDB, une disparité dans γ-irradiation formation γH2AX foyers dans l'euchromatine et l'hétérochromatine a été observé 5-7. Récemment, nous avons utilisé un panel d'anticorps mono-, di-ou tri-méthylé histone H3 lysine 9 au (H3K9me1, H3K9me2, H3K9me3), qui sont empreintes épigénétiques de l'hétérochromatine constitutive et le silencing transcriptionnel et lysine 4 (H3K4me1, H3K4me2, H3K4me3 ), qui sont étroitement corrélées activement transcrire régions euchromatiques, pour étudier la distribution spatiale des rayonnements ionisants γH2AX suivantes 8. En conformité avec les idées dominantes sur la biologie de la chromatine, nos résultats montrent une corrélation étroite entre la formation et la transcription γH2AX actif 9. Ici nous démontrons notre méthode d'immunofluorescence pour la détection et la quantification des γH2AX foyers dans des cellules non adhérentes, avec un accent particulier sur la co-localisation avec d'autres marqueurs épigénétiques, analyse d'image et de modélisation 3D.
Protocole
Préparation de cellules
- Homme érythroleucémique K562 cellules sont cultivées dans du RPMI-1640 supplémenté avec 10% (v / v) de sérum bovin foetal et 20 mg / ml de gentamicine dans une atmosphère humidifiée 2 à 5% l'environnement à 37 ° C.
- Environ 18 heures avant la coloration des cellules en croissance exponentielle laver (optimale à 5 x 10 5 cellules / ml) avec un tampon phosphate salin (PBS), remettre en suspension dans un milieu frais et retour à 37 ° C, 5% de CO 2.
- Laver les cellules deux fois avec du PBS par centrifugation à environ 1500 rpm pendant 5 minutes et remettre en suspension dans un milieu frais.
- Compter les cellules et d'ajuster la densité cellulaire d'environ 5 x 10 5 cellules / ml.
Les cellules peuvent être comptés, soit par une méthode automatisée (par exemple, ou de Sysmex Coulter avec la taille de filtre entre 5 à 20 microns) ou en utilisant la méthode d'exclusion au bleu trypan et un hémocytomètre. Nombre excessif de cellules (> 800 cellules / cm 2) peut conduire à la non-uniforme coloration.
Irradiation et immunofluorescence
- Assemblez des clips cytospin, cartes de filtre et de diapositives avec un étiquetage approprié.
Lors du montage de l'appareil cytospin s'assurer que le trou dans la carte du filtre coïncide avec l'entonnoir.
- Exposer les cellules soit γ-irradiation ou les rayons X (2GY dans cet exemple).
Pour prévenir la formation de foyers pendant l'irradiation, maintenir les cellules sur la glace pendant 5 à 10 minutes avant et pendant l'irradiation.
Après l'irradiation incuber les cellules à 37 ° C, 5% de CO 2 pendant le temps nécessaire (pour des niveaux de pointe de 30 γH2AX minutes à 1 heure, 1 heure dans cet exemple).
- Laver les cellules deux fois avec du PBS froid par centrifugation et remettre en suspension dans du PBS frais.
- Distribuer 100 à 150 pi de la suspension cellulaire dans chaque entonnoir cytospin et de spin à 500 rpm pendant 5 minutes.
- Séparez les diapositives de cytospins et permettre aux cellules de modérément air sec pendant environ 15 minutes.
Ne laissez pas sécher complètement les cellules de morphologie cellulaire peut se désintégrer.
- Tracez un cercle autour des cellules avec un stylo hydrophobe.
- Fixer les cellules avec du paraformaldéhyde 4% pendant 5 minutes à température ambiante (TA).
Dans notre expérience, la fixation au paraformaldéhyde est supérieure à la fixation avec de l'éthanol ou de méthanol. Les cellules en suspension nécessitent une fixation pendant 5 minutes à température ambiante alors que les temps de fixation plus long (15 à 20 minutes) sont nécessaires pour une fixation optimale des cellules adhérentes.
Nous trouvons que la coloration des rendements immédiatement de meilleurs résultats que le stockage des lames fixées à -20 ° C, ce qui aboutit généralement à la fluorescence de fond élevé.
- Laver les cellules deux fois avec du PBS pendant 5 minutes chacune.
- Perméabiliser les cellules avec 0,1% de Triton-X 100 à TA pendant 5 minutes.
Comparé à Tween-80, nous observons généralement de meilleurs signaux dans les cellules perméabilisées avec du Triton X-100. Selon le type de cellule, il peut être nécessaire de changer l'heure de perméabilisation. Par exemple, dans les cellules K562 perméabilisation pendant 5 minutes à température ambiante est suffisante alors que dans des cellules adhérentes une perméabilisation 15 minutes est nécessaire.
- Laver les cellules trois fois avec du PBS pendant 5 minutes chacune.
- Bloc cellules dans 1% de BSA pendant 30 minutes (3 x 10 minutes) à température ambiante.
Nous avons comparé l'efficacité bloquant en utilisant le sérum (provenant de la même espèce que l'anticorps secondaire) et l'albumine sérique bovine dans du PBS. BSA a été plus efficace pour réduire au minimum la liaison non spécifique de l'anticorps secondaire par rapport au sérum. Nous avons comparé les différents temps de blocage, le blocage nuit à 4 ° C par rapport à 3 x 10 minutes et 3 x 20 minutes étapes bloquant à la température ambiante, et a déterminé que le blocage de 3 x 10 minutes a été optimale.
- Ajouter 50 ul d'anticorps primaire (1: 500 dilué dans 1% de BSA) à chaque diapositive.
L'incubation avec l'anticorps primaire à température ambiante pendant 60 minutes dans les résultats de la coloration de fond réduite par rapport à une nuit d'incubation à 4 ° C.
- Pour tache différents marqueurs simultanément utiliser des anticorps dirigés dans différentes espèces (souris par exemple les anti-γH2AX et de lapin anti-méthylé H3K4 dans cet exemple).
- Incuber avec des anticorps primaires pendant 90 minutes à température ambiante sur une plateforme à bascule à 250 rpm.
Toutes les incubations sont effectuées dans une auge coloration humidifié.
- Laver les cellules trois fois avec du PBS pendant 5 minutes chacune.
- Ajouter 50 uL d'(1: 1000 dilué dans 1% de BSA) anticorps secondaire à chaque diapositive.
Pour les taches pour différents marqueurs sur la même lame utiliser des anticorps secondaires avec dspécificité d'espèce DIFFÉRENTES (selon l'anticorps primaire) et la fluorescence d'onde d'émission (par exemple anti-souris Alexa 488 (vert) et anti-lapin Alexa-546 (rouge) dans cet exemple).
- Incuber les cellules pendant 60 minutes à température ambiante sur une plateforme à bascule à 250 rpm.
Il est recommandé d'incuber les cellules dans une chambre noire humide pour éviter la décoloration et le séchage de l'anticorps secondaire.
- Laver les cellules trois fois avec du PBS pendant 5 minutes chacune.
- Ajouter 50 uL d'(1:500 dilué dans du PBS) TOPRO-3 à chaque diapositive.
- Laver les lames avec du PBS pendant 5 minutes 3X.
- Retirer l'excès d'humidité à partir de diapositives et ajouter anti-fade solution.
Il est recommandé de ne pas sécher complètement avant d'ajouter les cellules anti-fade solution.
- Lamelle, sceller avec du vernis à ongles et laissez glisse la nuit dans l'obscurité à température ambiante.
Il est recommandé d'utiliser des lamelles spécifiques confocale # 1.5 (de 0,16 à 19 microns d'épaisseur) et vernis à ongles transparent.
En plaçant la lamelle sur la lame, les soins devraient être prises pour éviter la formation de bulles d'air.
L'acquisition des images
- Un microscope confocal Zeiss LSM510 Meta est utilisé pour acquérir des images en utilisant le standard GFP (green, 488 nm), PI (rouge 543 nm) et les lasers rouge lointain (bleu 633 nm).
Les images acquises en utilisant un microscope confocal révèle une meilleure résolution spatiale.
Comme la taille des foyers γH2AX peut être inférieure à 0,5 μicrons, il est recommandé d'acquérir des images avec au moins une taille de 0,5 μicron étape le long de l'axe Z..
A 63 l'huile d'immersion x objectif est préférée par rapport à un grossissement soit supérieur ou inférieur. Pour les cellules d'imagerie pour de nombreux foyers comptant, il est préférable d'utiliser une vitesse de balayage de 8 et taille d'image de 1024 x 1024 pixels. Pour illustrer la relation spatiale entre différentes protéines nucléaires, il est recommandé d'utiliser une vitesse de balayage de 6 avec taille d'image de 2048 x 2048 pixels.
Lorsque l'imagerie par de multiples canaux d'une acquisition scanner en ligne est recommandé par rapport à un balayage de trame. Cela évite de blanchiment et de meilleure résolution est obtenue. Balayage séquentiel est utilisé pour prévenir saigner à travers entre les canaux.
Le comptage des foyers
L'analyse d'image et de compter les foyers peuvent être effectuées en utilisant divers logiciels (inlcuding Metamorph, Image-J et Imaris). La procédure pour le comptage des foyers utilisant Metamorph est décrite ici.
- Ouvrez piles d'images γH2AX soit directement à partir du menu fichier ou en utilisant le numéro de build piles option.
- Aller dans le processus de menu et choisit l'arithmétique de la pile.
- Choisissez la projection maximale et sélectionnez les avions à inclure et cliquez sur OK.
- Enregistrer l'image résultante comme un Tiff γH2AX. fichier et ouvrez le TOPRO-3 (bleu) de l'image.
- Aller vers les régions et de sélectionner un outil de dessin région et d'élaborer les régions autour de noyaux.
- Cliquez sur l'image Tiff γH2AX et aller au menu de processus et de sélectionner des filtres morphologiques.
- Chose Top-Hat et sélectionnez l'image que γH2AX une image source.
- Appliquer Top-Hat filtre et l'image résultante sera une image binaire avec moins de bruit et de la variation d'intensité réduite dans les foyers.
Des précautions doivent être prises au moment de choisir Top-Hat valeurs. Les valeurs optimales peuvent être obtenues par comparaison visuelle des images avant et après l'application de filtres.
- Allez dans le menu et sélectionner l'image processus de seuil.
- Choisissez le seuil inclusif et sélectionner les valeurs de seuil inférieur et supérieur.
Il est généralement les valeurs de seuil qui affectent plusieurs foyers. Par conséquent, une grande attention est requise lors de la sélection des valeurs de seuil. Ce peut être mieux assuré par le nombre des foyers comptant en utilisant différents seuils dans les cellules exposées à la baisse de 2 Gy de rayonnement γ-, puis de comparer le nombre des foyers avec comptage manuel (par œil). La valeur du seuil optimal est celui qui minimise l'inclusion de fond et maximiser l'intégration des foyers.
- Sélectionnez l'image TOPRO-3 et allez dans le menu des régions et sélectionnez l'option de transfert de régions. Sélectionnez l'image source que TOPRPO-3 et la destination comme Top-Hat et cliquez sur OK.
- Une fois les régions nucléaires sont transférées à l'image chapeau allez dans le menu de mesurer et sélectionnez Analyse morphométrie intégré.
- Dans la fenêtre pop-up de sélection de source d'image-Top-Hat et de mesurer par zone.
- Sélectionnez la mesure de toutes les régions et cliquez sur mesure pour obtenir le nombre des foyers dans l'ensemble des noyaux correspondant dans l'image Haut-Hat.
- Le nombre des foyers de chaque région peut être exporté dans un fichier MS-Excel en utilisant l'option log-données.
3Dreconstruction d'images
Pour créer une image 3D à partir d'une pile utilisant Metamorph:
- Allez dans le menu et choisissez pile de reconstruction 3D.
- Sélectionnez l'angle de rotation (par exemple 160 °, 320 °).
- Sélectionnez la reconstruction 3D de type maximum.
- Choisissez le plan de rotation (horizontale ou verticale).
- Choisissez la distance Z-étalonnage.
Il est préférable d'utiliser l'utilisateur spécifié Z-distance (optimal est de 0,5 μicrons).
- Choisissez OK pour créer une reconstruction 3D.
Ligne de balayage d'analyse
Pour l'analyse de scan en ligne en utilisant Metamorph:
- Ouvrez soit une image plane unique ou d'un fichier empilés.
- Allez à la commande de mesure outil de bars et de sélectionner l'analyse scan en ligne.
- Tracez une ligne sur la cellule et cela va automatiquement révéler l'intensité de fluorescence et de la distance de chaque marqueur sur le chemin de la ligne.
Pour élucider les relations spatiales de marqueurs chromatine différentes, par exemple, γH2AX foyers et la méthylation des histones, il est préférable de tracer des lignes qui couvrent les régions qui sont à la fois dense et pauvre en ces marqueurs.
Les données représentant
Aux fins de cette démonstration, nous avons utilisé des anticorps contre γH2AX foyers et à H3K4me, pour évaluer la distribution spatiale des CDB à un déterminant épigénétique de la transcription activement euchromatine. Comme le montre la figure 1, après irradiation avec 2GY, γH2AX foyers formés principalement dans les régions qui ont été ternes pour les deux taches H3K4me et pour le colorant ADN TOPRO-3 (vive les régions d'ADN tachés sont indicatifs de l'hétérochromatine).
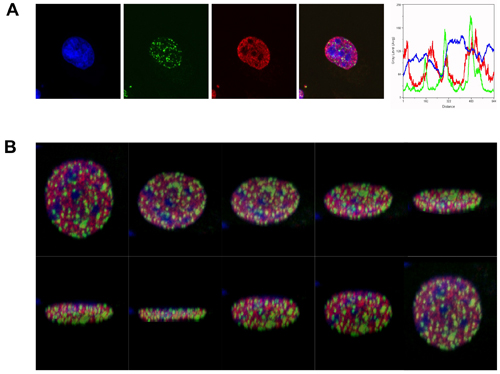
Figure 1. ΓH2AX foyers à prédominance dans l'euchromatine, en réponse aux radiations ionisantes. (A) de visualisation par immunofluorescence de γH2AX foyers (en vert) chez l'homme érythroleucémique K562, 1 heure après γ-irradiation (2 Gy). γH2AX foyers sont indiquées par rapport à H3K4me, représentant activement transcrire euchromatine (rouge). L'ADN est étiqueté avec TOPRO-3 (bleu). L'image fusionnée (bleu, rouge et vert) montre l'exclusion γH2AX foyers de régions hétérochromatiques. L'analyse de balayage de ligne (fluorescence à distance vs intensité) indique la répartition relative des marqueurs dans un seul plan. (B) Tranches à des plans différents de la reconstruction 3D de l'image fusionnée décrit ci-dessus.
Déclarations de divulgation
Remerciements
Le soutien de l'Institut australien des sciences et techniques nucléaires est reconnu. TCK a été récipiendaire du prix AINSE. Laboratoire de médecine épigénomique est soutenu par la National Health and Medical Research Council de l'Australie (566 559). Ce travail est financé par le CRC d'Imagerie Biomédicale Development Ltd, établie et soutenue dans les centres du gouvernement australien s de Recherche Coopérative (CRC). LM est soutenue par la recherche de Melbourne (Université de Melbourne) et biomédicale bourses d'imagerie complémentaires CRC. Le soutien de Monash Micro Imaging (Drs Stephen Cody et Iska Carmichael) a été inestimable pour ce travail.
matériels
| Name | Company | Catalog Number | Comments | |
| Roswell Park Memorial Institute -1640 (RPMI-1640) | Growth medium | Invitrogen | 22400071 | RPMI-1640, pH 7.4 medium supplemented with 10% (v/v) fetal bovine, 2mM L-glutamine, 20μg/ml gentamicin, 20mM (HEPES) N-2-Hydroxyethylpiperazine-N’-2-Ethanesulfonic Acid |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F2442 | ||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7906 | BSA (1%) is used to block any non-specific antibody binding. Primary and secondary antibodies are diluted in BSA. | |
| PBS (without Ca2+ and Mg2+) | Invitrogen | 17-517Q | ||
| Trypan blue | Sigma-Aldrich | T6146 | Used to distinguish between live and dead cells. | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | Triton X-100 (0.1%) used to permeabilise cells. |
| Paraformaldehyde | Reagent | Sigma-Aldrich | 158127 | Paraformaldehyde (4%) used to fix cells. |
| Mouse monoclonal anti-phospho histone-H2AX antibody | Primary Antibody | EMD Millipore | 16193 | Dilution of primary antibody (1:500), in 1% BSA. |
| HistoneH3 (Mono-methyl K4) | Primary Antibody | Abcam | AB8895 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) | Secondary Antibody | Invitrogen | 11029 | Dilution of secondary antibody (1:500), in 1% BSA. |
| Alexa Fluor 546 goat anti-rabbit IgG (H+L) | Secondary Antibody | Invitrogen | 11035 | |
| TOPRO3 | DNA Stain | Invitrogen | T3605 | TOPRO3 is a DNA dye with an Abs/Em of 642/661 nm. DAPI could be used if the confocal microscope is equipped with a 405 nm laser. |
| ProLong Gold | Anti-fade solution | Invitrogen | P36930 | This glycerol based mounting medium must be used with an oil based lense that matches its refractive index. |
| Polylysine slides | Menzel-Glaser | |||
| Coverslips (22x50mm) | Coverslips | Menzel-Glaser | CS2250100 | |
| Tissue Culture Flask, Vented Cap | Culture Flask | BD Biosciences | 353112 | |
| Shandon Cytospin 4 | Thermo Fisher Scientific, Inc. | |||
| Cytofunnels | Shandon, Inc. | |||
| Filter Cards | Shandon, Inc. | 353025 | ||
| Coplin Jar, glass | Grale Scientific P/L | 1771-OG | ||
| Staining Trough | Grale Scientific P/L | V1991.99 | ||
| PAP Pen | Zymed Laboratories, Inc. | 008877 | ||
| Gammacell 1000 Elite Irradiator | Gamma Irradiator | Nordion International Inc. | ||
| Zeiss LSM 510 Meta Confocal | Confocal Microscope | Equipped with 3 lasers: 488 nm, 543 nm and 633 nm. | ||
| Metamorph | Software for Imaging analysis | Molecular Devices |
Références
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J Cell Biol. 146 (5), 905-916 (1999).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Bonner, W. M. . Nat Rev Cancer. 8 (12), 957-967 (2008).
- Dickey, J. S. H2AX: functional roles and potential applications. Chromosoma. 118 (6), 683-692 (2009).
- Kim, J. A., Kruhlak, M., Dotiwala, F., Nussenzweig, A., Haber, J. E. Heterochromatin is refractory to gamma-H2AX modification in yeast and mammals. J Cell Biol. 178 (2), 209-218 (2007).
- Cowell, I. G. gammaH2AX foci form preferentially in euchromatin after ionising-radiation. PLoS One. 2 (10), e1057-e1057 (2007).
- Kinner, A., Wu, W., Staudt, C., &, I. l. i. a. k. i. s., G, . Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Res. 36 (17), 5678-5694 (2008).
- Vasireddy, R. S., Karagiannis, T. C., El-Osta, A. gamma-radiation-induced gammaH2AX formation occurs preferentially in actively transcribing euchromatic loci. Cell Mol Life Sci. 67 (2), 291-294 (2010).
- Goodarzi, A. A. ATM signaling facilitates repair of DNA double-strand breaks associated with heterochromatin. Mol Cell. 31 (2), 167-177 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon