Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Auswertung der räumlichen Verteilung der γH2AX folgenden ionisierender Strahlung
In diesem Artikel
Zusammenfassung
Die mikroskopische Analyse von γH2AX Herde, die im Anschluss an die Phosphorylierung von H2AX an Ser-139 in Reaktion auf DNA-Doppelstrangbrüche zu bilden, hat sich zu einem wertvollen Werkzeug in der Strahlenbiologie. Hier haben wir ein Antikörper gegen mono-methylierte Histon H3 an Lysin 4 als epigenetische Marker aktiv Transkription Euchromatin, um die räumliche Verteilung der Strahlung induzierten γH2AX Bildung innerhalb des Zellkerns zu bewerten.
Zusammenfassung
Eine frühe molekulare Reaktion auf DNA-Doppelstrangbrüche (DSB) ist die Phosphorylierung des Ser-139-Rest innerhalb der Terminal SQEY Motiv des Histon H2AX 1,2. Diese Phosphorylierung von H2AX wird durch die Phosphatidyl-inosito-3-Kinase (PI3K)-Familie von Proteinen, Ataxie Teleangiektasien mutiert (ATM), DNA-Protein-Kinase-katalytischen Untereinheit und ATM und Rad3-bezogene (ATR) 3 vermittelt. Die phosphorylierte Form von H2AX, die so genannte γH2AX, breitet sich auf benachbarte Regionen des Chromatins von der Website des DSB bilden diskrete Herde, die leicht visualisiert immunofluorecence Mikroskopie 3 sind. Analyse und Quantifizierung von γH2AX Herden wurde in großem Umfang verwendet werden, um DSB Bildung und Reparatur, insbesondere als Reaktion auf ionisierende Strahlung und zur Bewertung der Wirksamkeit verschiedener Strahlung modifizierende Verbindungen und zytotoxischen Verbindungen 4 bewerten.
Angesichts der exquisiten Spezifität und Sensitivität dieser de novo Marker DSBs, hat sie neue Einblicke in die Prozesse der DNA-Schädigung und Reparatur im Rahmen von Chromatin zur Verfügung gestellt. Zum Beispiel in der Strahlenbiologie das zentrale Paradigma ist, dass die Kern-DNA der kritischen Ziel in Bezug auf die Strahlenempfindlichkeit ist. In der Tat hat der allgemeine Konsens im Bereich weitgehend an das Chromatin als eine homogene Vorlage für DNA-Schäden und Reparatur zu sehen. Allerdings hat mit dem Einsatz von γH2AX als molekulare Marker für DSBs, eine Ungleichheit in γ-Bestrahlung induzierten γH2AX Foci-Bildung in Euchromatin und Heterochromatin beobachtet worden 5-7. Kürzlich haben wir eine Gruppe von Antikörpern, entweder mono-, di-oder tri-methyliert Histon H3 an Lysin 9 (H3K9me1, H3K9me2, H3K9me3), die epigenetischen Prägungen der konstitutiven Heterochromatin und transkriptionellen Silencing und Lysin 4 (H3K4me1, H3K4me2, H3K4me3 sind ), die eng korreliert aktiv Transkription euchromatischen Regionen, um die räumliche Verteilung der γH2AX folgenden ionisierender Strahlung 8 zu untersuchen. In Übereinstimmung mit der herrschenden Vorstellungen über Chromatin Biologie, angegeben unsere Ergebnisse eine enge Korrelation zwischen γH2AX Bildung und aktive Transkription 9. Hier zeigen wir unsere Immunfluoreszenz Verfahren zur Detektion und Quantifizierung von γH2AX Brennpunkte in nicht-haftenden Zellen mit einem besonderen Fokus auf Co-Lokalisation mit anderen epigenetischen Markierungen, Bildanalyse und 3D-Modellierung.
Protokoll
Zellpräparation
- Menschliche erythroleukämische K562-Zellen werden in RPMI-1640 Medium mit 10% (v / v) fötalem Rinderserum und 20 mg / ml Gentamicin in einem befeuchteten 5% CO 2-Umgebung bei 37 ° C ergänzt gewachsen
- Etwa 18 Stunden vor dem Färben waschen exponentiell wachsenden Zellen (optimal bei 5 x 10 5 Zellen / ml) mit Phosphat-gepufferter Kochsalzlösung (PBS), in frischen Medien und zurück auf 37 resuspendieren ° C, 5% CO 2.
- Waschen Sie die Zellen zweimal mit PBS durch Zentrifugation bei etwa 1500 rpm für 5 Minuten und resuspendieren in frisches Medium.
- Zählen von Zellen und stellen Sie die Zelldichte auf ca. 5 x 10 5 Zellen / ml.
Die Zellen können entweder durch ein automatisiertes Verfahren (z. B. Sysmex oder Coulter Counter mit Filter der Größe zwischen 5 bis 20 Mikron) oder mit dem Trypanblau-Ausschluss-Verfahren und eine Hämocytometer gezählt werden. Überschüssiges Anzahl der Zellen (> 800 Zellen / cm 2) kann zu ungleichmäßigen Färbung führen.
Bestrahlung und Immunfluoreszenzfärbung
- Montieren Zytospin Clips, Filter-Karten und Folien mit entsprechenden Kennzeichnung.
Bei der Montage der Zytospin Gerät sicherzustellen, dass das Loch im Filter-Karte mit dem Trichter fällt.
- Expose Zellen entweder γ-Strahlung oder Röntgenstrahlung (2Gy in diesem Beispiel).
Um zu verhindern, die Bildung von Schwerpunkten bei der Bestrahlung, um die Zellen auf Eis für 5 bis 10 Minuten vor und während der Bestrahlung.
Nach der Bestrahlung inkubiert die Zellen bei 37 ° C, 5% CO 2 für die erforderliche Zeit (Für Spitzenwerte γH2AX Ebenen 30 Minuten bis 1 Stunde, 1 Stunde in diesem Beispiel).
- Waschen Sie die Zellen zweimal mit kaltem PBS durch Zentrifugation und Resuspension in frischem PBS.
- Dispense 100 bis 150 ul der Zellsuspension in jedes Zytospin Trichter und drehen sich mit 500 Umdrehungen pro Minute für 5 Minuten.
- Trennen Sie die Folien aus Cytospins und damit die Zellen bis mäßig Luft für ca. 15 Minuten trocknen lassen.
Lassen Sie sich nicht Zellen vollständig trocken wie Zellmorphologie kann zerfallen.
- Zeichne einen Kreis um die Zellen mit einem hydrophoben Stift.
- Fix-Zellen mit 4% Paraformaldehyd für 5 Minuten bei Raumtemperatur (RT).
In unserer Erfahrung ist Fixierung mit Paraformaldehyd überlegen Fixierung mit Ethanol oder Methanol. Suspensionszellen erfordern Fixierung für 5 Minuten bei RT während längere Fixierung Zeiten (15 bis 20 Minuten) für eine optimale Fixierung der adhärenten Zellen benötigt werden.
Wir finden, dass Färbung sofort bessere Ergebnisse als das Speichern der festen Objektträger bei -20 ° C in der Regel ergibt sich eine hohe Hintergrundfluoreszenz.
- Waschen Sie die Zellen zweimal mit PBS für jeweils 5 Minuten.
- Permeabilisieren die Zellen mit 0,1% Triton-X 100 bei RT für 5 Minuten.
Im Vergleich zu Tween-80 haben wir in der Regel zu beobachten bessere Signale in Zellen mit Triton-X 100 permeabilisiert. Je nach Zelltyp kann es erforderlich sein, um die Permeabilisierung der Zeit ändern. Zum Beispiel in K562-Zellen Permeabilisierung für 5 Minuten bei RT ist ausreichend, während in adhärenten Zellen eine 15-minütige Permeabilisierung ist nicht erforderlich.
- Wash Zellen dreimal mit PBS für jeweils 5 Minuten.
- Block-Zellen in 1% BSA für 30 Minuten (3 x 10 Minuten) bei RT.
Wir verglichen die Sperrwirkung mit Serum (abgeleitet von derselben Art wie der Sekundärantikörper) und Rinderserumalbumin in PBS. BSA wurde effizienter zu minimieren unspezifische Bindung der sekundären Antikörper im Vergleich zu Serum. Wir verglichen verschiedene Sperrzeiten, über Nacht blockiert bei 4 ° C bis 3 gegenüber x 10 Minuten und 3 x 20 Minuten blockiert Schritte bei Raumtemperatur und bestimmt, dass die Blockierung für 3 x 10 Minuten optimal.
- Dann werden 50 ul der primäre Antikörper (1: 500 in 1% BSA verdünnt) zu jedem Dia.
Inkubation mit primärem Antikörper bei RT für 60 Minuten führt zu einer verringerten Hintergrundfärbung zu einer Inkubation über Nacht bei 4 ° C im Vergleich
- Um Flecken verschiedene Marker gleichzeitig nutzen Antikörper in verschiedenen Spezies (zB Maus-Anti-γH2AX und Kaninchen-Anti-methylierte H3K4 in diesem Beispiel) angehoben.
- Inkubieren mit primären Antikörpern für 90 Minuten bei RT auf einem Schaukelstuhl Plattform mit 250 UpM.
Alle Inkubationen werden in einem befeuchteten Färbetrog durchgeführt.
- Wash Zellen dreimal mit PBS für jeweils 5 Minuten.
- Add 50 ul (1: 1000 in 1% BSA verdünnt) sekundäre Antikörper zu jeder Folie.
Um Flecken für verschiedene Markierungen auf der gleichen Folie verwenden Sekundärantikörper mit dUNTERSCHIEDLICHE Speziesspezifität (nach dem primären Antikörper) und Fluoreszenz-Emissionswellenlänge (z. B. Anti-Maus-Alexa 488 (grün) und Anti-Kaninchen Alexa-546 (rot) in diesem Beispiel).
- Inkubieren Zellen für 60 Minuten bei RT auf einem Schüttler bei 250 rpm Plattform.
Es wird empfohlen, um Zellen in einem dunklen feuchten Kammer zu vermeiden, Ausbleichen und Austrocknen der sekundären Antikörper inkubiert.
- Wash Zellen dreimal mit PBS für jeweils 5 Minuten.
- Add 50 ul (1:500 verdünnt in PBS) TOPRO-3 zu jeder Folie.
- Waschen Sie die Objektträger mit PBS 3x 5 Minuten.
- Entfernen Sie überschüssige Feuchtigkeit aus Dias und fügen Anti-Fade-Lösung.
Es wird empfohlen, nicht auf Zellen vollständig, bevor Sie Anti-Fade-Lösung trocknen.
- Deckglas, Dichtung mit Nagellack und lassen Sie gleitet über Nacht im Dunkeln bei Raumtemperatur.
Es wird empfohlen, konfokale spezifischen Deckgläser # 1.5 (0,16-19 Mikrometer dick) und klaren Nagellack verwenden.
Beim Einsetzen der Deckglas auf dem Objektträger, sollte darauf geachtet werden, um die Bildung von Luftblasen zu vermeiden.
Bildaufnahme
- Ein Zeiss LSM510 Meta Konfokalmikroskop wird verwendet, um Bilder mit dem Standard-GFP (grün, 488 nm), PI (rot 543 nm) und weit rot (blau 633 nm) Laser erwerben.
Bilder aufgenommen mit einem konfokalen Mikroskop offenbaren bessere räumliche Auflösung.
Da die Größe der γH2AX Brennpunkten kann niedriger sein als 0,5 μicrons, empfiehlt es sich, Bilder mit mindestens einer 0,5 μicron Schrittweite entlang der Z-Achse zu erwerben.
Ein 63 x Ölimmersionsobjektiv Objektiv ist im Vergleich zu entweder höher oder niedriger Vergrößerung bevorzugt. Für die Bildgebung viele Zellen für Brennpunkte Zählen ist es besser, eine Scan-Geschwindigkeit von 8 und Bildgröße von 1024 x 1024 Pixel verwenden. Zur Veranschaulichung der räumlichen Beziehung zwischen den verschiedenen nukleären Proteine empfiehlt es sich, eine Scan-Geschwindigkeit von 6 mit Bildgröße von 2048 x 2048 Pixel verwendet wird.
Bei der Abbildung von mehreren Kanälen einer Zeilenkamera Akquisition ist im Vergleich zu einem Frame-Scan empfohlen. Dadurch wird vermieden, Bleichen und eine bessere Auflösung erreicht wird. Sequential Scan wird verwendet, um das Durchschlagen zwischen den Kanälen zu verhindern.
Foci Zählen
Bildanalyse und Schwerpunkte Zählen kann mit verschiedenen Software-Paketen (inlcuding Metamorph, Image-J und Imaris) werden. Das Verfahren für die Herden zu zählen mit Metamorph ist hier beschrieben.
- Öffnen γH2AX Bildstapeln entweder direkt aus dem Datei-Menü oder indem Sie die Build-Nummer Stacks Option.
- Gehen Sie zum Menü-Prozess und wählte Stack Arithmetik.
- Wählen Sie Maximale Projektion und wählen Sie die Ebenen einbezogen werden und klicken Sie auf OK.
- Speichern Sie die resultierende Bild als γH2AX Tiff. Datei und öffnen Sie die TOPRO-3 (blau) Bild.
- Zum Regionen und wählen Sie eine Region Zeichnung und zeichnen Regionen rund um Kernen.
- Klicken Sie auf γH2AX Tiff Bild und gehen Sie auf Prozess-Menü und wählen morphologische Filter.
- Wählen Sie Top-Hat und wählen γH2AX Bild als Quelle Bild.
- Bewerben Top-Hat-Filter und die daraus resultierende Bild wird ein binäres Bild mit weniger Rauschen und weniger Variation in Herden Intensität.
Es sollte darauf geachtet bei der Auswahl Top-Hat-Werte sein. Optimale Werte können durch visuellen Vergleich der Bilder vor und nach der Anwendung von Filtern erzielt werden.
- Zum Prozess-Menü und wählen Schwelle Bild.
- Wählen inclusive Schwelle, und wählen Sie den niedrigeren und höheren Schwellenwerten.
Es ist in der Regel die Schwellenwerte, die Brennpunkte Zahl beeinflussen. Daher ist viel Aufmerksamkeit erforderlich, wenn Sie Schwellenwerte. Dies kann am besten durch das Zählen Brennpunkte Nummer mit unterschiedlichen Schwellenwerten in Zellen, die weniger als 2 Gy γ-Strahlung erreicht werden und dann vergleichen Brennpunkte Zahlen mit manuellen Zählung (nach Augenmaß). Der optimale Schwellenwert ist derjenige, der die Einbeziehung der Hintergrund minimiert und maximiert die Einbeziehung der Brennpunkte.
- Wählen Sie die TOPRO-3 Bild und gehen Sie zu den Regionen Menü und wählen Sie den Transfer Regionen Option. Wählen Sie das Quellbild als TOPRPO-3 und das Ziel als Top-Hat und klicken Sie auf OK.
- Sobald die nukleare Regionen sind die Top-Hat Bild übertragen gehen Sie zu der Maßnahme Menü und wählen Sie Integrierte Morphometrie Analysis.
- In dem Popup-Fenster wählen Sie Quellbild-Top-Hat und messen durch die Gegend.
- Wählen Sie messen alle Regionen und klicken Sie auf Maßnahme, um die Brennpunkte Zahl in allen entsprechenden Kerne in den Top-Hat Bild zu erhalten.
- Die Schwerpunkte Zahlen aus jeder Region in eine MS-Excel-Datei mit der Log-Daten-Option exportiert werden.
3DRekonstruktion von Bildern
So erstellen Sie ein 3D-Bild von einem Stapel mit Metamorph:
- Gehen Sie auf die Stack-Menü und wählen Sie 3D-Rekonstruktion.
- Wählen Sie den Drehwinkel (zB 160 °, 320 °).
- Wählen Sie die 3D-Rekonstruktion Typ-Maximum.
- Wählen Sie die Ebene der Drehung (horizontal oder vertikal).
- Wählen Sie die Z-Kalibrierung zu erreichen.
Es ist besser, den Benutzer angegebenen Z-Abstand verwenden (optimal ist 0,5 μicrons).
- Wählen Sie OK, um eine 3D-Rekonstruktion zu schaffen.
Line-Scan-Analyse
Für Line-Scan-Analyse mit Metamorph:
- Öffnen Sie entweder eine einzelne Ebene Bild oder ein gestapeltes Datei.
- Zum messen Symbolleisten Befehl und wählen Sie Line-Scan-Analyse.
- Zeichnen Sie eine Linie quer über die Zelle und diese wird automatisch zeigen die Fluoreszenz-Intensität und Entfernung der einzelnen Marker auf dem Weg der Linie.
Zur Aufklärung der räumlichen Beziehung von verschiedenen Chromatin Marker, zum Beispiel γH2AX Brennpunkte und Histon-Methylierung, ist es vorzuziehen, Linien, die Regionen, die sowohl dicht und arm in dieser Marker sind span ziehen.
Repräsentative Daten
Für den Zweck dieser Demonstration verwendeten wir Antikörper gegen γH2AX Brennpunkte und H3K4me, um die räumliche Verteilung der DSBs eines epigenetischen Determinante aktiv Transkription Euchromatin zu bewerten. Wie in Abbildung 1 dargestellt, nach Bestrahlung mit 2Gy, gebildet γH2AX Schwerpunkte vor allem in Regionen, die langweilig für beide H3K4me Färbung und für die DNA-Färbung TOPRO-3 (hell gefärbten DNA-Regionen sind bezeichnend für Heterochromatin) wurden.
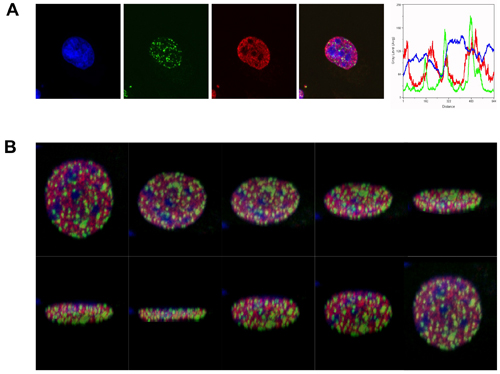
Abbildung 1. ΓH2AX Schwerpunkte bilden überwiegend in Euchromatin in Reaktion auf ionisierende Strahlung. (A) Immunfluoreszenz Visualisierung von γH2AX Brennpunkte (grün) in der menschlichen erythroleukämische K562-Zellen, 1 Stunde nach γ-Bestrahlung (2 Gy). γH2AX Schwerpunkte sind in Bezug auf H3K4me gezeigt, was aktive Transkription Euchromatin (rot). DNA wird mit TOPRO-3 (blau) gekennzeichnet. Das fusionierte Bild (blau, rot und grün) zeigt den Ausschluss γH2AX Foci aus heterochromatischen Regionen. Das Line-Scan-Analyse (Fluoreszenz-Intensität vs Distanz) zeigt die relative Verteilung der Marker in einer einzigen Ebene. (B) Scheiben in verschiedenen Ebenen von der 3D-Rekonstruktion des fusionierten Bild oben beschrieben.
Offenlegungen
Danksagungen
Die Unterstützung des Australian Institute of Nuclear Science and Engineering anerkannt wird. TCK war der Empfänger der AINSE Auszeichnungen. Epigenomischen Medicine Lab wird von der National Health and Medical Research Council of Australia (566559) unterstützt. Diese Arbeit wird durch die CRC for Biomedical Imaging Development Ltd finanziert, errichtet und unterstützt unter der australischen Regierung s Cooperative Research Centres (CRC)-Programm. LM wird von Melbourne Research (University of Melbourne) und Biomedical Imaging CRC zusätzliche Stipendien unterstützt. Die Unterstützung der Monash Micro Imaging (Drs. Stephen Cody und Iska Carmichael) war von unschätzbarem Wert für diese Arbeit.
Materialien
| Name | Company | Catalog Number | Comments | |
| Roswell Park Memorial Institute -1640 (RPMI-1640) | Growth medium | Invitrogen | 22400071 | RPMI-1640, pH 7.4 medium supplemented with 10% (v/v) fetal bovine, 2mM L-glutamine, 20μg/ml gentamicin, 20mM (HEPES) N-2-Hydroxyethylpiperazine-N’-2-Ethanesulfonic Acid |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F2442 | ||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7906 | BSA (1%) is used to block any non-specific antibody binding. Primary and secondary antibodies are diluted in BSA. | |
| PBS (without Ca2+ and Mg2+) | Invitrogen | 17-517Q | ||
| Trypan blue | Sigma-Aldrich | T6146 | Used to distinguish between live and dead cells. | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | Triton X-100 (0.1%) used to permeabilise cells. |
| Paraformaldehyde | Reagent | Sigma-Aldrich | 158127 | Paraformaldehyde (4%) used to fix cells. |
| Mouse monoclonal anti-phospho histone-H2AX antibody | Primary Antibody | EMD Millipore | 16193 | Dilution of primary antibody (1:500), in 1% BSA. |
| HistoneH3 (Mono-methyl K4) | Primary Antibody | Abcam | AB8895 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) | Secondary Antibody | Invitrogen | 11029 | Dilution of secondary antibody (1:500), in 1% BSA. |
| Alexa Fluor 546 goat anti-rabbit IgG (H+L) | Secondary Antibody | Invitrogen | 11035 | |
| TOPRO3 | DNA Stain | Invitrogen | T3605 | TOPRO3 is a DNA dye with an Abs/Em of 642/661 nm. DAPI could be used if the confocal microscope is equipped with a 405 nm laser. |
| ProLong Gold | Anti-fade solution | Invitrogen | P36930 | This glycerol based mounting medium must be used with an oil based lense that matches its refractive index. |
| Polylysine slides | Menzel-Glaser | |||
| Coverslips (22x50mm) | Coverslips | Menzel-Glaser | CS2250100 | |
| Tissue Culture Flask, Vented Cap | Culture Flask | BD Biosciences | 353112 | |
| Shandon Cytospin 4 | Thermo Fisher Scientific, Inc. | |||
| Cytofunnels | Shandon, Inc. | |||
| Filter Cards | Shandon, Inc. | 353025 | ||
| Coplin Jar, glass | Grale Scientific P/L | 1771-OG | ||
| Staining Trough | Grale Scientific P/L | V1991.99 | ||
| PAP Pen | Zymed Laboratories, Inc. | 008877 | ||
| Gammacell 1000 Elite Irradiator | Gamma Irradiator | Nordion International Inc. | ||
| Zeiss LSM 510 Meta Confocal | Confocal Microscope | Equipped with 3 lasers: 488 nm, 543 nm and 633 nm. | ||
| Metamorph | Software for Imaging analysis | Molecular Devices |
Referenzen
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J Cell Biol. 146 (5), 905-916 (1999).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Bonner, W. M. . Nat Rev Cancer. 8 (12), 957-967 (2008).
- Dickey, J. S. H2AX: functional roles and potential applications. Chromosoma. 118 (6), 683-692 (2009).
- Kim, J. A., Kruhlak, M., Dotiwala, F., Nussenzweig, A., Haber, J. E. Heterochromatin is refractory to gamma-H2AX modification in yeast and mammals. J Cell Biol. 178 (2), 209-218 (2007).
- Cowell, I. G. gammaH2AX foci form preferentially in euchromatin after ionising-radiation. PLoS One. 2 (10), e1057-e1057 (2007).
- Kinner, A., Wu, W., Staudt, C., &, I. l. i. a. k. i. s., G, . Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Res. 36 (17), 5678-5694 (2008).
- Vasireddy, R. S., Karagiannis, T. C., El-Osta, A. gamma-radiation-induced gammaH2AX formation occurs preferentially in actively transcribing euchromatic loci. Cell Mol Life Sci. 67 (2), 291-294 (2010).
- Goodarzi, A. A. ATM signaling facilitates repair of DNA double-strand breaks associated with heterochromatin. Mol Cell. 31 (2), 167-177 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten