Method Article
בידוד של פידליטי גרסאות של וירוסים RNA ו אפיון תדירות המוטציה וירוס
In This Article
Summary
המאמר הנוכחי מתאר את הצעדים הנדרשים כדי לבודד ולאפיין RNA פולימראז גרסאות נאמנות RNA של וירוסים וכיצד להשתמש בתדר נתונים מוטציה כדי לאשר את השינויים נאמנות בתרבית רקמה.
Abstract
וירוסים RNA להשתמש RNA polymerases תלוי רנ"א לשכפל הגנומים שלהם. שיעור גבוה של טעות מהותית של אנזימים אלו הוא תורם גדול לדור של גיוון אוכלוסיה קיצונית המאפשרת הסתגלות ואבולוציה וירוס. הגדלת הראיות עולה כי שיעורי שגיאה מהותית, ועל תדרים מוטציה וכתוצאה מכך, של וירוסים RNA יכול להיות מווסתת על ידי שינויים עדינים חומצת אמינו ל פולימראז נגיפי. למרות מבחני ביוכימי קיימים כמה polymerases נגיפי RNA המאפשרים למדוד כמותית ההתאגדות נאמנות, כאן אנו מתארים שיטה פשוטה למדידת תדרי מוטציה של וירוסים RNA אשר הוכיחה להיות מדויקת ככל גישות ביוכימיות בזיהוי מוטציות נאמנות שינוי. הגישה משתמשת בטכניקות virological וסדר קונבנציונאלי שניתן לבצע במעבדות לביולוגיה ביותר. בהתבסס על הניסיון שלנו עם מספר רב של וירוסים שונים, זיהינו את הצעדים המפתח חייב להיות מותאם כדי להגדיל את הסיכוי של בידוד גרסאות נאמנות להפקת נתונים של מובהקות סטטיסטית. בידוד ואפיון של מוטציות נאמנות שינוי יכול לספק תובנות חדשות על מבנה ותפקוד פולימראז 1-3. יתר על כן, אלה גרסאות נאמנות יכולה להיות כלי שימושי באפיון מנגנונים של הסתגלות ואבולוציה וירוס 4-7.
Protocol
1. קבע את טווח הריכוזים mutagen כי הוא רעיל לתאים מינימלית
המטרה של התרגיל הזה היא לקבוע מה טווח של ריכוזי mutagen ניתן להשתמש במהלך זיהום ללא רעילות לתא העודף. בעיקרו של דבר, אתה רוצה לשחזר את התנאים שידרשו עבור הידבקות בווירוסים. עבור רוב וירוסים, זיהומים האחרון בין 2 ל 7 ימים. הכינו צלחות מספיק תאים מדגם בשעה כל יום. אם לא חסיד תאים משמשים, לשנות את הפרוטוקול בהתאם.
- ביום שלפני הניסוי, זרעי 7 x 10 5 תאים הלה / היטב צלחת 6-גם כי להשיג תת ומחוברות (75%) monolayer יום של הניסוי. גם כל הצלחת יטופלו עם ריכוז שונה של mutagen, המתיר מגוון של 6 ריכוזי.
- ביום הניסוי, להכין דילולים mutagen במדיום בתרבית רקמה. עבור תאים הלה, להשתמש בטווח של 0-1000 מיקרומטר עבור אנלוגים הבסיס (ribavirin, 5-fluorouracil, 5-azacytidine), 0 עד 50 מ"מ עבור MgCl 2, ו -0 עד 5 מ"מ עבור MnCl 2.
- לשאוב את המדיום מהבארות ולהחליף בינוני 2 mutagen-שיושלם מ"ל ולחזור חממה.
- כל 24 שעות, השתמש באחת צלחת של תאים כדי לבדוק כדאיות התא. ניתן להשיג זאת על ידי ביצוע trypan כחול מכתים או באמצעות ממוסחר פלואורסצנציה / הארה מבחני (CellTiter זוהרים למשל של Promega ® Assay זריח כדאיות התא).
- עבור מכתים הדרה כחול trypan, לנתק את התאים מהצלחת אחד (שטופלו בריכוזים שונים של mutagen) בעדינות תאים גלולה על ידי צנטריפוגה.
- מחק תאים supernatant ו resuspend ב PBS (בסרום יכול להפריע מכתים).
- מערבבים 1 נפח תא להשעיה PBS עם נפח של 1 0.4% trypan כחול, דגירה למשך 2 דקות בטמפרטורת החדר.
- ב hemacytometer, לספור את קיימא (בלא כתם) ולא קיימא (כחול מוכתם) תאים. חישוב אחוזי התאים קיימא עבור כל הריכוז של mutagen, כולל שליטה מטופל. אנו מוצאים כי התנאים לגרום למוות פחות מ -50% על ידי תא הקצה זיהום (כאשר titers היותר הם הגיעו) הם אידיאליים עבור בידוד של התנגדות mutagen.
2. קביעת ריכוז אופטימלי שאינו רעיל mutagen כי מתונה מפחית titers וירוס (כ 0.5-2 הפחתה יומן)
תרגיל זה משמש כדי לקבוע את הריכוז של mutagen כי יהיה להפעיל לחץ סלקטיבי חזק, בלי יותר מדי mutagenizing האוכלוסייה. עבור RNA מוטאגנים, אנו מוצאים כי זה מתאים 10.5-2 יומני הפחתות titer וירוס. בריכוזים אלה, כל הגנום עובר מוטציה לפחות אחד או שניים בעמדות. Mutagen עשוי לסייע לדור של מוטציה ההתנגדות, אשר לאחר מכן ניתן יהיה נבחר על המעבר. אם מוטציות רבות מדי הם הציגו (ב ריכוזים גבוהים מאוד mutagen), מוטציות הנושאים את המוטציה התנגדות עצמם יהיו mutagenized קטלנית, הפגיעה הבידוד שלהם.
- זרעים צלחות עם תאים באמצעות באותם תנאים כמו שלב 1
- ביום הניסוי, להכין דילולים mutagen במדיום בתרבית רקמה. השתמש את אותו טווח של ריכוזי כפי שנקבע לעיל, אלא לכלול ריכוזים שהביאו למוות על תא 50%. הכינו מספיק כדי לכסות את כל אמצעי היטב פעמיים (4 מ"ל לכל היטב), המאפשר טיפול מקדים של תאים לפני ההדבקה, עם ריכוז של כל mutagen.
- לשאוב הבינוני pretreat תאים עם mutagen ידי דוגרים במדיום mutagen-בתוספת של 2 שעות. עבור סוגי תאים ביותר, זה מספיק זמן לספיגה של mutagen.
- הסר בינוני להדביק בנגיף את ריבוי הפנים של זיהום נמוך (0.1 או 0.01) בהיקף מינימלי (200 μl של 6 צלחות היטב). דגירה 15-60 דקות, כדי לאפשר הנגיף להדביק תאים. הסלע צלחת במרווחי זמן קבועים על מנת להבטיח כי inoculum מכסה את monolayer התא.
- לשאוב את הנגיף מחוסן ולשטוף פעמיים עם 2 מ"ל PBS כדי להסיר כמה שיותר inoculum ככל האפשר.
- הוסף בינוני עם ריכוזים מתאימים של mutagen זה התאים היטב לדגור על המקבילה של 3-6 מחזורי שכפול.
- קציר וירוס מבאר כל לקבוע את ההשפעה על אנטי וירוס titer. ניתן לעשות זאת על ידי assay פלאק סטנדרטי או הגבלת דילול (TCID 50). הערה: כימות של הנגיף על ידי טכניקות סינתזה רק למדוד RNA עשוי להיות לא מתאים בגלל תופעות מוטגניות לא יזוהו. הגנום Mutagenized המכילות מוטציות קטלניות עדיין עשויים להיות מזוהים על ידי qRT-PCR למשל, אבל לא יהיה שנצפתה מבחני הכדאיות וירוס.
- מתוך titers מחושב, לזהות את הריכוז של mutagen המפחיתה titers וירוס (לעומת הזיהום קבוצת הביקורת) על ידי 10.5-2 יומנים כי הוא גם לא רעילים לתאים (באופן אידיאלי, פחות מ -50% רעילות).
3. בידוד identiמתלקחת של וריאנטים mutagen עמידים
בצע גדול גודל האוכלוסייה קטעים בריכוז אופטימלי mutagen שהוגדרו לעיל ולבדוק titers וירוס מסדרות את המעבר. כמו שליטה, וירוס מעבר במדיום הגידול ללא mutagen כלשהו. כפי בקרה אחר כדי לפקח על הופעתה הפוטנציאל של חלקיקים פגום להתערב (די), לבצע זיהומים טרי והעדר mutagen בכל שלב המעבר (שליטה unpassaged).
- ביום שלפני 25 ס"מ, זרע זיהום 2 צלוחיות עם 1.5 x 10 6 תאים הלה (בגדלים בקבוק אחרים יכולים לשמש) להשיג תת ומחוברות monolayers למחרת.
- ביום הזיהום, pretreat תאים 2 שעות עם מדיום המכיל את הריכוז האופטימלי של כל mutagen, נקבע בסעיף 2.
- הסר בינוני להדביק תאים עם נפח מינימלי בבית 1 של משרד הפנים או משרד הפנים הגדול ביותר שלא לגרום להיווצרות פגום (di) להתערב חלקיק של נגיף הנלמד.
- לאחר 30-60 דקות של זיהום, לשאוב inoculum ולשטוף פעמיים עם PBS, ולאחר מכן להוסיף בינוני טריים בתוספת mutagen בכל הריכוזים המתאימים.
- דגירה עבור פרק הזמן שנקבע בסעיפים 1 ו 2 שמתאים titer וירוס מקסימלית בתנאים האלה. קציר הנגיף הצאצאים.
- Titer וירוס במעבר כל וחזור על 3 השלבים הקודמים.
- במהלך הקטעים הראשונים, titers וירוס של דגימות mutagen שטופלו צריכה לרדת בהתאם, לעומת כייל את הנגיף המקורי הביקורת (ללא טיפול ו unpassaged) titers וירוס. אם titers וירוס של mutagen passaged דגימות לטפס בחזרה לרמות כמו שליטה מטופל, האוכלוסייה סביר מכיל וריאנט עמיד mutagen. עד 20 או 30 מעברים ייתכן שיהיה צורך, למרות שאנחנו מבודדים ביותר של וריאנטים הנאמנות שלנו בין 5 ל -15 קטעים.
- לאחר titers וירוס לסדרת מעבר נתון להגיע גודל זהה titers קבוצת הביקורת, תמצית RNA מכל דגימות כולל שליטה מטופל ממספר קטע אותו. ערכות החילוץ RNA או מיצוי Trizol ניתן להשתמש.
- בצע RT-PCR באמצעות primers כי להגביר את פולימראז או רפליקז הגנים של הנגיף של עניין. בשלב השני, הגנום כולו (לפחות באזורים קידוד) צריך להיות רצף לבחון האם פנוטיפים התנגדות המפה גנים וירוס אחרות. הדבר חשוב במיוחד עבור מוטאגנים בסיס אנלוגי, כגון ribavirin, אשר משפיע על היבטים אחרים של הנגיף ותפקוד התא. במקרה זה גרסה עשוי להיות עמיד בפני אחד מן הפעילויות הללו נגיפים אחרים, לא תהיה גרסה נאמנות.
- לטהר את RT-PCR מוצרים באמצעות ערכת טיהור PCR ורצף כדי להשיג את mutagen עמידים קונצנזוס רצף האוכלוסייה. כלול שולט רקע שגיאה רצף (ראה דיון).
- באמצעות יישור רצף תוכנה רצף קונצנזוס וירוס כהפניה, וליישר את הרצפים. זיהוי מוטציות נקודה חדשה, עם תשומת לב מיוחדת לכל המופיעים באופן בלעדי באוכלוסיית מטופלים mutagen במעבר שבו titers וירוס להגיע לרמות נורמליות. אם מוטציה זו אינה נוכחת קטעים מוקדם ולא נוכח שולטת מטופל ממספר מעבר זהה (המעיד על הסתגלות למעבר תרבית תאים), ואז מוטציה זו אחראית סביר, לפחות בחלקה, להתנגדות mutagen. אל תסמוך על בסיס רצף שנקרא (הגרסה טקסט של רצף) ותוכנה יישור לבד. בדוק את chromatograms עבור פסגות מיעוט שייתכן שלא נענו על ידי תוכנה יישור. מוטציה המייצגים 20-30% מכלל האוכלוסייה ימשיך להראות כמו השיא, אבל קטן מדי כדי להיות מזוהה כ 'N' על ידי ניתוח רצף סטנדרטי.
4. לאחר המוטציה זוהתה, לבודד או ליצור את הגרסה ואשר את הפנוטיפ התנגדות מספר מוטאגנים RNA
בשלב הבא, המציג את הגרסה מוטציה מזוהה מבודד כדי לאשר את זיקתה פנוטיפ את ההתנגדות. זה חיוני כי המוטציה החשודים שינוי נאמנות הוא למד רקע נקי גנטית (כלומר, לא מציגים מוטציות נוספות במקום אחר בגנום). במצב הטוב ביותר, שיבוט cDNA זיהומיות קיים שתאפשר את הדור מלאי של גרסה mutagen עמידים על ידי mutagenesis אתר מכוונת על רקע גנטי נקי. במקרה זה, סעיף 4 אינו הכרחי. עם זאת, אם שיבוט cDNA אינו זמין, בידוד יכול להיעשות על ידי טיהור פלאק של הנגיף, כמתואר להלן. יותר סיבוב אחד של טיהור פלאק ייתכן שיהיה צורך לבודד את וריאנט על רקע נקי גנטית.
- בידוד מוטנטים עמידים mutagen ידי assay פלאק.
- כדי לבודד את מוטציה מזוהה, לבצע assay פלאק תקן תחת agarose (0.5-1% הסופי wt / כרך) שכבת ב 6 גם הצלחות. הכן דילולים סדרתי של הנגיף, מבוסס על titers המניות, כדי דילutions כי יהיה לייצר בין 10 ל 50 מופרדים היטב הפלאק.
- כאשר הפלאק גלויים לעין (בדרך כלל 2 עד 5 ימים שלאחר זיהום, בהתאם לנגיף), לסמן את המיקום של הפלאק על הצלחות באמצעות פיפטה p200 עם קצה המסנן, לצלול בעדינות את קצה באמצעות כיסוי agarose נזהרים שלא לעקור ולהעביר את עמדת כיסוי (אשר תגרום זיהום לחצות של הפלאק בודדים).
- הרם בזהירות את קצה מתוך כיסוי ולהעביר את התקע agarose הכלול קצה אל Eppendorf המכיל 250 μl של בינוניים מערבולת. אל תדאג אם קצה כי הוא הסיר אינו מכיל agarose, עבור רבים וירוסים RNA, פלאק הממוצע רבים וירוסים RNA מכיל 10 5 וירוסים כמות מספקת יועברו פשוט על ידי נגיעה בקצה אל פני השטח של השלט.
- בחר עד 10 הפלאק לכל טיפול mutagen. בהתאם chromatograms של רצף כי זיהו את המוטציה, מעריכים כ איזה אחוז של האוכלוסייה מכיל את המוטציה הרצויה. המטרה היא לבודד שלושה או ארבעה שלטים עם המוטציה. כמה מוטציות אלה גם לשאת נוספים, מוטציות לא רצויות, אשר מאוחר יותר להיות מזוהה על ידי רצף.
- חלץ את RNA דגימות אלה (אך לחסוך מחצית המדגם כדי ליצור מלאי גדול של הנגיף), ולבצע RT-PCRs שתאפשר רצף של הגנום כולו. בממוצע, וירוסים RNA יכיל עד שני הבדלים מוטציוני ביחס רצף קונצנזוס, ולכן רצף 3 או 4 פלאק מטוהרים וירוסים בכל פעם כדי לזהות את לבודד המכיל את המוטציה הרצויה ללא מוטציות נוספות.
- לאחר שזוהו, להכין מלאי גדול של וירוס זה עבור כל המחקרים במורד הזרם, באמצעות מדגם פלאק מטוהרים שהושגו לעיל כדי להדביק בקבוק גדול של תאים, למשל 8x10 6 תאים הלה בבקבוק T75 ..
- אשר את הרגישות mutagen / התנגדות שמעניקה המוטציה מזוהה.
- שימוש לשבט מבודד או שנוצר עתה, וירוס בר לשלוט בסוג מוכן בתנאים דומים, לחזור על ניסויים בסעיף 2 או באמצעות מגוון רחב של ריכוזי mutagen, או הריכוז שבו מוטציה ההתנגדות נוצר.
- השתמש בכמה תנאים שונים RNA מוטגניות (ribavirin, 5-fluorouracil, 5-azacytidine, גדל Mg 2 +, Mn 2 +). אם גרסה פולימראז עמיד סוג אחד או יותר של mutagen, אז זה סביר יותר להניח כי גרסה זו היא באיכות גבוהה. לחילופין, יתכן כי ההתנגדות היא מוטציה ספציפית עבור תנאי מוטגניות יחיד, במיוחד מאז כמה תרכובות אלו משפיעים על וירוסים RNA באמצעות מספר מנגנונים 8.
5. הפידבקים שכפול
מאז נאמנות, שינוי מוטציות לרוב המפה פולימראז, ייתכן כי המוטציה פולימראז אותו יהיה לשנות באופן משמעותי קינטיקה שכפול חשוב לקבוע הדמיון והשוני שכפול אשר יאפשרו השוואה טובה יותר של הבדלי התדרים מוטציה ביצע להלן. כדי לעשות זאת, לבחון שכפול על ידי לפחות שתי גישות מחמיא - אחד בוחן ייצור וירוס נוסף אשר בוחן סינתזה RNA.
- צעד אחד צמיחה וירוס קינטיקה
- ביום שלפני הניסוי, זרעי 6-גם צלחות כנדרש, אחד צלחת לכל נקודת הזמן להיבדק. שקול להשתמש בבארות בשלושה עותקים עבור כל מוטציה לבין סוג וירוס הבר.
- ביום הניסוי, להסיר הבינוני להדביק בארות בווירוס זה בכל הפנים של 10 על מנת להבטיח כי כל תא נגוע בו זמנית. דגירה 30-60 דקות 37 ° C.
- צלחות רוק כל 10 דקות כדי למנוע ייבוש של monolayer התא. הסרת וירוס ולשטוף פעמיים עם 2 מ"ל PBS. חשוב להסיר כמה שיותר inoculum ככל האפשר. החלף בינוני צמיחה.
- בעקבות זיהום בזמן = 0, הקציר וירוס מהצלחת אחד. חזור צלחות החממה הקציר וירוסים במרווחי זמן קבועים כי ההיקף מחזור שכפול אחד (למשל עבור 3h, 5 שעות, 7h, 9h, 12 שעות, 24 שעות).
- וירוס titer, שנקטפו בכל נקודת זמן (פלאק assay למשל, TCID50, assay FFU), וכן גרף את עקומות גדילה של כייל לעומת הזמן.
- קינטיקה של RNA סינתזה
קינטיקה של סינתזת RNA ניתן לנטר באמצעות אחת הגישות המצוין למטה. אם אפשר, דגימות אותו בשימוש כדי לקבוע צעד אחד קינטיקה צמיחה יש להשתמש כדי למדוד את רמות RNA.- qRT-PCR. הליך זה נותן מדדים כמותיים ביותר של שכפול על פני טווח גדול, מתוך עותקים בגנום כמה> 10 10, תלוי ברגישות של assay. עיצוב primers ו בדיקות כי לכסות קטע קטן (<200 נ"ב) של אזור גנומי שמור ביותר.
- צפון ניתוח כתם. למרות כמותי פחות qRT-PCR, בטכניקה זו מאפשר אישור ויזואלי כי התוצאות שכפול באורך מלא הגנום וכי אין סיום שרשרת משמעותית מתרחשת כתוצאה של המוטציה פולימראז.
- הביטוי של הגן הכתב. אם שיבוט cDNA להביע גן הכתב (בלוציפראז למשל) זמין, אז זה עשוי לשמש כתחליף לבדיקת יכולת replicative. עם זאת, נגיף רקומביננטי לא אמור לשמש ליישומים אחרים (כגון קביעת תדירות מוטציה) מאז לחצים בררניים פועל וירוס זה לא יהיה אותו דבר, במיוחד מאז וירוסים אלה יש נטייה למחוק את כתב הגן מוכנס.
6. מוטציה למדוד תדרים
זהו שלב קריטי המאשר כי המוטציה פולימראז מזוהה המקנה עמידות mutagen משנה שכפול נאמנות. חשוב לציין כי המוטציה תדרים נמדד כאן לא שיעורי מוטציה. כדי לקבוע שיעורי, מדידה מאוד זהירים קינטיקה של שכפול (כמות של RNA מסונתז ואורך מחזור שכפול) חייב להיקלט פנימה מדידת תדרים מוטציה עם זאת, כל עוד היסטוריה המעבר קינטיקה שכפול מנוטרים, מספק לשחזור, מדדים כמותיים של שכפול נאמנות. תדרים המוטציה ניתן לקבוע מהם באוכלוסייה וירוס קיימא (פלאק שיבוטים או דילול מגביל) או של האוכלוסייה הכולל וירוס (וירוס או מניות supernatant). כדי לקבוע תדרים מוטציה, להכין במניות מהווירוס מעבר מאוחר יותר (למשל, מעבר 2 או מעבר). חשוב שהאוכלוסייה וירוס יש לו זמן להרחיב את המגוון הגנטי שלו קרוב יותר שיווי משקל מוטציה-מבחר.
- מוטציה תדרים של האוכלוסייה וירוס קיימא
גישה זו, אם כי מייגע יותר, נותן מידע על כמה מוטציות רבות נמצאים על הגנום הממוצע אשר שומרים על יכולת שכפול. יצוין, עם זאת, הטיה עבור גרסאות כושר גבוה תתרחש כושר נמוך יותר, גרסאות קיימא שלא בקלות פלאק, למשל, עשוי לא להיות מזוהה. ככזו, היא מאפשרת גם אמצעים יותר נרדף (DS) ולא נרדף (DN) החלפות נוקלאוטיד כי ניתן להשתמש כדי לחקור אם סלקציה חיובית פועל על האוכלוסייה. עם זאת, בגלל מוטציות יהיו פחות לכימות, מספר גדול יותר של רצפים יהיה צורך לניתוח סטטיסטי. טכניקה זו מתבססת על בידוד של וירוסים בודדים על ידי טיהור או פלאק או דילול מגבילים, כפי שתואר לעיל. כנקודת מוצא, אנו ממליצים על בידוד של 48 "שיבוטים" יחיד של וירוס מסוג בר הגרסה mutagen עמידים. כל האוכלוסייה המשובטים מבודד באופן זה צפוי לשאת כל מוטציה הגנום מייסד שהוצגו. כמות הרנ"א נוכח השלט מבודד או הגבלת דילול גם הוא בדרך כלל די הגברה על ידי RT-PCR. אם יש צורך, הגברה קצר (פחות מאחוז אחד מחזור שכפול) על מספר מינימום של התאים (למשל 24 בפורמט צלחת היטב) ניתן להשתמש כדי להשיג RNA יותר, עם זאת, הגברה מינימום צריכה להתבצע כדי למנוע הצטברות של מוטציות חדשות. שים לב שכל לשבט האוכלוסייה להשוות חייבים לעבור את אותו מספר של מחזורי שכפול.- בודד 24-48 שיבוטים וירוס על ידי טיהור פלאק או דילול מגבילים.
- תמצית RNA של אוכלוסיות מבודדות המשובטים
- RT-PCR להגביר שבר מכסה של עד 3kb עבור כל דגימה. מומלץ לכסות את האזור חלבון מבניים, אשר נוטה לסבול מוטציות קיימא יותר מאשר באזורים שמורים יותר של אי - גנים מבניים.
- לטהר את מוצרי ה-PCR, רצף ולבצע ניתוח מוטציה (סעיף 7).
- מוטציה תדרים של האוכלוסייה הכולל וירוס
למרות יתרון של השיטה השנייה היא שגם גרסאות כושר נמוך ייכללו רצף, המתיר תמונה רחבה יותר של הספקטרום של מוטציות. עם זאת, זה לא יכול להיות אידיאלי עבור ניתוח פילוגנטי כי להניח אוכלוסיות וירוס קיימא (למשל DN / dS ערכים) וזיהוי של המוטציות הרלוונטיות ביותר, שכן שינויים קטלני (שינוי מבנה RNA, קודונים לעצור, דרמטי שינויים חומצת אמינו) לא יכול להיות מזוהה לחלוטין והיה להישמר בניתוח. עם זאת, טכניקה זו מאפשרת לחוקר לקבל את הנתונים הכי משמעותי מבחינה סטטיסטית כדי לאשר שינוי של נאמנות כאשר יש חוסר ב assay במבחנה ביוכימיים. טכניקה זו נשענת על הגברה RT-PCR של רנ"א virion מוחלט, כולל הגנום עם כושר גופני נמוך או מוטציות קטלניות כי לא ייצרו הפלאק. תדרים המוטציה מתקבל על ידי שיטה זו יכולה להיות גבוה פי 10 מאשר על ידי שלט המגביל שיבוט או דילול.- תמצית RNA מן האוכלוסייה הכוללת virion
- RT-PCR ampliפ.י. אזור 800-1200 נוקלאוטיד מחלק של הרצף הגנומי קידוד כי ידוע לסבול יש מוטציות גנטיות שונות (חלבונים מבניים למשל). שברים גדולים לא להכניס בקלות לתוך וקטורים לשיבוט כגון TopoTA ו יהיה לייצר מספרים מספקת של transformants. למרות שברי קטנים יותר הם אפילו טוב יותר, את הכיסוי של הגנום רצף עשוי להיות מעט מדי כדי להשיג מובהקות סטטיסטית. שבר של לפחות 800 נ"ב היתרי כיסוי ברצף עם שני פריימרים ומהווה פשרה טובה בין למקסם את כיסוי רצף ומזעור עלויות ריצוף. אנו מוצאים כי בין 70 ל 100 רצפים מכסה אזור 800 נוקליאוטידים reproducibly מאשרת את נאמנות שינו את גרסאות לנו למד במעבדה. שים לב כי וקטור אחרים / שיטות שיבוט ניתן להשתמש עם יעילות שווה.
- לטהר את המוצר RT-PCR בעזרת ערכת מסחריות או על ידי מיצוי DNA משקעים סטנדרטי /.
- אם RT-PCR אנזימים תשתמש אינם מייצרים המסוכך, לבצע הרחבה 10 דקות על ידי הוספת 1 מיקרומטר ATP ו פולימראז תקי
- TopoTA שיבוט הבאים הוראות היצרן
- עבור כל האוכלוסייה וירוס כדי להיחקר, בחר 96 מושבות, המזוהה כבעל להכניס חיובית על ידי הקרנת כחול / לבן על צלחות מצופה XGal. בתחילה, לבדוק נוכחות של הכנסות עבור כל אזור בגנום שונה להיות משובטים, כדי לאשר את תוקפו של הקרנה כחול / לבן על ידי הקרנת גודל הפלסמיד על agarose ג'לים או מושבת יחיד-PCR. שימוש בגודל שבר והתנאים לעיל, אנו משיגים תוצאות חיוביות 90%
- לגדול כל המושבה במרק נוזלי לילה 1 מ"ל של מדיום LB ב 96 צלחות תרבית החיידקים טוב
- למחרת להכין minipreps בפורמט 96-היטב.
- כל צלחת עם רצף primers מספיק (primers המשמש RT-PCR למשל, או TopoTA primers M13) לקבל כיסוי מרבי של המגזר משובטים. ביצוע ניתוח מוטציה (סעיף 7).
7. רצף ניתוח
בצע ניתוחים רצף באמצעות הפניה או רצף קונצנזוס לכל אוכלוסיית ותוכנה יישור המתאים. אנו ממליצים Lasergene או Sequencher כי יכול בקלות לזהות SNPs ביחס לקונצנזוס.
- יישר את רצפי באמצעות תוכנה מתאימה (למשל Lasergene או Sequencher).
- בטל רצפים באיכות ירודה (קורא בסיס רע, יותר מדי 'N של או קצר מדי אורך). זהה את מגוון נוקלאוטיד שמכוסה על ידי כל הרצפים. מאז אזורים שונים של הגנום יהיה פחות או יותר לסבול מוטציות, מסיבות השוואה זה הכרחי כי אותו אזור מכוסה במלואו על שיבוט כל רצף שמר לניתוח. לכן, אם התגובות ברצף כמה מבוצעות לכל שיבוט, ואחד רצף נכשל עבור שיבוט נתון, לבטל את clone (כל הרצפים) מניתוח.
- זיהוי לספור את SNPs כי הם זן שונה ההתייחסות.
- חשב את תדירות מוטציה על ידי חלוקת סך של SNPs מזוהה על ידי המספר הכולל של רצף נוקלאוטידים (מספר אורך x שיבוטים של האזור רצף). הצגת מספר זה כמספר הממוצע של מוטציות ל 10K nt רצף הופך את המספר יותר ידידותי למשתמש ואז להשאיר אותו כמו לכל נוקלאוטיד. לדוגמה, עבור האוכלוסייה סוג בר בלוח 1, 55 mutations/121, 978 נוקלאוטידים בסך הכל X 10,000 = 4.51 מוטציות לכל 10,000 רצף נוקליאוטידים.
- אם SNP אותו מופיע על מספר רב של שיבוטים, להציג שני ערכים לכלול או לא לכלול אלה מוטציות חוזרות ונשנות. באופן כללי, עבור האוכלוסייה וירוס המופק הורה הומוגנית (פלאק על ידי טיהור או לשכפל זיהומיות) ו passaged רק כמה פעמים תרבית תאים, סלקציה חיובית לא הפעילו את השפעותיו מספיק כדי לגרום הצטברות של SNP זהה את המוטציה ערכי תדר נמדד בדרך זו לשקף טוב יותר את תדירות שגיאה של פולימראז עם אפקטים מינימלי של בחירה חיובית או טיהור.
- קבע את חלוקת מוטציה. ערכו רשימה מדורגת של מספר שיבוטים באוכלוסייה כל כך להציג 0, 1, 2, 3, וכו '.. מוטציות באזור רצף.
- חישוב האוכלוסייה המגוון ויראלי בהשוואה מרחק pairwise. מתוך ניקה רצפים נערך באופן ידני להכין מערך כולל באזור התייחסות. ישנן מספר תוכניות יישור כניסה: ClustalW / X ( http://www.clustal.org/ ), (שריר http://www.drive5.com/muscle/ ), EbioX עבור משתמשי מקינטוש ( http://www. ebioinformatics.org / ebiox / ), וכו 'ודא שכל רצפים שלך הם באותו אורך, לחתוך במידת הצורך. מומלץ להתחיל של רצפי הוא קודון קידוד כדי להקל על ניתוח האחורי. אנו ממליצים לשמור את כל המערכים בפורמט fasta, אשר לקרוא בקלות על ידי רוב התוכנות הזמינות. i> כדי לבצע את הניתוח מרחק pairwise, לחשב את כל ההשוואות pairwise אפשרי בין רצפים של אותה אוכלוסיה. מוטציות ממוצע למצוא השוואות אז יכול להיות מחושב כדי לציין ההטרוגניות באוכלוסייה.
- ערכים עבור נרדף (DS) ולא נרדף (DN) בתוך האוכלוסייה ניתן להשיג בקלות. אנו מוצאים את התוכנה MEGA (http://www.megasoftware.net/) שימושי וידידותי למשתמש עבור סוג זה של ניתוח.
- כדי לקבל כיוון הבחירה שאנו נותנים שתי אפשרויות אם כי הם לא היחידים שאפשר. 1) לקבל את היחס בין ד.נ. ו DS. ערכים גבוהים יותר מ 1 אומר סלקציה חיובית. ערכים נמוכים מ 1 אומר בחירה וטיהור. 2) השתמש בשרת האינטרנט Datamonkey ( http://www.datamonkey.org/ ). טען יישור בתבנית fasta ולנתח אותם עם מודול SLAC. זה ייתן לך אומדן של DN / DS.
- ביצוע ניתוחים סטטיסטיים. בהתאם לכמות הנתונים מספר רצפים, מגוון רחב של בדיקות ניתן להשתמש. מספר מחקרים הסתמכו על בדיקות מרובע צ'י של המספר הכולל של מוטציות לעומת המספר הכולל של נוקלאוטידים הקונצנזוס שבה כל שיבוטים משולבים 9. מחקרים אחרים ביצעו בדיקות המדויק של פישר, מחושב על מספר רצפים המציגים מוטציות לעומת מספר רצפים ללא מוטציה 10. אם הנתונים מוטציוני מספיק שנוצר, אנו ממליצים על ביצוע בדיקת סכום מדורגת כגון מאן ויטני U. לשם כך, דרגה מספר שיבוטים באוכלוסייה כל וירוס לפי מספר מוטציות הנוכחי על כל רצף RNA. ויטני מאן אז יהיה המבחן הבדלים בהתפלגות מוטציה של אוכלוסיות. מסיבה זו, אנו ממליצים על רצף לפחות 800 זוגות בסיסים, כדי להגדיל את הסיכוי למצוא שיבוטים עם מוטציות מרובות. בדיקה זו היא איתנה, אבל דורש גודל מדגם גדול יותר. מצד שני, הוא אינו מחייב את גודל המדגם זהה עבור שתי האוכלוסיות המושווים (למשל, דגימות טבלה 1 הם n = 148 1 ו n 2 = 84).
8. נציג התוצאות:
ההשפעה תלויה במינון של ריכוז mutagen על כדאיות התא ואת הכדאיות וירוס מוצג באיור 1. בדוגמה זו, מצאנו כי מעבר הנגיף AZC 100 מיקרומטר צומצם titer וירוס על ידי ביומן 10.5-2 ממוקד, אך הכדאיות הלה התא לא מושפעת לרעה במהלך 2 ימים נדרש הידבקות בווירוסים. זה ניסוי הפיילוט הובילה הבחירה של ריכוז AZC 100 מיקרומטר למעבר סדרתי של הנגיף, כדי לבחור עבור עמידות mutagen. איור 2 ממחיש את הירידה הראשונית titer, ולאחריו הופעת פנוטיפ התנגדות mutagen. במהלך הקטעים הראשונים mutagen, כמו מוטציות קטלניות לצבור, ירידה משמעותית titers הנגיף מתרחש. בהדרגה, גרסה mutagen עמיד עולה בקנה אחד עם הופעתה חזרה titers וירוס לא שונה שולטת מטופל. בשלב זה, אחוז גדול של האוכלוסייה וירוס מציג את המוטציה התנגדות. רצף של אוכלוסייה זו וירוס מגלה את השינוי חומצת אמינו (ים) אחראי. לאחר שזוהו, ומבודד או שנוצר עתה, הנגיף mutagen עמידים עשויים להיות רגישים פחות פראי סוג שונה RNA מוטאגנים (אנלוגים בסיס של מבנה שונה, למשל). איור 3 מראה mutagen RNA עמיד Coxsackie וירוס B3 כי titers גבוה יותר סוג בר בנוכחות ribavirin, 5-fluorouracil, ו-5-azacytidine ו MgCl גבוה 2 ו MnCl 2. התנגדות רחבה כדי RNA מוטאגנים היא אינדיקציה חזקה של שכפול נאמנות מוגברת. אימות קינטיקה שכפול של הגרסה נאמנות דומה וירוס מסוג בר יסייעו השוואה של תדרים מוטציה. איור 4 מתאר את צעד אחד צמיחה קינטיקה של גרסה באיכות גבוהה לעומת סוג בר. אם שיעורי שכפול titers הסופי אינם דומים, אז צעדים יש לנקוט כדי להשוות אוכלוסיות וירוס גודל דומה, אשר עברו את אותו מספר סיבובים של שכפול. הקשר בין קצב סינתזת רנ"א ונאמנות שכפול לא מאופיין היטב, במיוחד in vivo. קצב שכפול איטי עלול לגרום תדירות מוטציה ירד (נאמנות גבוהה), אם כי זה לא שלטון מוחלט, כפי שמוצג באיור 4. עם הפרמטרים לעיל הוקם, תדרים המוטציה של הגרסה נאמנות אוכלוסיות סוג בר ניתן להשוות לקבל אישור שכפול גנטי של נאמנות משתנה. איור 5 מראה יישור רצף של סוג בר גבוה גרסה נאמנות, עם מוטציות נקודה מזוהה. מוטציות נספרים, דורגה על פי מספר מוטציות לכל שיבוט (לוח 1), כפי שהוא מיוצג תדירות מוטציה ממוצעת האוכלוסייה, לכל 10,000 רצף נוקליאוטידים, איור 6.
s = "jove_content"> 
באיור 1. קביעת תנאים אופטימליים כדי לבחור עבור עמידות mutagen RNA:. ושמירה של כדאיות התא גבוהה עם מתונה (ירידה יומן 1-2 ב titer וירוס) תאים הלה טופלו בריכוזים המצוין של ribavirin ו נגוע בטבע סוג Coxsackie וירוס B3 על הפנים של 0.01. 48 שעות זיהום פוסט, הווירוס הצאצאים היה לקצור titers נקבעו על ידי TCID 50. אחוז התאים ששרדו טיפול 48 שעות, נקבע על ידי מכתים כחול Trypan, מצוין מתחת ציר ה-x. התוצאות מראות כי ריכוז של 100 ו - 200 מיקרומטר להפחית titers וירוס על ידי יומן 1-2, מבלי להשפיע על כדאיות התא.
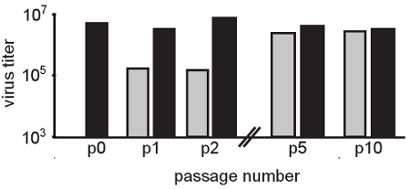
איור 2. מעבר סידורי בנוכחות ריכוזים מתונים של רנ"א מוטאגנים בוחר לאוכלוסיות mutagen עמידים. בנתון זה, Chikungunya וירוס היה passaged בתאים הלה בנוכחות 50 מיקרומטר ribavirin (סרגלים אפורים). קטעים בקרה בוצעו העדר ribavirin (פסים שחורים). אחרי כל קטע, הצאצאים וירוס היה לכמת ידי assay פלאק הקלאסי על תאים BHK. ההשפעה מוטגניות ניכר במהלך המעברים הראשון (P1 ו-P2 לעומת האוכלוסייה החל P0) שבו titers שטופלו על ידי וירוס ירידה יומן 2. בהדרגה, titers לחזור (מטופל) לרמות נורמליות. הבדלים משמעותיים הם נצפו 5 אוכלוסיות מעבר mutagen מטופלים לעומת לא מטופלים, טוען כי וריאנטים עמידים נבחרו. אכן, רצף קונצנזוס של האוכלוסייה זיהו מוטציות ייחודי באוכלוסייה וירוס בטיפול ribavirin.
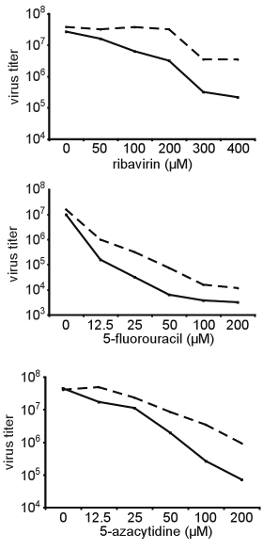
איור 3. אישור התנגדות רחבה RNA מוטאגנים מבנה שונה. המוצג כאן, החלופה הגבוהה נאמנות A372V של Coxsackie וירוס B3 כי בתחילה היה מבודד במסך המתואר בסעיף 3 נוצר מתוך שיבוט זיהומיות נבדק רגישות היחסי לריכוזים שונים של שונה RNA מוטאגנים (ribavirin, 5-fluorouracil, 5-azacytidine). הלה תאים שטופלו בריכוזים המצוין של ribavirin ו נגוע בטבע סוג Coxsackie וירוס B3 על משרד הפנים של 0.01. 48 שעות זיהום פוסט, הווירוס הצאצאים היה לקצור titers נקבעו על ידי TCID 50. המוצגים כאן הם סוג של titers בר (שורות מוצק) ו A372V וריאנט (קווים מקווקווים) כפונקציה של ריכוז mutagen. A372V בעקביות titers גבוה יותר מאשר סוג בר תחת כל התנאים שנבדקו.
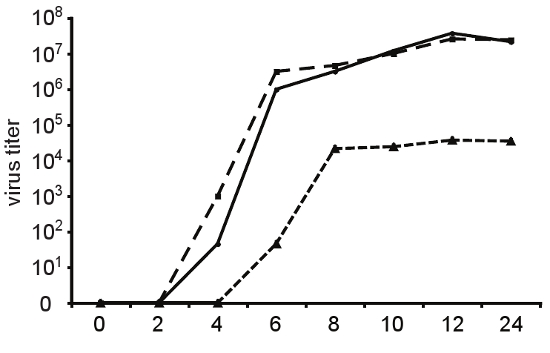
איור 4. שיעורי שכפול וגירסאות נאמנות. כדי לקבוע את צעד אחד קינטיקה הצמיחה של הייצור וירוסים, תאים הלה נדבקו ב משרד הפנים = 10 עם אחד מסוגי בר (קו מוצק), באיכות גבוהה גרסה A372V (מקפים ארוכים) או גרסה שכפול לקוי Cx64 (קצר מקפים) של Coxsackie וירוס B3. בנקודות הזמן שצוין, הצאצאים וירוס היה שנקטפו מן התאים supernatants ידי להפשיר-להקפיא titered ידי TCID 50. הגידול נאמנות של A372V לא עולה בקנה אחד עם פגם שכפול הנצפה בתרבית רקמה. Cx64 גרסה מציג עיכוב משמעותי קינטיקה שכפול ומגיע titers המקסימלי שהם פי 1000 נמוך יותר מאשר סוג הנגיף בטבע.
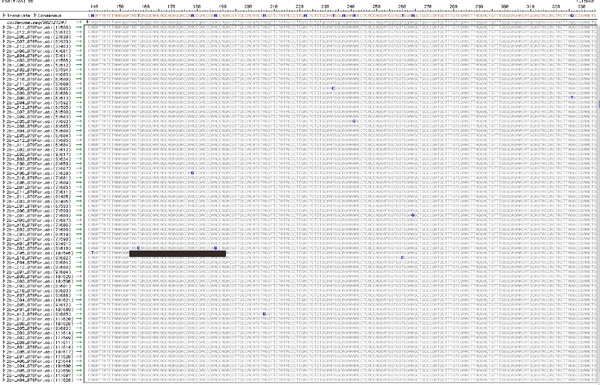
איור 5. המערך של רצפי TopoTA משובטים מהאוכלוסייה כל וירוס. שימוש בגישה המתוארת בסעיף 7, כל רצף המתקבל המוצר RT-PCR משובטים כפי הנראה מקורו הגנום יחיד, ייחודי בתוך אוכלוסיית וירוס הכולל יהיה אפוא, לשאת מוטציות ייחודי. האיור מציג מערך טיפוסי, מעקב נקי של רצפים באיכות ירודה ויזואליזציה של SNPs. SNPs הכולל (10 בנתון זה) בתוך אוכלוסיה נספרים, ומספר SNPs המופיעים שיבוט כל מצוינים. לדוגמה, מודגש על ידי שיבוט בר, מכיל 2 מוטציות ייחודי בעוד 8 שיבוטים אחרים מכילים מוטציה יחידה, ייחודית. מידע זה נמצא בשימוש כדי לקמפל טבלה 1. כדי להציג גרסה גדולה יותר של דמות זו אנא לחץ כאן .
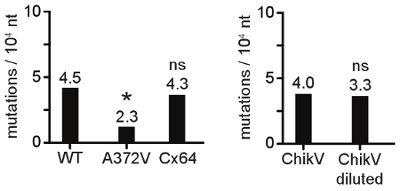
איור 6. ייצוג גרפי של תדרים מוטציה של אוכלוסיות וירוס. לפרשנות קל, הנתונים המספריים המתקבלים רצף ניתוחים סטטיסטיים ניתן לייצג את תרשים או, או היסטוגרמה (ראה כאן). וירוס A372V מייצר פחות מוטציות סוג בר מציג תדירות מוטציה נמוך משמעותית (*, p <0.01). הגרסה Cx64, כי משכפל את titers 1000 פי נמוך יותר מאשר סוג בר, presלהורים תדירות מוטציה זהה (ns, לא משמעותי) המציין מהירות שכפול ונאמנות אינם קשורים בהכרח. באותה Chikungunya וירוס (CHIKV) האוכלוסייה נותן תדרים מוטציה דומה אם המניה וירוס, או דילול של פי 10 5, משמש להפקת RNA.
הפצה מוטציה סיכום עבור ניתוח סטטיסטי.
הערה: כל שיבוט, זה חיוני כי האזור הגנומי זהה (אורך של רצף) מכוסה. במקרה זה, 859 נוקליאוטידים לכל משובט. זה קריטי עבור ניתוחים סטטיסטיים. מצד שני, סכום בדרגת המבחנים המשמשים לניתוח סטטיסטי אינם דורשים את גודל המדגם להיות זהה, החוקר חופשי להשוות אוכלוסיית שונות גודל המדגם. לפיכך, 142 שיבוטים של סוג בר יכול להיות לעומת 84 שיבוטים של A372V.
| # שיבוטים עם מוטציות n | סוג בר | A372V |
| 7 מוטציות | 0 | 0 |
| 6 מוטציות | 0 | 0 |
| 5 מוטציות | 0 | 0 |
| 4 מוטציות | 0 | 0 |
| 3 מוטציות | 1 | 0 |
| 2 מוטציות | 6 | 2 |
| 1 מוטציות | 40 | 14 |
| 0 מוטציות | 95 | 68 |
| סך מוטציות | 55 | 18 |
| שיבוטים סך רצף | 142 | 84 |
| סך רצף נוקליאוטידים | 121978 | 72,156 |
| Mutations/10 4 NT | 4.51 | 2.49 |
טבלה 1. . ההפצה מוטציה סיכום עבור ניתוח סטטיסטי הערה: כל שיבוט, זה חיוני כי האזור הגנומי זהה (אורך של רצף) מכוסה. במקרה זה, 859 נוקליאוטידים לכל משובט. זה קריטי עבור ניתוחים סטטיסטיים. מצד שני, סכום בדרגת המבחנים המשמשים לניתוח סטטיסטי אינם דורשים את גודל המדגם להיות זהה, החוקר חופשי להשוות אוכלוסיית שונות גודל המדגם. לפיכך, 142 שיבוטים של סוג בר יכול להיות לעומת 84 שיבוטים של A372V.
Discussion
בחירת קו התא. היעילות של אנלוגים בסיס כמו רנ"א מוטאגנים בקורלציה עם ספיגת היחסי שלהם על ידי תאים מסוגים שונים 11. אם קו התא המשמש בדרך כלל למעבר הנגיף מוכיחה להיות עקשן mutagen ספיגת או רגיש מדי (רעילות לתא גבוה), ייתכן שיהיה צורך להשתמש עוד קו התא עומד בדרישות אלה ועדיין מתירני כדי שכפול נגיפי. לאחר גרסה התנגדות mutagen מבודד, שאר האפיון יכול להתבצע בקו, מקורי התא המועדף. מניסיוננו, תאים הלה בקלות לקחת את mutagen; תאים BHK לדרוש עד 10 פי ריכוזים גבוהים יותר ותאי Vero הם עקשן ספיגת mutagen.
בחירת mutagen. בניסיון לבודד גרסאות נאמנות על ידי טיפול mutagen, את סיכויי ההצלחה הוא גדל אם יש יותר מסוג אחד של mutagen משמש. מאגר מוטאגנים אנלוגי של מבנה שונה, כי הם שולבו בטעות לתוך הגנום במהלך שכפול יהיה בעיקר לגרום לגרום משנה מסוים של מוטציות מחזורי שכפול הבאים: טיפול ribavirin טובות GtoA ומוטציות CtoU המעבר 12: 5-azacytidine יש הטיה דומה, עם תוספת של CtoG ו transversions GtoC 13: 5-fluorouracil מעדיפים גורם מעברים AtoG ו UtoC 14. לחלופין, ריכוזים גבוהים יותר של Mg 2 + או Mn 2 + ניתן להוסיף עד בינוני, כדי להגביר את תדירות מוטציה הכולל של וירוסים RNA ללא משוא פנים המתואר לעיל 12. בהתאם קודון רצפים של וירוס, ואת השינויים קודון הנדרש כדי לייצר גרסה נאמנות, חלקם של תנאים אלה תעדיף את הופעתה של גרסה זו על פני אחרים. במשך יותר נאמנות poliovirus G64S ו Coxsackie וירוס A372V, טיפול ribavirin נבחר בקלות ביותר עבור גרסאות כי המעבר AtoG נדרש באתר קודון תאמו את המוטציות שנוצרו בעיקר על ידי זה ribavirin.
משרד הפנים לעומת גודל האוכלוסייה. ב וירולוגיה, פרוטוקולים זיהום בתרבית רקמה לשים לב במיוחד ריבוי של זיהום (משרד הפנים), כדי למנוע הצטברות של חלקיקים פגום להתערב (נמוך משרד הפנים), או לקדם רקומבינציה בין וירוסים (גבוה הפנים), עבור דוגמה. כדי לבחור לאירועים הופעתה מעל סדרתי passaging, חשוב גם לשקול את גודל האוכלוסייה וירוס. מאז מוטנטים עמידים בתחילה קיים בתדר נמוך, עדיף להעביר גדולים כמו גודל האוכלוסייה ככל האפשר מעבר אחד למשנהו (10 -10 5 6 וירוסים, למשל) כדי להימנע מאיבוד אלה גרסאות המתעוררים במעבר אחד. דרוג את גודל טוב או בקבוק (מספר תאים נגועים) עשויה לעזור לצמצם את הגידול הפנים אם זה של דאגה. מצד שני, עבור ניסויים שבהם הרגישות של וירוס mutagen נבחנת, זיהום נמוך הפנים מתבצע על מנת להגדיל את מספר מחזורי שכפול המתרחשים הניסוי ולהימנע ההצלה של הגנום mutagenized ידי הגנום כושר גבוה דרך השלמה של שיתוף תאים הנגועים. זה חשוב מכיוון שנוצר על מוטציות בגנום צאצאים במהלך הסיבוב הראשון של שכפול לא יזוהו מיד. רוב אלה RNAs mutagenized עדיין יהיה ארוז לתוך virion. זה בסיבוב הבא של זיהום כי מוטציות קטלניות נוכח הגנומים הללו תגרום מחזור השכפול בוטלה, וצמצום titer וירוס. זה עשוי להיות נחוץ כדי לאפשר כמה סיבובים של הצטברות מוטציות לפני השפעה משמעותית של mutagenesis קטלני הוא ציין. לבסוף, אם על הסדרה מעבר בנוכחות mutagen, titers וירוס ממשיכים לרדת עד הכחדה, אז החוקר צריך לנסות passaging וירוס בהדרגה כמויות mutagen (החל בריכוז נמוך מאוד).
בידוד של הדור המשובט RNA mutagen עמידים מן האוכלוסייה RNA mutagen עמידים. מוטאגנים RNA להציג מוטציות אקראיות מרובים כל הגנום, אבל הבחירה בהתנגדות רק להעשיר (לתקן את רצף קונצנזוס) המוטציה התנגדות. כדי לזהות את המוטציה, אנו רצף האוכלוסייה עמידים mutagen (הקונסנזוס של האוכלוסייה) ולא וירוסים בודדים. לפיכך, יחיד, שנוצר על ידי מוטציות אקראיות mutagen לא מזוהים ברצף, רק מוטציות הגורמות לשינויים קונצנזוס הבאים הבחירה, נמצאים. מניסיוננו אנו מזהים רק אחד או שניים כאלה ברצף שינויים קונצנזוס. ברגע האוכלוסייה עמידים mutagen מתקבל ואת מוטציה ההתנגדות מזוהה, יש צורך ליצור מלאי טהור יותר של גרסה זו. מעל תיארנו תהליך טיהור פלאק. לחילופין, אם וירוס של עניין אינו מייצר לוחות לזיהוי בקלות, הגרסה הרצויה ניתן purified ידי הגבלת דילול. גישה זו היא למעשה 50 TCID בפורמט 96-היטב, שם המניות וירוס הוא מדולל כזה פחות מ -50% בארות נגועים. שימוש דילול, גישה זהה לעיל נלקח, לבודד עד 10 גרסאות הפרט המאשר רצפים שלהם. כאמור, במקרה הטוב, שיבוט cDNA זיהומיות של זן הנגיף זמין. בידוד של גרסה ולכן לא היה צורך. מניסיוננו, גרסאות נאמנות הן תוצאה של החלפות יחיד חומצת אמינו ולכן יכול להיווצר תוך שימוש פשוט, ערכות mutagenesis ממוסחר כמו Quikchange (Agilent). אפשרות משנית היא להשתמש שיבוט cDNA של זן קשורה קשר הדוק. עם זאת, אם זן הקשורות בשימוש, מומלץ מאוד להשתמש גם גישה זו בידוד הנגיף (טיהור פלאק למשל) כי יש לנו גילו כי מוטציה זהה נאמנות שינוי על שני וירוסים קשורה קשר הדוק לא בהכרח יש את אותו אפקט.
פידליטי ו. שכפול מבחר גרסאות RNA mutagen עמידים גרמו לבידודה של שתי גרסאות גבוהים או נמוכים יותר נאמנות עם מאפיינים צמיחה דומים עמיתיהם בטבע שלהם סוג 4,12,15. נכון לעכשיו, הקשר בין פעילות שיעורי פולימראז ונאמנות לא מובנת לחלוטין. במבחנה מחקרים ביוכימיים באמצעות RNA פולימראז מטוהר הראו כי גרסאות נאמנות גבוהה יש שיעורי עיבוד איטי יותר, ואילו גרסאות נאמנות נמוכה נוטים להיות עיבוד מהיר יותר 1-3,12. בתרבות רקמות, הבדלים אלה לא ברור כלל, מה שמראה כי הזמינות של משאבים, ולא מהותי בפעילות קינטיקה פולימראז, הוא שיעור הגבלת צעד. אם גרסה נאמנות משכפל עם קינטיקה שאינם שונים באופן משמעותי מן סוג בר, אז השוואה של תדרים המוטציה שלהם יכול להתבצע ישירות. אם שינוי משמעותי מאוד קינטיקה שכפול קיים, אז הנתונים צריך להיות מנורמל להסביר הבדלים קינטית, למשל על ידי השוואת וירוסים שעברו את אותו מספר של מחזורי שכפול. מניסיוננו, אם כי אין הבדלים משמעותיים צעד אחד קינטיקה צמיחה נצפו בין סוג בר גבוה גרסאות נאמנות, אנו ציין כי גרסאות נאמנות גבוהה באופן עקבי כייל גבוה יותר (בתוך יומן 1) לעומת סוג פרוע אבל הם עושים מעט פחות RNA (בתוך באותו סדר גודל), נוסף המצביע על כך הגנום שהם מייצרים מכילים פחות מוטציות הן ובכך, מדבקות ועוד.
הכנת המדגם וסדר. במשך כל השלבים פרוטוקולים אלה, קיים הכרח כי באיכות גבוהה, הוכחה קריאה אנזימים משמשים PCR ו - RT-PCR להגביל החדרת מוטציות נוספות מאחר שלא ניתן להבחין בין מוטציות רלוונטי מבחינה ביולוגית. זה קריטי, כי האוכלוסיות וירוס להשוות הוכנו באותם תנאים (היסטוריה המעבר, תרבות בינוני רקמה, טמפרטורה, שיטת השאיבה RNA, RT-PCR פרוטוקולים, וכו ') כמו כן, חשוב להבטיח כי מספיק חומר המוצא היתה המתקבל מיצוי RNA כזה להקה חזק שנוצר על ידי RT-PCR. דילול 1 / 100 של המדגם RNA צריך גם לתת להקה לזיהוי RT-PCR, המציין כי המדגם מכיל מספר מספיק של מולקולות RNA כדי למנוע הטיה בייצוג (הגברה הגנום אותו שוב ושוב). מאז תדירות מוטציה היא ההפצה, ניתן היה לצפות כי ערכים דומים יושג ללא קשר לגודל האוכלוסייה, בתנאי הטיה הנ"ל לא מתרחשת. כמו איור 6 מראה, 10 5 פי דילול של מניות וירוס נותן תדירות מוטציה שאינה שונה באופן משמעותי ממלאי ההורים.
עד תנאים אופטימליים TopoTA שיבוט נמצאים, לאשר את קיומו של מוסיף לאחר ההקרנה כחול / לבן, על ידי מושבת PCR לפני ריצוף. כמו שליטה על רעש מוטציוני (מוטציות הציג RT-PCR וסדר), שיבוט מוצר PCR מן הנושא פלסמיד רצף ויראלי אותו ו / או לשכפל ו RT-PCR מוצרים רצף ב RNA במבחנה עיבד המתאים הגנום וירוס (להיות מודע לכך אנזימים שונים במבחנה תעתיק יש שיעור שגיאה שונות לא יכול לתת מידע שימושי כמו טעות הרקע האמיתי בהליך שלך). כמה רצפי הנגיף עלול להיות רעיל חיידקים, ולכן חשוב לוודא זאת לפני שתחליט על האזור של הגנום הנגיפי להיות רצף של תדירות מוטציה. בניתוח רצפים מתקבל על ידי TopoTA, לציין כי שיבוט זה אמור להכיל רק אחד להכניס / רצף. אם שיא כפול הוא ציין, דבר המצביע על אוכלוסייה מעורבת, זה אפשרי, כי שני מושבות חיידקים השכנות נבחרו. אפשר גם, אם כי מאוד לא סביר בהתחשב התדרים מוטציה נמוך שכפול חיידקים, כי המוטציה הוצג במהלך הגברה של פלסמיד בתרבות חיידקי. ב p פלאקurified אוכלוסיות, שיא כפול עשוי לייצג הפלאק חופפים, או וירוס כי היא רוכשת מוטציה חדשה או מביטול מוטציה במהלך התפתחות פלאק. היו עקביים להחליט אם למנות או לא למנות אלו מוטציות.
לבסוף, יש לזכור כי את התדרים מוטציה משמש כאן הם ערכים יחסיים. הם תקפים רק בהשוואת אוכלוסיות וירוס גדלו בתנאי זהה, רצף על האזור אותו! הם לא צריכים להיחשב ערכים מוחלטים של שיעור המוטציות, או תדירות מוטציה של הגנום כולו. עם זאת, כאשר תנאי נשלטים, הם מתירים לשחזור, השוואות כמותיות של הבדלים בהתפלגות מוטציה ותדירות.
Disclosures
Acknowledgements
עבודה זו נתמכה על ידי מימון הרפואה והבריאות מענק מחקר מן העיר של פריז, צרפת הלאומי מענק ANR-09-JCJC-0118-1, ואת ERC גרנט החל פרויקט RNAvirusPopDivNVax לא. 242719.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| ribavirin | סיגמא | R9644-10 מ"ג | |
| 5-fluorouracil | סיגמא | F6627-1G | |
| 5-azacytidine | סיגמא | A2385-100mg | |
| MgCl 2 | סיגמא | M1028-100 מ"ל | |
| MnCl 2 | סיגמא | M1787 | |
| Trypan כחול | סיגמא | T8154-20ML | |
| TopoTA שיבוט ערכת | Invitrogen | 10351021 | |
| Quikchange mutagenesis ערכת | Agilent | 200516 | אם שיבוט cDNA זיהומיות זמין |
| 96-היטב miniprep ערכת | Macherey-נגל | 740625 | |
| Lasergene, Sequencher | DNAstar, Gene Codes Corporation | www.dnastar.com www.genecodes.com | יישור או תוכנות אחרות |
References
- Arias, A. Determinants of RNA-dependent RNA polymerase (in)fidelity revealed by kinetic analysis of the polymerase encoded by a foot-and-mouth disease virus mutant with reduced sensitivity to ribavirin. J Virol. 82, 12346-12355 (2008).
- Arnold, J. J., Vignuzzi, M., Stone, J. K., Andino, R., Cameron, C. E. Remote site control of an active site fidelity checkpoint in a viral RNA-dependent RNA polymerase. J Biol Chem. 280, 25706-25716 (2005).
- Korneeva, V. S., Cameron, C. E. Structure-function relationships of the viral RNA-dependent RNA polymerase: fidelity, replication speed, and initiation mechanism determined by a residue in the ribose-binding pocket. J Biol Chem. 282, 16135-16145 (2007).
- Pfeiffer, J. K., Kirkegaard, K. A single mutation in poliovirus RNA-dependent RNA polymerase confers resistance to mutagenic nucleotide analogs via increased fidelity. Proc Natl Acad Sci U S A. 100, 7289-7294 (2003).
- Pfeiffer, J. K., Kirkegaard, K. Increased fidelity reduces poliovirus fitness and virulence under selective pressure in mice. PLoS Pathog. 1, e11-e11 (2005).
- Vignuzzi, M., Stone, J. K., Arnold, J. J., Cameron, C. E., Andino, R. Quasispecies diversity determines pathogenesis through cooperative interactions in a viral population. Nature. 439, 344-348 (2006).
- Vignuzzi, M., Wendt, E., Andino, R. Engineering attenuated virus vaccines by controlling replication fidelity. Nat Med. 14, 154-161 (2008).
- Crotty, S., Cameron, C., Andino, R. Ribavirin's antiviral mechanism of action: lethal mutagenesis. J Mol Med. 80, 86-95 (2002).
- Coffey, L. L., Vignuzzi, M. Host alternation of chikungunya virus increases fitness while restricting population diversity and adaptability to novel selective pressures. J Virol. 85, 1025-1035 (2011).
- Ciota, A. T. Role of the mutant spectrum in adaptation and replication of West Nile virus. J Gen Virol. 88, 865-874 (2007).
- Ibarra, K. D., Pfeiffer, J. K. Reduced ribavirin antiviral efficacy via nucleoside transporter-mediated drug resistance. J Virol. 83, 4538-4547 (2009).
- Levi, L. I. Fidelity variants of RNA dependent RNA polymerases uncover an indirect, mutagenic activity of amiloride compounds. PLoS Pathog. 6, e1001163-e1001163 (2010).
- Sierra, S., Dávila, M., Lowenstein, P. R., Domingo, E. Response of foot-and-mouth disease virus to increased mutagenesis: influence of viral load and fitness in loss of infectivity. J Virol. 74, 8316-8323 (2000).
- Ruiz-Jarabo, C. M., Ly, C., Domingo, E., de la Torre, J. C. Lethal mutagenesis of the prototypic arenavirus lymphocytic choriomeningitis virus (LCMV). Virology. 308, 37-47 (2003).
- Sierra, M. Foot-and-mouth disease virus mutant with decreased sensitivity to ribavirin: implications for error catastrophe. J Virol. 81, 2012-2024 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved