Method Article
ウイルスの変異頻度のRNAウイルスと特性の忠実性の変異の分離
要約
現在の記事は、RNAウイルスとどのように組織培養の忠実度の変化を確認するために、変異頻度のデータを使用するためのRNAポリメラーゼの忠実度の亜種を分離し、特徴付けるために必要な手順を説明します。
要約
RNAウイルスは、自分のゲノムを複製するRNA依存性RNAポリメラーゼを使用してください。これらの酵素の本質的に高いエラー率は、ウイルスの適応と進化を容易に極端な人口の多様性の世代に大きな貢献しています。証拠を増やすと、RNAウイルスの固有誤差率、および結果として得られる変異の頻度は、ウイルスのポリメラーゼに微妙なアミノ酸の変化によって変調することができることを示しています。生化学的アッセイは、定款の忠実度の定量的測定を可能にするいくつかのウイルスRNAポリメラーゼのために存在しますが、ここで我々は忠実変える変異を同定する生化学的なアプローチな限り正確であることが証明されてRNAウイルスの変異の頻度を測定する簡単な方法を説明します。アプローチは、ほとんどの生物学の実験室で行うことができる、従来のウイルス学的およびシーケンシング技術を使用しています。異なるウイルスの数の経験に基づいて、我々は、忠実度の亜種を分離して統計的有意性のデータを生成する可能性を高めるために最適化する必要がある重要な手順を特定している。忠実変える変異の単離および特性は、ポリメラーゼの構造と機能1月3日に新たな洞察を提供することができます。さらに、これらの忠実度の亜種は、ウイルスの適応と進化4-7のメカニズムを特徴付けるのに有用なツールになります。
プロトコル
1。細胞への毒性が極めて低いです。変異原の濃度の範囲を決定する
この演習の目的は、変異原性物質の濃度の範囲は、過剰の細胞毒性を伴わずに感染中に使用できるのかを判断することです。基本的には、ウイルス感染に必要とされる条件を再現したいと思うでしょう。 2と7日間の最後のほとんどのウイルス、感染症のため。毎日ではサンプルの細胞に十分なプレートを準備します。非接着細胞を使用する場合は、それに応じてプロトコルを修正する。
- 実験の前日に、シード7 /よくサブコンフルエント(75%)単分子膜の実験の日を達成、6ウェルプレートで× 10 5 HeLa細胞。プレートの各ウェルを6濃度の範囲を可能にして、変異原物質の異なる濃度で処理されます。
- 実験日に、組織培養培地で変異原物質の希釈液を調製する。 HeLa細胞の場合は、(リバビリン、5 -フルオロウラシル、5 -アザシチジン)、MgCl 2の場合は0〜50mMの、およびMnCl 2を 0〜5 mMの塩基類似体の場合は0〜1000μmの範囲を使用してください。
- 井戸から培地を吸引し、2mlの変異添加培地および培養器へのリターンと交換してください。
- 24時間ごとに、細胞の生存を確認するために細胞の一つのプレートを使用してください。これは、トリパンブルー染色または使用して商品化蛍光/発光アッセイ(例えば、プロメガのCellTiter -グロ®発光細胞の生存率アッセイ)で行うことができます。
- トリパンブルー排除染色の場合は、遠心分離によってつのプレートからの細胞(変異原性物質の異なる濃度で処理)と穏やかに細胞をペレット化を切り離します。
- PBSの上清と再懸細胞を(血清は、染色を妨げる可能)捨てる。
- 0.4%トリパンブルー、室温で2分間インキュベートの1ボリュームをPBSで1ボリュームの細胞懸濁液を混ぜる。
- 血球計算盤では、実行可能な(未染色)と非現実的な(青色に染色)細胞を数える。未処理の対照を含む変異原性物質の各濃度に対して生存細胞の割合を計算する。我々は、感染のエンドポイントで50%未満の細胞死(最大力価に達したとき)の結果は変異原性抵抗の分離に最適であることがその条件を見つける。
2。適度に(約0.5〜2ログの減少)ウイルスの力価を減少させる最適な、非毒性変異原物質の濃度を決定する
この演習では、人口を過剰突然変異誘発することなく、強力な選択圧を発揮する変異原物質の濃度を決定するために提供しています。 RNA変異原性物質の場合は、私たちは、これがウイルスの力価の10.5から2ログの削減に対応していることを見つける。これらの濃度では、すべてのゲノムは、少なくとも1つまたは2つの位置に変異している。変異原は、その後、経過とともに選択される耐性変異の生成を補助することがあります。あまりにも多くの変異が(非常に高い変異原性の濃度で)を導入している場合は、耐性変異を有する変異体は、自身が彼らの分離を妨げ、致死的変異誘発になります。
- ステップ1と同じ条件を用いて細胞をシードプレート
- 実験日に、組織培養培地で変異原物質の希釈液を調製する。上記決定された濃度の同じ範囲を使用しますが、50%以上の細胞死につながった濃度を除外する。変異原性物質の各濃度で、感染前の細胞の前処理を可能にする、(ウェルあたり4ml)を二回各ウェルをカバーするために十分なメディアの準備。
- 培地を吸引し、2時間変異添加培地でインキュベートすることにより、変異を持つ細胞を前処理。ほとんどの細胞タイプの場合、これは変異原性物質の取り込みのための十分な時間です。
- 培養液を除去し、最小音量で感染の低い重度MOI(0.1または0.01)(6ウェルプレートに200μL)でウイルスに感染する。ウイルスが細胞に感染できるように15分から1時間インキュベートする。接種材料は、細胞単層をカバーすることを保証するために定期的にプレートを揺らし。
- 接種ウイルスを吸引除去し、可能な限り接種をできるだけ多く取り除くために2 mlのPBSで2回洗浄。
- 3月6日複製サイクルに相当するための各ウェルでインキュベート細胞に変異原性物質の適切な濃度で培地を追加。
- 収穫の各ウェルからのウイルスやウイルスの力価に対する抗ウイルス効果を決定する。これは、標準的なプラークアッセイまたは限界希釈法(TCID 50)によって行うことができます。注:変異原性が検出されないことがありますので、測定のみRNA合成が適切ではないかもしれないという技術によるウイルスの定量。致死変異を含む変異誘発ゲノムはまだ、例えば定量RT - PCRによって検出される可能性がありますが、ウイルスの生存率アッセイで観察されませんでした。
- 計算された力価から、また細胞(理想的には、50%未満毒性)に対して非常に毒性がない10.5から2ログでウイルス力価を(未処理の対照の感染に比べて)減少させる変異原の濃度を特定する。
3。アイソレーションと識別子変異原性物質耐性変異株のfication
上で定義した最適な変異原の濃度に大規模な人口サイズの通路を実行し、通路の系列におけるウイルス力価を確認してください。コントロールとして、あらゆる変異のない増殖培地で継代ウイルス。欠陥干渉粒子(DI)の潜在的な出現を監視する別のコントロールとして、(unpassagedコントロール)各パッセージの段階で変異原性物質の不在下で新鮮な感染症を実行します。
- 感染前日に、1.5 × 10 6のHeLa細胞(他のフラスコのサイズを使用することができる)とシード25cm 2のフラスコには、次の日のサブコンフルエントな単層を取得する。
- 感染症の日に、2節で決定した各変異原性物質の最適濃度を含む培地で2時間、細胞を前処理。
- 培養液を除去し、MOI 1で最小体積または研究されているウイルスのための欠陥干渉(DI)粒子の形成につながるしないMOI最大で細胞を感染させる。
- 感染症の30-60分後に、接種を吸引し、PBSで2回洗浄し、適切な濃度で変異原を添加した新鮮培地を追加してください。
- これらの条件における最大のウイルス力価に対応するセクション1と2で指定した時間インキュベートする。子孫ウイルスを回収する。
- 力価は、各継代でウイルスと3の手順を繰り返します。
- 最初の数通路の間に、変異原処理した試料のウイルス力価は、元のウイルスの力価とコントロール(未処理及びunpassaged)ウイルスの力価と比較して、それに応じて削除する必要があります。変異原性のウイルスの力価は、試料は未処理のコントロールと同じレベルに戻って登る継代した場合、人口はおそらく変異耐性変異株が含まれています。我々は5から15継代の間に私たちの忠実度の亜種の大部分を分離したものの、最大20または30継代までは、必要な場合があります。
- 所定の通路のシリーズのためのウイルスの力価は、未処理のコントロールの力価と同じ大きさに到達すると、同じ継代数からの未処理の制御を含め、すべてのサンプルからRNAを抽出する。 RNA抽出キットまたはトリゾール抽出を使用することができます。
- 興味のあるウイルスのポリメラーゼまたはレプリカーゼ遺伝子を増幅するプライマーを用いたRT - PCRを行います。第二段階では、ゲノム全体は(少なくともコード領域)の抵抗の表現型は同様に他のウイルスの遺伝子にマッピングするかどうかを調べるために塩基配列を決定する必要があります。これは、ウイルスと細胞機能の他の側面に影響を与えるようなリバビリンのようなベースアナログ変異原、、のために特に重要です。この場合、バリアントは、これらの他の抗ウイルス活性のいずれかに耐性がある可能性があり、忠実度のバリアントにはなりません。
- 変異原物質耐性の人口のコンセンサス配列を得るためにPCR精製キットとシーケンスを使用してRT - PCR産物を精製する。エラーをシーケンシングするためのバックグラウンドのコントロールが含まれています(説明を参照)。
- リファレンスとして配列アラインメントソフトウェアとウイルスのコンセンサス配列を使用して、シーケンスの位置を合わせます。ウイルスの力価は、通常のレベルに到達する通路に変異治療の人口に排他的に表示される任意の特定の注意を払って、新たな点突然変異を識別する。この変異は、以前passagesに存在し、同じ通路番号(細胞培養通路への適応を示す)からの未処理のコントロールに存在しないではない場合、この変異は、変異原性抵抗のため、少なくとも一部は、おそらく責任がある。ベースと呼ばれるシーケンス(シーケンスのテキストバージョン)と単独でアライメントソフトウェアに依存しないようにしてください。アライメントソフトウェアでは見落とされている可能性があります少数のピークのクロマトグラムを確認してください。総人口の20〜30%に相当する変異体はまだピークとして表示されますが、標準的な配列解析で'N'として識別するには小さすぎる。
4。変異が同定されたら、バリアントを切り分けたり、生成し、いくつかのRNAの変異原性物質への耐性表現型を確認する
次に、同定された変異を提示するバリアントは、耐性表現型へのリンクを確認するために分離されています。それは、忠実度を変更することが疑われる変異が(つまり、他のゲノムに付加的な変異を提示しない)遺伝的にきれいな背景で研究されていることが不可欠です。最高の状況では、感染性cDNAクローンは、きれいな遺伝的背景の上に、部位特異的突然変異誘発によって変異原性物質、耐性変異株の株式の生成を起こすことになりますが存在します。このケースでは、セクション4は必要ありません。しかし、cDNAクローンが利用できない場合、分離は、以下に説明するウイルスのプラーク精製、によって行うことができます。プラーク精製の複数のラウンドがきれいに、遺伝的背景に変異を分離するために必要となる場合があります。
- プラークアッセイによる変異原物質耐性の変異株の分離。
- 同定された変異体を単離するために、6ウェルプレートのアガロース(0.5〜1%の最終wt / vol)のオーバーレイで標準プラークアッセイを行う。希に、株式価に基づいて、ウイルスの希釈系列を準備10と50も区切りプラークの間に生成されますutions。
- プラークが(通常2〜5日後に感染症、ウイルスに応じて)はっきりと表示されている場合、プレート上のプラークの位置をマークし、フィルターチップのP200ピペットを使用して、静かにではないに注意してアガロースオーバーレイを通して先端を突き通す(個々のプラークの交差汚染をもたらすであろう)オーバーレイの位置を外れるとシフト。
- 慎重にオーバーレイの外端を持ち上げ、培地と渦の250μlを含むエッペンドルフの先端に含まれているアガロースプラグを転送する。削除された先端はアガロースが含まれていない場合、心配しないで、多くのRNAウイルスのために、多くのRNAウイルスの平均プラークは10 5ウイルスと十分な量が含まれてプラークの表面に先端を触れるだけで転送されます。
- 変異原物質の治療につき10プラークにピックアップ。それが突然変異を同定シーケンシングのクロマトグラムに応じて、所望の変異を含んでいる人口の何パーセント程度と推定。目的は、変異を持つ3つまたは4つのプラークを分離することです。これらの変異体のいくつかはまた後でシーケンシングによって識別される、追加、不要な変異を、運ぶでしょう。
- (しかし、ウイルスの大規模な株式を作るサンプルの半分を保存する)これらのサンプルからRNAを抽出し、ゲノム全体のシーケンシングを許可するRT - PCRを行う。任意の追加の変異のない所望の変異を含む分離を識別する時にウイルスを精製したので、シーケンス3または4プラーク、平均では、RNAウイルスは、コンセンサス配列に対する2つの変異の違いまでが含まれます。
- 識別後、T75フラスコ中の細胞、例えば、8 × 10 6のHeLa細胞の大きなフラスコを感染させるために上記で得られたプラーク精製サンプルを使用して、すべての下流の研究のためにこのウイルスの大規模な株式を作る..
- 同定された変異により付与される変異原感受性/抵抗性を確認してください。
- 同様の条件下で調製、分離または新しく生成されたクローン、および野生型のコントロールのウイルスを使用して、いずれかの変異原性物質濃度の全範囲、または耐性突然変異が生成された濃度を用いて、2節での実験を繰り返す。
- (リバビリン、5 -フルオロウラシル、5 -アザシチジン、MG2を増加+、Mn 2 +が )。いくつかの異なるRNA変異原性の条件を使用して、ポリメラーゼ変異体は変異原性物質の複数の種類に耐性である場合、それは、この亜種は、高忠実度であることがより可能性があります。また、それは耐性変異は、これらの化合物のいくつかは、機構8の数を介してRNAウイルスに影響を与える、特に以来、単一の変異原性条件に対して特異的である可能性があります。
5。複製率を確認してください
以来、忠実度を変化させる変異が最も頻繁にポリメラーゼにマップする、それは同じポリメラーゼの変異が著しく、レプリケーション速度を変更することが可能であり、それは突然変異の頻度の違いのよりよい比較は、以下の実行を許可されるの類似点と複製の違いを決定することが重要です。 RNA合成を調べ、ウイルスの生産と別のを調べて1 - そのためには、少なくとも二つの無料のアプローチで、レプリケーションを調べる。
- ワンステップのウイルスの増殖速度
- 必要に応じて実験の前日に、シード6ウェルプレート、タイムポイントごとに1プレートをテストする。各変異体と野生型のウイルスのために3つのウェルを使用することを検討してください。
- 実験日に、培地を除去し、すべてのセルが同時に感染していることを保証するためにMOI 10で各ウイルスをウェルの中に感染する。 37℃で30〜60分インキュベート℃に
- ロックは、プレート10分ごとに細胞単層の乾燥を避けるために。ウイルスを削除し、2 mlのPBSで2回洗浄。可能な限り接種をできるだけ多く除去することが重要です。増殖培地に交換してください。
- 時間= 0での感染に続いて、一つのプレートからウイルスを採取。インキュベーターに板を返し、単一のレプリケーションサイクル(7H 3H、5H用など、、9H、12H、24時間)にまたがる定期的にウイルスを収穫。
- 力価の各時点(例えばプラークアッセイ、TCID50、FFU検定)で収穫されたウイルス、およびグラフ価対時間の成長曲線。
- RNA合成の速度論
RNA合成の動態は、下記のいずれかのアプローチを使用して監視できます。可能であれば、ワンステップの成長速度を決定するために使用される同一のサンプルは、RNAレベルを測定するために使用する必要があります。- 定量RT - PCR。この手順では、アッセイの感度に応じて、いくつかのゲノムのコピーから> 10 10に、広い範囲でのレプリケーションの高度に定量的な対策を提供します。高度に保存されたゲノム領域の小さな断片(<200 bp)をカバーする設計のプライマーとプローブ。
- ノーザンブロット分析。定量RT - PCRよりも定量的なものの、この手法は完全長のゲノムの複製の結果ことと有意な連鎖停止がポリメラーゼの突然変異の結果として発生していないことを視覚的に確認可能に。
- レポーター遺伝子の発現。レポーター遺伝子(例えばルシフェラーゼ)を発現するcDNAクローンが使用可能な場合、これは複製能力を調べるために代理として使用することができます。これらのウイルスが挿入されたレポーター遺伝子を削除する傾向があるので、このウイルスに作用する選択圧は、特に、同じではないでしょうしかし、組換えウイルスは、他のアプリケーション(このような変異の頻度の決定など)には使用しないでください。
6。突然変異の頻度を測定する
これは、特定されたポリメラーゼの変異は、変異原性物質を変化させる複製忠実度に対する耐性を付与することを確認する上で重要なステップです。ここで測定された突然変異の頻度が突然変異率ではないことに注意することは重要です。レート、レプリケーション速度の非常に注意深い測定を(合成されたRNAの量と複製サイクルの長さ)を決定することは、しかし突然変異の頻度を測定インチ考慮する必要があります限り、通過履歴とレプリケーションの速度が監視されるように、複製の再現性、定量的な対策を提供します。忠実。突然変異の頻度は、実行可能なウイルス集団(プラーククローンまたは限界希釈法)で、総ウイルスの人口(ウイルスの株式または上清)のいずれかに決定することができます。突然変異の頻度を決定するために、後の通路(例えば通路2またはそれ以上)からウイルス株を準備。ウイルスの人口は近い突然変異 - 選択の均衡への遺伝的多様性を拡大する時間があったことが重要です。
- 実行可能なウイルス集団の変異の頻度
このアプローチは、より多くの労力を要するものの、複製能力を保持している平均的ゲノム上に存在するどのように多くの変異に関する情報を提供します。それは、より高い適応度の亜種のバイアスが発生するということに注意すべきだと下のフィットネス、実行可能な亜種を簡単にプラークは、例えば、検出されない場合がありますしない。このように、それはまた、正の選択が人口に動作しているかどうかを検討するために使用することができます(DN)同義(DS)と非同義塩基置換のよりよい対策を可能にします。しかし、少数の変異が定量化されるため、シーケンスの大きい数は、統計分析のために必要となります。この手法は、上記のように、プラークの精製または限界希釈のどちらかによって、個々のウイルスの分離に依存しています。出発点として、我々は、野生型ウイルスと変異原物質耐性変異体の48個"クローン"の分離をお勧めします。この方法で単離された各クローン集団は、創設者のゲノムを提示どんな突然変異運ぶために期待されています。孤立したプラークまたは限界希釈におけるRNAの存在量は、よく一般的にRT - PCRによる増幅で十分です。必要に応じて、セルの最小数(例えば24ウェルプレートフォーマット)の短い増幅(以下複数のレプリケーションサイクルは)より多くのRNAを得るために使用できますが、最小の増幅がnew変異の蓄積を避けるために実行する必要があります。比較する各クローンと人口は、レプリケーションを同じサイクル数を受けなければならないことに注意してください。- プラーク精製または限界希釈法によって24から48のウイルスクローンを分離する。
- 分離されたクローン集団からRNAを抽出
- RT - PCRは、各サンプルに対して3キロバイトまでカバーする断片を増幅した。非構造遺伝子のより多くの保存領域よりも多くの実行可能な変異を容認する傾向がある構造蛋白質領域を、カバーするのが最善です。
- 、PCR産物を精製するシーケンスおよび変異解析(セクション7)を実行します。
- 総ウイルス集団の変異の頻度
この第2の方法の利点は、ですが、低い適応度の亜種は、突然変異のスペクトルの広い画像を可能にして、シーケンシングにも含まれます。しかし、それは、実行可能なウイルス集団(例:DN / dSの値)と最も関連性の変異の同定を想定して系統発生解析に理想的ではない可能性があるので致命的変化を完全に識別することができます(RNA構造は、終止コドン、ドラマチックなアミノ酸変化が改変)と分析に保持される。それにもかかわらず、この手法は、in vitro生化学的アッセイの欠如がある場合に忠実度の変化を確認するために、最も統計的に有意なデータを取得するために研究者を可能にします。この手法は、低フィットネスやプラークを生成しません致死変異を有するゲノムを含むトータルビリオンRNAのRT - PCR増幅に依存しています。この方法により得られた変異の頻度は、プラークまたは限界希釈クローニングよりも10倍高くなることがあります。- 総ビリオンの人口からRNAを抽出
- RT - PCRアンプ年度の変異を許容し、遺伝分散(例えば構造タンパク質)を有することが知られているゲノムコード配列の一部を800から1200塩基の領域。大きな断片は、そのようなTopoTAとしてクローニングベクターに容易に挿入されず、形質転換の不十分な番号を生成します。小さいフラグメントがさらに良いですが、ゲノム配列決定の報道は、統計的有意性を得るために少なすぎるかもしれません。少なくとも800bpの断片は2つのプライマーを用いてシーケンスカバレッジを可能にし、シーケンスカバレッジを最大化し、シーケンシングのコストを最小限に抑えるとの間の良い妥協です。我々は、800ヌクレオチドの領域をカバーする70〜100の配列が繰り返し我々が研究室で研究しているバリアントの変更された忠実度を確認することを見つける。他のベクトル/クローニング方法は等しい効率で使用できることに注意してください。
- 市販のキットや標準的なDNA抽出/沈殿によるを用いたRT - PCR産物を精製する。
- 使用するRT - PCR酵素は突出末端を生成しない場合、1μMATPおよびTaqポリメラーゼを追加して10分の延長を行う
- メーカーの指示に従ってTopoTAのクローン
- 検討される各ウイルスの人口については、XGalコーティングプレート上で青/白スクリーニングにより、正のインサートを有するものとして同定された96コロニーを、選択します。当初は、アガロースゲルまたはシングルコロニーPCRでプラスミドサイズのスクリーニングで青/白スクリーニングの有効性を確認するために、クローン化されているそれぞれの異なるゲノム領域用インサートの存在をテストします。フラグメントサイズと上記の条件を使用して、我々は90%の陽性を達成
- 96ウェルバクテリア培養プレートのLB培地1ml中に一晩液体ブロスに各コロニーを成長させる
- 次の日は、96ウェルフォーマットでミニプレップを準備。
- 複製されたセグメントの最大範囲を得るために十分なプライマー(例えば、RT - PCRに用いるプライマー、またはTopoTA M13プライマー)との配列の各プレート。変異解析(セクション7)を実行します。
7。シーケンスの解析
各集団と、適切なアライメントソフトウェアのための基準やコンセンサス配列を用いてシーケンス解析を行います。我々は容易にコンセンサスを基準にしてSNPを同定することができますLasergeneまたはSequencherをお勧めします。
- 適切なソフトウェア(例えばLasergeneまたはSequencher)を使用してシーケンスを合わせます。
- 質の悪いシーケンス(悪いベースコール、あまりにも多くの'Nのまたは長さが短すぎる)を捨てる。すべてのシーケンスで覆われているヌクレオチドの範囲を識別します。ゲノムの異なる領域が多かれ少なかれ突然変異を許容するので、比較上の理由からそれは同じ領域が完全に解析のために保持、各シーケンスのクローンでカバーされていることが不可欠です。いくつかのシーケンス反応はクローンごとに実行、1つのシーケンスが、特定のクローンで失敗している場合はこのように、、解析からクローン(すべてのシーケンスを)捨てる。
- 参考菌株とは異なるSNPを識別し、数える。
- (地域配列決定のクローン×長さの数)塩基配列のヌクレオチドの総数によって識別されるSNPの合計数を割ることによって突然変異の頻度を計算します。 10K NTシーケンスあたりの突然変異の平均数は、ヌクレオチドごとにそれを残して、よりユーザーフレンドリーな、数字をレンダリングすると、この番号を提示する。例えば、表1に、55の野生型の個体群に対してmutations/121、978の全ヌクレオチドX 10,000 10,000ヌクレオチド当たり= 4.51変異塩基配列を決定。
- 同じSNPは、クローンの大量に表示されている場合、これらの繰り返しの変異を含めたり除外したりする二つの値を提示する。一般的に、均質な親(プラーク精製によってまたは感染性クローンから)から生成し、細胞培養でのみ数回継代ウイルスの人口のために、正の選択は、同じSNPの蓄積と突然変異を引き起こすのに十分その効果を発揮していない周波数は、この方法が良い正または純化淘汰の最小限の影響でポリメラーゼのエラーの頻度を反映した測定値。
- 突然変異の分布を決定する。現在0、1、2、3、等、各集団におけるクローンの数の順位付きリストを作る..領域における変異は、塩基配列を決定。
- ペアワイズ距離の比較によってウイルス集団の多様性を計算する。からきれいにして手動で編集されたシーケンスは、参照領域を含む配置を準備する。利用可能ないくつかのアラインメントを行なうプログラムがあります:ClustalWの/ X( http://www.clustal.org/~~V )、マッスル( http://www.drive5.com/muscle/ )、EbioXは、Macユーザーのために( のhttp://www。 ebioinformatics.org / ebiox / )、などを確認し、すべてのシーケンスが同じ長さ、必要に応じて収穫されていることを確認。これは、シーケンスの開始は後部分析を容易にするためのコーディングコドンであることをお勧めします。我々は容易に利用できるほとんどのソフトウェアによって読み取られるFASTA形式、内のすべてのアライメントを維持示唆している。 ペアワイズ距離解析を実行するには、同じ母集団に属する配列の間のすべての可能な一対比較を計算する。比較に見られる平均的な変異は、人口の異質性を示すために計算することができます。
- 同義(DS)と、集団内(DN)の非同義の値を容易に得ることができる。我々は、MEGAソフトウェア(http://www.megasoftware.net/が)便利で、この種の分析のためのユーザーフレンドリー見つける。
- 彼らは可能性だけではないものの、選択の方向を取得するために、我々は二つの可能性を与える。 1)DNおよびDSの比率を取得します。 1より大きい値は、正の選択を意味する。 1より低い値では、浄化の選択を意味する。 2)Datamonkey Webサーバを使用します( http://www.datamonkey.org/~~V )。 FASTA形式でアライメントをアップロードし、SLACのモジュールとそれらを分析する。これにより、DN / dSの見積もりを与える。
- 統計分析を実行します。シーケンスのデータと数の量に応じて、さまざまなテストを使用することができます。いくつかの研究では、すべてのクローンは9組み合わされるコンセンサス塩基の総数に対する突然変異の総数のカイ二乗検定に頼ってきた。他の研究では、フィッシャーの正確検定を行い変異10無しでシーケンスの数対の変異を提示する配列の数を計算しています。十分な変異データが生成されている場合は、我々は、それぞれのRNAシーケンス上に存在する変異の数によって各ウイルスの集団におけるクローンの数をランク付け、そのためにはそのようなマンホイットニーUのようにランク和検定を行うことをお勧めします。マンホイットニーは、個体群の変異の分布の違いをテストします。このような理由から、我々は複数の変異を持つクローンを見つけるの可能性を高めるために、少なくとも800塩基対の配列決定をお勧めします。このテストは堅牢ですが、より大きなサンプルサイズが必要です。一方で、それが比較されようとしている個体群に対して同じサンプルサイズを必要としない(例えば、表1からのサンプルは、N 1 = 148とn 2 = 84です)。
8。代表的な結果:
細胞の生存とウイルスの生存率に変異原性物質の濃度の用量依存性の効果は、図に示されている1この例では、我々は、100μMAZCでそのウイルスの継代がターゲットの10.5から2ログでウイルスの力価の減少が、HeLa細胞の生存率はであったが見つかりました否定的にウイルス感染に必要な2日間の影響はありません。このパイロットの実験では変異原物質の抵抗を選択するために、ウイルスの継代のための100μMAZC濃度の選択につながった。 図2は、変異の耐性表現型の出現に続いて力価の最初の低減を、示しています。変異原物質の最初のいくつかの通路の間に、致死変異が蓄積するにつれて、ウイルス力価の有意な低下が発生します。徐々に、変異原物質耐性変異は、その出現は、未処理のコントロールと違い、ウイルスの力価に戻ったと一致現れる。この段階で、ウイルスの人口の大部分は耐性変異を示す。このウイルス集団の配列決定によって、アミノ酸の変化(の)責任を明らかにする。一度識別され、隔離されたまたは新しく生成された、変異原物質耐性ウイルスは、別のRNA変異原への野生型(異なる構造の塩基類似体、例えば)よりも感度が低い可能性があります。 図3は、より高い力価RNA変異原性物質耐性コクサッキーウイルスB3を示していますリバビリン、5 -フルオロウラシル、5 -アザシチジン、及び高いMgCl 2とMnCl 2を存在下で野生型。 RNA変異原への幅広い抵抗が増加複製忠実度の強力な指標です。忠実度のバリアントのその複製の動態を確認することは変異の頻度の比較で助けとなる野生型のウイルスに似ています。 図4は、野生型に比べて高い忠実度の変種の一歩成長の動力学を描いている。複製率と最後の力価は似ていない場合は、その後の手順は、レプリケーションのラウンド数が同じに受けた同じような大きさのウイルスの集団を、比較に注意する必要があります。 RNAの合成速度と複製の忠実度の間のリンクは、特にin vivoで 、よく特徴付けではありません。これは絶対的なルールはないが、図4に示すように低速な複製率は、低下した変異頻度(より高い忠実度)になることがあります。確立された上記のパラメータを使用して、忠実度の変異と野生型の個体群の変異の頻度は、変更された複製の忠実度の遺伝学的に確認を得るために比較することができる。 図5は、特定された点突然変異で、野生型と高忠実度のバリアントの配列アラインメントを示す。変異がカウントされる、クローンあたりの突然変異の数(表1)に基づいてランク付け、および10,000のヌクレオチド配列決定、 図6のあたり、人口あたりの平均突然変異の頻度として表現。

図1。 RNA変異の抵抗を選択するために最適な条件を決定する:。適度な(ウイルスの力価で1〜2ログの減少)HeLa細胞と高い細胞生存の保持は、リバビリンの指示された濃度で処理し、MOIで野生型コクサッキーウイルスB3に感染させた0.01の。 48時間、感染後、子孫ウイルスを回収したと力価は、TCID 50により決定した。トリパンブルー染色により決定される48時間で治療を生存細胞の割合は、、x軸の下に表示されます。結果は100の濃度および200μMが細胞の生存に影響を及ぼすことなく、1-2ログでウイルス力価を減少させることを示している。
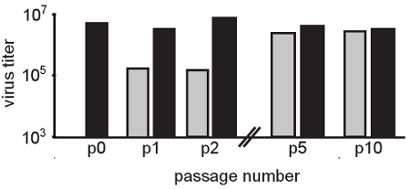
図2。 RNA変異原性物質の適度な濃度の存在下で継代は、変異原性物質耐性の人口のために選択されます。この図では、チクングニヤウイルスは50μMリバビリン(灰色の棒)の存在下でHeLa細胞で継代した。制御通路は、リバビリンの不在(黒いバー)で行った。各継代後、ウイルスの子孫は、BHK細胞上の古典的なプラークアッセイにより定量した。変異原性作用は、2つのログによって処理されたウイルスの力価の低下第一通路(P0から始まる人口に比べて、p1とp2)の間に明らかである。徐々に、力価は、通常(未処理)のレベルに戻ります。有意差は耐性変異株が選択されていることを示唆し、未処理に比べて通路5変異原物質で処理した個体群では観察されない。確かに、人口のコンセンサス配列決定は、リバビリンの治療を受けているウイルスの人口にユニークな変異を同定した。
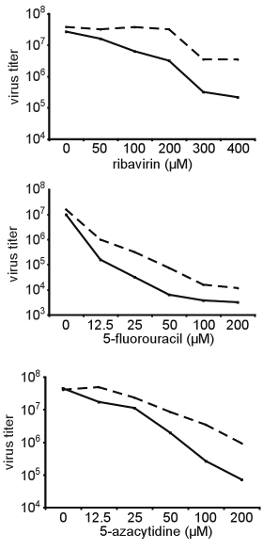
図3。異なる構造の変異原性物質をRNAに広範な抵抗の確認は、ここには示されて、最初に第3章で説明した画面で分離されたコクサッキーウイルスB3の高い忠実度A372V変異体は感染性クローンから生成し、異なる濃度との相対感度を測定した異なるRNA変異原(リバビリン、5 - フルオロウラシル、5 - アザシチジン)。 HeLa細胞は、リバビリンの指示された濃度で処理し、MOI 0.01の時に野生型コクサッキーウイルスB3に感染させた。 48時間、感染後、子孫ウイルスを回収したと力価は、TCID 50により決定した。野生型(実線)とA372V変異(破線)変異原性物質の濃度の関数としての力価はここに示す。 A372Vは一貫してテストしたすべての条件の下で野生型よりも高い力価。
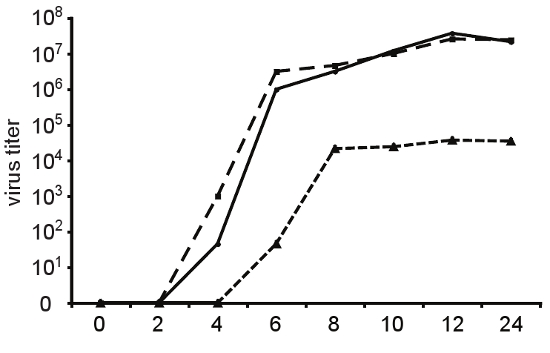
図4。複製率と忠実度の亜種。ウイルスの生産のワンステップの成長速度を決定するには、HeLa細胞は、いずれの野生型(実線)、高忠実度バリアントA372V(長い破線)または複製欠損変異Cx64(短いとMOI = 10で感染させたコクサッキーウイルスB3のダッシュ)。示された時点で、ウイルスの子孫は、凍結融解によって細胞と上清から回収したとTCID 50により力価。 A372Vの忠実度の増加は、組織培養で観察可能な複製の欠陥とは一致しない。バリアントのCx64は、レプリケーションの速度が大幅に遅延を示し、野生型のウイルスよりも1000倍も低い最大力価に達する。
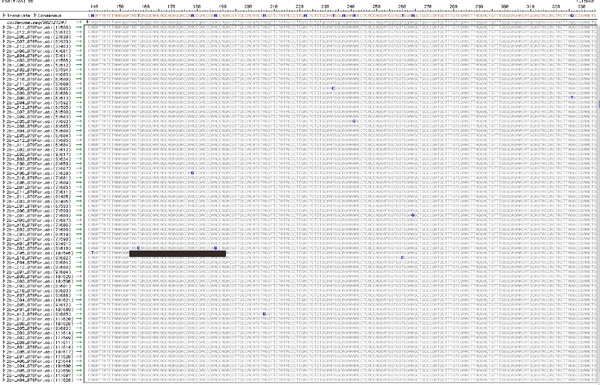
図5。各ウイルス集団からTopoTAクローン配列のアラインメント。7節で説明したアプローチを使用するには、各シーケンス取得からクローニングされたRT - PCR産物は、おそらく全体のウイルス集団内の単一の、ユニークなゲノムに由来するので、ユニークな変異を運ぶ。図は、質の悪いシーケンスとSNPの可視化のクリーンアップに続く、典型的な配置を示しています。集団内の合計のSNP(この図10)はカウントされ、各クローンに表示されるSNPの数が記載されています。他の8クローンは、単一の、ユニークな変異が含まれているのに対し、例えば、バーで下線クローンは、2ユニークな変異が含まれています。このデータは、表1をコンパイルするために使用されます。この図の拡大版を表示するにしてくださいこちらをクリック 。
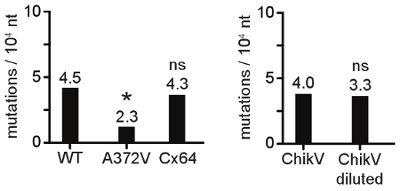
図6。ウイルス個体群の変異の頻度のグラフィック表現が。容易に解釈するために、シーケンスおよび統計分析から得られた数値データはグラフ、またはヒストグラム(ここに示されている)のいずれかとして表現することができます。 A372Vのウイルスは、野生型よりも少ない突然変異を生成し、有意に低い変異頻度を(*、P <0.01)を提示します。力価に複製Cx64変異、1000倍の野生型、圧力よりも低いその複製の速度と忠実度を示す同一の変異頻度は(NS、有意ではない)は必ずしもリンクされていないents。同じチクングンヤ熱ウイルス(CHIKV)人口は、ウイルスの株かどうか同じような突然変異の周波数を与える、または10 5倍希釈は、RNAの抽出に使用されます。
統計分析のための突然変異の分布の要約。
注:それぞれのクローンの場合は、同じゲノム領域(およびシーケンスの長さ)がカバーされることが不可欠です。この場合、クローン当たり859ヌクレオチド。これは統計分析のための非常に重要です。一方で、統計分析に使用される順位和検定はサンプルサイズが同じである必要がなく、研究者はサンプルサイズが異なるの人口を比較するために自由です。したがって、野生型の142クローンはA372Vの84のクローンと比較することができます。
| n個の変異を有する#クローン | 野生型 | A372V |
| 7変異 | 0 | 0 |
| 6変異 | 0 | 0 |
| 5変異 | 0 | 0 |
| 4変異 | 0 | 0 |
| 3変異 | 1 | 0 |
| 2突然変異 | 6 | 2 |
| 1変異 | 40 | 14 |
| 0変異 | 95 | 68 |
| 合計変異 | 55 | 18 |
| 合計クローンはシークエンス | 142 | 84 |
| 全ヌクレオチドは、配列を決定 | 121978 | 72156 |
| Mutations/10 4 NT | 4.51 | 2.49 |
表1。統計分析のための突然変異の分布の概要注:各クローンの場合は、同じゲノム領域(およびシーケンスの長さ)がカバーされることが不可欠です。この場合、クローン当たり859ヌクレオチド。これは統計分析のための非常に重要です。一方、統計分析のために使用される順位和検定はサンプルサイズが同じである必要がない、研究者はサンプルサイズが異なるの人口を比較するために自由です。したがって、野生型の142クローンはA372Vの84のクローンと比較することができます。
ディスカッション
細胞株の選択は。RNA変異原性物質として塩基類似体の効果は、異なる細胞型11によるそれらの相対的な取り込みと相関する。通常、ウイルスの継代に使用される細胞株は、取り込みや敏感すぎ(高い細胞毒性を)変異原性物質に不応性であることが判明した場合、それはこれらの要件を満たしていると、まだウイルス複製に許容である別の細胞株を使用する必要があります。変異原性の抵抗のバリアントが分離されると、特性の残りの部分はオリジナルの、好ましい細胞ラインで実行することができます。我々の経験では、HeLa細胞は容易に変異を取る、BHK細胞は変異の取り込みに抵抗性の10倍高い濃度およびVero細胞にまで必要とする。
変異原性の複数のタイプが使用されている場合は変異原性物質の選択は。変異処理により忠実度の亜種を分離しようとするには、成功の可能性を高めることができます。誤って複製中にゲノムに組み込まれている別の構造の基本アナログ変異原性物質は、主にその後の複製サイクルにおける突然変異の特定のサブセットの結果を誘発する:リバビリンの治療はGtoAとCtoU遷移変異12を支持し、5 -アザシチジンはと、同じようなバイアスを持っていますCtoGとGtoCトランスバージョン13の加算は、5 -フルオロウラシル優先エイトグと宇徳遷移14を誘導する。また、Mg 2 +のまたはMn 2の高濃度は、+ 12、上記のバイアスなしでRNAウイルスの全体的な突然変異の頻度を増加させる培地に補足することができます。ウイルスのコドンの配列、および忠実度のバリアントを生成するために必要なコドンの変化に応じて、これらの条件のいくつかは他のものに比べてこの変種の出現を優先します。忠実度の高いポリオウイルスG64SおよびコクサッキーウイルスA372V、コドンのサイトで必要なエイトグの遷移が主にこのリバビリンによって生成される突然変異に相当するので、最も容易に亜種のために選択されたリバビリンの治療のために。
MOI対人口サイズ。ウイルス感染症領域では、組織培養感染のプロトコルはのために、欠陥干渉粒子(低MOI)の蓄積を避けるために、またはウイルス(高MOI)との間で組換えを促進するため、感染の多重度(MOI)に特に注意を払う例。継代シリアルオーバー出現のイベントのために選択するには、ウイルスの人口規模を考慮することも重要です。耐性変異株は、当初は低頻度で存在するので、それは各通路にこれらの新興の変種を失うのを避けるために(10 5 -10 6ウイルス、など)次の1つの通路から、できるだけ多くの人口のサイズとして転送することが最善です。よくまたはフラスコの大きさ(感染した細胞の数)をスケールアップすること、これが問題になる場合MOIの増加を最小限に抑えるために役立つことがあります。一方、変異原性物質に対するウイルスの感受性がテストされている実験のために、低MOI感染は実験で発生する複製のサイクル数を増やすこととによってより高い適応度のゲノムで変異ゲノムの救助を避けるために行われ共同感染細胞における相補。複製の最初のラウンドの間に子孫のゲノム上で生成された変異がすぐに検出されないので、これは重要です。これらの変異RNAのほとんどは、依然としてビリオンにパッケージ化されます。それはこれらのゲノムに存在する致死突然変異が中止された複製サイクルにつながる、とウイルス力価の低下することを感染症の次のラウンドになります。それは致死突然変異誘発の有意な効果が観察される前に、変異の蓄積のいくつかのラウンドを可能にするために必要となる場合があります。最後に、変異原性物質の存在下で継代のシリーズを介して、ウイルスの力価が絶滅するまで低下し続ける場合は、研究者は徐々に変異原性物質(非常に低濃度から開始する)の量を増やすことで、ウイルスを継代してみてください。
RNA変異-抵抗性個体群からRNA変異原性物質耐性クローンの単離と世代。RNA変異原性物質は、それぞれのゲノムに複数のランダムな突然変異を導入するが、抵抗の選択は、唯一の(とコンセンサス配列に修正)耐性変異を豊かにする。この変異を識別するには、我々の配列変異の抵抗性の人口(人口のコンセンサス)ではなく、個々のウイルス。したがって、変異原によって作成された単一の、ランダムな突然変異が連続して検出されていない、唯一の変異は選択した後のコンセンサスの変化にその結果が、発見されています。我々の経験では、1つまたは2つだけそのようなコンセンサス配列の変更を識別します。変異原物質抵抗性個体群が得られ、耐性変異が同定されれば、それはこの亜種の多くの純粋な株式を生成する必要があります。上記の、我々は、プラーク精製の手順を説明した。また、興味のあるウイルスが容易に識別できるプラークを生成しない場合は、希望するバリアントはpurif可能性があります限界希釈法によってIED。このアプローチは、本質的にウイルスストックは、井戸の50%未満が感染しているように希釈して96ウェルフォーマット、のTCID 50です。この希釈を用い、上記と同様のアプローチは、10個の変種まで分離し、そのシーケンスを確認するには、取得されます。前述したように、最善のケースでは、ウイルス株の感染性cDNAクローンは入手可能です。変異体の分離は、このように必要ではないでしょう。我々の経験では、忠実度の亜種は、単一のアミノ酸置換の結果であり、したがってそのようなQuikchange(アジレント)のような単純な、市販の変異導入キットを使用して生成することができます。 secondaryオプションは、密接に関連菌株のcDNAクローンを使用することです。しかし、関連株が使用されている場合、我々は強く我々は2つの密接に関連ウイルスに突然変異を変える同じ忠実度は、必ずしも同じ効果を持っていないことを発見したので、このアプローチとウイルスの分離(例えば、プラーク精製)の両方を使用することをお勧めします。
フィデリティと複製。RNA変異原性物質耐性変異株の選択は、野生型の対応4,12,15に似ている成長の特性を持つ上位と下位忠実バリアントの両方の分離をもたらしました。現在、ポリメラーゼ活性率と忠実度の間のリンクは完全には分かっていない。低忠実度の亜種は、より高速な処理1-3,12を持っている傾向がある一方、in vitroで精製したRNAポリメラーゼを用いて生化学的研究は、より高い忠実度の亜種が遅い処理速度を有することが示されている。組織培養では、これらの違いは、律速段階である、そのリソースの可用性ではなく、内因性ポリメラーゼ活性の動態を示唆し、通常は明らかではありません。忠実度のバリアントは、野生型と有意差はない速度で複製する場合は、それらの変異の頻度の比較を直接行うことができます。レプリケーションの速度で非常に重要な変更が存在する場合、データは複製を同じサイクル数を受けたウイルスを比較することによって、例えば運動の違い、を考慮して正規化する必要があります。ワンステップの成長速度に有意差が野生型と高忠実度の亜種間で観察されなかったものの、我々の経験では、、(内々には、より高い忠実度の亜種が一貫して野生型に比べて(1ログ内の)より高い力価が観察しかし、彼らはわずかにRNAを作る同程度の大きさ)は、さらにそれらが生み出すゲノムが少ない突然変異を含む多くの感染、従ってであることを示唆している。
サンプル調製とシーケンシングは。これらのプロトコルのすべての手順については、それは彼らが生物学的に関連する変異と区別できないので、高忠実度、プルーフリーディング酵素は、さらなる変異を導入制限するためにPCRおよびRT - PCRに使用されることが不可欠です。それは比較されるウイルスの集団は十分な出発材料ができたことを確認することも重要であると同じ条件(流路の歴史、組織培養培地、温度、RNA抽出法、RT - PCRのプロトコル、等)で準備されていることが重要です強力なバンドがRT - PCRによって生成されるように、RNAの抽出から得られる。 RNAサンプルの1 / 100希釈は、試料が(何度も同じゲノムを増幅する)表現のバイアスを避けるために、RNA分子の十分な数字が含まれていることを示す、検出可能なRT - PCRのバンドを与える必要があります。変異頻度がディストリビューションなので、一つは前述のバイアス発生していないを提供し、同様の値に関係なく、人口規模の得られることを期待。図6に示すように、ウイルスストックの10 5倍希釈では、親の株と大幅に異なるがない突然変異の頻度を与えます。
TopoTAクローニングのための最適な条件が見つかるまで、シーケンスの前にコロニーPCRによって、青/白スクリーニング後の挿入の有無を確認する。である(ウイルスのゲノムに対応するのin vitro転写されたRNAの変異ノイズ(RT - PCRおよびシークエンシングによって導入された変異)、プラスミドベアリングから同じウイルス配列をPCR産物をクローンおよび/またはクローンとシーケンスRT - PCR産物のためのコントロールとしてin vitro転写酵素で異なるが)別のエラー率を持っていると、プロシージャの実際のバックグラウンドでエラーに有用な情報を得られない可能性があることに注意。いくつかのウイルスの配列は、バクテリアに有毒かもしれないので、突然変異の頻度のために配列決定されるウイルスゲノムの領域を決定する前にこれを確認することが重要です。 TopoTAによって得られた配列を分析する際に、各クローンは1つだけ挿入/配列を含む必要があることに注意して。ダブルピークが混合集団を示唆し、観察される場合、それは2つの隣接する細菌のコロニーが選択されている可能性があります。非常に低い突然変異は細菌培養におけるプラスミドの増幅の間に導入されたこと、細菌の複製に低い突然変異の周波数を与えられたが、それは、も可能です。プラークpのurified集団、ダブルピークが重なってプラーク、またはプラークの開発中に新たな変異を獲得したり突然変異を戻しているウイルスを表してもよい。一貫性と数えるかどうか、これらの変異をカウントするかどうかを決定します。
最後に、ここで使用される突然変異の頻度は相対値であることに留意してください。彼らは、同じ条件下で栽培したウイルス集団の比較でのみ有効であり、同じ領域に塩基配列を決定!これらは、突然変異率、または全体としてのゲノムの変異頻度の絶対値として解釈されるべきではない。しかし、条件が制御されている場合、それらは、突然変異の分布と周波数の差の再現性、定量的な比較を許可しません。
開示事項
謝辞
この作品は、パリ市から医療研究助成金、フランス国立助成金ANR - 09 - JCJC - 0118 - 1、およびno ERCの開始グラントRNAvirusPopDivNVaxプロジェクトからの資金によって支えられている。 242719。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| リバビリン | シグマ | R9644 - 10mgの | |
| 5 - フルオロウラシル | シグマ | F6627 - 1G | |
| 5 - アザシチジン | シグマ | A2385 - 100mgの | |
| MgCl 2の | シグマ | M1028 - 100ML | |
| MnCl 2を | シグマ | M1787 | |
| トリパンブルー | シグマ | T8154 - 20mlの | |
| TopoTAクローニングキット | インビトロジェン | 10351021 | |
| Quikchange変異導入キット | アジレント | 200516 | cDNAの感染性クローンは入手可能である場合 |
| 96ウェルミニプレップキット | マシュレ-ナーゲル | 740625 | |
| Lasergene、Sequencher | DNASTAR、ジーンコード株式会社 | www.dnastar.com www.genecodes.com | または他のアラインメントソフトウェア |
参考文献
- Arias, A. Determinants of RNA-dependent RNA polymerase (in)fidelity revealed by kinetic analysis of the polymerase encoded by a foot-and-mouth disease virus mutant with reduced sensitivity to ribavirin. J Virol. 82, 12346-12355 (2008).
- Arnold, J. J., Vignuzzi, M., Stone, J. K., Andino, R., Cameron, C. E. Remote site control of an active site fidelity checkpoint in a viral RNA-dependent RNA polymerase. J Biol Chem. 280, 25706-25716 (2005).
- Korneeva, V. S., Cameron, C. E. Structure-function relationships of the viral RNA-dependent RNA polymerase: fidelity, replication speed, and initiation mechanism determined by a residue in the ribose-binding pocket. J Biol Chem. 282, 16135-16145 (2007).
- Pfeiffer, J. K., Kirkegaard, K. A single mutation in poliovirus RNA-dependent RNA polymerase confers resistance to mutagenic nucleotide analogs via increased fidelity. Proc Natl Acad Sci U S A. 100, 7289-7294 (2003).
- Pfeiffer, J. K., Kirkegaard, K. Increased fidelity reduces poliovirus fitness and virulence under selective pressure in mice. PLoS Pathog. 1, e11-e11 (2005).
- Vignuzzi, M., Stone, J. K., Arnold, J. J., Cameron, C. E., Andino, R. Quasispecies diversity determines pathogenesis through cooperative interactions in a viral population. Nature. 439, 344-348 (2006).
- Vignuzzi, M., Wendt, E., Andino, R. Engineering attenuated virus vaccines by controlling replication fidelity. Nat Med. 14, 154-161 (2008).
- Crotty, S., Cameron, C., Andino, R. Ribavirin's antiviral mechanism of action: lethal mutagenesis. J Mol Med. 80, 86-95 (2002).
- Coffey, L. L., Vignuzzi, M. Host alternation of chikungunya virus increases fitness while restricting population diversity and adaptability to novel selective pressures. J Virol. 85, 1025-1035 (2011).
- Ciota, A. T. Role of the mutant spectrum in adaptation and replication of West Nile virus. J Gen Virol. 88, 865-874 (2007).
- Ibarra, K. D., Pfeiffer, J. K. Reduced ribavirin antiviral efficacy via nucleoside transporter-mediated drug resistance. J Virol. 83, 4538-4547 (2009).
- Levi, L. I. Fidelity variants of RNA dependent RNA polymerases uncover an indirect, mutagenic activity of amiloride compounds. PLoS Pathog. 6, e1001163-e1001163 (2010).
- Sierra, S., Dávila, M., Lowenstein, P. R., Domingo, E. Response of foot-and-mouth disease virus to increased mutagenesis: influence of viral load and fitness in loss of infectivity. J Virol. 74, 8316-8323 (2000).
- Ruiz-Jarabo, C. M., Ly, C., Domingo, E., de la Torre, J. C. Lethal mutagenesis of the prototypic arenavirus lymphocytic choriomeningitis virus (LCMV). Virology. 308, 37-47 (2003).
- Sierra, M. Foot-and-mouth disease virus mutant with decreased sensitivity to ribavirin: implications for error catastrophe. J Virol. 81, 2012-2024 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved