Method Article
바이러스 변이 주파수의 RNA 바이러스 및 특성화의 피델리티 변종의 분리
요약
현재 문서는 RNA 바이러스 및 조직 문화의 충실도 변경 사항을 확인하는 돌연변이 주파수 데이터를 사용하는의 RNA 중합 효소의 충실도 변종을 분리하고 특징하는 데 필요한 단계를 설명합니다.
초록
RNA 바이러스들은 genomes을 복제하는 RNA 의존 RNA의 polymerases를 사용합니다. 이 효소의 본질적으로 높은 오류 비율은 바이러스 적응과 진화를 용이하게 극단적인 인구 다양성의 생성에 큰 기여입니다. 증거를 증가하면 고유 오차 속도와 RNA 바이러스의 돌연변이 결과로 주파수가 바이러스 효소에 미묘한 아미노산의 변화에 의해 변조된 수있다는 것을 보여줍니다. 생화학 assays는 법인 성실의 양적 측정을 허용 몇 가지 바이러스성 RNA의 polymerases을 위해 존재하지만, 우리가 충실도 변경 변이를 식별 생화 학적 접근처럼 정확하게 입증되었습니다 RNA 바이러스의 돌연변이 주파수를 측정하는 간단한 방법을 설명합니다. 접근 방식은 대부분의 생물 실험실에서 수행할 수 있습니다 종래의 virological 및 시퀀싱 기술을 사용합니다. 다른 바이러스의 번호와 경험을 바탕으로, 우리는 충실도 변종을 분리하고 통계적 의미의 데이터를 생성 가능성을 높이기 위해 최적화할 수 있어야합니다 핵심 단계를 확인합니다. 성실 변경 변이의 분리 및 특성은 효소의 구조와 기능 1-3에 새로운 통찰력을 제공할 수 있습니다. 또한, 이러한 충실도 변종 바이러스 적응과 진화 4-7의 메커니즘을 특성화에 유용한 도구가 될 수 있습니다.
프로토콜
1. 세포에 최소한 독성 mutagen의 농도의 범위를 결정
이 운동의 목적은 mutagen의 농도의 범위가 초과 세포 독성없이 감염 동안 사용할 수있는 결정하는 것입니다. 기본적으로, 당신은 바이러스 감염에 필요한 될 조건을 재현하는 것이 좋습니다. 대부분의 바이러스 감염이 7 일 사이 마지막. 매일에 샘플 세포에 충분한 접시를 준비합니다. 비 점착 성의 세포를 사용하는 경우, 그에 따라 프로토콜을 수정합니다.
- 당일 전에 실험 씨앗 7 X / 잘 하위 합류 (75 %) monolayer에게 실험의 하루를 달성 6 잘 플레이트에서 10 5 헬라 세포. 접시의 각 잘는 6 농도의 범위를 허용, mutagen의 각기 다른 농도로 취급됩니다.
- 실험의 날, 조직 문화 매체 mutagen의 dilutions을 준비합니다. 헬라 세포 들어, 기본 analogs에 대한 0-1000 μm의 범위 (ribavirin, 5 - fluorouracil, 5 - azacytidine), MgCl 2 0-50 MM하고, MnCl 2 0-5 밀리미터를 사용합니다.
- 우물에서 매체를 대기음 2 ML mutagen - 보충 매체와 인큐베이터로 돌아가 함께 바꿉니다.
- 24 시간마다는 세포 생존을 확인하는 세포 중 하나가 접시를 사용합니다. 이것은 얼룩 푸른 trypan를 수행하거나 상용화 형광 / 발광 assays (예 : Promega의 CellTiter - 글로 ® 발광 세포 생존 분석)를 사용하여 수행할 수 있습니다.
- trypan 블루 제외 얼룩 들어, 하나의 플레이트 (mutagen의 다양한 농도로 처리) 및 원심 분리에 의해 부드럽게 펠릿 세포에서 세포를 분리.
- PBS에 뜨는 및 resuspend 세포를 (혈청 얼룩을 방해할 수 있습니다) 폐기하십시오.
- 상온에서 2 분 동안 품어 0.4 % trypan 파랑, 1 볼륨 PBS 1 볼륨 세포 현탁액을 섞는다.
- hemacytometer에서 실용적 (흠없는) 및 비 가능한 (스테인드 파란색) 세포를 계산합니다. 치료 컨트롤을 포함하여 mutagen의 각 농도에 대해 가능한 세포의 비율을 계산합니다. 우리는 감염 종점에서 50 % 미만의 세포 사망 (최대 titers에 도달하는 경우)의 결과가 mutagen 저항의 절연에 이상적입니다 그 조건을 찾으십시오.
2. 적당히 (약 0.5-2 로그 감소) 바이러스 titers을 줄여 최적의 비 독성 mutagen 농도를 결정
이 운동은 인구 오버 mutagenizing없이 강력한 선택 압력을 발휘합니다 mutagen의 농도를 결정하는 역할을합니다. RNA mutagens 들어, 우리는이 바이러스 titer의 10.5-2 로그 감면에 해당하는 것을 발견했습니다. 이 농도에서 모든 게놈은 적어도 하나 또는 두 개의 위치에 변이이다. mutagen 다음 통로를 통해 선정됩니다 저항 변이의 생성에 도움이됩니다. 너무 많은 돌연변이 (매우 높은 mutagen의 농도에서) 도입하는 경우, 저항 변이를 베어링 돌연변이 자체가 그들의 고립을 막고, lethally mutagenized 것입니다.
- 단계 1과 동일한 조건을 사용하는 전지로 시드 플레이트
- 실험의 날, 조직 문화 매체 mutagen의 dilutions을 준비합니다. 위의 결정과 같은 농도 같은 범위를 사용하지만 50 % 이상 세포 죽음을 초래한 농도를 제외할 수 있습니다. mutagen 각각의 농도로, 감염하기 전에 세포의 전처리에 대한 수 있도록 (물론 최대 4 개의 ML) 두 번 각 우물을 감추기에 충분 할만큼 매체 준비.
- 2 시간 mutagen - 보충 매체 잠복기하여 mutagen와 미디엄과 pretreat 세포를 대기음. 대부분의 세포 유형에 대한,이 mutagen의 이해를위한 충분한 시간이다.
- 미디어를 제거하고 최소 볼륨에서 감염의 낮은 다중성 뫄 (0.1 또는 0.01) (6 - 잘 접시 200 μl)에서 바이러스에 감염. 바이러스가 세포를 감염시킬 수 있도록 15-60 분 정도 알을 품다. inoculum이 세포 monolayer을 커버 수 있도록 정기적인 간격으로 접시를 록.
- 주사 바이러스를 대기음하고 가능한 inoculum의 많은를 제거 2 ML PBS로 두 번 씻는다.
- 3-6 복제주기의 상당 각 잘하고 품어 세포에 mutagen의 적절한 농도와 매체를 추가합니다.
- 하베스트 각 우물에서 바이러스 및 바이러스 titer의 항바이러스 효과를 결정합니다. 이것은 표준 상패 분석하거나 희석을 제한 (TCID 50)하여이 작업을 수행할 수 있습니다. 참고 : mutagenic 효과가 감지되지 않을 수 있기 때문에 측정만이 RNA 합성이 적합하지 않을 수 방법으로 바이러스의 부량. 치명적인 변이를 포함하는 Mutagenized genomes은 여전히 예를 들어 qRT - PCR에 의해 감지 수 있지만, 바이러스 생존의 assays에서 관찰되지 않을 것입니다.
- 계산 titers에서, 또한 세포 (이상, 50 % 미만의 독성)에 매우 독성되지 않습니다 10.5-2 기록하여 바이러스 titers을 줄여 mutagen의 농도를 (치료 제어 감염에 비해) 식별합니다.
3. 분리 및 identimutagen 강한 변종 fication
위에서 정의한 최적의 mutagen 농도에서 대규모 인구 크기 통로를 수행하고 통로 시리즈를 통해 바이러스 titers를 확인하십시오. 컨트롤 마찬가지로 모든 mutagen없이 성장 매체 통로 바이러스. 다른 컨트롤 결함이 방해 입자 (DI)의 잠재적인 출현을 모니터로, 각 통로 단계 (unpassaged 제어)에 mutagen의 부재에 신선한 감염을 수행합니다.
- 당일에 감염, 종자 25cm 전에 1.5 X 10 6 헬라 세포 (다른 플라스크 크기를 사용할 수 있습니다) 2 flasks은 다음날 하위 합류 monolayers를 얻을 수 있습니다.
- 감염의 날, 제 2의 결정 각 mutagen의 최적 농도를 포함하는 매체를 2 시간 동안 세포를 pretreat.
- 미디어를 제거하고 뫄 1이나 바이러스가 연구되고 결함에 대한 방해 (DI) 입자 형성을 초래하지 뫄 최대에서 최소 볼륨 세포를 감염.
- 감염의 30~60분 후, inoculum를 대기음하고 PBS로 두 번 세척 후, 적절한 농도에서 mutagen와 보충 신선한 매체를 추가하십시오.
- 이러한 조건에서 최대의 바이러스 titer에 해당하는 섹션 1과 2에서 결정 시간의 기간 동안 품어. 자손 바이러스를 수확.
- Titer 각각의 통로에서 바이러스와 3 위의 단계를 반복합니다.
- 처음 몇 구절 동안 mutagen 처리 샘플 바이러스 titers 원래 바이러스 titer 및 제어 (치료 및 unpassaged) 바이러스 titers에 비해, 그에 따라 드롭한다. mutagen의 바이러스 titers이 샘플은 치료 컨트롤과 같은 수준으로 올라 passaged 경우, 인구는 가능성이 mutagen 강한 변종을 포함하고 있습니다. 우리는 5 15 구절 사이의 충실도 변종의 대부분을 격리 있지만 최대 20 ~ 30 구절로이 필요할 수 있습니다.
- 주어진 통로 시리즈 바이러스 titers은 치료 제어 titers 같은 크기에 도달하면, 같은 통로 번호에서 치료 관리를 포함한 모든 샘플에서 RNA를 추출. RNA 추출 키트 또는 Trizol 추출 사용할 수 있습니다.
- 관심의 바이러스의 중합 효소 또는 replicase 유전자를 증폭 primers를 사용하여 RT - PCR을 수행합니다. 두 번째 단계에서는, 전체 게놈은 (적어도 코딩 지역) 저항 phenotypes뿐 아니라 다른 바이러스 유전자에 매핑 여부를 조사하는 합성한다. 이것은 바이러스와 세포 기능의 다른 측면에 영향을 미치는 ribavirin 같은 기본 아날로그 mutagens, 특히 중요합니다. 이 경우에는 변종이 다른 항바이러스 활동 중 하나에 강한 수 있으며 충실도 변형되지 않습니다.
- mutagen 방지 인구 합의 순서를 얻기 위해 PCR 정화 키트 및 시퀀스를 사용하여 RT - PCR 제품 정화. (토론 참조) 순서 오류에 대한 배경 컨트롤을 포함합니다.
- 참고로 순서 정렬 소프트웨어와 바이러스 합의 순서를 사용하여 시퀀스를 정렬합니다. 바이러스 titers 정상 수준에 도달 통로에서 mutagen 취급 인구만을 표시하는보다 세심한주의와 함께 새로운 포인트 변이를 식별합니다. 이 돌연변이 이전 구절에서 현재와 같은 통로 번호 (세포 배양 통로에 적응을 나타내는)에서 치료 컨트롤에 존재하지 않습니다면,이 변이는 mutagen의 저항에 적어도 부분적으로 가능성이 책임을진다. 기본 불리는 순서 (시퀀스의 텍스트 버전) 혼자 정렬 소프트웨어에 의존하지 마십시오. 정렬 소프트웨어 놓친되었을 수도 있습니다 소수 봉우리에 대한 chromatograms를 확인하십시오. 전체 인구의 20~30%을 나타내는 돌연변이 아직 정상으로 표시하지만, 표준 서열 분석에 의해 'N'으로 식별 너무 작은 것입니다.
4. 돌연변이가 확인되면 격리 또는 생성 변종을 여러 RNA의 mutagens에 저항 표현형 확인
다음, 확인된 변이를 제시 변종은 저항 표현형하기 위해 링크를 확인하기 위해 격리됩니다. 그것은 정절을 변경하는 의심 돌연변이가 (즉, 다른 게놈에 추가 변이를 제시하지 않음) 유전자 깨끗한 배경에 공부는 것을 중요합니다. 최고의 상황에서 전염성 cDNA 클론은 깨끗한 유전 배경에 사이트 이동 돌연변이 유발에 의한 mutagen 모성 변형의 주식의 생성을 허용 것이 존재합니다. 이 경우에는 제 4 필요가 없습니다. cDNA 클론를 사용할 수없는 경우에는 격리는 아래에서 설명하는 바이러스의 상패 정화에 의해 할 수 있습니다. 상패 정화 하나 이상의 라운드는 깨끗하고 유전 배경에 변종을 분리해야 할 수 있습니다.
- 상패 분석하여 mutagen 모성 돌연변이의 분리.
- 확인된 돌연변을 분리하려면, 아가로 오스 (WT / 권 최종 0.5-1 %) 6 - 잘 접시에 오버레이 아래 표준 상패 분석을 수행합니다. dil에 주식 titers에 따라 바이러스의 시리얼 dilutions을, 준비10 50 잘 구분 plaques 사이에 생성됩니다 utions.
- plaques은 (대개 바이러스에 따라 2-5일 게시 감염) 명확하게 표시되는 경우, 접시에 plaques의 위치를 표시하고 필터 팁과 p200 피펫을 사용하여 부드럽게되는 아가로 오스의 오버레이를 통해 팁을 뛰어들다하지 않도록주의 이동시키다 및 (개인 plaques의 교차 오염을 초래 하리라는 사실)을 오버레이의 위치를 이동.
- 조심스럽게 오버레이 밖으로 팁을 리프트와 매체 및 와동 250 μl를 포함 eppendorf에 팁에 포함된 아가로 오스 플러그를 전송할 수 있습니다. 제거 끝은 아가로 오스를 포함하지 않는 경우 걱정하지 마세요, 많은 RNA 바이러스에 대한 많은 RNA 바이러스에 대한 평균 상패가 10 5 바이러스를 포함하고 충분한 양의은 상패의 표면에 팁을 만져 간단히 전송됩니다.
- mutagen 처리 당 10 plaques까지 선택하십시오. 그 변이를 확인 순서의 chromatograms에 따라 원하는 변이를 포함하는 인구의 비율을 대략 예상하고있다. 목표는 돌연변이로 서너 plaques을 분리하는 것입니다. 이러한 돌연변이 중 일부는 나중에 시퀀싱에 의해 식별됩니다 추가, 원치 않는 변이를 수행합니다.
- (그러나 바이러스의 큰 주식을 만들 수있는 샘플의 절반을 저장)이 샘플에서 RNA를 추출하고, 전체 게놈의 시퀀싱을 허용합니다 RT - PCRs를 수행합니다. 추가 변이없이 원하는 돌연변이를 포함하는 분리를 식별하는 동시에 바이러스를 정화함으로써, 순서 3 또는 4 상패, 평균, RNA 바이러스는 합의 순서에 관하여 두 mutational 차이까지 포함됩니다.
- 일단 확인, T75 플라스크에 세포, 예를 들어 8x10 6 헬라 세포의 큰 플라스크를 감염 위의 얻은 플라크 정화 샘플을 사용하여 모든 스트림 연구에 대해이 바이러스의 큰 주식을 ...
- 확인된 돌연변이에 의해 수여 mutagen 감도 / 저항을 확인합니다.
- 중 mutagen의 농도의 전체 범위, 또는 저항 변이가 생성된되는 농도를 사용하여 제 2의 실험을 반복, 유사한 조건에서 준비한 격리 또는 새로 생성된 복제 및 야생 유형 제어 바이러스를 사용합니다.
- (ribavirin, 5 - fluorouracil, 5 - azacytidine, MG 2 증가 +, MN 2 +). 여러 RNA mutagenic 조건을 사용하여 효소의 변종은 mutagen 하나 이상의 종류에 강한되면 이것이 변종 높은 충실도는 것을 가능성이 높습니다. 또는, 그것은 이러한 화합물 중 일부는 메커니즘 8 숫자를 통해 RNA 바이러스에 영향을 특히 이후 저항 돌연변이 하나 mutagenic 조건에 대한 구체적인 가능성이 있습니다.
5. 복제 요금을 확인
이후 성실 - 변경 돌연변이 가장 자주 효소에지도가 동일한 효소의 돌연변이 상당히 복제 속도론을 변경시킬 수도 있으며 그것이 돌연변이 주파수의 차이를 잘 비교는 아래 수행 허용됩니다 유사점과 복제의 차이를 결정하는 것이 중요합니다. 바이러스 생산 및 RNA 합성을 조사하여 그 다른 검사 - 하나 이렇게하려면 적어도 두 무료 방법으로 복제를 확인합니다.
- 한 단계 바이러스 성장 속도론
- 당일 전에 실험 씨앗 6 - 잘 접시 필요한 경우, 테스트하는 시점 당 한 판. 각각의 돌연변이와 야생 유형 바이러스 세중의의 우물을 사용하는 것을 고려하십시오.
- 실험의 날, 미디어를 제거하고 모든 세포가 동시에 감염되도록 뫄 10 각 바이러스에 우물을 감염. 37 30-60분을 품어 ° C.
- 록 접시 10 분마다 세포 monolayer의 건조되지 않도록합니다. 바이러스를 제거 2 ML PBS로 두 번 씻는다. 가능한 inoculum의 많은를 제거하는 것이 중요합니다. 성장 매체로 바꾸십시오.
- 한 접시에서 시간 = 0, 수확에게 바이러스를 감염에 따라. 인큐베이터에 접시를 반환하고 단일 복제주기를 (7h 3H에 대한 예, 5h, 9h, 12h, 24 시간) 기간 정기적으로 바이러스를 수확.
- Titer 각각의 시점 (예 : 상패 분석, TCID50, FFU 분석)에 수확 바이러스, 그리고 그래프 titer 대 시간의 성장 곡선.
- RNA 합성의 속도론
RNA 합성의 속도론은 접근 방법 중 하나를 아래에 표시를 사용하여 모니터링할 수 있습니다. 가능하면 한 단계 성장 속도론을 결정하는 데 사용되는 동일한 시료 RNA 수준을 측정하는 데 사용해야합니다.- qRT - PCR. 이 절차는 분석의 감도에 따라 몇 게놈 사본에서> 10 10, 큰 범위에서 복제의 높은 양적 측정을 제공합니다. 디자인 primers 고도 보존 게놈 지역의 작은 조각 (<200 BP)를 커버 프로브.
- 노던 얼룩 분석. qRT - PCR보다 정량 있지만,이 기술은 복제 결과 전체 길이 genomes 및한다는 의미 체인 해지는 중합 효소 돌연변이의 결과로 발생하지 않는 시각적 확인을 수 있습니다.
- 리포터 유전자의 표현. 리포터 유전자 (예 루시페라제) 표현 cDNA 클론을 사용할 수있다면, 이것은 replicative 용량을 검사하기 위해 대리로 사용할 수 있습니다. 이 바이러스가 삽입된 리포터 유전자를 삭제하는 경향이 있기 때문에이 바이러스에 행동 선택적 압력이 특히 같은되지 않습니다 때문에 그러나, 재조합 바이러스는 다른 응용 프로그램 (예 : 돌연변이 주파수의 결정 등)에 사용해서는 안됩니다.
6. 측정 돌연변이 주파수
이것은 확인된 효소의 돌연변이가 mutagen 바꿀지도 모르겠어 복제 충실도에 대한 저항력을 부여하는 것을 확인에있는 중요한 단계입니다. 여기서 측정된 주파수 변이가 돌연변이 속도를하지 않는주의하는 것이 중요합니다. 요금, 복제 속도론 매우 신중 측정 (합성 RNA의 양과 복제주기의 길이)를 확인하려면, 그러나 돌연변이 주파수를 측정 인치 고려되어야 한 통과 기록 및 복제 속도론을 감시 등 복제의 재현성, 양적 조치를 제공합니다 성실. 돌연변이 주파수는 중 가능한 바이러스 인구 (플라크의 클론 또는 제한 희석) 또는 전체 바이러스 인구 (바이러스 주식 또는 표면에 뜨는)에서 확인할 수 있습니다. 돌연변이 주파수를 확인하려면, 나중에 통로 (예 : 통로 2 또는 이후)에서 바이러스 주식을 준비합니다. 바이러스 인구가 가까이 돌연변이 - 선택 균형하기 위해 유전 다양성을 확장하는 시간을 갖고하는 것이 중요합니다.
- 가능한 바이러스 인구의 돌연변이 주파수
이 방법은 더 힘드는지만, 복제 능력을 유지 평균 게놈에있는 얼마나 많은 돌연변이에 대한 정보를 제공합니다. 이것은 높은 피트니스 변종에 대한 편견이 발생할 것입니다, 그러나, 언급되어야하며 낮은 적합성, 실용적 변종 쉽게 상패는, 예를 들어, 검색되지 않을 수없는. 따라서, 그것은 또한 동의어보다 조치 (DS)와 긍정적인 선택이 인구에 연기 여부를 탐색하는 데 사용할 수있는 비 동의어 (DN) 뉴클레오 티드 대체를 허용합니다. 더 적은 변이가 계량 것입니다 때문에, 시퀀스의 큰 숫자는 통계 분석을 위해 필요한 것입니다. 이 기술은 위에서 설명한 바와 같이, 상패 정화 또는 제한 희석에 의해 개별 바이러스의 고립에 의존하고 있습니다. 출발점으로, 우리는 야생 타입 바이러스 및 mutagen 모성 변형 48 개인 '클론'의 절연을하는 것이 좋습니다. 이러한 방식으로 분리된 각각의 clonal 인구는 설립자의 게놈은 표시대로 돌연변이 수행할 예정입니다. RNA의 금액은 고립 플라크에 존재하거나 희석을 제한하는 것은 물론 일반적으로 RT - PCR에 의해 증폭 충분합니다. 필요한 경우, 세포의 최소 숫자 (예 : 24 웰 플레이트 형식)에 대한 짧은 증폭 (이하 하나의 복제주기)가 더 많은 RNA를 얻는 데 사용할 수 있지만, 최소 증폭 새로운 변이의 축적을 피하기 위해 수행되어야합니다. 비교 각 클론과 인구 복제 사이클의 동일한 숫자를 받아야해야합니다.- 상패 정화 또는 제한 희석하여 24-48 바이러스 클론을 분리.
- 격리 clonal 인구에서 RNA를 추출
- RT - PCR은 각 샘플에 대해 3킬로바이트까지 커버 조각을 증폭. 비 구조 유전자의 이상 보존 지역보다 더 가능한 변이를 용납하는 경향이 구조 단백질 영역을 커버하는 것이 좋습니다.
- PCR 제품, 순서를 정화 및 돌연변이 분석 (섹션 7) 수행합니다.
- 전체 바이러스 인구의 돌연변이 주파수
이 두 번째 방법의 장점이있다지만도 낮은 피트니스 변종은 돌연변이의 스펙트럼의 광범위한 사진을 허락 배열에 포함됩니다. 그러나, 가능한 바이러스 집단 (예 : DN / DS 값)과 가장 관련성이 높은 변이의 신분을 가정 phylogenetic 분석에 적합하지 않을 수 있습니다 때문에 치명적인 변경 사항을 완전히 확인할 수 없습니다 (RNA 구조가, 정지 codons, 극적인 아미노산 변화가 변경) 및 분석에 유지됩니다. 그럼에도 불구하고, 이것이 기술은 체외 생화 학적 분석에의 부족이있을 때 성실 변경을 확인하는 가장 통계적으로 의미가있는 데이터를 얻을 수있는 연구원 수 있습니다. 이 기술은 낮은 적합성 또는 plaques을 생성하지 않습니다 치명적인 돌연변이와 genomes를 포함하여 총 virion의 RNA의 RT - PCR 증폭에 의존합니다. 이 방법에 의해 얻은 돌연변이 주파수는 플라크 또는 희석 복제를 제한하여보다 10 배 높은 수 있습니다.- 전체 virion 인구에서 RNA를 추출
- RT - PCR ampli년도 변이를 용납하고 유전 분산 (예 : 구조 단백질)이 알려져있다 게놈 코딩 순서의 일부에서 800-1200 염기 지역. 큰 조각은 TopoTA 같은 복제 벡터에 쉽게 삽입되지 않으며 transformants의 부족 번호를 생성합니다. 작은 조각도 더 있지만 게놈 합성의 보험 통계 중요성을 얻기 위해 너무 작은 수 있습니다. 최소 800 BP의 조각은 두 primers와 시퀀스 범위를 허용하고 시퀀스 범위를 극대화하고 시퀀싱 비용을 최소화 사이 좋은 타협이다. 우리는 800 염기 영역을 포함 70 사이에 100 시퀀스 reproducibly 우리가 실험실에서 공부했습니다 변종의 변경된 충실도를 확인 것을 발견했습니다. 다른 벡터 / 복제 방법이 동일 효율적으로 사용할 수 있습니다.
- 상용 키트 또는 표준 DNA 추출 / 석출로를 사용하여 RT - PCR 제품을 정화.
- 사용 RT - PCR 효소가 overhangs을 생산하지 않는 경우, 1 μm의 ATP 및 DNA 형성 촉매 효소를 추가하여 10 분 연장을 수행
- 제조 업체의 지침에 따라 TopoTA 클론
- 각 바이러스 인구가 공부하기 위해서는, XGal 코팅 접시에 흰색 / 파란색 검사하여 긍정적인 삽입을 가진 것으로 확인된 96 식민지를 선택합니다. 처음에는 아가로 오스 젤 또는 단일 콜로니 PCR에 플라스미드의 크기 심사에 의해 백색 / 블루 심사의 타당성을 확인하기 위해 복제되는 각기 다른 게놈 영역에 대한 삽입의 존재를 테스트합니다. 조각의 크기와 이상의 조건을 사용하여, 우리는 90 % 반응을 달성
- 96 잘 세균성 문화 접시에있는 LB 매체 1 ML에서 하룻밤 액체 스프의 각 식민지를 성장
- 다음날 96 아니라 형식으로 minipreps을 준비합니다.
- 복제된 세그먼트의 최대 범위를 얻을 정도로 primers (예를 들어, RT - PCR에 사용 primers, 또는 TopoTA m13의 primers)와 시퀀스의 각 판. 돌연변이 분석 (섹션 7) 수행합니다.
7. 서열 분석
각 인구 적절한 정렬 소프트웨어에 대한 참조 또는 합의 순서를 사용하여 시퀀스 분석을 수행합니다. 우리는 Lasergene 또는 쉽게 합의에 관한 SNPs를 식별할 수 Sequencher을 권장합니다.
- 적절한 소프트웨어 (예 : Lasergene 또는 Sequencher)를 사용하여 시퀀스를 정렬합니다.
- 품질 시퀀스를 (나쁜 기본 전화, 너무 많은 'N의 또는 길이가 너무 짧은) 폐기하십시오. 모든 시퀀스에 의해 덮여있다 염기 범위를 식별합니다. 게놈의 다른 지역이 더 많거나 적은 변이를 용납하기 때문에 비교 이유는 동일한 영역이 완전히 분석으로는 각 합성의 클론에 대한 덮여 것이 중요합니다. 여러 시퀀스 반응이 클론마다 수행, 하나의 시퀀스가 해당 복제에 실패하는 경우 따라서, 분석의 복제 (모든 시퀀스) 삭제.
- 식별 및 참조 부담에서 다른 SNPs를 계산합니다.
- (지역 합성의 클론 X 길이의 수) 합성 세포핵의 총수로 식별 SNPs의 총 수를 나누어 변이의 주파수를 계산. 10K NT 합성마다 변이의 평균 개수는 염기마다로 떠나는보다 사용자 친화 다음 번호를 렌더링으로이 번호를 제시. 예를 들어, 표 1, 55 야생 타입 인구 mutations/121, 978 총 세포핵 X 10,000 10,000 세포핵 당 = 4.51 변이 합성.
- 동일한 SNP는 클론의 다수에 나타나는 경우, 이러한 반복 변이를 포함하거나 제외할 두 값을 제시한다. 일반적으로 동질적인 부모 (상패 정화 또는 전염성 클론에서)에서 생산 및 세포 배양에서만 몇 번 passaged 바이러스 인구, 긍정적인 선택은 동일한 SNP의 축적과 돌연변이를 일으킬 정도의 영향을 끼쳤다되지 않았습니다 주파수 값이 방법이 더 긍정적이나 정화 선택의 최소한의 효과와 효소의 오류 빈도를 반영 측정.
- 돌연변이의 분포를 확인합니다. 각 인구 클론의 수를들의 우선 순위되는 현재 0, 1, 2, 3, 등 만들기 .. 지역의 돌연변 합성.
- pairwise 거리 비교하여 바이러스성 인구 다양성을 계산합니다. 에서 청소하고 수동으로 편집한 시퀀스가 참조 영역을 포함하여 정렬을 준비합니다. ClustalW / X (사용 가능한 여러 정렬 프로그램이 있습니다 http://www.clustal.org/ ), 근육 ( http://www.drive5.com/muscle/ Mac 사용자를위한), EbioX ( http://www는. ebioinformatics.org / ebiox / ) 등 정말 모든 시퀀스가 동일한 길이가 필요한 경우 작물 아르합니다. 이것은 시퀀스의 시작은 사후 분석을 용이하게하기 위해 코딩 코돈 것을 권장합니다. 우리가 쉽게 사용할 수 대부분의 소프트웨어에서 읽을 수 있습니다 fasta 형식의 모든 정렬을 유지하는 것이 좋습니다.
- 을 pairwise 거리 분석을 수행하려면, 같은 인구에 속하는 시퀀스 사이에 가능한 모든 pairwise 비교 계산합니다. 비교에서 발견된 평균 변이는 다음 인구 이질를 나타내기 위해 계산하실 수 있습니다.
- 동의어 (DS)와 인구 이내 (DN) 이외의 동의어에 대한 값을 쉽게 구할 수 있습니다. 우리는 메가 소프트웨어 (http://www.megasoftware.net/)가 유용하고 이러한 종류의 분석을위한 친절한 사용자 찾습니다.
- 그들이 가능한만이 아니지만 선택의 방향을 얻으려면 우리는 두 가지 가능성을 제공합니다. 1) DN과 DS 사이의 비율을 구합니다. 하나 이상의 값 긍정적인 선택을 의미합니다. 1보다 낮은 값을 정화 선택을 의미합니다. 2) Datamonkey 웹서버 (사용 http://www.datamonkey.org/ ). fasta 형식으로 정렬을 업로드하고 SLAC 모듈을 분석할 수 있습니다. 이것은 당신에게 DN / DS의 견적을 제공할 것입니다.
- 통계 분석을 수행합니다. 데이터 및 시퀀스 번호의 수량에 따라 테스트의 다양한 사용하실 수 있습니다. 일부 연구가 모든 클론은 9 결합 합의 세포핵의 총 개수 대비 변이의 총 개수 치 평방 테스트에 의존합니다. 다른 연구는 피셔의 정확한 테스트를 수행 돌연변 10 않고 시퀀스의 수를 비교 변이를 제시 시퀀스의 수를 계산합니다. 충분한 mutational 데이터가 생성되면, 우리는 각각의 RNA 합성에있는 변이의 수를 기준으로 각각의 바이러스 인구 클론의 수를 순위, 이렇게하려면 같은 만 휘트니 U.으로 순위 합계 테스트를 수행하는 것이 좋습니다. 만 휘트니는 다음 인구의 돌연변이 분포의 차이에 대한 테스트합니다. 이러한 이유로, 우리는 여러 변이와 클론을 찾는의 가능성을 높일 적어도 800 기본 쌍을 시퀀싱하는 것이 좋습니다. 이 테스트는 강력하지만 큰 샘플 크기를 필요로합니다. 반면에, 그것이 비교되는 두 인구에 대해 동일한 샘플 크기를 필요로하지 않습니다 (예 : 표 1의 샘플은 N 1 = 148와 N 2 = 84아르).
8. 대표 결과 :
세포 생존 및 바이러스 생존 능력에 mutagen 농도의 선량에 의존 효과는이 예제에서, 우리는 100 μm의 제품 AZC에서 바이러스 통로가 대상 10.5-2 로그에 의해 바이러스 titer 감소되었음을 발견했다. 그림 1에 나타난하지만, 헬라 세포 생존했습니다입니다 부정적인 바이러스 감염에 필요한 2 일 동안 영향을하지 않습니다. 바이러스의 시리얼 통과 100 μm의 AZC 농도의 선택에 LED이 시범 실험, mutagen의 저항에 따라 선택할 수 있습니다. 그림 2 mutagen 저항 표현형의 출현 다음 titer의 초기 감소를 보여줍니다. mutagen의 처음 몇 구절 동안 치명적인 돌연변이가 축적으로 바이러스 titers에 큰 방울이 발생합니다. 서서히, mutagen 방지 변종의 출현이 경과 컨트롤로부터 다른 바이러스 titers에 반환과 일치 나온다. 이 단계에서는 바이러스 인구의 큰 비율은 저항 변이를 제공합니다. 이 바이러스 인구의 시퀀싱하면 아미노산의 변화 (S)이 책임을 보여줍니다. 일단 확인하고, 격리 또는 새로 생성된, mutagen 방지 바이러스는 다른 RNA mutagens에 야생 유형 (서로 다른 구조의 기본 analogs, 예를 들면)보다 민감 수 있습니다. 그림 3보다 높은 titers RNA mutagen 방지 콕새키 바이러스 B3를 보여줍니다 ribavirin, 5 - fluorouracil, 5 - azacytidine, 높은 MgCl 2, MnCl 2 앞에서 야생 입력합니다. RNA mutagens에 광범위한 저항은 증가 복제 성실의 강한 표시이다. 돌연변이 주파수의 비교에 도움이 될 충실도 변종의 복제 속도론을 확인하는 것은 야생 유형의 바이러스와 비슷합니다. 그림 4는 야생 유형에 비해 높은 충실도 변형의 한 단계 성장 속도론을 묘사. 복제 속도와 최종 titers 비슷한하지 않은 경우, 다음 단계는 복제의 반올림 같은 번호를받은 유사한 크기의 바이러스 인구를 비교로 이동해야합니다. RNA 합성 속도와 복제 충실도 사이의 링크는 잘 특히 생체내에서 특징되지 않습니다. 이것은 절대적인 규칙은 아니지만 그림 4와 같이 느린 복제 속도, 감소 돌연변이 주파수 (높은 충실도)에 발생할 수 있습니다. 위의 매개 변수가 설립으로 충실도 변형 및 야생 형식 인구의 돌연변이 주파수는 변경 복제 성실의 유전자 확인을 구하는 비교할 수 있습니다. 점 돌연변이가 확인된와 그림 5는 야생 타입과 높은 충실도 변형의 순서 정렬을 보여줍니다. 10,000 세포핵은 그림 6을 합성마다 변이가 계산됩니다, 클론 당 돌연변이 (표 1)의 개수에 따라 결정하고, 인구 당 평균 돌연변이 주파수로 표시.

그림 1. RNA mutagen의 저항에 따라 선택하여 최적의 조건을 결정 :. 중간 (바이러스 titer에 1-2 로그 드롭) 헬라 세포 높은 세포 생존 능력의 유지는 ribavirin의 표시 농도를 취급하고 뫄에서 야생 유형 콕새키 바이러스 B3 감염된 0.01니다. 48시간 게시물 감염, 자손 바이러스가 수확되어 titers는 TCID 50에 의해 결정됩니다. Trypan 푸른 얼룩에 의해 결정 48 시간 치료를 생존 세포의 비율은, x 축은 아래 표시됩니다. 결과는 100 농도 200 μm의이 세포 생존에 영향을주지 않고, 1-2 로그에 의해 바이러스 titers을 줄일 것을 보여줍니다.
그림 2. RNA mutagens의 적당한 농도의 존재에 시리얼 통로 mutagen 모성 인구를 위해 선택합니다.이 그림에서 Chikungunya 바이러스가 50 μm의 ribavirin (회색 막대)의 존재에 헬라 세포에 passaged되었습니다. 제어 통로는 ribavirin의 부재 (검은 막대)에서 수행되었다. 각 통과 후, 바이러스 자손은 BHK 세포에서 고전 상패 분석하여 계량했다. mutagenic 효과는 첫 번째 구절 중에 분명하다 (p0 시작 인구에 비해 P1 및 P2) 어디에이 로그에 의해 취급 바이러스 titers 드롭. 서서히 titers 정상 (치료) 수준으로 돌아갑니다. 더 중요한 차이점은 강한 변종이 선택되었는지 제안, 치료에 비해 통로 5 mutagen 처리 인구에서 관찰되지 않습니다. 실제로, 전체 인구의 합의 순서는 ribavirin 치료를 받고 바이러스 인구 독특한 변이를 발견.
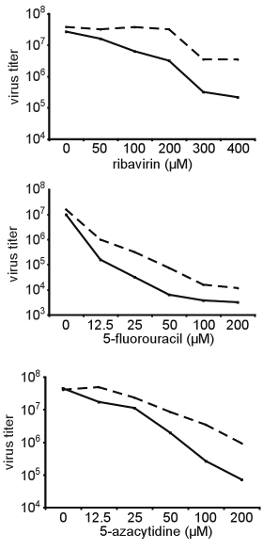
그림 3. 다양한 구조의 mutagens를 RNA에 광범위한 저항의 확인은. 여기에 표시된 초기 제 3 절에서 설명하는 화면에서 고립되었다 콕새키 바이러스 B3의 높은 충실도 A372V 변종은 감염 복제에서 생성 및 다양한 농도하기 위해 상대적으로 감도를 위해 테스트되었습니다 다른 RNA mutagens (ribavirin, 5 - fluorouracil, 5 - azacytidine). 헬라 세포는 ribavirin의 표시 농도와 치료 및 뫄 0.01의 야생 유형 콕새키 바이러스에 감염된 B3되었습니다. 48시간 게시물 감염, 자손 바이러스가 수확되어 titers는 TCID 50에 의해 결정됩니다. 야생 유형 (고체 라인)과 A372V 변종 (점선 라인) mutagen 농도의 함수로의 titers은 여기에 표시됩니다. A372V 지속적으로 테스트를 모든 조건 하에서 야생 입력보다 높은 titers.
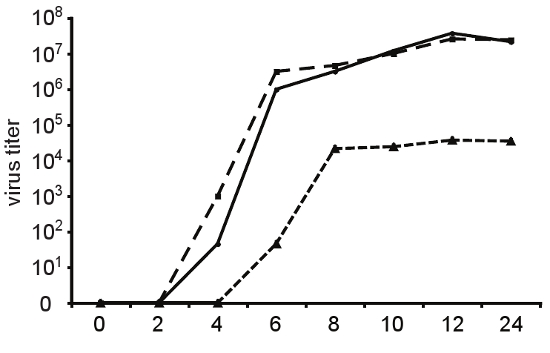
그림 4. 복제 속도와 충실도 변종. 바이러스 생산의 한 단계 성장 속도론을 확인하려면은 헬라 세포는 중 야생 종류 (실선), 높은 충실도 변종 A372V (긴 대시) 또는 복제 결함 변종 Cx64 (단편과 뫄 = 10에 감염되었습니다 콕새키 바이러스 B3의 대시). 시간 지점에서 바이러스 자손이 동결 - 해동하여 세포 supernatants에서 수확 및 TCID 50에 의해 titered 되었음 지적했다. A372V의 충실도 증가 조직 문화에 관찰 복제 결함과 일치하지 않습니다. 변형 Cx64 복제 속도론에 상당한 지연을 제시하고 야생 유형 바이러스보다 1,000 배 낮은 최대 titers 도달합니다.
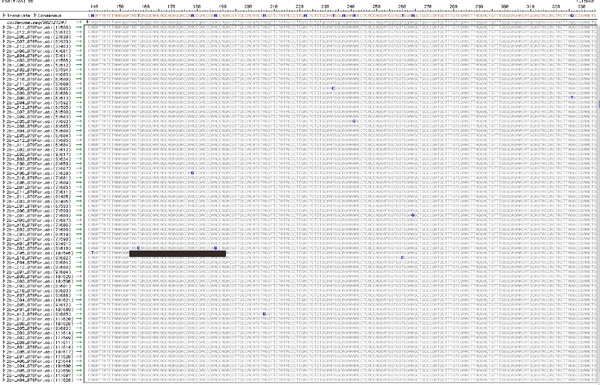
그림 5. 각 바이러스 인구에서 TopoTA 복제 시퀀스의 정렬. 제 7, 복제 RT - PCR 제품에서 얻은 각각의 순서에 설명된 방법을 사용하면 아마도 전체 바이러스 인구 내에서 하나의 독특한 게놈에서 유래하기 때문에, 독특한 변이를 수행합니다. 그림은 품질이 낮은 시퀀스와 SNPs의 시각화의 청소까지 다음과 같은 전형적인 정렬을 보여줍니다. 인구 내에서 총 SNPs가 (이 그림 10) 계산되며, 각각의 클론에 게재 SNPs의 숫자가 설명되어 있습니다. 8 다른 클론은 단일 독특한 변이를 포함하는 반면에 예를 들어, 막대에 의해 밑줄 복제가 2 독특한 돌연변이 포함되어 있습니다. 이 데이터는 표 1을 컴파일하는 데 사용됩니다. 이 그림의 더 큰 버전을 확인하려면 주시기 바랍니다 여기를 클릭하십시오 .
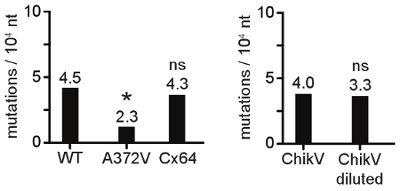
그림 6. 바이러스 집단의 돌연변이 주파수의 그래픽 표현. 쉽게 해석은 순서 및 통계 분석에서 얻은 수치 데이터 중 차트 또는 히스토그램 (여기에 표시된)로 표현하실 수 있습니다. A372V 바이러스는 야생 타입 미만 변이를 생성하고 크게 낮은 돌연변이 주파수를 (* P <0.01) 제공합니다. titers에 야생의 유형, 프레스보다 1,000 배 낮은 복제 Cx64 변종,복제 속도와 충실도가 반드시 연결되지 나타내는 동일한 돌연변이 빈도 (NS 아닌 상당한)을 행군. 동일한 Chikungunya 바이러스 (CHIKV) 인구 바이러스 재고 여부 유사한 돌연변이 주파수를 제공하거나, 10 5 배 희석은 RNA 추출에 사용됩니다.
통계 분석을 위해 돌연변이 배포 요약입니다.
참고 : 각 복제 들어, 같은 게놈 영역 (및 순서의 길이)이 적용되어 중요합니다. 이 경우 클론 당 859 세포핵. 이것은 통계 분석을 위해 중요합니다. 한편, 통계 분석에 사용 순위 합계 테스트는 샘플 크기가 동일하지 않아도, 연구자는 표본의 크기를 다양한 인구를 비교하기 위해 무료입니다. 그러므로 야생 타입의 142 클론은 A372V의 84 클론을 비교할 수 있습니다.
| N 변이와 함께 # 클론 | 야생 유형 | A372V |
| 7 변이 | 0 | 0 |
| 6 변이 | 0 | 0 |
| 5 변이 | 0 | 0 |
| 네 변이 | 0 | 0 |
| 세 변이 | 1 | 0 |
| 이 변이 | 6 | 2 |
| 한 변이 | 40 | 14 |
| 0 변이 | 95 | 68 |
| 총 변이 | 55 | 18 |
| 총 클론 합성 | 142 | 84 |
| 총 세포핵은 합성 | 121978 | 72,156 |
| Mutations/10 4 NT | 4.51 | 2.49 |
표 1. . 통계 분석을 위해 돌연변이 배포 요약 참고 : 각 클론의 경우, 같은 게놈 영역 (및 시퀀스의 길이)이 적용되어 중요합니다. 이 경우 클론 당 859 세포핵. 이것은 통계 분석을 위해 중요합니다. 한편, 통계 분석에 사용 순위 합계 테스트는 샘플 크기가 동일하지 않아도, 연구자는 표본의 크기를 다양한 인구를 비교하기 위해 무료입니다. 그러므로 야생 타입의 142 클론은 A372V의 84 클론을 비교할 수 있습니다.
토론
세포주의 선택. RNA mutagens과 같은 기본 analogs의 효능은 다른 세포 유형 11 그들의 상대적인 이해와 연결합니다. 일반적으로 바이러스 통로에 사용되는 셀 라인이 이해하거나 너무 민감한 (높은 세포 독성)을 mutagen에 내화물로 증명한다면, 이러한 요구 사항을 충족하면서 바이러스 복제 허용하는 다른 세포주를 사용해야 할 수도 있습니다. mutagen 저항 변형이 고립되면 특성의 나머지 부분은 원래, 선호하는 세포주에서 수행할 수 있습니다. 우리의 경험에서 헬라 세포는 쉽게 mutagen을 차지, BHK 세포는 mutagen의 이해에 내화물 아르 10 배 높은 농도와 베로 세포까지 필요합니다.
mutagen 이상의 한 종류를 사용하는 경우 mutagen.의 선택은 mutagen 처리, 성공의 가능성에 의해 충실도 변종을 분리하려고 증가합니다. 잘못 복제하는 동안 genomes에 통합됩니다 다양한 구조의 기본 아날로그 mutagens은 주로 후속 복제주기의 변이의 특정 하위 집합의 결과를 유도합니다 ribavirin 치료는 GtoA 및 CtoU 전환 변이 12 호의, 5 azacytidine는 비슷한 편견을 가지고, 함께 CtoG 및 GtoC transversions 13 또한, 5 fluorouracil 우선적으로 AtoG 및 UtoC 전환 유도 14. 또는, MG 2 + 또는 MN이 높은 농도는 + 12 위에서 설명한 바이어스없이 RNA 바이러스의 전반적인 돌연변이의 빈도를 증가시키기 위해 매체를 보충하실 수 있습니다. 바이러스 '코돈 시퀀스에 따라, 그리고 충실도 변종을 생성하는 데 필요한 코돈의 변화, 이러한 조건 중 일부는 다른 이상이 변종의 출현을 선호합니다. 코돈 사이트에서 필요한 AtoG 전이는 주로이 ribavirin에 의해 생성되는 돌연변이로 통신을하기 때문에 높은 충실도 poliovirus G64S 및 콕새키 바이러스 A372V 들어, ribavirin 치료는 가장 쉽게 변종을 위해 선택했습니다.
뫄 대 인구의 크기. 바이러스학에서 조직 문화 감염에 대한 프로토콜을 위해 (높은 뫄) 결함이 방해 입자 (낮은 뫄)의 축적을 방지하거나 바이러스 사이의 재조합을 촉진하기 위해, 감염의 다중성 (뫄)에 특히주의 예. passaging 시리얼 이상 출현 이벤트에 대한 선택하려면, 바이러스 인구 크기를 고려하는 것도 중요합니다. 내성 돌연변이 처음 낮은 주파수에 존재하므로, 각 통로에서 이러한 새로운 변종을 잃지 않도록 다음 (10 5 -10 6 바이러스, 예) 한 구절에서와 같은 대규모 인구 크기 최대한을 전송하는 것이 좋습니다. 물론이나 플라스크의 크기 (감염된 세포의 수를) 최대 배율 것은이 우려하는 경우 뫄의 증가를 최소화하는 데 도움이 될 수 있습니다. 반면에, mutagen에 대한 바이러스의 감도가 테스트되고있는 실험을 위해, 낮은 뫄 감염을 통해 높은 피트니스 genomes에 의해 실험에서 발생하는 복제 사이클의 수를 증가하고 mutagenized genomes의 구조를 방지하기 위해 수행됩니다 공동 감염 세포 complementation. 복제의 첫 라운드 동안 자손의 genomes에서 발생하는 돌연변이가 즉시 감지되지 않습니다 때문에 이것은 중요합니다. 이러한 mutagenized RNAS의 대부분은 여전히 virion로 포장됩니다. 그것이 genomes에있는 치명적인 돌연변이가 중단 복제주기의 결과, 및 바이러스 titer 감소됩니다 감염의 다음 라운드에 있습니다. 그것은 치명적인 돌연변이 유발에 큰 영향을 관찰하기 전에 변이의 축적 여러 라운드를 허용해야 할 수도 있습니다. 마지막으로, mutagen의 존재에있는 통로 시리즈 이상, 바이러스 titers가 멸종 때까지 드롭 계속하면, 연구자는 점차 mutagen (매우 낮은 농도에서 시작)의 양의 증가에 바이러스를 passaging 시도해야합니다.
절연 및 RNA mutagen 모성 인구에서 RNA mutagen 저항력 클론을 생성. RNA의 mutagens는 각 염색체에 여러 무작위 변이를 소개하지만, 저항에 대한 선택은 저항 변이를 풍성하게 (그리고 합의 순서로 수정)합니다. 이 변이를 확인하기 위해, 우리 시퀀스 mutagen 모성 인구 (인구의 합의)이 아닌 개별 바이러스. 따라서 mutagen에 의해 만들어진 하나의 무작위 돌연변이가 순서대로 발견되지 않고 다음과 같은 선정 합의의 변화에 결과가 발견되는 유일한 변이. 우리의 경험에서 우리는 하나 또는 두 개의 같은 합의 순서 변경을 식별합니다. mutagen 모성 인구가 취득되고 저항 변이가 확인되면,이 변종보다 순수한 주식을 생성하는 것이 필요합니다. 위, 우리는 상패 정화 절차를 설명했다. 또는 관심있는 바이러스가 쉽게 식별할 수 plaques를 생성하지 않는 경우, 원하는 변종 purif 수 있습니다희석을 제한함으로써 지휘를 맡는. 이러한 접근 방식은 기본적으로 바이러스 재고가 우물의 50 % 미만이 감염되는 등 희석 수 있습니다 96 - 웰 형식의 TCID 50입니다. 이 희석을 사용하여, 상기와 같은 방법 10 개인 변종까지 분리하고 그들의 순서를 확인한에 찍은 것입니다. 언급했듯이, 가장 좋은 경우에, 바이러스 스트레인의 감염성 cDNA 클론이 가능합니다. 변종의 격리 따라서 필요 없을 것입니다. 우리의 경험에서 충실도 변종은 하나의 아미노산 대체의 결과이며, 따라서 같은 Quikchange (애질런트)와 같은 간단한 상용 돌연변이 유발 키트를 사용하여 생성할 수 있습니다. 이차 옵션은 밀접하게 관련 변형의 cDNA 클론을 사용하는 것입니다. 관련 변형을 사용하는 경우에는, 우리는 강력하게 우리가 두 밀접한 관련이 바이러스에 동일한 성실 변경 돌연변이 반드시 동일한 효과를 가지고되지 않습니다 찾을 수 있기 때문에 이러한 접근 방식 및 바이러스 분리 (예 : 상패 정화)를 모두 사용하는 것이 좋습니다.
성심과 RNA mutagen 강한 변종의 복제. 선택은 그들의 야생 유형 매쉬 4,12,15과 유사한 성장 특성 모두 높은 낮은 충실도 변종의 격리 결과있다. 현재, 효소 활동 속도와 성실 사이의 링크는 완전히 이해되지 않습니다. 낮은 충실도 변종 빠르게 처리 1-3,12을하는 경향이있는 동안 체외에서 정화 RNA 효소를 사용하여 생화학 연구, 높은 충실도 변종 느린 처리 속도를 가지고 것으로 나타났습니다. 조직 문화에서 이러한 차이는 속도 - 제한 단계, 그 자원의 가용성,보다 본질적인 효소 활동 속도론을 제안, 보통 분명하지 않습니다. 충실도 변종이 야생 유형에서 크게 다르지 않아, 속도론과 복제한다면, 자신의 돌연변이 주파수의 비교 직접 만들 수 있습니다. 복제 속도론에 매우 중요한 변경이있는 경우 다음 데이터 복제 사이클의 동일한 숫자를받은 바이러스를 비교하여 예를 들어 운동의 차이에 대한 계정을 정상화해야합니다. 한 단계 성장 속도론에 큰 차이가 야생 유형과 높은 충실도 변종 사이에 관찰된도했지만 우리의 경험에서, (안에 우리는 높은 충실도의 변종이 지속적으로 야생 유형에 비해 (1 로그 이내) 높은 titer 것을 관찰 그러나 그들은 약간 덜 RNA를 크기의 순서대로)은 더 이상 그들이 생산 genomes 적은 수의 변이를 포함하는보다 전염성 따라서는 것을 몰랐다.
샘플 준비 및 시퀀싱이. 이러한 프로토콜의 모든 단계를 위해, 그것은 그들이 생물학 관련 돌연변이 구별되지 않을 수 있기 때문에 높은 충실도, 증명 - 독서 효소가 추가 변이를 도입 제한 PCR 및 RT - PCR에 사용되는 필수적입니다. 그것은 비교하는 바이러스 인구가 충분한부터 자료가 있다고 확인하는 것도 중요합니다 같은 조건 (통과 기록, 조직 문화 매체, 온도, RNA 추출 방법, RT - PCR 프로토콜 등)에 준비되었습니다 것이 중요합니다 강한 밴드가 RT - PCR에 의해 생성된 이러한 RNA 추출에서 얻은. RNA 샘플의 100분의 1 희석도 샘플 (반복적으로 동일한 게놈을 확장) 표현의 선입견을 피하기 위해 RNA 분자의 충분한 숫자를 포함되었음을 나타내는 감지 RT - PCR 밴드를 제공한다. 돌연변이 주파수 분포이기 때문에, 하나는 유사한 값이 상기 바이어스가 발생하지 않습니다 제공에 관계없이 인구의 크기를 얻을 수있을 것으로 기대합니다. 그림 6 보여주는 마찬가지로 바이러스 주식의 10 5 배 희석은 부모의 혈통이 크게 다르지 않다 돌연변이 주파수를 제공합니다.
TopoTA 복제를위한 최적의 조건이 발견되기 전까지는, 시퀀싱 전에 식민지 PCR에 의해, 백색 / 블루 심사 후 삽입의 존재를 확인합니다. mutational 소음 (RT - PCR 및 시퀀싱에 의해 도입 돌연변이)에 대한 제어로서, (가 바이러스 게놈에 해당하는 체외 베꼈는데 RNA의 플라스미드 베어링 같은 바이러스 시퀀스 및 / 또는 복제 및 시퀀스 RT - PCR 제품에서 PCR 제품을 복제 시험 관내 전사 효소에서 다른 것을 알고)는 다른 오류 요금을하고 프로 시저에서 실제 배경 오류와 같은 유용한 정보를 제공하지 않을 수 있습니다. 일부 바이러스 시퀀스는 박테리아에 독성 수 있으므로 그것은 돌연변이 주파수에 대해 합성되는 바이러스 게놈의 지역에 결정하기 전에 이것을 확인하는 것이 중요합니다. TopoTA 얻은 시퀀스를 분석, 각 클론 단 하나의 삽입 / 순서를 포함해야합니다. 더블 피크가 혼합 인구를 제안, 관찰 경우, 두 개의 인접한 박테리아 식민지가 선택되었습니다 수도 있습니다. 정말 어처구니가 돌연변이 박테리아 문화에 플라스미드의 증폭 동안 도입된 것을, 박테리아 복제의 낮은 돌연변이 주파수를 제공하지만 그것은 또한 가능합니다. 플라크의 P에서인구 urified, 더블 피크는 새로운 돌연변을 획득하거나 상패 개발 중에 돌연변을 되돌린 것입니다 중복 plaques, 또는 바이러스를 나타내는 수 있습니다. 일치와 카운트 없거나 이러한 변이를 계산할지 여부를 결정합니다.
마지막으로, 여기에 사용되는 변이의 주파수는 상대적인 가치는 것을 명심하십시오. 그들은 동일한 조건 하에서 재배 바이러스 인구를 비교에 유효하고, 같은 지역을 통해 합성 있습니다! 그들은 돌연변이 속도, 또는 전체 게놈의 돌연변이 빈도의 절대 가치로 이동해서는 안됩니다. 단, 조건이 통제하는 경우, 그들은 돌연변이 분포 및 주파수의 차이의 재현성, 양적 비교를 허용 않습니다.
공개
감사의 말
이 작품은 파리의 도시, 아니 프랑스 국립 부여 ANR - 09 - JCJC - 0118-1, 그리고 ERC 시작 부여 RNAvirusPopDivNVax 프로젝트에서 의료 및 건강 연구 부여에서 기금에 의해 지원되었다. 242719.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
|---|---|---|---|
| ribavirin | 시그마 | R9644 - 10MG | |
| 5 - fluorouracil | 시그마 | F6627 - 1G | |
| 5 azacytidine | 시그마 | A2385 - 100MG | |
| MgCl 2 | 시그마 | M1028 - 100ML | |
| MnCl 2 | 시그마 | M1787 | |
| Trypan 파랑 | 시그마 | T8154 - 20ML | |
| TopoTA 복제 키트 | Invitrogen | 10351021 | |
| Quikchange 돌연변이 유발 키트 | 애질런트 | 200516 | cDNA 전염성 복제 사용할 경우 |
| 96 - 웰 miniprep 키트 | Macherey - 나겔 | 740625 | |
| Lasergene, Sequencher | DNAstar, 진 코드 주식 회사 | www.dnastar.com www.genecodes.com | 또는 기타 정렬 소프트웨어 |
참고문헌
- Arias, A. Determinants of RNA-dependent RNA polymerase (in)fidelity revealed by kinetic analysis of the polymerase encoded by a foot-and-mouth disease virus mutant with reduced sensitivity to ribavirin. J Virol. 82, 12346-12355 (2008).
- Arnold, J. J., Vignuzzi, M., Stone, J. K., Andino, R., Cameron, C. E. Remote site control of an active site fidelity checkpoint in a viral RNA-dependent RNA polymerase. J Biol Chem. 280, 25706-25716 (2005).
- Korneeva, V. S., Cameron, C. E. Structure-function relationships of the viral RNA-dependent RNA polymerase: fidelity, replication speed, and initiation mechanism determined by a residue in the ribose-binding pocket. J Biol Chem. 282, 16135-16145 (2007).
- Pfeiffer, J. K., Kirkegaard, K. A single mutation in poliovirus RNA-dependent RNA polymerase confers resistance to mutagenic nucleotide analogs via increased fidelity. Proc Natl Acad Sci U S A. 100, 7289-7294 (2003).
- Pfeiffer, J. K., Kirkegaard, K. Increased fidelity reduces poliovirus fitness and virulence under selective pressure in mice. PLoS Pathog. 1, e11-e11 (2005).
- Vignuzzi, M., Stone, J. K., Arnold, J. J., Cameron, C. E., Andino, R. Quasispecies diversity determines pathogenesis through cooperative interactions in a viral population. Nature. 439, 344-348 (2006).
- Vignuzzi, M., Wendt, E., Andino, R. Engineering attenuated virus vaccines by controlling replication fidelity. Nat Med. 14, 154-161 (2008).
- Crotty, S., Cameron, C., Andino, R. Ribavirin's antiviral mechanism of action: lethal mutagenesis. J Mol Med. 80, 86-95 (2002).
- Coffey, L. L., Vignuzzi, M. Host alternation of chikungunya virus increases fitness while restricting population diversity and adaptability to novel selective pressures. J Virol. 85, 1025-1035 (2011).
- Ciota, A. T. Role of the mutant spectrum in adaptation and replication of West Nile virus. J Gen Virol. 88, 865-874 (2007).
- Ibarra, K. D., Pfeiffer, J. K. Reduced ribavirin antiviral efficacy via nucleoside transporter-mediated drug resistance. J Virol. 83, 4538-4547 (2009).
- Levi, L. I. Fidelity variants of RNA dependent RNA polymerases uncover an indirect, mutagenic activity of amiloride compounds. PLoS Pathog. 6, e1001163-e1001163 (2010).
- Sierra, S., Dávila, M., Lowenstein, P. R., Domingo, E. Response of foot-and-mouth disease virus to increased mutagenesis: influence of viral load and fitness in loss of infectivity. J Virol. 74, 8316-8323 (2000).
- Ruiz-Jarabo, C. M., Ly, C., Domingo, E., de la Torre, J. C. Lethal mutagenesis of the prototypic arenavirus lymphocytic choriomeningitis virus (LCMV). Virology. 308, 37-47 (2003).
- Sierra, M. Foot-and-mouth disease virus mutant with decreased sensitivity to ribavirin: implications for error catastrophe. J Virol. 81, 2012-2024 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유