A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפרוטוקולים עבור הרכבת חיסון וגינלי אוסף דוגמאות במודל ניסיוני של עכבר קנדידה דלקת הנרתיק
In This Article
Summary
מפתח טכניקות כדי לשמש להערכת קנדידה דלקת הנרתיק במודל חיה ניסיוני מתוארים. שיטות תאפשר איסוף מהיר של דגימות מן הנרתיק לימפוציטים ניקוז בלוטות לימפה המותני. טכניקות אלה יכולים להצמיח מודלים העכבר של מחלות אחרות בדרכי המין הנשי התחתון.
Abstract
Vulvovaginal קנדידה (VVC), נגרמת על ידי מינים קנדידה, הוא זיהום פטרייתי בדרכי המין הנשי הנמוך שמשפיע על כ -75% מהנשים בריאים במהלך שנות הפוריות שלהן, 18,32-34. גורמים predisposing כוללים שימוש באנטיביוטיקה, סוכרת בלתי מבוקרת והן הפרעה ברמות הורמון הרבייה עקב הריון, גלולות למניעת הריון או טיפול הורמונלי 33,34. VVC חוזרים (RVVC), כמוגדר שלוש או יותר אפיזודות לשנה, משפיעה על 5 נפרד 8% מהנשים ללא גורמי predisposing 33.
דגם ניסיוני של העכבר VVC כבר נקבעה בעבר במחקר בפתוגנזה ותגובה מארח הרירית כדי קנדידה 3,4,11,16,17,19,21,25,37. מודל זה גם היה מועסק כדי לבחון טיפולים נגד פטריות פוטנציאל in vivo 13,24. המודל דורש כי בעלי חיים להישמר במצב של pseudoestrus עבור optimal קנדידה קולוניזציה / זיהום 6,14,23. בתנאים אלה, בעלי חיים מחוסן יהיה להבחין נטל פטרייתי וגינלי במשך שבועות עד חודשים. מחקרים שנעשו בעבר מראים במקביל גבוהה מאוד בין המודל בבעלי חיים הידבקות בני אדם יחסית המאפיינים החיסונית הפיזיולוגית 3,16,21. הבדלים, לעומת זאת, כוללים חוסר קנדידה כמו הפלורה בנרתיק רגיל ו-pH נייטרלי הנרתיק בעכברים.
הנה, אנחנו מדגימים סדרה של שיטות המפתח במודל דלקת הנרתיק עכבר הכוללים חיסון הנרתיק, איסוף מהיר של דגימות מהנרתיק, הערכת נטל פטרייתי וגינלי, וההכנות רקמות להפקת בידוד הסלולר /. זה ואחריו נציג תוצאות עבור המרכיבים של נוזל שטיפה וגינלית, נטל פטרייתי, וניקוז הלימפה התשואות לויקוציטים. עם שימוש בהרדמה, דגימות שטיפה ניתן לאסוף בנקודות זמן רבות על עכברים זהה להערכת האורך שלזיהום / קולוניזציה. יתר על כן, מודל זה לא דורש סוכנים ליזום מערכת החיסון לזיהום, ומאפשר מחקרים החיסונית בתנאים המארח מוגדר. לבסוף, מודל וכל טכניקה הציג כאן עלול להצמיח שימוש במתודולוגיות לבחון ומחלות זיהומיות אחרות של דרכי להוריד את המין הנשי (חיידקים, טפילים, ויראלי) ו בהתאמה הגנות המארח המקומי או מערכתי.
Protocol
1. חיסון הנרתיק עם קנדידה אלביקנס
- שלושה ימים לפני חיסון, ולמנוע את השימוש בבעלי חיים על מנת לחשוף את הבטן, להזריק 100 μl של שמן שומשום המכילה 0.1-0.5 מ"ג של β-estradiol תת עורי באזור הבטן התחתונה. מראש את המחט כ -5 עד 10 מ"מ לרוחב על העור כדי למזער זליגת מאתר ההזרקה.
הממשל תת עורית של אסטרוגן בבטן התחתונה הוא האופטימלי במודל זה בשל הקרבה קרוב בדרכי המין. מינון אפקטיבי עשוי להשתנות על ידי זנים העכבר, או נגזרים הגילאים אסטרוגן. במחקרים קודמים באמצעות CBA-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 ב), Balb / c (H-2 ד), DBA / 2 (H- 2 ד), SJL (H-2 s) עכברים ב 6-8 שבועות של גיל, 0.1 mg/100 μl נמצא יעיל שמעידים עיבוי של קיר הנרתיק, הקטינה ריר בנרתיקגדל נשל תא אפיתל. העכברים שטופלו מעל בריכוז זה עם אסטרוגן התערוכה קולוניזציה וגינלית בקנה אחד עם קנדידה. עבור חיסון בעכברים של זני והגילאים אחרות, מחקר פיילוט מומלץ כדי להבטיח את האפקטיביות של אסטרוגן בתנאים שונה ולהגדיל את מינון האסטרוגן במידת הצורך.
הפתרון אסטרוגן יש להכין טרי כל פעם ביום של הזריקה. כדי להבטיח מסיסות מלאה של אסטרוגן שמן שומשום, לערבב היטב את הפתרון באמצעות מערבל מערבולת וחום לסירוגין על 37 ° C. חזור על הזרקה שבועית במשך כל תקופת המחקר. - כדי להכין את inoculum, להוסיף loopful של C. אלביקנס blastoconidia מן הכנה תת האחרונות על אגר Sabouraud-דקסטרוז (SDA) לתוך 10 מ"ל של מרק Phytone-peptone בתוספת גלוקוז 0.1%. דגירה התרבות מרק לשלב נייח עבור 18 שעות של 25 מעלות צלזיוס באמבט מים רועד.
- לאחר דגירה, לאסוף הדואר התרבות מרק לתוך צינור חרוטי 15 מ"ל ו צנטריפוגות ב XG 800 דקות 5. שטפו את גלולה פעמיים עם PBS סטרילית.
- ספירת blastoconidia קיימא hemocytometer על ידי הרחקה trypan צבע כחול. התאם את הריכוז התא 2.5 x 10 6 / מ"ל (או ריכוז inoculum הרצוי) ב-PBS סטרילית.
- כדי לייצב את העכבר, החזק את בסיס הזנב עם שתי אצבעות להרים את האגן כלפי מעלה כך את פתח הנרתיק כלפי פנים אתה (איור 1A). הוא אידיאלי אם העכבר מונח על משטח שטוח מגוררת (למשל בראש כלוב), כך העכבר יכול לספק התנגדות כנגד איפוק הזנב.
- פיפטה 20 μl (או נפח המבוקש לא יעלה על 20 μl) של ההשעיה inoculum ידי הוספת טיפ פיפטה כ - 5 מ"מ עמוק לתוך לומן הנרתיק (איור 1B). השלמת שלב זה במהירות ובעדינות ככל האפשר כדי למזער את המצוקה העכבר.
2. הנרתיק lavages
- בעקבות המתת חסד (או הרדמה), hבן העכבר כלפי מטה על ידי בבסיס הזנב עם שתי אצבעות, כך פתח הנרתיק הופכת להיות חשוף.
- שטיפה וגינלית על ידי החדרת לומן 100 μl של PBS סטרילי עם השאיפה חוזרים ונשנים תסיסה עם קצה פיפטה. קצה פיפטה יכול להיות סתומים עם תאים. במקרה זה, לוותר על התאים הפרעה ולהמשיך lavaging עם PBS שנותרו בנרתיק. איסוף נוזל שטיפה לתוך צינור microcentrifuge.
- לחלופין, lavages הנרתיק יכול להתבצע בהרדמה על עכברים עם הרדמה נשימתית isoflurane. לשם כך, לחשוף את העכברים כדי מתאדה isoflurane עד שהם מסומם לגמרי (~ 30 שניות.). החזק את העכברים כלפי מטה על ידי בבסיס הזנב בעדינות שטיפה וגינלית לומן באמצעות 50 μl של PBS סטרילית. ודא כדי למנוע תסיסה קשה עם קצה פיפטה כדי למזער את הטראומה הנרתיק במהלך הליך זה. עכברים מסומם צריך להתאושש מההרדמה בתוך 30 שניות של חשיפה לאוויר הסביבה.
Isofluraneניתן מתאדה באמצעות אידוי isoflurane ו-O 2 (המועדפת) או מערכת טיפה תקן סגור בחדר ללא הרדמה מערכת מאדה (דורש מעקב צמוד של החיה בעוד תרופות הרגעה כדי למנוע מצוקה נשימתית).
Lavages בנרתיק על עכברים בהרדמה צריכה להיות שיטת הבחירה של דגימות שטיפה האורך על עכברים זהים. Lavaging ברציפות אינו משפיע על הערכת נטל פטרייתי לאורך זמן 41.
- עבור רטוב הר ההכנות, להעביר 10 μl של נוזל שטיפה לשקופית זכוכית לצפות בהגדלה של 400-1000x על ידי מיקרוסקופ אור. בנוסף, שברים הסלולר של נוזל שטיפה יכול להיות מוכתם לבחון התא מורפולוגיות גרעיני. במשך ההכנות למרוח, להעביר 10 μl של נוזל שטיפה לשקופית זכוכית להפיץ בעדינות באמצעות הקיר החיצוני של קצה פיפטה. להשאיר את דגימות למרוח עם מקבע CytoPrep ואת כתם בטכניקת Papanicolaou סטנדרטית (בדיקת פאפ). שימו לב בהגדלה 400 × באמצעות מיקרוסקופ אור.
3. כימות נטל פטרייתי וגינלי
- בכל צלחת 96 מסביב לתחתית היטב, להעביר את נוזל שטיפה לתוך אחד היטב בשורה העליונה 180 μl של PBS סטרילי לתוך 5 בארות הבאות של העמודה (ירידה של הצלחת).
- בצע 1:10 דילולים הסידורי של נוזל שטיפה וגינלית על ידי העברת 20 μl של נוזל לבאר הבא בעמודה. מערבבים היטב על ידי השאיפה לחזור לפני כל העברה. דילולים סידורי של עד 12 דגימות שטיפה (שורה אחת אופקית מלא) ניתן לבצע בו זמנית בעזרת פיפטה 12 ערוצים.
- החל דילול הנמוך ביותר, להעביר 10 μl של המדגם על אגר Sabouraud-דקסטרוז (SDA). ציפוי של עד 36 דגימות יכול להתבצע על צלחת 1 באמצעות SDA מוכן בצלחות פטרי עם רשת רבוע ו פיפטה מתכווננת רב המרווח.
- ספירת יחידות המושבה להרכיב (CFUs) לאחר הדגירה על 34 מעלות צלזיוס ואו 48 ח
4. רקמת הנרתיק מיצוי
- בעקבות הליך שטיפה וגינלית, להניח את העכבר מורדמים על הגב שלה להרוות את אזור המפשעה עם אתנול 70%. בעזרת זוג מלקחיים, להרים את פתח השתן כלפי מעלה, כך פתח הנרתיק הופכת להיות חשוף.
- הכנס זוג מלקחיים מעוקל לתוך לומן בנרתיק לאתר את צוואר הרחם. תוך שמירה על אחיזה איתנה עם המלקחיים, לחלץ את צוואר הרחם דרך חלל הנרתיק (איור 2A-C).
- הנרתיק והבלו בבסיס של פתח הנרתיק ולאחר מכן להסיר את צוואר הרחם מהנרתיק במספריים כירורגית. זכור כי רקמת הנרתיק הוא involuted (האפיתל בצד הפנימי של הנרתיק חשוף החוצה). הרקמה יכולה להיות הפוכה רוחבית כדי לשמור על הכיוון המקורי של הנרתיק או פתח לתוך גיליון על ידי ביצוע חתך לרוחב.
רקמות הנרתיק נכרת יכול לשמש 1) שאיבת לימפוציטים בעקבות קולאז'עיכול nase (~ 1 × 10 4 / עכבר) 40, 2) לתא אפיתל בידוד הבאים dispase העיכול (~ 5 × 10 4 / עכבר) 28, 3) ההכנות קפוא או פרפין, מוטבע עבור ניתוחים היסטולוגית 25.
5. לימפה הצומת מותני כריתה
- בעקבות הליך שטיפה וגינלית, להניח את העכבר מורדמים על הגב שלה להרוות את הבטן עם אתנול 70%. ביצוע חתך רוחבי החל הבטן התחתונה אל החזה ולחשוף את האיברים הפנימיים. בעזרת זוג מלקחיים בשתי ידיים, להזיז את המעיים כלפי מעלה, כך כלי הדם המרכזיים להיות גלוי.
- אתר את הווריד הנבוב נחות הבטן ואבי העורקים. בדרך כלל, זוג בלוטות הלימפה המותני ניתן לזהות סמוך אבי העורקים בבטן, הממוקם בערך באמצע הדרך בין מוצאם של עורקי הכסל כליות משותף 39. בלוטות לימפה אלה ניתן להבחין ויזואלית על ידי מרקם אלסטי מרקמת שומןוהם קלים יותר אטום בצבע לעומת רקמת השומן (איור 3). אלה בלוטות הלימפה באופן ניכר יותר אצל בעלי חיים נגועים לעומת בעלי חיים uninoculated.
- והבלו בלוטות הלימפה על ידי הצבת microforceps תחת הצומת ואז להרים בעדינות להיפרד לרקמות.
6. בידוד של תאים הלימפה בתוך תא בודד השעיות
- העברת בלוטות הלימפה על מסך רשת תיל סטרילית (כ -3 × 3 ס"מ 2 בגודל) ממוקמים בתוך צלחת פטרי סטרילית זכוכית המכיל ~ 10 מ"ל של תמיסת מלח מאוזנת "הנקס (HBSS) (איור 4).
- עם צלחת פטרי נוטה מעט, לחץ על בלוטות הלימפה מול המסך עם ראש הבוכנה במזרק. ודא לשבור את כל בלוטות הלימפה, כך התוכן הסלולרי של הצמתים לעבור דרך המסך בזמן הלא הסלולר רכיבים של צמתים (למשל, קרומים, stroma, שומן) להישאר על המסך.
- באמצעות מזרק הבוכנה זהה, לשאוב tהוא התאים המכילים HBSS. לשטוף את המסך עם ~ 5 מ"ל HBSS לאסוף את הנוזל שנותר לתוך צינור חרוטי 15 מ"ל.
- צנטריפוגה ב XG 800 עבור 10 דקות. לשאוב כל משקעי שומן בחלק העליון של הנוזל עם טפטפת לפני השלכת הנוזלים. שטפו את תא גלולה שלוש פעמים עם HBSS. Resuspend גלולה ב 1 מ"ל של HBSS ותאי קיימא למנות על ידי הרחקה trypan צבע כחול.
7. נציג תוצאות:
שברים הסלולר של נוזל שטיפה וגינלית מ> 4 ימים עכברים מחוסן בדרך כלל מורכב קנדידה, ותאי אפיתל מחלחל הסלולר (איור 5). על ידי מיקרוסקופ רטוב הר, קנדידה ניתן לזהות ויזואלית על ידי נוכחות של העובש כמו גם שמרים (איור 5A). ההכנות למרוח נוזל שטיפה וגינלית יכול להיות מוכתם על ידי טכניקה Papanicolaou לבחון תאים אפיתל leukocytes הסתננות, אשר התאים העיקריים הם נויטרופילים שזוהו על ידי Tri-nuclear אונות (איור 5 ב). הנויטרופילים מעט מאוד, אם בכלל, מזוהים בעכברים uninoculated (איור 5 ג) 41.
דוגמה נטל פטרייתי וגינלי מוצגת באיור 6. נוזל שטיפה וגינלית שנאספו בנקודות זמן ספציפיות תרבותית עבור ספירה CFU (איור 6 א). קולוניזציה זיהום נרתיקי / עם קנדידה נמשכת במשך שבועות אסטרוגן העכברים שטופלו מחוסן (איור 6B), בעוד קנדידה נכשל להקים קולוניזציה וגינלית שאינם אסטרוגן העכברים שטופלו מחוסן (איור 6C). אסטרוגן עכברים שטופלו uninoculated להישאר שלילי קנדידה לאורך זמן (מידע לא מוצג). בנוסף, lavages הנרתיק יכול להתבצע גם פעם אחת על עכברים נפרד בכל נקודת זמן או longitudinally בעכברים אותו תחת הרדמה.
בלוטות הלימפה הן המותני בלוטות הלימפה העיקרי ייבוש בדרכי המין ואת האתר הרלוונטי ביותר על מנת להעריך את התגובה החיסונית מערכתית לאתגר הנרתיק. N OTE כי אלו בלוטות לימפה מוגדלות עלול להפוך בעכברים מחוסן בזמן שהם מופיעים בדרך כלל קטן למדי בעכברים uninoculated. החלמה הסלולר ליקוציט בדרך כלל נע בין 8 × 10 5 עכבר / uninoculated עד 5 × 10 6 העכבר / מחוסן. בנוסף בלוטות הלימפה המותני, בלוטות הלימפה מפשעתי, popliteal ו mesenteric יכול לשמש גם.
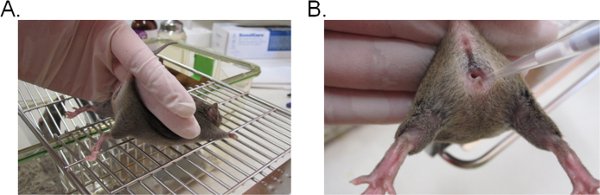
באיור 1. חיסון הנרתיק עם קנדידה. א) עכבר מאופק עבור חיסון. העכבר ממוקם על הוספת כלוב תיל בידי בבסיס הזנב, מעט כלפי מעלה כדי להרים את הרגליים לחשוף את פתח הנרתיק. הירך של העכבר ניתן התייצב עם היד כמו שהוא מנסה להתנגד איפוק הזנב. ב) הקדמה של inoculum לתוך לומן הנרתיק. טיפ פיפטה מוחדר בעדינות על 5 מ"מ עמוק לתוך לומן הנרתיק. Inoculum השעיית מופקד אז.
התחת = "jove_content"> 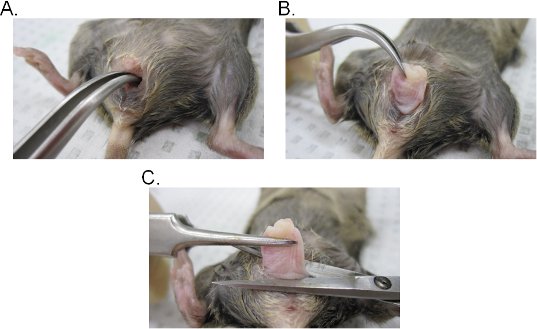
באיור 2. מיצוי רקמת הנרתיק. א.ב.) הוצאה של צוואר הרחם. צוואר הרחם נמצא עם מלקחיים מעוקל חשוף החוצה דרך חלל הנרתיק. פעם מתוך חלל הנרתיק, צוואר הרחם הוא משך עוד החוצה באופן מלא לחשוף את הנרתיק. ג) מיצוי של הנרתיק. הנרתיק הוא נכרת מן הפות עם מספריים. מנותקת פעם, להסיר את צוואר הרחם מהנרתיק.

באיור 3. זיהוי של בלוטות הלימפה המותני. המיקום של בלוטות הלימפה המותני בין האיברים הסמוכים / כלי הדם באזור האגן מצוין. אבי העורקים, בטן. B, השתן בשלפוחית השתן. C, עורק הכסל המשותף. אני, המעיים. L, הכבד. R, פי הטבעת. S, טחול. U, Uteri.

איור 4. בלוטות הלימפה המותני דגש על מסך רשת תיל. בלוטות הלימפה הן אספו על המסך ממוקם בצלחת פטרי עם HBSS. בלוטות הלימפה הן לחוצות המסך עם הבוכנה מזרק להשיג תאים הלימפה בתוך תא בודד השעיות.
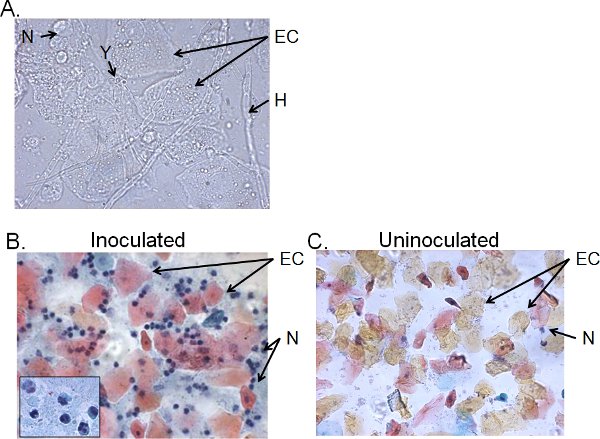
איור 5. שברים נייד של נוזל שטיפה וגינלית מעכברים מחוסן. בדיקת פאפ) Wet-mount ו-B) ההכנות של דגימות שנאספו שטיפה וגינלית 4 ימים לאחר חיסון ו-C) מעכברים uninoculated. תמונות מוצגות ב × 1000 (א) או 400 × (B, C) ההגדלה. הוספה ב 'מראה את המורפולוגיה הגרעין של נויטרופילים הנרתיק ב × 1000. קנדידה שמרים (Y) העובש (H), בתאי אפיתל (EC) ו neutrohils (N) מצוינים.
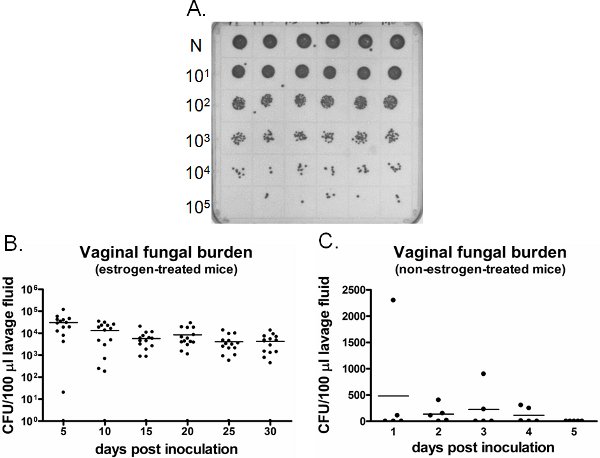
איור 6. זיהוייון הנטל פטרייתי וגינלי. א) נציג C. albicans מושבות גדלו על צלחת SDA. מסודרים (N) דגימות שטיפה משש עכברים מחוסן שונות (השורה העליונה) היו מדוללים באופן סדרתי תרבותי עבור ספירה CFU. ב) כימות נטל פטרייתי בנרתיק באסטרוגן שטופלו ו-C) ללא אסטרוגן העכברים שטופלו. CFU/100 μl של נוזל שטיפה מעכברים מחוסן הוערכה על נקודות הזמן המצוין.
Discussion
דגם ניסיוני של העכבר קנדידה דלקת הנרתיק הוקם ושימש היסטורית על בעשורים האחרונים כדי ללמוד בתגובה מארח הרירית כדי קנדידה, כמו גם בדיקות וטיפולים נגד פטריות 3,4,11,13,16,17,19,21,24, 25,37. הפרוטוקולים המוצגים כאן לשלב יעיל בשיטות פחות עתירי עבודה, ואשר נראה כי אחת מ...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה זו נתמכה על ידי R01 AI32556 (NIAID, המכון הלאומי לבריאות). עבודה זו נתמכה גם על ידי לואיזיאנה חיסון מרכז ודרום לואיזיאנה המכון לחקר מחלות מדבקות בחסות מועצת העוצרים לואיזיאנה בחלקו.
Materials
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| נקבה CBA / י עכברים | Charles River Laboratories | 01C38 | 5-6 שבועות של גיל |
| קנדידה אלביקנס (3153A) | האוסף הלאומי של פטריות פתוגניים, בריטניה | NCPF3153 | |
| שמן שומשום | Sigma-Aldrich | S3547 | לא צריך להיות מראש לעקר לפני השימוש |
| Β אסטרדיול-17-valerate | Sigma-Aldrich | E1631 | 0.1-0.5mg בשמן שומשום |
| Phytone peptone | בקטון דיקינסון | 211906 | עם תוספת גלוקוז 0.1% |
| Trypan פתרון כחול | Sigma-Aldrich | T8154 | |
| Sabouraud אגר דקסטרוז | בקטון דיקinson | 211584 | |
| Collagenase סוג IV | Sigma-Aldrich | C5138 | 0.25% |
| Dispase | Invitrogen | 17105-041 | 1.7 U / ml |
| קווי המסכים | TWP | 060X060S0065W36T | רשת מס '60, אל חלד |
| הנקס "פתרון מאוזן מלח | Invitrogen | 24020-117 | |
| CytoPrep מקבע | פישר סיינטיפיק | 12-570-10 | שומר על שקופיות למרוח |
| Papanicolaou כתם EA-65 | EMD כימיקלים | 7054X-85 | |
| Papanicolaou כתם OG-6 | EMD כימיקלים | 7052X-85 | |
| אלום hematoxylin האריס " | EMD כימיקלים | 638A-85 | |
| Isoflurane | בקסטר בריאות | NDC 10019-773-60 | בשימוש עם מאדה isoflurane או ירידה במערכת סגורה הרדמה קאמרית |
References
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved