Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Протоколы для Вагинальные Прививка и сбора проб в экспериментальной модели мышей Candida Вагинит
В этой статье
Резюме
Основные методы, используемые в оценке Candida Вагинита в экспериментальной животной модели описаны. Методы позволят быстрый сбор образцов вагинального и лимфоцитов из слив поясничных лимфатических узлов. Эти методы могут привести к мышиных моделях других заболеваний в женской нижних половых путей.
Аннотация
Вульвовагинального кандидоза (ВВЦ), вызванного видами Candida, является грибковой инфекцией нижних половых путей женщины, которая затрагивает около 75% здоровых женщин в течение репродуктивного возраста 18,32-34. Предрасполагающие факторы включают антибиотик использования, неконтролируемого диабета и нарушение репродуктивных гормонов в связи с беременностью, оральных контрацептивов или гормональной терапии 33,34. Периодические ВВЦ (RVVC), определяется как три и более эпизодов в год, влияет на отдельном от 5 до 8% женщин, не имеющих предрасполагающие факторы 33.
Экспериментальной модели мышей ВВЦ была создана и используется для изучения патогенеза и слизистых ответ принимающей Candida 3,4,11,16,17,19,21,25,37. Эта модель также была использована для испытаний потенциальной противогрибковое лечение в естественных условиях 13,24. Модель предполагает, что животные содержаться в состоянии выбрать для pseudoestrusimal Candida колонизации / инфекции 6,14,23. В таких условиях, затравленных животных будет обнаружено вагинальных грибковых нагрузку на несколько недель или месяцев. Прошлые исследования показывают чрезвычайно высокую параллель между моделью человека и животных инфекция относительно иммунологических и физиологических свойств 3,16,21. Различия, однако, в том числе отсутствие Candida в качестве нормальной влагалищной флоры и нейтральный рН влагалища у мышей.
Здесь мы демонстрируем ряд ключевых методов в модели вагинит мыши, которые включают вагинальные прививки, быстрый сбор образцов вагинального, оценка вагинальных грибковых бремя, и тканевые препараты для сотовых добычи / изоляции. Далее следуют представитель результаты для трехсторонних промывания влагалища жидкости, грибковые бремя, и осушения лимфатических узлов дает лейкоцитов. При использовании анестетиков, промывание образцы могут быть собраны в нескольких точках времени на тех же мышей для продольной оценкиинфекции / колонизации. Кроме того, эта модель не требует иммуносупрессивных препаратов для инфицирования, что позволяет иммунологических исследований при определенных условиях хозяина. Наконец, модель и каждая техника введенные здесь, может привести к использованию методологии для изучения других инфекционных заболеваний нижних женских половых путей (бактериальные, паразитарные, вирусные) и соответствующего местного или системного защиту хозяина.
протокол
1. Вагинальные инокуляции Candida Albicans
- За три дня до прививки, в то время как сдерживающее животных подвергать живот, вводят 100 мкл кунжутное масло, содержащее 0,1-0,5 мг β-эстрадиола подкожно в нижнюю часть живота. Advance иглу от 5 до 10 мм сбоку от кожи, чтобы минимизировать утечки из места инъекции.
Подкожного введения эстрогена в нижней части живота является оптимальным в данной модели из-за непосредственной близости от половых путей. Эффективные дозы могут различаться в зависимости от штамма мыши, возраст или эстроген производных. В предыдущих исследованиях с использованием CBA-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 б), BALB / C (H-2 г), DBA / 2 (H- 2 г), SJL (H-2 с) мышей на 6-8 недельного возраста, 0,1 мг/100 мкл был найден эффективный свидетельствует утолщение стенки влагалища, снижение вагинальной слизи иувеличилась эпителиальных шелушение клеток. Мыши выше получавших эстроген при этой концентрации выставки соответствует вагинальной колонизации Candida. Для прививки у мышей других штаммов и возрастов, пилотное исследование рекомендуется для обеспечения эффективности эстрогенов при измененных условиях и увеличение дозы эстрогена, если необходимо.
Эстроген решение следует приготовить свежую каждый раз в день инъекции. Для обеспечения полной растворимости эстрогена в кунжутное масло, тщательно перемешать раствор с помощью миксера вихря и тепло с перерывами при температуре 37 ° C. Повторите инъекции еженедельно в течение периода исследования. - Для подготовки посевной, добавьте loopful С. Albicans blastoconidia из последних подготовке субкультуры на Сабуро-агар декстрозы (ПДД) в 10 мл Phytone-пептонном бульоне дополнен с 0,1% глюкозы. Инкубируйте бульон культуры стационарной фазы в течение 18 ч при температуре 25 ° С в пожимая водяной бане.
- После инкубации, собирать йэлектронной бульон культуры в 15 мл коническую трубку и центрифуги при 800 мкг в течение 5 мин. Вымойте гранул в два раза стерильной PBS.
- Перечислять жизнеспособной blastoconidia на гемоцитометра по трипанового исключения синий краситель. Отрегулируйте концентрацию клеток до 2,5 х 10 6 / мл (или желаемого посевной концентрации) в стерильном PBS.
- Для стабилизации мыши, удерживая основания хвоста двумя пальцами и поднимите бедра вверх так, чтобы вход во влагалище лица по отношению к вам (рис. 1А). Это идеально, если мышь помещается на плоскую поверхность тертым (например, клетки сверху), так что мышь может обеспечить устойчивость к хвосту сдержанность.
- Внесите 20 мкл (или желаемую громкость не должна превышать 20 мкл) посевного подвески путем введения пипетки около 5 мм в глубину вагинального просвета (рис. 1б). Заполните этот шаг, как быстро и нежно, как свести к минимуму бедствия в мышь.
2. Вагинальные промываний
- После эвтаназии (или анестезия), чстарые мыши в сторону понижения на основании хвоста двумя пальцами так, чтобы вход во влагалище становится подвергается.
- Промывание вагинального просвета путем введения 100 мкл стерильной PBS с повторными стремление и агитации с кончика пипетки. Кончика пипетки может засориться с ячейками. В этом случае обойтись без препятствий клетки и продолжают lavaging с остальными PBS во влагалище. Сбор лаваже в микроцентрифужных трубки.
- Кроме того, вагинальных орошений могут быть выполнены на мышах с наркозом изофлуран анестезии летучими. Для этого, разоблачить мышей испаряется изофлуран пока они полностью не седативные (~ 30 сек.). Держите мышь в сторону понижения на основании хвоста и аккуратно промывание просвета вагинального, используя 50 мкл стерильной PBS. Убедитесь в том, чтобы избегать резких агитации с кончика пипетки, чтобы минимизировать травмы влагалища во время этой процедуры. Sedated мышей должна оправиться от наркоза в течение 30 секунд контакта с окружающим воздухом.
Изофлюранаможет быть испаряется использованием изофлуран испаритель и O 2 (предпочтительно) или стандартная система падение закрытой камере без анестезии испаритель системы (требуется тщательный мониторинг животных в то время как седативные, чтобы избежать расстройства дыхания).
Вагинальные смывов на анестезию мышей должна быть методом выбора для продольных образцов на промывание же мышей. Последовательный lavaging не влияет на оценку грибковых нагрузку с течением времени 41.
- Для влажных монтажа подготовку, передачу 10 мкл лаваже на предметное стекло и наблюдать на 400-1000x увеличения с помощью световой микроскопии. Кроме того, сотовые доли лаваже могут быть окрашены для изучения клеток и ядерной морфологии. Для мазков подготовку, передачу 10 мкл лаваже на предметное стекло и осторожно распространяется, используя внешнюю стену кончика пипетки. Заповедник мазок образцов с фиксатором CytoPrep и пятна по стандартной методике Папаниколау (Пап-мазка). Соблюдать при 400-кратном увеличении с помощью световой микроскопии.
3. Количественная оценка вагинальных грибковых бремя
- В 96-круглым дном пластины, передача лаваже в одну лунку в верхнем ряду и 180 мкл стерильной PBS на следующие 5 скважин этого столбца (снижение на табличке).
- Сделать 1:10 серийные разведения промывания влагалища жидкость путем передачи 20 мкл жидкости к следующему хорошо в столбце. Тщательно перемешать повторными стремление перед каждой передачи. Серийные разведения до 12 промывание образцов (один полный горизонтальный ряд) могут быть выполнены одновременно с помощью 12-канальной пипетки.
- Начиная с самой низкой разведении, передаче 10 мкл образца на Сабуро-агар декстрозы (ПДД). Покрытие до 36 образцов могут быть выполнены на 1 пластины с использованием ПДД подготовлен в квадратных чашки Петри с сеткой и регулируемые пипетки многоканальный интервал.
- Перечислять колониеобразующих единиц (CFUs) после инкубации при 34 ° С Пили 48 ч.
4. Вагинальные добычи ткани
- После процедуры промывания влагалища, лежал эвтаназии мыши на его спине и насыщают паховой области с 70% этанола. Использование пара щипцов, поднимите мочевого отверстия вверх так, чтобы вход во влагалище становится подвергается.
- Вставьте пару изогнутых щипцов в вагинальной полости и найти шейку матки. При сохранении надежного сцепления с щипцы, извлечение шейки матки через вагинальные полости (рис. 2A-C).
- Акцизный влагалища у основания во влагалище, а затем удалить шейку матки из влагалища с хирургическими ножницами. Имейте в виду, что вагинальные ткани инволютированной (внутренний эпителий-стороне влагалища подвержена внешним). Ткань может быть либо сбоку перевернутого сохранить исходную ориентацию во влагалище или открыт в лист, делая боковой разрез.
Подакцизные ткани влагалища могут быть использованы для: 1) лимфоцитов коллажа после удаленияnase пищеварения (~ 1 × 10 4 / мышь) 40, 2) эпителиальных клеток изоляции следующие dispase пищеварения (~ 5 × 10 4 / мышь) 28, 3) замороженные или парафин подготовки гистологических анализов 25.
5. Поясничный иссечение лимфатических узлов
- После процедуры промывания влагалища, лежал эвтаназии мыши на его спине и насыщают живота с 70% этанола. Сделать боковой разрез, начиная с нижней части живота к груди и выставить внутренних органов. Используя пару щипцов в обеих руках, двигаться кишечника вверх так, чтобы центральные кровеносные сосуды становятся видимыми.
- Найдите нижней полой вены и брюшной аорты. Как правило, пары поясничных лимфатических узлов может быть идентифицирован, прилегающих к брюшной аорты, расположенного примерно на полпути между происхождении почечной и общей подвздошной артерии 39. Эти лимфатические узлы могут быть визуально отличить от жировой ткани упругими текстурыи легче и менее прозрачным в цвете по сравнению с жировой ткани (рис. 3). Эти лимфатические узлы заметно больше у инфицированных животных по сравнению с uninoculated животных.
- Акцизный лимфатических узлов, помещая microforceps в узле, а затем подтянуть аккуратно отделить от окружающей ткани.
6. Выделение лимфоидных клеток в одноклеточных суспензий
- Передача лимфатические узлы на экране стерильной проволочной сетки (примерно 3 х 3 см 2 размера) помещается внутри стерильные стеклянные чашки Петри, содержащей ~ 10 мл сбалансированного солевого раствора Хэнкса (HBSS) (рис. 4).
- В чашке Петри слегка наклонены, нажмите лимфатических узлов против экран с головой поршень шприца. Убедитесь в том, чтобы разбить все лимфатические узлы так, что клеточное содержимое узлов проходят через экран в то время как не-клеточных компонентов узлов (то есть, мембраны, стромы, жир), остаются на экране.
- Используя тот же поршень и шприца, аспирацию тон HBSS, содержащих клетки. Вымойте экран с ~ 5 мл HBSS и собирать остатки жидкости в 15 мл коническую трубку.
- Центрифуга при 800 мкг в течение 10 мин. Аспирируйте любые жировые отложения в верхней части жидкости с пипеткой до отбрасывая жидкости. Промыть осадок клеток в три раза с HBSS. Ресуспендируют гранул в 1 мл HBSS и перечислить жизнеспособных клеток трипанового исключения синий краситель.
7. Представитель Результаты:
Клеточных фракциях промывания влагалища жидкость от> 4-дневный прививку мышей обычно состоят из Candida, эпителиальные клетки и клеточные инфильтраты (рис. 5). По мокрой монтажа микроскопии, Candida может быть визуально определить наличие гиф, а также дрожжи (рис. 5А). Мазок препаратов промывание влагалища жидкости могут быть окрашены по Папаниколау технику для изучения эпителиальные клетки и проникают лейкоциты, из которых основной клетки нейтрофилов, определенные три-нуклоновар долях (рис. 5В). Очень немногие нейтрофилы, если таковые имеются, обнаруженных в uninoculated мышей (рис. 5С) 41.
Например вагинальных грибковых бремя показано на рисунке 6. Промывание влагалища жидкость, полученная в определенные моменты времени культивировали в течение КОЕ перечисление (рис. 6А). Вагинальные колонизации / инфекции Candida сохраняется в течение недели в эстроген обработанных прививку мышей (рис. 6Б), а Candida не может установить вагинальные колонизации, не связанных с эстроген-лечение прививку мышей (рис. 6С). Эстроген обработанных uninoculated мышей остаются отрицательными для Candida в течение всего времени (данные не представлены). Кроме того, вагинальных орошений можно выполнять как в свое время на отдельных мышей в каждый момент времени или продольно в той же мыши под анестезией.
Поясничных лимфатических узлов первичный дренаж лимфатических узлов половых путей и наиболее актуальные сайт, чтобы оценить для системного иммунного ответа на вагинальные проблемы. NOTE, что эти лимфатические узлы могут стать расширен в прививку мышей, когда они обычно появляются очень малы по uninoculated мышей. Лейкоцитов сотовой восстановление обычно составляет от 8 × 10 5 / uninoculated мыши до 5 × 10 6 / прививку мыши. В дополнение к поясничного лимфатических узлов, паховые, подколенные и брыжеечные лимфатические узлы также могут быть использованы.
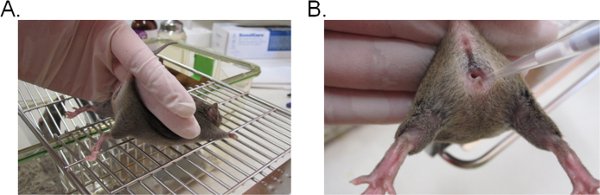
Рисунок 1. Вагинальные инокуляции Candida. ) Мыши сдержанный для прививки. Мышь находится на вставке клетки проволоки и проведен основания хвоста, слегка вверх, чтобы поднять ноги и подвергать влагалища. Бедра мыши может быть стабилизирована с той же рукой, он пытается сопротивляться хвост сдержанность. Б) внедрение посевной в вагинальной полости. Кончика пипетки аккуратно вставлены около 5 мм в глубину вагинального просвета. Подвески посевной затем на хранение.
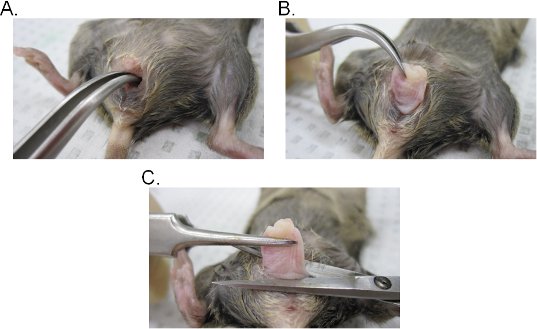
Рисунок 2. Вагинальный извлечения тканей. АВ) Добыча шейки матки. Шейка матки расположена с изогнутым пинцетом и подвергаются наружу через вагинальный полости. Выйдя из вагинальной полости, шейке матки далее вытащил наружу, чтобы полностью раскрыть влагалище. C) Добыча влагалище. Влагалище вырезали из вульвы с помощью ножниц. Как только индивидуальный удалить шейку матки из влагалища.

Рисунок 3. Определение поясничных лимфатических узлов. Расположение поясничного лимфатических узлов среди окружающих органов / кровеносных сосудов в районе таза указывается. , Брюшной аорты. B, мочевого пузыря. С, общей подвздошной артерии. Я, кишечника. L, печени. R, прямую кишку. S, селезенки. U, матки.

Рисунок 4. Поясничных лимфатических узлов размещены на экран сетка. Лимфатические узлы объединяются на экран помещается в чашку Петри с HBSS. Лимфатические узлы прижимается экран с поршень шприца для получения лимфоидных клеток в одноклеточных суспензий.
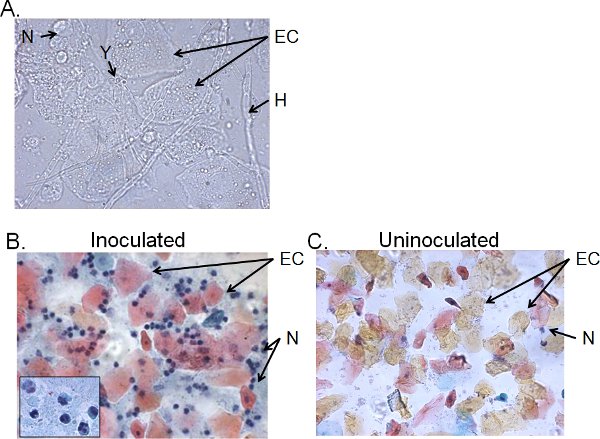
Рисунок 5. Сотовая фракций промывания влагалища жидкости из прививку мышей. ) Мокрая монтажа и Б) Мазок Папаниколау препаратов промывание влагалища проб 4 дня после инокуляции и С) из uninoculated мышей. Изображения показываются в 1000 × () или 400 × (B, C) увеличении. Вставить в B показывает, ядерная морфология вагинальные нейтрофилы при 1000 ×. Candida дрожжей (Y) и гифы (H), эпителиальные клетки (ЕС) и neutrohils (N), указаны.
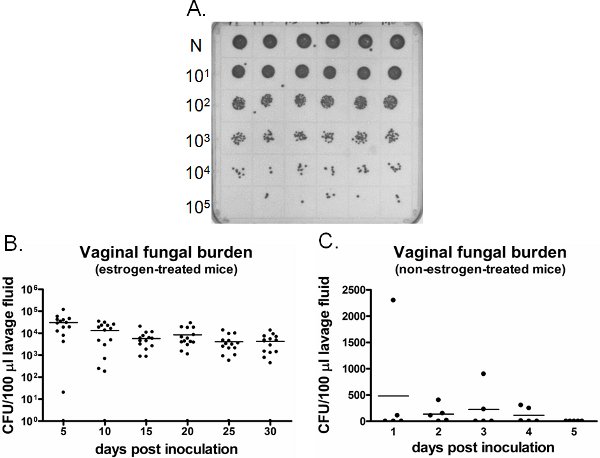
Рисунок 6. Detectионных вагинальных грибковых бремя. А) представитель C. Albicans колоний, выросших на тарелку ПДД. Аккуратные (N) промывание образцов из шести различных прививку мышей (верхний ряд) были последовательно разбавлены и культивировали в течение перечисления КОЕ. Б) Количественная оценка вагинальных грибковых бремя в эстроген обращению и С), не эстроген-мышей. CFU/100 мкл промывание жидкости из прививку мышей оценивалась на указанные моменты времени.
Обсуждение
Экспериментальной модели мышей Candida вагинит был создан и исторически использовались в течение последних нескольких десятилетий исследования слизистой оболочки ответ принимающей Candida, а также для тестирования противогрибковое лечение 3,4,11,13,16,17,19,21,24, 25,37. Протоколы, пре?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана R01 AI32556 (NIAID, Национальный институт здравоохранения). Эта работа также была частично поддержана Луизиана вакцины Центр и Юг Луизиана Институт исследований в области инфекционных болезней поддержке Луизиана Совет регентов.
Материалы
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Женский CBA / J мышей | Charles River лаборатории | 01C38 | 5-6 недельного возраста |
| Candida Albicans (3153A) | Национальная коллекция патогенных грибов, Великобритания | NCPF3153 | |
| Кунжутное масло | Sigma-Aldrich | S3547 | Не нужно предварительно стерилизовать перед использованием |
| Β-эстрадиол 17-валерат | Sigma-Aldrich | E1631 | 0.1-0.5 мг в кунжутное масло |
| Phytone пептон | Becton Dickinson | 211906 | Дополнение с 0,1% глюкозы |
| Трипановый синий раствор | Sigma-Aldrich | T8154 | |
| Сабуро агар декстрозы | Becton ДикИнсон | 211584 | |
| Коллагеназы типа IV | Sigma-Aldrich | C5138 | 0,25% |
| Dispase | Invitrogen | 17105-041 | 1,7 Ед / мл |
| Сетка экраны | TWP | 060X060S0065W36T | № 60 сетки из нержавеющей |
| Сбалансированный солевой Хэнкса решение | Invitrogen | 24020-117 | |
| CytoPrep фиксатором | Fisher Scientific | 12-570-10 | Сохраняет мазка слайды |
| Папаниколау пятно EA-65 | EMD Химические вещества | 7054X-85 | |
| Папаниколау пятно OG-6 | EMD Химические вещества | 7052X-85 | |
| Квасцы Харриса гематоксилин | EMD Химические вещества | 638A-85 | |
| Изофлюрана | Baxter Healthcare | НДЦ 10019-773-60 | Используется с изофлуран испаритель или в капельной системой закрытой камере анестезии |
Ссылки
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены