Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Deneysel Fare Modeli Vajinal Aşılama ve Örnek Toplama Protokolleri Candida Vajinit
Bu Makalede
Özet
Değerlendirilmesinde kullanılacak kilit teknikleri Candida Vajinit deneysel bir hayvan modeli anlatılmaktadır. Yöntemleri, lomber lenf düğümleri drenaj, vajinal örneklerin ve lenfositler hızlı toplama sağlayacaktır. Bu teknikler, kadın alt genital sistem diğer hastalıkların fare modelleri yol açabilir.
Özet
Vulvovajinal kandidiazis (VVC), Candida türlerinin neden olduğu, aksi takdirde sağlıklı kadınların yaklaşık% 75'i üreme yıl boyunca 18,32-34 etkileyen alt dişi genital sistemin bir mantar enfeksiyonu. Predispozan faktörler, antibiyotik kullanımı, kontrolsüz diyabet ve rahatsızlık üreme hormon düzeyleri gebeliğe bağlı, oral kontraseptif veya hormon replasman tedavileri 33,34 içerir . Tekrarlayan VVC (RVVC) yılda üç veya daha fazla bölüm olarak tanımlanan, hiçbir predispozan faktör 33 ile% 8 kadın için ayrı bir 5 etkiler.
VVC deneysel bir fare modeli kurulmuş ve patogenezi ve Candida 3,4,11,16,17,19,21,25,37 mukozal konak yanıtı çalışma için kullanılan olmuştur. Bu model aynı zamanda, in vivo 13,24 potansiyel antifungal tedaviler test etmek için işe alındı . Modeli hayvanlar opt pseudoestrus bir devlet muhafaza gerektirirolmuş bölgeler Candida kolonizasyonu / infeksiyonu 6,14,23. Bu koşullar altında, haftalar veya aylar için inoküle hayvanlar vajinal mantar yükünün saptanabilir olacaktır. Geçmişte yapılan çalışmalar, immünolojik ve fizyolojik özellikleri 3,16,21 göre hayvan modeli ve insan enfeksiyonu arasındaki son derece yüksek bir paralellik göstermektedir. Farklılıklar Ancak, normal vajinal flora olarak Candida eksikliği ve farelerde nötr bir vajinal pH içerir.
Burada, bir dizi vajinal aşılama, vajinal örneklerin hızlı toplanması, vajinal mantar yükünün değerlendirilmesi ve hücresel çıkarma / izolasyonu için doku hazırlıkları fare vajinit modeli temel yöntemler göstermektedir. Bu vajinal lavaj sıvısı, mantar yükünü, ve drenaj lenf nodu lökosit verim bileşenlerinin temsilcisi sonuçları takip edilmektedir. Anesteziklerin kullanımı ile lavaj örnekleri boyuna değerlendirilmesi için aynı fareler üzerinde birden fazla zaman noktalarında toplananenfeksiyon / kolonizasyon. Ayrıca, tanımlanmış ana koşullar altında immünolojik çalışmalar sağlayan bu model, enfeksiyon başlatmak için herhangi bir immünosupresif ajanlar gerektirir. Son olarak, model ve her iki tekniğin burada potansiyel düşük kadın genital sistem (viral, parazitik, bakteriyel) ve ilgili lokal veya sistemik konak savunmasını diğer bulaşıcı hastalıkları incelemek için metodolojilerin kullanımı doğurabilecek tanıttı.
Protokol
1. Candida albicans ile Vajinal aşılama
- Aşılama Üç gün önce, karın ortaya çıkarmak için hayvan frenleyici, alt karın bölgesinde subkütan 0.1-0.5 mg β-östradiol içeren susam yağı enjekte 100 ul. Enjeksiyon yerinden sızıntı en aza indirmek için cilde yan 5 ila 10 mm iğne ilerletin.
Alt karın östrojen subkutan uygulanması, genital sistem yakınlığı nedeniyle bu model en uygunudur. Etkili dozlarda fare suşlar, yaşları ya da östrojen türevleri göre değişebilir. CBA-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 b), Balb / c (H-2 d) Daha önceki çalışmalarda, DBA / 2 (H- 2 d), yaş 6-8 hafta SJL (H-2 s) farelerde, 0.1 mg/100 ul etkili bulunmuştur vajinal duvar kalınlaşması ile kanıtlanır, vajinal mukus ve azaltılmışepitel hücre dökülmesi arttı. Yukarıdaki bu konsantrasyonda östrojen ile tedavi edilen farelerde, Candida ile tutarlı vajinal kolonizasyon sergilerler . Diğer suşları ve yaşları farelerde aşılama için bir pilot çalışma değiştirilmiş koşullar altında östrojen etkinliğini sağlamak ve gerekirse östrojen dozu artırmak için önerilir.
Östrojen çözüm enjeksiyon gününde her zaman taze olarak hazırlanması gerekir. Susam yağı östrojen tam çözünürlük sağlamak için, iyice bir vorteks mikser ve ısı 37 ° aralıklı olarak kullanarak çözüm karıştırmak ° C Haftalık çalışma süresi boyunca enjeksiyon işlemi tekrarlayın. - Inokulum hazırlamak için, C. loopful ekleyin 10 ml% 0.1 glukoz ile desteklenen Phytone-pepton suyu içine Sabouraud dekstroz agar (SDA) bir son altkültürü hazırlık albicans blastoconidia. 25 ° C sallayarak bir su banyosunda 18 saat süreyle sabit faz suyu kültür inkübe edin.
- Inkübasyon sonrasında, inci toplamake 5 dakika boyunca 800 xg'de 15 ml konik boru ve santrifüj içine suyu kültürü. Pelet steril PBS ile iki kez yıkayın.
- Tripan mavi boya dışlama hemasitometre canlı blastoconidia numaralandırır. Hücre konsantrasyonu 2.5 x 10 6 / ml steril PBS (ya da istediğiniz bir inokulum konsantrasyonu) ayarlayın.
- Fare stabilize etmek için, iki parmak ile kuyruk tabanı tutun ve vajinal açıklık (Şekil 1A) dönüktür kalça yukarı kadar kaldırın. Fare, fare kuyruğu kısıtlama karşı direnç sağlar, böylece, düz bir rendelenmiş yüzey (örneğin kafesinin üst) yerleştirilir ise idealdir.
- Pipet 20 ul vajinal lümen (Şekil 1B) derinliklerine yaklaşık 5 mm pipet ucu takarak inokulum süspansiyon (veya istenen hacmi 20 ul geçmemek üzere). Fare sıkıntı olduğunca çabuk ve nazik bir şekilde mümkün olan en aza indirmek için bu adımı tamamlayın.
2. Vajinal lavaj
- Aşağıdaki ötenazi (ya da genel anestezi), hvajinal açılış maruz olur böylece iki parmak ile kuyruk tabanı tarafından aşağı eski fare.
- Bir pipet ucu ile tekrar aspirasyon ve ajitasyon ile steril PBS 100 ul getirerek vajinal lümen Lavaj. Pipet ucu hücreleri ile tıkanmış olabilir. Bu durum ortaya çıkarsa, engelleyen hücreleri dağıtmak ve lavaging vajina içinde kalan PBS ile devam edin. Bir mikrosantrifüj tüp içine lavaj sıvısı toplayın.
- Alternatif olarak, vajinal lavaj izofluran uçucu anestezi ile anestezi fareler üzerinde yapılabilir. Bunun için, tam olarak (~ 30 sn.) Sedasyon kadar izofluran buharlaşmış farelerin maruz kalmaktadır. Farelerin kuyruk tabanı tarafından aşağı doğru tutun ve yavaşça 50 ul steril PBS kullanarak vajinal lümen lavajı. Bu işlem sırasında vajina travmayı en aza indirmek için bir pipet ucu ile sert bir ajitasyon önlemek için emin olun. Sedatize fareler ortam havasına maruz kalma 30 saniye içinde anestezi kurtarmak gerekir.
İsofluranınizofluran bir buharlaştırıcı ve O 2 (tercih edilen) veya buharlaştırıcı sistemi (solunum sıkıntısı önlemek için sedasyon ise hayvanın yakın takip gerektirir) olmadan kapalı anestezi odasına standart bir damla sistemi kullanarak buharlaşmış olabilir.
Anestezi fareler üzerinde Vajinal lavaj aynı fareler üzerinde uzunlamasına lavaj örnekleri için tercih edilen yöntem olmalıdır. Ardıl lavaging zaman 41 üzerinde mantar yükünün değerlendirilmesi etkilemez.
- Lavaj sıvısı, cam bir slayt üzerine monte ıslak hazırlıkları için 10 ul transferi ve ışık mikroskobu ile 400-1000x büyütme az gözlemlemek. Ayrıca, lavaj sıvısının hücresel kesirler hücre ve nükleer morfolojileri incelemek için lekeli olabilir. Smear hazırlıkları için lavaj sıvısı, cam bir slayt üzerine 10 ul transferi ve dış duvar bir pipet kullanarak hafifçe yayılır. CytoPrep fiksatif ile smear örnekleri korumak ve standart Papanicolaou tekniği ile leke (Pap smear.) 400 × büyütmede ışık mikroskobu ile gözlemleyin.
3. Vajinal mantar yükünün Kantitasyonu
- 96 yuvarlak alt plaka, lavaj sıvısı, bu sütunun aşağıdaki 5 kuyu (tabak aşağı) içine üst satır ve 180 ul steril PBS iyi birine aktarın.
- Sütun bir sonraki kuyuya 20 ul sıvı aktararak vajinal lavaj sıvısının 01:10 seri dilüsyonları olun. Her aktarmadan önce tekrarlanan aspirasyon ile iyice karıştırın. 12 lavaj örnekleri (tam bir yatay satır) kadar seri dilüsyonları 12-kanallı pipet kullanarak aynı anda yapılabilir.
- Sabouraud dekstroz agar (SDA), en düşük sulandırma ile başlayarak, 10 ul üzerine örnek aktarmak. 36 örnekleri kadar Kaplama, 1 tabak kullanarak kare ızgara ve ayarlanabilir bir boşluk çok kanallı pipet petri kaplarına hazırlanan SDA yapılabilir.
- 34 az inkübasyondan sonra koloni oluşturan birim (CFU) numaralandırır ° C fveya 48 saat
4. Vajinal doku ekstraksiyonu
- Vajinal lavaj prosedürü izleyerek, sırtında ötenazi fare yattı ve% 70 etanol ile kasık bölgesinde doyurabilecek. Bir çift forseps kullanarak, yukarı vajinal açılış maruz haline gelmesi idrar orifis kaldırın.
- Kavisli bir forseps bir çift vajinal lümen içine yerleştirin ve serviks bulun. Forseps ile sağlam bir tutuş korurken, vajinal boşluğu (Şekil 2A-C) ile serviks ayıklayın.
- Vajina Vergi üssünde vajinal açılış ve ardından cerrahi makas ile vajinadan rahim ağzı çıkarın. Vajinal dokuların (epitel tarafı vajina iç dışa açık) involuted olduğunu aklınızda bulundurun. Doku ya yanal vajinanın başlangıç yönlendirmesinden korumak için ters veya lateral kesi yaparak bir sayfa açılıyordu olabilir.
Eksize vajinal dokuların) 1 kullanılabilir lenfosit çekimini takiben kolajhistolojik analizler için 25 Nase sindirim (~ 1 × 10 4 / fare) 40, 2) epitel hücre izolasyonu aşağıdaki dispase sindirim (~ 5 × 10 4 / fare) 28, 3) dondurulmuş veya parafine gömülü preparatlar.
5. Bel lenf nodu eksizyonu
- Vajinal lavaj prosedürü izleyerek, sırtında ötenazi fare yattı ve% 70 etanol ile karın doyurabilecek. Lateral kesi alt karın göğüs başlangıç yapın ve iç organların maruz. Iki eliyle bir çift forseps kullanarak, merkezi kan damarları görünür hale gelir bağırsak yukarı kadar hareket ettirin.
- Inferior vena kava ve abdominal aorta bulun. Normalde, bir çift lomber lenf nodu, abdominal aort bitişik belirlenen yaklaşık yarım böbrek ve ortak iliak arterlerden 39 kökeni arasında yer olabilir. Bu lenf düğümleri görsel olarak yağ dokusunun elastik doku tarafından ayırt edilebilirve yağ dokusu (Şekil 3) ile karşılaştırıldığında daha açık renkli ve daha opak. Bu lenf düğümleri uninoculated hayvanlara göre, enfekte hayvanların belirgin şekilde daha büyük.
- Vergi sonra lenf düğümü altında microforceps koyarak düğümleri ve doku çevreleyen ayrı hafifçe yukarı çekin.
6. Tek hücre süspansiyonları lenfoid hücrelerin izolasyonu
- ~ 10 ml Hanks dengeli tuz solüsyonu (HBSS) (Şekil 4) içeren bir steril cam petri içine yerleştirilen steril bir tel örgü ekran (boyut olarak yaklaşık 3 x 3 cm 2) üzerine lenf düğümleri aktarın.
- Hafif eğimli petri ile karşı lenf düğümleri bir şırınga piston kafası ile ekran tuşuna basın. Düğümleri hücresel olmayan bileşenleri (yani, membranlar, stroma, yağ) ekranda kalırken düğümleri hücresel içeriği ekrana geçmesi, böylece tüm lenf düğümleri kırmak için emin olun.
- Aynı piston ve şırınga, aspirat tiçeren hücrelerin HBSS. ~ 5 ml HBSS ile ekran yıkayın ve 15 ml konik bir tüp içine kalan sıvı toplamak.
- 10 dakika için 800 xg'de santrifüjleyin. Sıvı atarak önce bir pipet ile sıvının üst kısmında herhangi bir yağ mevduat aspire. HBSS hücre pelletini üç kez yıkayın. Tripan mavi boya dışlanma ve numaralandırmak canlı hücreler tarafından HBSS 1 ml pelletini tekrar.
7. Temsilcisi Sonuçlar:
> 4-günlük inoküle fareler vajinal lavaj sıvısının hücresel kesirler genellikle Candida, epitel hücreleri ve hücresel infiltratlar (Şekil 5) oluşur. Islak-montaj mikroskopi, Candida görsel hifler varlığı yanı sıra maya (Şekil 5A) tarafından tespit edilebilir. Ana hücreleri üç nucle tarafından belirlenen nötrofil olan epitel hücreleri ve infiltre lökositler, vajinal lavaj sıvısının Smear hazırlıkları incelemek için Papanicolaou tekniği ile boyananar loblar (Şekil 5B). Çok az sayıda nötrofil, eğer varsa, 41 uninoculated fareler (Şekil 5C) tespit edilir.
Vajinal mantar yükünün bir örnek Şekil 6'da gösterilmiştir. CFU sayımı (Şekil 6A) için belirli bir zaman noktalarında toplanan Vajinal lavaj sıvısı kültürü. Candida vajinal kolonizasyonu olmayan östrojen ile tedavi edilen farelerde (Şekil 6C) inoküle kurmak için başarısız olur, Candida vajinal kolonizasyon / enfeksiyon, östrojen tedavisi inoküle fareler (Şekil 6B) hafta boyunca devam etmektedir . Uninoculated östrojen ile tedavi edilen farelerde süresi (veriler gösterilmemiştir) boyunca Candida negatif kalır. Buna ek olarak, her zaman noktasında veya boyuna aynı farelerde anestezi altında vajinal lavaj ayrı fareler üzerinde ya bir kez gerçekleştirilir olabilir.
Lomber lenf düğümleri, genital sistem ve vajinal sorun sistemik bağışıklık yanıtlarını değerlendirmek için en uygun site temel drenaj lenf düğümleri. Note uninoculated fareler normalde oldukça küçük görünen bu lenf düğümleri inoküle farelerde genişlemiş olabilir. Lökosit hücresel kurtarma genellikle 8 aralık × 10 5 / uninoculated fare 5 × 10 6 / inoküle fare. Lomber lenf bezlerine ek olarak, kasık, popliteal ve mezenterik lenf düğümleri de kullanılabilir.
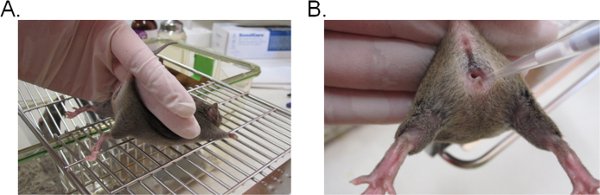
Şekil 1. Candida ile Vajinal aşılama. A) fare inokülasyon için ölçülü. Fare, bir tel kafes eklemek yerleştirilir ve bacaklar hafifçe yukarı doğru kaldırın ve vajinal açılma ortaya çıkarmak için, kuyruk tabanı tarafından düzenlenen. Kuyruk kısıtlama direnmeye çalışır fare kalça aynı eli ile stabilize olabilir. B) inokulum vajinal lümen içine giriş. Bir pipet yavaşça vajinal lümen içine derin yaklaşık 5 mm eklenir. Süspansiyon inokulum sonra yatırılır.
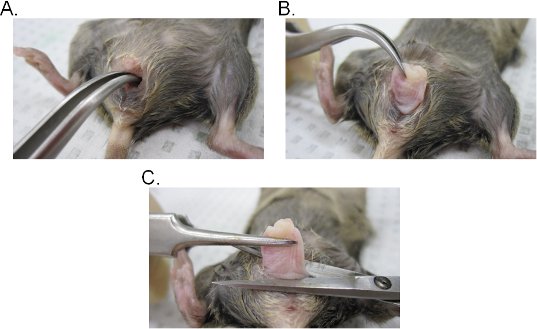
Şekil 2: Vajinal doku ekstraksiyonu . AB serviks) Ekstraksiyon. Serviks kavisli bir forseps ile yer ve vajinal boşluğu yoluyla dışa maruz kalmaktadır. Bir kez vajinal kavite, serviks, vajina tamamen açığa çıkarmak için daha fazla dışa çekilir. C) vajina Ekstraksiyon. Vajina, vulva makas ile eksize edilir. Müstakil sonra, vajinadan rahim ağzı çıkarın.

Şekil 3. lomber lenf nodlarının belirlenmesi. Pelvis çevresinde, çevre organlara / kan damarları arasında lomber lenf nodu yeri gösterilir. A, abdominal aorta. B, mesane. C, iliyak arter. Ben, bağırsak. L, karaciğer. R, rektum. S, dalak. U, Uteri.

Şekil 4, bir tel örgü ekran üzerine yerleştirilen lomber lenf düğümleri . Lenf düğümleri, HBSS ile bir petri kabına yerleştirilir ekrana toplanmış. Lenf düğümleri tek hücre süspansiyonları lenfoid hücreleri elde etmek için bir şırınga pistonu ile ekrana bastırılır.
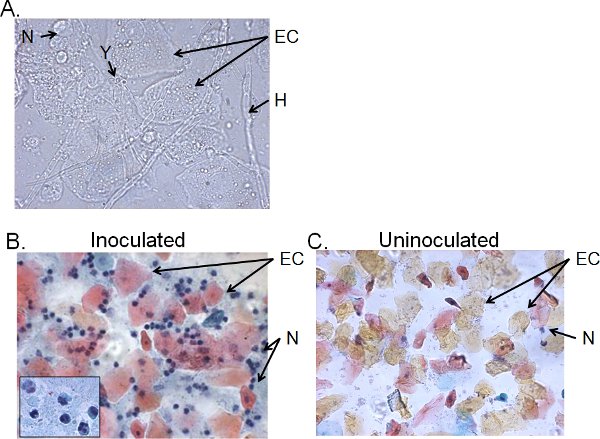
Şekil 5 inoküle farelerden alınan vajinal lavaj sıvısı Hücresel kesirler. Vajinal lavaj örneklerinin A) Islak mount ve B) Pap smear preparatları uninoculated farelerden alınan) sonrası aşılama ve C 4 gün toplanan. Görüntüler 1000 × (A) veya 400 × (B, C) büyütme. B eklemek 1000 × vajinal nötrofil nükleer morfoloji göstermektedir. Candida maya (Y) ve hif (H), epitel hücreleri (EC) ve neutrohils (N) gösterilir.
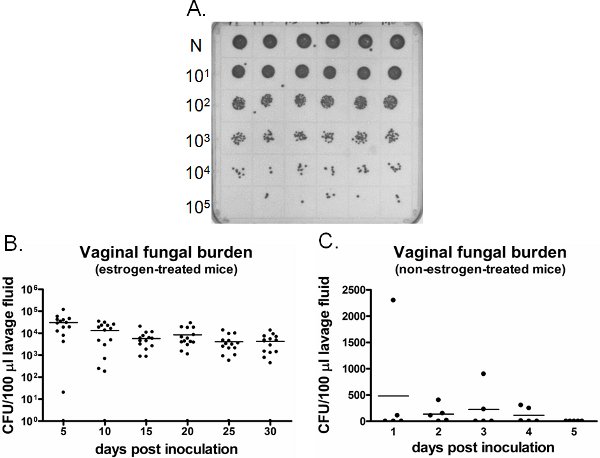
Şekil 6: Algılamavajinal mantar yükünün iyon. A) Temsilcisi C. albicans kolonileri SDA plaka üzerinde büyüdü. Neat (N) altı (üst satırda) farklı inoküle fareler lavaj örnekleri seri olarak seyreltilmiş ve CFU sayımı için kültüre edildi. B) vajinal mantar yükünün Niceleme östrojen ile tedavi edilen ve C) non-östrojen ile tedavi edilen farelerde. Inoküle farelerden alınan lavaj sıvısı CFU/100 ul belirtilen zaman noktalarında değerlendirildi.
Tartışmalar
Candida vajinit, deneysel bir fare model kurulmuş ve tarihsel olarak son birkaç yıldır kullanılan 3,4,11,13,16,17,19,21,24 antifungal tedaviler test etmek için Candida mukozal konak yanıtının yanı sıra çalışma olmuştur 25,37. Protokoller, burada verimli ve daha az emek-yoğun yöntemleri dahil, ve Candida vajinit en optimize edilmiş bir model sistemleri bugüne kadar açıklanan gibi görünen sundu. Bu teknikler hızlı kantifikasyon vajinal ö...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma, R01 AI32556 (NIAID, Ulusal Sağlık Enstitüsü) tarafından desteklenmiştir. Bu çalışma ayrıca, Louisiana Aşı Merkezi ve Güney Louisiana Louisiana Regents Kurulu tarafından desteklenen Enfeksiyon Hastalıkları Araştırma Enstitüsü tarafından desteklenmiştir.
Malzemeler
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar |
| Kadın CBA / J fareler | Charles River Laboratuvarları | 01C38 | 5-6 hafta |
| Candida albicans (3153A) | Patojenik Mantarlar, Birleşik Krallık Ulusal Koleksiyonu | NCPF3153 | |
| Susam yağı | Sigma-Aldrich | S3547 | Kullanmadan önce ön sterilize edilmek üzere ihtiyaç duymaz |
| Β-östradiol 17-valerat | Sigma-Aldrich | E1631 | Susam yağı 0.1-0.5mg |
| Phytone pepton | Becton Dickinson | 211906 | % 0.1 glukoz ile Ek |
| Tripan mavi çözümü | Sigma-Aldrich | T8154 | |
| Sabouraud dekstroz agar | Becton Dickinson | 211584 | |
| Kollajenaz tip IV | Sigma-Aldrich | C5138 | % 0.25 |
| Dispase | Invitrogen | 17105-041 | 1.7 U / ml |
| Tel örgü ekranlar | TWP | 060X060S0065W36T | No 60 mesh, paslanmaz |
| Hanks dengeli tuz çözeltisi | Invitrogen | 24020-117 | |
| CytoPrep fiksatif | Fisher Scientific | 12-570-10 | Smear slaytlar korur |
| Leke Papanicolaou EA-65 | Merck Kimyasallar | 7054X-85 | |
| Leke Papanicolaou RG-6 | Merck Kimyasallar | 7052X-85 | |
| Harris 'Şap hematoksilen | Merck Kimyasallar | 638A-85 | |
| İsofluranın | Baxter Healthcare | NDC 10019-773-60 | Izofluran buharlaştırıcı ya da bir damla sistemi el anestezi kamara kapalı |
Referanslar
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır