JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
의 실험 마우스 모델에서 질 접종 및 샘플 수집을위한 프로토콜 칸디다 질염
요약
평가에 사용되는 주요 기술 칸디다 질염이 설명되어 있습니다. 방법은 허리 림프절을 배수의 질 표본 및 lymphocytes의 급속한 컬렉션을하실 수 있습니다. 이 기술은 여성의 낮은 성기 요로에있는 다른 질병의 마우스 모델에 상승을 줄 수 있습니다.
초록
칸디다 종에 의한 Vulvovaginal 칸디다 증 (VVC)은, 그들의 생식 년 18,32-34 동안 달리 건강한 여성의 약 75 %에 영향을 미치는 낮은 여성의 성기 요로의 곰팡이 감염입니다. Predisposing 요인 항생제 사용, 통제 당뇨병 방해 생식 호르몬 수준에 임신으로 인해, 경구 피임약이나 호르몬 대체 요법 33,34을 포함합니다. 연간 세 개 이상의 에피소드로 정의된 재발성 VVC (RVVC)는없고 predisposing 요인 33 여성의 8 %를 별도의 다섯 영향을 미칩니다.
VVC의 실험 마우스 모델은 설립 pathogenesis과 칸디다 3,4,11,16,17,19,21,25,37에 점막 호스트 응답을 연구하는 데 사용되었습니다. 이 모델은 또한 생체내 13,24 잠재적인 antifungal 치료를 테스트하기 위해 고용되었습니다. 모델 동물에 대한 선택 pseudoestrus의 상태로 유지합니다imal 칸디다 식민 / 감염 6,14,23. 이러한 조건에서, 주사 동물 개월 주 동안 질 곰팡이 부담을 감지합니다. 과거 연구는 면역 및 생리 특성 3,16,21에 상대적인 동물 모델과 인간 사이의 감염이 매우 높은 병렬을 보여줍니다. 차이점은, 그러나, 정상적인 질 식물로 칸디다의 부족과 생쥐의 중립 질 산도를 포함합니다.
여기에서 우리는 질 접종, 질 표본의 신속한 수집, 질 곰팡이 부담 평가 및 세포 추출 / 격리에 대한 조직 준비를 포함하는 마우스 질염 모델의 주요 방법의 일련 보여줍니다. 이것은 질 세척 유체, 곰팡이 부담, 그리고 배수 림프절의 백혈구의 수율의 성분에 대한 대표적인 결과는 다음입니다. anesthetics의 사용으로 세척 샘플의 길이 평가를 위해 같은 생쥐에 여러 시간 지점에서 수령 가능감염 / 식민지. 또한,이 모델은 정의된 호스트 조건 하에서 면역 연구를 허용, 감염을 시작하는 데 아무런 immunosuppressive 요원을 필요하지 않습니다. 마지막으로, 모델 및 각 기술은 여기에 잠재적으로 낮은 여성의 성기 요로 (바이러스성, 기생, 세균)과 각 지역 또는 체계 호스트 방어의 다른 감염증을 조사하는 방법론의 사용에 상승을 줄 수 소개했다.
프로토콜
1. 칸디다 albicans와 질 접종
- 이전 접종에 사흘은 복부를 노출하기 위해 동물을 억제하면서, 낮은 복부에 subcutaneously β - estradiol의 0.1-0.5 MG를 포함 참기름 100 μl를 주입. 사출 사이트에서 누출을 최소화하기 위해 피부에 측면 5-10mm에 대한 바늘을 전진.
아래 복부에있는 에스 트로겐의 피하 행정부는 성기 요로에 근접으로 인해이 모델에 최적입니다. 효과적인 복용이 마우스 변종, 연령 또는 에스 트로겐 유도체에 따라 다를 수 있습니다. CBA - J (H - 2 κ), C3H/HeN (H - 2 κ), C57BL / 6 (H - 2 B), Balb / C (H - 2 D)를 사용하여 이전 연구에서, DBA / 2 (H - 이 D), 연령 6-8 주가 SJL (H - 2의) 마우스가 0.1 mg/100 μl가 효과가 있던 질 벽 농화에 의해 입증, 질 점액 및 감소상피 세포 sloughing 증가했습니다. 이상이 농도에서 에스 트로겐과 치료를 마우스는 칸디다와 일치하는 질 식민지를 나타냅니다. 다른 변종과 연령대의 생쥐에 접종 들어, 파일럿 연구는 수정된 조건에서 에스 트로겐의 효과를 보장하고 필요한 경우 에스 트로겐 복용을 증가하는 것이 좋습니다.
에스 트로겐 솔루션은 주입 당일에 매번 신선한 준비되어야합니다. 참기름에 에스 트로겐의 완전한 용해도를 보장하기 위해 철저하게 37 간헐적으로 소용돌이 믹서 및 열을 사용하여 솔루션을 믹스 ° C. 연구 기간에 걸쳐 매주 주사를 반복합니다. - inoculum를 준비하려면, C.의 loopful을 추가 0.1 %의 포도당과 보충 Phytone - 펩톤의 국물의 10 ML에 Sabouraud - 덱스 트로 오스 한천 (SDA)에 최근 subculture 준비에서 albicans blastoconidia. 25 ° 흔들어 물을 욕조에서 C 18 H에 대한 고정 단계로 국물 문화를 품어.
- 부화 후, 일를 수집5 분 800 XG에 15 ML 원뿔 튜브와 원심 분리기로 전자 국물 문화. 멸균 PBS로 두 번 펠렛 씻으십시오.
- trypan 청색 색소 제외하여 hemocytometer에서 가능한 blastoconidia를 열거합니다. 2.5 세포 농도를 조절 X 10 멸균 PBS로 6 / ML (또는 원하는 inoculum의 농도).
- 마우스를 안정화하기 위해, 두 손가락으로 꼬리의 기반을 잡고 위쪽으로하므로 질구가 (그림 1A) 방향으로 얼굴을 그 엉덩이를 리프트. 마우스가 마우스의 꼬리 구속에 대한 저항을 제공할 수 있도록 평평한 grated 표면 (예 : 케이지 상단)에 위치하는 경우 그것은 이상적입니다.
- 질 루멘 (그림 1B)에 깊이 5mm에 대한 피펫 팁을 삽입하여 inoculum 서스펜션의 피펫 20 μl (20 μl을 초과하지 않는 원하는 볼륨). 마우스의 고통을 최소화하는 등 신속하고 부드럽게 가능한이 단계를 완료하십시오.
2. 질 lavages
- 다음 안락사 (또는 마취), H질구가 노출 될 수 있도록 두 손가락으로 꼬리의 기지에 의해 아래로 오래된 마우스.
- 피펫 팁과 반복 열망과 동요와 함께 멸균 PBS 100 μl을 도입하여 질 루멘을 세척. 피펫 팁은 세포들로 가득 찼어 될 수 있습니다. 이 문제가 발생하면, 방해 세포를 분배하고 질에 남아 PBS와 lavaging 계속 진행합니다. microcentrifuge 튜브로 세척 유체를 수집합니다.
- 또한, 질 lavages는 isoflurane 흡입 마취와 anesthetized 생쥐에서 수행할 수 있습니다. 이를 위해, 그들은 완전히 (~ 30 초). 회복될 때까지 isoflurane을 증발에 쥐를 노출. 꼬리의 기지에 의해 아래쪽으로 마우스를 잡고 부드럽게 멸균 PBS의 50 μl를 사용하여 질 루멘을 세척. 이 절차를 수행하는 동안 음부에 외상을 최소화하기 위해 피펫 팁과 거친 동요를 방지해야합니다. 진정 마우스는 주위 공기에 노출을 30 초 이내에 마취에서 회복해야합니다.
Isofluraneisoflurane 기화기와 O 2 (선호) 또는 표준 드롭 시스템 기화기 시스템 (호흡 곤란을 피하기 위해 진정제 동안 동물의 가까이 모니터링 필요)하지 않고 마취 챔버를 폐쇄를 사용하여 증발 수 있습니다.
anesthetized 생쥐에 대한 질 lavages 같은 생쥐에 세로 세척 샘플 선택하는 방법해야합니다. 연속 lavaging 시간이 41여 곰팡이 부담의 평가에 영향을 미치지 않습니다.
- 축축한 마운트 준비 들어, 유리 슬라이드에 세척 유체의 10 μl를 전송 가벼운 현미경으로 400 배율 1000x에서 관찰합니다. 또한, 세척 유체의 세포 분수는 세포와 핵 morphologies를 검토 스테인드 수 있습니다. 비방 준비 들어, 유리 슬라이드에 세척 유체의 10 μl를 전송하고 부드럽게 피펫 팁의 외벽을 사용하여 확산. CytoPrep의 정착액으로 얼룩 샘플을 보존 및 표준 Papanicolaou 기술에 의해 착색 (자궁 세포진 검사). 가벼운 현미경으로 400 × 확대 관찰.
3. 질 곰팡이 부담 부량
- 96 잘 둥근 바닥 판, 그 칼럼의 다음과 같은 다섯 우물 (접시 아래)에 맨 윗줄과 멸균 PBS 180 μl 잘 하나에 세척 유체를 전송합니다.
- 열에있는 다음 잘하는 유체의 20 μl를 전송하여 질 세척 유체의 1시 10분 시리얼 dilutions하십시오. 각 전송 전에 반복 흡인에 의해 철저히 섞는다. 12 세척 샘플 (한 전체 가로 행)까지 직렬 dilutions은 12 채널 피펫을 사용하여 동시에 수행할 수 있습니다.
- 가장 낮은 희석부터 Sabouraud - 덱스 트로 오스 한천 (SDA)에 샘플 10 μl를 전송합니다. 최대 36 샘플의 도금은 격자 및 조정 간격 멀티채널 피펫과 사각형 배양 접시에 준비 SDA를 사용하여 한 접시에 수행할 수 있습니다.
- 34에서 배양 후 콜로니 형성 단위 (CFUs)를 열거 ° C F또는 48 H.
4. 질 조직 추출
- 질 세척 절차에 따라, 그 뒷면에있는 euthanized 마우스를 틀어서 70 % 에탄올로 사타구니 영역을 포화. 포셉 한 켤레를 사용하여 상승하므로 질구가 노출되는 것을 요도 구멍 리프트.
- 질 루멘으로 휘어져 포셉 한 켤레를 삽입하여 자궁 경부를 찾습니다. 포셉와 확고한 그립을 유지하면서, 질 캐비티 (그림 2A - C)를 통해 자궁 경부의 압축을 풉니다.
- 질구의 기지에서 다음 소비세 질은 수술 가위로 질에서 자궁 경부를 제거합니다. 질 조직 (질 상피 쪽 내부 외부 노출) involuted는 것을 염두에 두십시오. 조직은 어느 측면 질의 원래 방향을 유지하기 위해 거꾸로 또는 측면 절개하여 시트에 열 수 있습니다.
Excised 질 조직은 1) 사용할 수 있습니다 림프구 추출 다음의 합성histological 분석 25 nase의 소화 (~ 1 × 10 4 / 마우스) 40, 2) 상피 세포 절연 다음 dispase의 소화 (~ 5 × 10 4 / 마우스) 28, 3) 냉동 또는 파라핀 - 임베디드 준비.
5. 허리 림프절의 절단
- 질 세척 절차에 따라, 그 뒷면에있는 euthanized 마우스를 틀어서 70 % 에탄올로 복부를 포화. 아래 복부에서 가슴에 시작 가로 절개를 만들고 내부 장기 노출. 양손의 집게 한 켤레를 사용하여 상승하므로 중앙 혈관이 표시되고 그 창자를 이동합니다.
- 하부 대정 맥과 복부 대동맥을 찾습니다. 일반적으로 요추 림프절 한 쌍의는 복부 대동맥에 인접한 식별에 대한 중간 신장 및 일반 장골의 동맥에 39의 기원 사이에 위치해 있습니다. 이러한 림프절은 시각 탄성 질감에 의해 지방 조직에서 구분할 수및 지방 조직 (그림 3)에 비해 컬러로 가볍고 더 불투명하고 있습니다. 이러한 림프절은 uninoculated 동물에 비해 감염된 동물에서 눈에 띄게 큰 있습니다.
- 절제 후 임파선 노드에서 microforceps을 배치하여 노드 및 조직을 주변에서 분리 부드럽게 올려.
6. 단일 셀 정지에 림프 세포의 분리
- 행크스 '균형 소금 솔루션 ~ 10 ML (HBSS) (그림 4)를 포함하는 살균 유리 페트리 접시 내에 살균 철망 화면 (크기 약 3 X 3cm 2)로 림프절을 전송합니다.
- 약간 경사 페트리 접시로, 주사기의 플런저 머리가 화면에 대한 림프절을 누르십시오. 노드의 비 세포 구성 요소 (즉, 세포막, 기질, 지방)가 화면에 남아있는 동안 노드의 휴대폰 내용이 화면에 통과되도록 모든 림프절을 휴식해야합니다.
- 같은 플런저와 주사기, 기음 t를 사용그는 포함하는 세포를 HBSS. ~ 5 ML의 HBSS와 함께 화면을 씻고 15 ML 원뿔 관에 남아있는 유체를 수집합니다.
- 10 분 800 XG에 원심 분리기. 유체 폐기하기 전에 피펫으로 유체의 상단에있는 지방 예금 기음. HBSS와 세포 펠렛을 세 번 씻으십시오. trypan 청색 색소 제외 의해 HBSS하고 열거 가능한 세포의 1 ML에 펠렛을 Resuspend.
7. 대표 결과 :
> 4 일 주사 생쥐에서 질 세척 유체의 세포 분수는 일반적으로 칸디다, 상피 세포 및 세포 infiltrates (그림 5)로 이루어져 있습니다. 축축한 마운트 현미경으로, 칸디다는 시각 균사의 존재뿐만 아니라 효모 (그림 5A)로 확인할 수 있습니다. 질 세척 유체의 비방 준비가 주요 세포 트라이 nucle 식별 neutrophils되어있는 상피 세포 침투 leukocytes을 검사 Papanicolaou 기술로 물들일 수있다AR 돌출부 (그림 5B). 거의 neutrophils가있는 경우, 41 uninoculated 생쥐 (그림 5C)에 감지됩니다.
질 곰팡이 부담의 예제는 그림 6에 표시됩니다. 특정 시간 지점에서 수집된 질 세척 유체는 CFU 열거 (그림 6A)에 대한 양식입니다. 칸디다가 아닌 에스 트로겐 - 대우 주사 생쥐 (그림 6C)의 질 식민지를 확립하는 데 실패하면서 칸디다와 질 식민지 / 감염, 에스 트로겐 - 치료 주사 생쥐 (그림 6B)의 주간 지속. 에스 트로겐 - 처리 uninoculated 생쥐는 시간 (데이터가 표시되지 않음)을 통해 칸디다에 대한 부정적 남아있다. 또한, 질 lavages는 각 시점 또는 길이 방향 마취하에 동일한 생쥐에서 별도의 생쥐에 중 한 번만 수행할 수 있습니다.
허리 임파선은 성기 요로와 질 도전하는 체계 면역 응답을 평가할 수있는 가장 관련성이 높은 사이트의 기본 배수 림프절입니다. N그들은 일반적으로 uninoculated 생쥐에서 매우 작은 나타나는 반면 이러한 림프절은 주사 생쥐에 확대 될 수 ote. 백혈구 세포 recoveries는 일반적으로 8 일부터 다양한 × 10 5 / uninoculated 마우스로 5 × 10 6 / 주사를 마우스. 허리 림프절 이외에도, 사타구니와 오금 mesenteric 림프절도 사용할 수 있습니다.
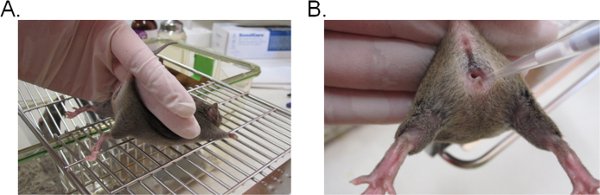
그림 1. 칸디다와 질 접종. A) 마우스 접종에 감금. 마우스는 와이어 케이지 삽입에 위치하고 약간 위쪽 다리를 들고와 질구를 노출, 꼬리의 기지에 의해 개최됩니다. 그것은 꼬리 구속에 저항하는 시도로 마우스의 엉덩이는 같은 손으로 안정 수 있습니다. 질 루멘에 inoculum의 B) 소개. 피펫 팁은 부드럽게 질 루멘에 깊이 5mm에 대한 삽입됩니다. 서스펜션 inoculum 그러면 입금됩니다.
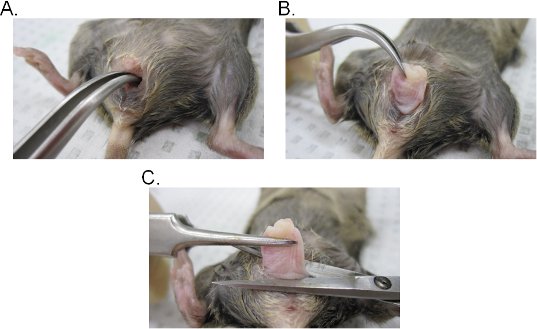
그림 2. 질 조직 추출. 자궁 경부의 AB) 추출. 자궁 경부는 곡선 집게와 함께 위치하고 질 캐비티를 통해 밖으로 노출됩니다. 일단 밖으로 질 구멍의 자궁 경부가 더욱 완벽하게 음부 노출 밖으로 뽑아입니다. 질 C) 추출. 질은 가위로 외음부에서 excised 수 있습니다. 일단 분리된, 음부에서 자궁 경부를 제거합니다.

그림 3. 요추 림프절의 식별. 골반 주변에 주변 장기 / 혈관 중에서 요추 림프절의 위치가 표시됩니다. A, 복부 대동맥. B, 방광. C, 공통 장골의 동맥. 난 장의. L, 간. R, 직장. S, 비장. U, Uteri.

그림 4. 와이어 메쉬 화면에 배치 허리 림프절. 림프절은 HBSS있는 페트리 접시에 배치 화면에 풀링하고 있습니다. 림프절은 단일 셀 정지에 림프 세포를 얻기 위해 주사기의 플런저와 함께 화면에 대해 누르면됩니다.
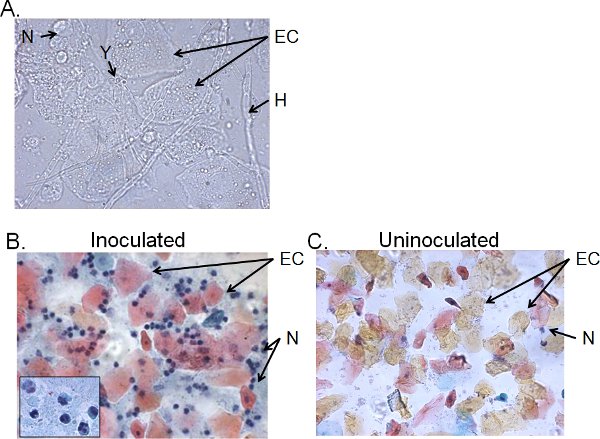
그림 5. 주사 생쥐에서 질 세척 유체의 세포 분수. 질 세척 샘플) 습식 마운트 및 B) 자궁 세포진 검사의 준비는 uninoculated 생쥐에서) 사일 포스트 접종 및 C를 수집. 이미지는 1,000 × (A) 또는 400 × 표시됩니다 (B, C) 확대. B의 삽입은 1000 ×의 질 neutrophils의 핵 형태를 보여줍니다. 칸디다 효모 (Y)와 균사 (H), 상피 세포 (EC)와 neutrohils (N)이 표시됩니다.
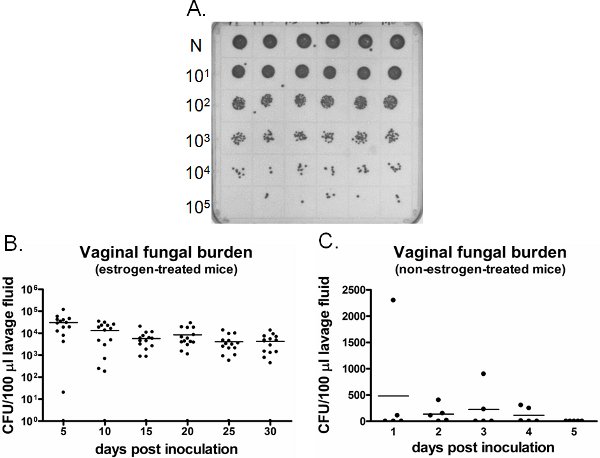
그림 6. 감지질 곰팡이 부담의 이온. A) C. albicans 대표의 식민지가 SDA의 접시에 성장. 여섯 가지 주사 생쥐 (맨 윗줄)에서 스트레이트 (N) 세척 샘플은 순차적으로 희석하여 CFU 열거를위한 교양되었습니다. B)에서 질 곰팡이 부담 부량 에스 트로겐 - 취급 C) 비 에스 트로겐 - 처리 쥐. 주사 생쥐에서 세척 유체의 CFU/100 μl는 지정된 시간 포인트에서 평가되었다.
토론
칸디다 질염의 실험 마우스 모델, 설립 역사적 3,4,11,13,16,17,19,21,24 antifungal 요법을 테스트뿐만 아니라 칸디다에 점막 호스트 응답을 연구하기 위해 지난 몇 십년에 사용되고 있습니다 25,37. 프로토콜은 여기 효율적이고 덜 노동 집약적인 방법 통합, 그리고 칸디다 질염의 가장 최적화된 모델 시스템 중 하나가 날짜 설명한 것으로 나타날 제시. 이 기술은...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 R01 AI32556 (NIAID, 건강의 국립 연구소)에 의해 지원되었다. 이 작품은 또한 루이지애나 백신 센터와 Regents의 루이지애나위원회 주최 감염증 연구 남부 루이지애나 연구소에 의해 부분적으로 지원되었다.
자료
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 여자 CBA / J 마우스 | 찰스 리버 연구소 | 01C38 | 나이 5-6주 |
| 칸디다 albicans (3153A) | 병원성 곰팡이 국립 수집, 영국 | NCPF3153 | |
| 향유 | 시그마 - 올드 리치 | S3547 | 사용하기 전에 미리 소독을 할 필요가 없다 |
| Β - estradiol 17 - valerate | 시그마 - 올드 리치 | E1631 | 참깨 기름에 0.1 - 0.5mg |
| Phytone 펩톤 | Becton 디킨슨 | 211,906 | 0.1 % 포도당과 보충 |
| Trypan 푸른 솔루션 | 시그마 - 올드 리치 | T8154 | |
| 덱스 트로 오스 Sabouraud 한천 | Becton 딕inson | 211,584 | |
| Collagenase 유형 IV | 시그마 - 올드 리치 | C5138 | 0.25 % |
| Dispase | Invitrogen | 17105-041 | 1.7 U / ML |
| 와이어 메쉬 스크린 | TWP | 060X060S0065W36T | 번호 60 메쉬, 스테인레스 |
| 행크스 '균형 소금 솔루션 | Invitrogen | 24020-117 | |
| CytoPrep 정착액 | 피셔 과학 | 12-570-10 | 얼룩 슬라이드를 보존 |
| Papanicolaou는 EA - 65 얼룩 | EMD 화학 | 7054X 85 | |
| Papanicolaou는 OG - 6 얼룩 | EMD 화학 | 7052X 85 | |
| 해리스 '명반의 hematoxylin | EMD 화학 | 638A - 85 | |
| Isoflurane | 박스터 헬스케어 | NDC 10019-773-60 | isoflurane 기화기 또는 드롭 시스템에서 사용되는 마취 챔버 폐쇄 |
참고문헌
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유