É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Protocolos para inoculação vaginal e coleta de amostra no Modelo Experimental de Rato Candida Vaginite
Neste Artigo
Resumo
Principais técnicas a serem utilizados na avaliação de Candida Vaginite em um modelo animal experimental são descritos. Os métodos permite uma recolha rápida de amostras vaginais e linfócitos de linfonodos drenantes lombar. Estas técnicas podem dar origem a modelos de ratos de outras doenças na parte inferior do trato genital feminino.
Resumo
Vulvovaginal candidíase (VVC), causada por espécies de Candida, é uma infecção fúngica do trato genital feminino, que afeta aproximadamente 75% das mulheres saudáveis durante seus anos reprodutivos 18,32-34. Os fatores predisponentes incluem uso de antibióticos, diabetes descontrolado e perturbação nos níveis de hormônios reprodutivos devido à gravidez, contraceptivos orais ou terapias de reposição hormonal 33,34. VVC recorrente (RVVC), definida como três ou mais episódios por ano, afeta a 5 separada a 8% das mulheres sem fatores predisponentes 33.
Um modelo experimental de rato VVC foi estabelecida e utilizado para estudar a patogênese e resposta do hospedeiro mucosa a Candida 3,4,11,16,17,19,21,25,37. Este modelo também foi empregado para testar potenciais terapias antifúngicas in vivo 13,24. O modelo exige que os animais sejam mantidos em estado de pseudoestrus para optimal Candida colonização / infecção 6,14,23. Sob tais condições, animais inoculados terá carga fúngica vaginal detectável por semanas a meses. Estudos anteriores mostram um paralelo extremamente elevada entre o modelo animal e infecção humana em relação a propriedades imunológicas e fisiológicas 3,16,21. Diferenças, entretanto, incluem a falta de Candida como flora vaginal normal e um pH neutro vaginal nos ratos.
Aqui, nós demonstramos uma série de métodos-chave no modelo de mouse que vaginite incluem inoculação vaginal, rápida coleta de amostras vaginal, avaliação da carga fúngica vaginal, e as preparações para a extração do tecido celular / isolamento. Isto é seguido por resultados representativos para constituintes do lavado vaginal, carga fúngica, e drenagem linfática produz leucócitos nó. Com o uso de anestésicos, as amostras de lavagem podem ser coletados em momentos diversos na mesma camundongos para avaliação longitudinal dainfecção / colonização. Além disso, este modelo não necessita de agentes imunossupressores para iniciar a infecção, permitindo estudos imunológicos em condições host definido. Finalmente, o modelo e cada técnica introduzida aqui poderia potencialmente dar origem a utilização das metodologias para examinar outras doenças infecciosas do trato genital feminino (bacterianas, parasitárias, virais) e respectivas defesas do hospedeiro local ou sistêmica.
Protocolo
1. Inoculação vaginal com Candida albicans
- Três dias antes da inoculação, enquanto prender o animal para expor o abdomen, injetar 100 ml de óleo de gergelim contendo 0,1-0,5 mg de β-estradiol por via subcutânea na parte inferior do abdômen. Antecedência a agulha cerca de 5 a 10 mm lateral à pele para minimizar a perda no local da injeção.
A administração subcutânea de estrogênio no abdômen inferior é ideal neste modelo devido à proximidade com o trato genital. Doses eficazes podem variar de acordo com linhagens de camundongos, idades ou derivados de estrógeno. Em estudos anteriores usando CBA-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 b), Balb / c (H-2 d), DBA / 2 (H- 2 d), SJL (H-2 s) ratos em 6-8 semanas de idade, 0,1 mL mg/100 foi encontrado eficaz evidenciado pelo espessamento da parede vaginal, diminuição do muco vaginal eaumento da descamação das células epiteliais. Camundongos tratados com estrógeno acima nesta concentração exibem a colonização vaginal consistentes com Candida. Para inoculação em camundongos, de outras cepas e idades, um estudo piloto é recomendado para garantir a eficácia do estrogênio nas condições modificadas e aumentar a dose de estrogênio, se necessário.
A solução de estrogênio deve ser preparado de cada vez no dia da injeção. Para garantir a solubilidade total de estrogênio no óleo de gergelim, misturar a solução com um vortex e calor de forma intermitente a 37 ° C. Repetir a injecção semanal durante todo o período do estudo. - Para preparar o inóculo, adicione um loopful de C. albicans blastoconidia de uma preparação subcultura recentes Sabouraud-dextrose agar (SDA) em 10 ml de caldo de Phytone-peptona suplementado com glicose 0,1%. Incubar a cultura caldo de fase estacionária por 18 horas a 25 ° C em banho-maria a tremer.
- Após a incubação, recolher ªe cultura caldo em um tubo cônico de 15 ml e centrifugar a 800 xg por 5 min. Lave o pellet duas vezes com PBS estéril.
- Enumerar blastoconidia viável em um hemocitômetro por exclusão corante azul de tripano. Ajustar a concentração celular de 2,5 x 10 6 ml / (ou a uma concentração de inóculo desejado) em PBS estéril.
- Para estabilizar o mouse, mantenha a base da cauda com dois dedos e levante o quadril para cima de modo que a abertura vaginal faces em sua direção (Figura 1A). O ideal é que o rato é colocado sobre uma superfície plana ralado (por exemplo, topo de gaiola) para que o mouse pode proporcionar resistência contra a restrição da cauda.
- Pipetar 20 mL (ou um volume desejado para não exceder 20 l) da suspensão de inóculo, inserindo a ponta da pipeta cerca de 5 mm de profundidade para dentro do lúmen vaginal (Figura 1B). Concluir esta etapa mais rápida e suavemente possível para minimizar o sofrimento do mouse.
2. Lavagens vaginais
- Eutanásia seguinte (ou anestesia), ho velho rato para baixo pela base da cauda com dois dedos de modo que a abertura vaginal fica exposta.
- A lavagem do lúmen vaginal através da introdução de 100 ul de PBS estéril com aspiração repetida e agitação com uma ponteira. A ponta da pipeta pode ficar entupido com as células. Se isso ocorrer, dispensar as células e continuar obstruindo lavaging com PBS restante na vagina. Recolher o lavado em um tubo de microcentrífuga.
- Em alternativa, lavagem vaginal pode ser realizado em ratos anestesiados com anestesia inalatória de isoflurano. Para isso, expor os ratos para vaporizado isoflurano até que estejam completamente sedados (~ 30 seg.). Segure os ratos para baixo pela base da cauda e gentilmente lavagem do lúmen vaginal utilizando 50 mL de PBS estéril. Certifique-se evitar a agitação dura com uma ponteira para minimizar o trauma da vagina durante este procedimento. Camundongos sedado deve se recuperar da anestesia dentro de 30 segundos de exposição ao ar ambiente.
Isofluranopode ser vaporizado utilizando um vaporizador de isoflurano e O 2 (preferencial) ou um sistema de queda norma fechada câmara de anestésico sem que o sistema vaporizador (requer acompanhamento de perto do animal, enquanto sedado para evitar problemas respiratórios).
Lavagens vaginais em ratos anestesiados deve ser o método de escolha para amostras de lavagem longitudinal sobre os ratos mesmo. Lavaging consecutivas não influencia a avaliação da carga de fungos ao longo do tempo 41.
- Para wet-mount preparações, a transferência de 10 ml do lavado numa lâmina de vidro e observar com ampliação de 1000x 400 por microscopia de luz. Além disso, as frações celulares do lavado pode ser manchado para examinar células e morfologias nuclear. Para as preparações de esfregaço, de transferência de 10 ml do lavado numa lâmina de vidro e gentilmente se espalhar usando a parede exterior de uma ponta da pipeta. Preservar as amostras de esfregaço com fixador CytoPrep e mancha pela técnica de Papanicolaou padrão (exame de Papanicolaou). Observe a 400 × ampliação por microscopia de luz.
3. Quantificação da carga fúngica vaginal
- Em uma placa de 96 poços de fundo redondo, transferir o lavado em um poço da linha superior e 180 mL de PBS estéril nas seguintes 5 poços dessa coluna (para baixo da placa).
- Faça 01:10 diluições em série de lavado vaginal, transferindo a 20 mL do fluido para o bem próxima na coluna. Misturar bem por aspiração repetida antes de cada transferência. Diluições em série de até 12 amostras de lavagem (uma linha horizontal completa) podem ser realizadas simultaneamente, utilizando uma pipeta de 12 canais.
- Começando com a menor diluição, transferir 10 ml da amostra em Sabouraud-dextrose agar (SDA). Chapeamento de até 36 amostras podem ser realizadas em uma placa usando SDA preparada em pratos de petri com grade quadrada e uma pipeta multicanal ajustável espaçamento.
- Enumerar unidades formadoras de colônia (UFC), após incubação a 34 ° C fou 48 h.
4. Extração de tecido vaginal
- Seguindo o procedimento vaginal lavagem, coloque o mouse sacrificados em suas costas e saturar a área da virilha com etanol 70%. Usando um par de fórceps, levante o orifício urinário para cima de modo que a abertura vaginal fica exposta.
- Inserir um par de fórceps curvado para dentro do lúmen vaginal e localizar o colo do útero. Mantendo uma pegada firme com o fórceps, extrair o colo do útero através da cavidade vaginal (Figura 2A-C).
- Vagina da Excise na base da abertura vaginal e, em seguida, remover o colo da vagina com uma tesoura cirúrgica. Tenha em mente que o tecido vaginal é involuído (interior epitélio lado da vagina é exposta para fora). O tecido pode ser invertida lateralmente para manter a orientação original da vagina ou aberto em uma folha, fazendo uma incisão lateral.
Excisadas tecidos vaginais pode ser usado para: 1) colagem após a extração de linfócitosnase digestão (~ 1 × 10 4 mouse /) 40, 2) das células epiteliais isolamento digestão dispase seguinte (~ 5 do mouse × 10 4 /) 28, 3) preparações congeladas ou parafina para análise histológica 25.
5. Excisão do nó de linfa lombar
- Seguindo o procedimento vaginal lavagem, coloque o mouse sacrificados em suas costas e saturar o abdômen com etanol 70%. Faça uma incisão lateral a partir da parte inferior do abdome para o tórax e expor os órgãos internos. Usando um par de fórceps em ambas as mãos, mover os intestinos para cima de modo que os vasos sanguíneos centrais tornam-se visíveis.
- Localizar a veia cava inferior e aorta abdominal. Normalmente, um par de gânglios linfáticos lombares podem ser identificadas adjacentes à aorta abdominal, localizado a meio caminho entre a origem das artérias ilíacas comuns renal e 39. Estes gânglios linfáticos podem ser visualmente diferenciado de tecido adiposo pela textura elásticae são mais leves e mais opaca na cor em relação ao tecido gorduroso (Figura 3). Estes linfonodos são visivelmente maior nos animais infectados em comparação com animais não inoculadas.
- Especiais de consumo os gânglios linfáticos, colocando micropinças sob o nó e, em seguida, puxar para cima com cuidado para separar tecido circundante.
6. Isolamento de células linfóides em uma única célula suspensões
- Transferência dos gânglios linfáticos em uma tela de arame de malha estéril (aproximadamente 3 x 3 cm 2 de tamanho) colocado dentro de um prato de vidro estéril petri contendo ~ 10 ml de solução de Hanks salina balanceada (HBSS) (Figura 4).
- Com a placa de Petri ligeiramente inclinado, pressione os linfonodos contra a tela com uma cabeça de êmbolo da seringa. Certifique-se de quebrar todos os linfonodos para que o conteúdo celular de nós passar pela tela enquanto os componentes não-celulares dos gânglios (ou seja, membranas, estroma, tecido adiposo) permanecem na tela.
- Usando o êmbolo e seringa mesmo, aspirado tele HBSS contendo células. Lavar a tela com HBSS ~ 5 ml e recolher o líquido restante em um tubo de 15 ml.
- Centrifugar a 800 xg por 10 min. Aspirar qualquer depósitos de gordura na parte superior do líquido com uma pipeta antes de descartar o líquido. Lave o pellet celular três vezes com HBSS. Ressuspender o sedimento em 1 ml de HBSS e enumerar células viáveis por exclusão corante azul de tripano.
7. Resultados representativos:
As frações celulares do lavado vaginal de> 4 dias de camundongos inoculados tipicamente consistem de Candida, células epiteliais e infiltração celular (Figura 5). Por wet-mount microscopia, Candida podem ser identificados visualmente pela presença de hifas, bem como levedura (Figura 5A). Preparados esfregaços de lavado vaginal pode ser manchado pela técnica de Papanicolaou para examinar células epiteliais e leucócitos infiltrantes, das quais as principais células são neutrófilos identificado pelo tri-nuclelobos ar (Figura 5B). Neutrófilos muito poucos, se houver, são detectados em ratos não inoculadas (Figura 5C) 41.
Um exemplo de carga fúngica vaginal é mostrado na Figura 6. Lavado vaginal coletadas em momentos específicos são cultivadas por CFU enumeração (Figura 6A). Colonização vaginal / infecção por Candida persiste por semanas em estrogênio tratados com camundongos inoculados (Figura 6B), enquanto Candida não consegue estabelecer a colonização vaginal não-tratadas com estrogênio camundongos inoculados (Figura 6C). Camundongos tratados com estrógeno não inoculadas permanecem negativos para Candida ao longo do tempo (dados não mostrados). Além disso, lavagens vaginais pode ser realizada uma única vez em ratos separados em cada momento ou longitudinalmente em camundongos mesmo sob anestesia.
Os linfonodos lombares são os principais linfonodos de drenagem do trato genital e do site mais relevante para avaliar a resposta imune sistêmica a um desafio vaginal. Note que esses nódulos linfáticos podem tornar-se ampliado em camundongos inoculados, enquanto eles normalmente aparecem muito pequenas não inoculado em camundongos. Leucócitos recuperações celular normalmente variam de 8 × 10 do mouse 5 / não inoculadas a 5 × 10 do mouse 6 / inoculados. Além de gânglios linfáticos lombares, linfonodos inguinais, poplíteos e mesentérica também pode ser usado.
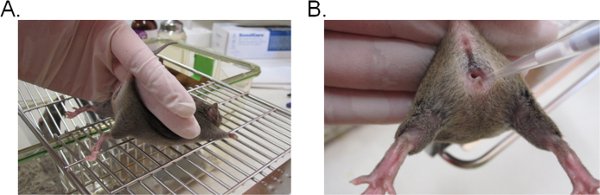
Figura 1. Inoculação vaginal com Candida. A) Um rato restringido para inoculação. O rato é colocado em uma gaiola de arame e inserção realizada pela base da cauda, ligeiramente para cima para levantar as pernas e expor a abertura vaginal. O quadril do mouse pode ser estabilizado com a mesma mão ao tentar resistir à contenção da cauda. B) Introdução do inóculo para o lúmen vaginal. A ponteira é gentilmente inserido cerca de 5 mm de profundidade para dentro do lúmen vaginal. O inóculo de suspensão é então depositado.
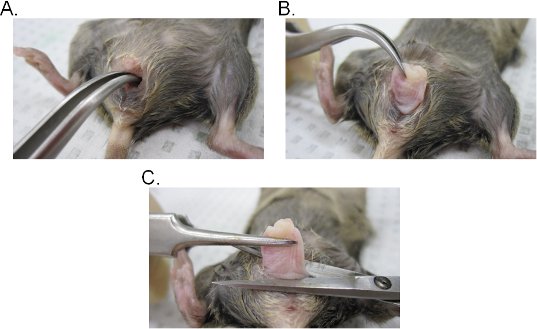
Figura 2. Extração de tecido vaginal. AB Extraction) do colo do útero. O colo do útero está localizado com uma pinça curva e exposto para fora através da cavidade vaginal. Uma vez fora da cavidade vaginal, o colo do útero é ainda mais puxado para fora, para expor completamente a vagina. C) Extração da vagina. A vagina é retirado da vulva com uma tesoura. Uma vez desligada, remova o colo da vagina.

Figura 3. Identificação dos linfonodos lombares. A localização dos gânglios linfáticos lombares entre os órgãos circunvizinhos / vasos sanguíneos nas imediações da pelve é indicado. A aorta abdominal. B, bexiga urinária. C, artéria ilíaca comum. I, intestinos. L, o fígado. R, reto. S, baço. U, Útero.

Figura 4. Os linfonodos lombares colocado em uma tela de malha de arame. Os linfonodos são agrupados na tela colocada numa placa de Petri com HBSS. Os linfonodos são pressionados contra a tela com um êmbolo da seringa para obter células linfóides em uma única célula suspensões.
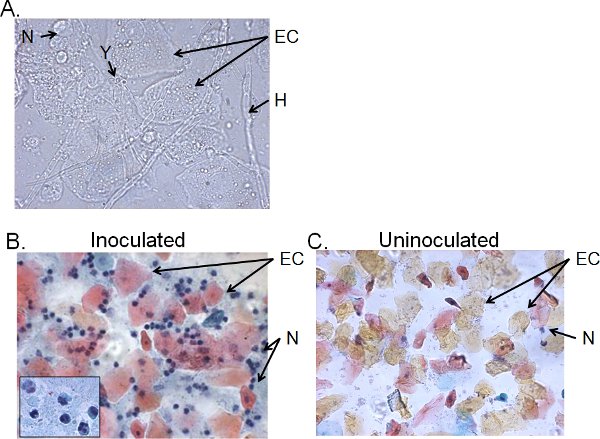
Figura 5. Frações celulares do lavado vaginal de camundongos inoculados. Preparações A) Wet-mount e B) colpocitológico vaginal amostras coletadas lavagem quatro dias após a inoculação e C) de ratos não inoculadas. Imagens são mostradas em 1000 × (A) ou 400 × (B, C) de ampliação. A inserção na B mostra a morfologia nuclear de neutrófilos vaginal em 1000 ×. Candida levedura (Y) e hifas (H), células epiteliais (CE) e neutrohils (N) são indicados.
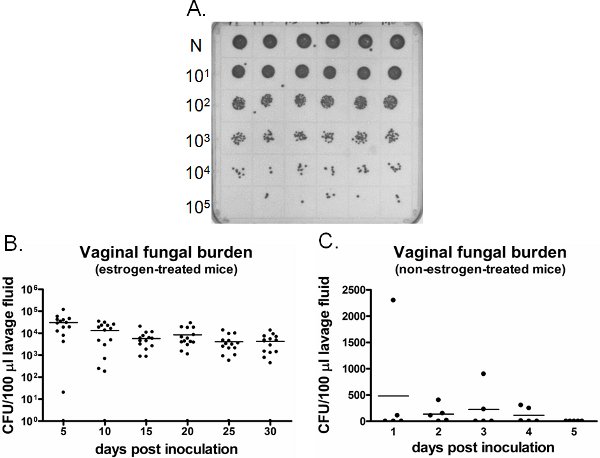
Figura 6. Detectíon de carga fúngica vaginal. A) colônias Representante C. albicans cultivadas em uma placa de SDA. Amostras puras (N) lavagem de seis diferentes camundongos inoculados (linha superior) foram diluídas em série e cultivadas para a enumeração UFC. B) Quantificação da carga fúngica vaginal de estrogênio-tratados e C) não-estrogênio camundongos tratados. Ufc/100 mL do lavado de camundongos inoculados foi avaliada em pontos de tempo indicado.
Discussão
Um modelo experimental do rato de Candida vaginite foi estabelecida e usada historicamente para as últimas décadas para estudar a resposta do hospedeiro mucosa a Candida, bem como para testar terapias antifúngicas 3,4,11,13,16,17,19,21,24, 25,37. Os protocolos aqui apresentados incorporam métodos eficientes e menos trabalhoso, e parecem ser um dos sistemas de modelo mais otimizada de Candida vaginite descritas até o momento. Estas técnicas permitem a quantificação rápida da...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo R01 AI32556 (NIAID, National Institute of Health). Este trabalho também foi apoiado em parte pela Louisiana Vaccine Center e Louisiana do Sul Instituto de Pesquisas de Doenças Infecciosas patrocinado pelo Conselho de Regentes Louisiana.
Materiais
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Feminino camundongos CBA / J | Charles River Laboratories | 01C38 | 5-6 semanas de idade |
| Candida albicans (3153A) | Colecção Nacional de fungos patogênicos, UK | NCPF3153 | |
| Óleo de gergelim | Sigma-Aldrich | S3547 | Não precisa ser pré-esterilizadas antes do uso |
| Β-estradiol 17-valerato | Sigma-Aldrich | E1631 | 0.1-0.5mg em óleo de gergelim |
| Phytone peptona | Becton Dickinson | 211906 | Suplemento com glicose 0,1% |
| Solução de azul de Trypan | Sigma-Aldrich | T8154 | |
| Ágar Sabouraud dextrose | Becton Dickinson | 211584 | |
| Colagenase tipo IV | Sigma-Aldrich | C5138 | 0,25% |
| Dispase | Invitrogen | 17105-041 | 1,7 U / ml |
| Malha de telas de arame | TWP | 060X060S0065W36T | No. 60 mesh, aço inoxidável |
| Solução de Hanks salina balanceada | Invitrogen | 24020-117 | |
| CytoPrep fixador | Fisher Scientific | 12-570-10 | Preserva esfregaço |
| Papanicolaou mancha EA-65 | Merck Química | 7054X-85 | |
| Papanicolaou mancha OG-6 | Merck Química | 7052X-85 | |
| Hematoxilina de Harris Alum | Merck Química | 638A-85 | |
| Isoflurano | Baxter Healthcare | NDC 10019-773-60 | Usado com vaporizador de isoflurano ou em um sistema fechado queda anestésico câmara |
Referências
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados