È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Protocolli per l'inoculazione vaginale e Prelievo dei campioni nel modello murino sperimentale di Candida Vaginite
In questo articolo
Riepilogo
Tecniche di chiave da utilizzare nella valutazione dei Candida in un modello animale sperimentale sono descritti. I metodi di permetterà una rapida raccolta di campioni vaginali e dei linfociti nei linfonodi di drenaggio lombare. Queste tecniche potrebbero dare origine a modelli murini di altre malattie del basso tratto genitale femminile.
Abstract
Candidosi vulvovaginale (VVC), causate da Candida specie, è una infezione fungina del basso tratto genitale femminile che colpisce circa il 75% delle donne in buona salute durante i loro anni riproduttivi 18,32-34. I fattori predisponenti comprendono l'uso di antibiotici, il diabete non controllato e disturbi dei livelli degli ormoni riproduttivi dovuti alla gravidanza, contraccettivi orali o terapia ormonale sostitutiva 33,34. VVC ricorrente (RVVC), definita come tre o più episodi l'anno, colpisce un separato da 5 a 8% delle donne senza fattori predisponenti 33.
Un modello murino sperimentale di VVC è stato istituito e utilizzato per studiare la patogenesi e la risposta dell'ospite mucose da Candida 3,4,11,16,17,19,21,25,37. Questo modello è stato utilizzato per testare potenziali terapie antifungine in vivo 13,24. Il modello prevede che gli animali sono mantenuti in uno stato di optare per pseudoestrusIMAL Candida colonizzazione / infezione 6,14,23. In tali condizioni, gli animali vaccinati avranno rilevabili vaginale carica fungina per settimane o mesi. Studi precedenti mostrano un parallelo estremamente elevata tra il modello animale e infezione umana rispetto alla proprietà immunologiche e fisiologiche 3,16,21. Le differenze, tuttavia, sono la mancanza di Candida come normale flora vaginale e un pH neutro vaginale nei topi.
Qui, dimostrano una serie di metodi chiave del modello vaginite mouse che includono l'inoculazione vaginale, la raccolta rapida di campioni vaginali, la valutazione del peso vaginale da funghi, e preparati per l'estrazione dei tessuti cellulari / isolamento. Questo è seguito da risultati rappresentativi per i componenti del liquido di lavaggio vaginale, carica fungina e drenaggio linfatico rendimenti dei leucociti nodo. Con l'uso degli anestetici, i campioni di lavaggio possono essere prelevati in punti più tempo sui topi stessi per la valutazione longitudinaleinfezione / colonizzazione. Inoltre, questo modello non necessita di farmaci immunosoppressori per avviare l'infezione, permettendo studi immunologici in condizioni definite serie. Infine, il modello e ogni tecnica introdotta qui potrebbe potenzialmente dar luogo ad utilizzare le metodologie per esaminare altre malattie infettive del basso tratto genitale femminile (batteriche, parassitarie, virali) e le rispettive difese dell'ospite locale o sistemica.
Protocollo
1. Inoculazione vaginale con Candida albicans
- Tre giorni prima dell'inoculazione, mentre frenare l'animale per esporre l'addome, iniettare 100 ml di olio di sesamo contengono 0,1-0,5 mg di β-estradiolo per via sottocutanea nella parte inferiore dell'addome. Avanzare l'ago di circa 5 a 10 mm laterale alla pelle per ridurre la dispersione dal sito di iniezione.
La somministrazione sottocutanea di estrogeni nel basso addome è ottimale in questo modello a causa della prossimità del tratto genitale. Dosi efficaci possono variare da ceppi di topi, di età o derivati degli estrogeni. In studi precedenti con CBA-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 b), Balb / c (H-2 d), DBA / 2 (H- 2 d), SJL (H-2 s) i topi a 6-8 settimane di età, 0,1 mg/100 microlitri è stato trovato efficace evidenziato da ispessimento della parete vaginale, riduzione muco vaginale eaumentata desquamazione delle cellule epiteliali. I topi trattati con estrogeni sopra a questa concentrazione mostra coerente colonizzazione vaginale da Candida. Per l'inoculazione in topi di altri ceppi e le età, uno studio pilota si raccomanda di garantire l'efficacia degli estrogeni nelle condizioni modificate e aumentare la dose di estrogeni, se necessario.
La soluzione estrogeni deve essere preparata fresca ogni volta il giorno di iniezione. Per garantire una completa solubilizzazione di estrogeni in olio di sesamo, mescolare la soluzione con un vortex e calore ad intermittenza a 37 ° C. Ripetere l'iniezione settimanale per tutto il periodo di studio. - Per preparare l'inoculo, aggiungere un un'ansata di C. albicans blastoconidia da una preparazione sottocultura recente su Sabouraud-destrosio agar (SDA) in 10 ml di brodo peptone Phytone-integrato con 0,1% di glucosio. Incubare il brodo di cultura di fase stazionaria per 18 ore a 25 ° C in un bagno d'acqua agitazione.
- Dopo l'incubazione, raccogliere °e brodo di cultura in un tubo da 15 ml e centrifugare a 800 xg per 5 minuti. Lavare il pellet due volte con PBS sterile.
- Enumerare blastoconidia possibili in un emocitometro per esclusione trypan colorante blu. Regolare la concentrazione cellulare a 2,5 x 10 6 / ml (o ad una concentrazione di inoculo desiderato) in PBS sterile.
- Per stabilizzare il mouse, tenere la base della coda con due dita e sollevare l'anca verso l'alto in modo che l'apertura vaginale volti verso di voi (Figura 1A). E 'ideale se il mouse è posizionato su una superficie piana grattugiato (es. gabbia in alto) in modo che il mouse in grado di fornire la resistenza contro la coda di moderazione.
- Pipettare 20 l (o un volume desiderato non superiore a 20 l), della sospensione di inoculo inserendo la punta della pipetta di circa 5 mm di profondità nel lume vaginale (Figura 1B). Completare questo passaggio il più velocemente e delicatamente possibile per ridurre al minimo disagio nel topo.
2. Lavaggi vaginali
- A seguito di eutanasia (o anestesia), hvecchio con il mouse verso il basso dalla base della coda con due dita in modo che l'apertura vaginale diventa esposti.
- Lavaggio del lume vaginale con l'introduzione di 100 l di PBS sterile con l'aspirazione ripetute e agitazione con la punta della pipetta. La punta della pipetta può ostruirsi con le cellule. In questo caso, dispensare le cellule ostacolando e continuare con le restanti lavaging PBS nella vagina. Raccogliere il liquido di lavaggio in una provetta.
- In alternativa, lavaggi vaginali può essere eseguito su topi anestetizzati con isoflurano anestesia inalanti. Per questo, esporre i topi di vaporizzato isoflurano fino a quando non sono completamente sedato (~ 30 sec.). Tenere il mouse verso il basso dalla base della coda e delicatamente lavaggio del lume vaginale usando 50 ml di PBS sterile. Assicurati di evitare l'agitazione dura con un puntale per minimizzare il trauma alla vagina durante questa procedura. Topi sedati dovrebbe recuperare dall'anestesia entro 30 secondi di esposizione all'aria ambiente.
Isofluranopossono essere vaporizzati con un vaporizzatore isoflurano e O 2 (preferito) o un sistema standard di camera chiusa goccia anestetico senza il sistema vaporizzatore (richiede uno stretto monitoraggio degli animali, mentre sedato per evitare difficoltà respiratorie).
Lavaggi vaginali in topi anestetizzati dovrebbe essere il metodo di scelta per i campioni longitudinali lavanda sui topi stessi. Lavaging consecutivi non influire sulla valutazione della carica fungina nel corso del tempo 41.
- Per umido-mount preparazioni, 10 ml di trasferimento del liquido di lavaggio su un vetrino e osservare con ingrandimento 400-1000x al microscopio ottico. Inoltre, le frazioni cellulari del liquido di lavaggio può essere macchiato di esaminare morfologia cellulare e nucleare. Per i preparati striscio, 10 ml di trasferimento del liquido di lavaggio su un vetrino e delicatamente diffondere tramite la parete esterna di un puntale. Conservare i campioni di striscio con fissativo CytoPrep e macchiare con la tecnica standard di Papanicolaou (Pap test). Osservare a 400 × ingrandimento al microscopio ottico.
3. Quantificazione del peso vaginale da funghi
- In un ben 96 round-piastra inferiore, trasferire il liquido di lavaggio in un pozzo della riga superiore e 180 ml di PBS sterile nelle seguenti 5 pozzi di quella colonna (la piastra).
- Fai 1:10 diluizioni seriali di liquido di lavaggio vaginale, trasferendo i 20 ml di liquido al pozzo successivo nella colonna. Mescolare accuratamente per aspirazione ripetuta prima di ogni trasferimento. Diluizioni seriali fino a 12 campioni di lavaggio (una riga completa orizzontale) possono essere eseguite contemporaneamente, utilizzando una pipetta a 12 canali.
- A partire dalla diluizione più basso, il trasferimento di 10 ml di campione su Sabouraud-destrosio agar (SDA). Placcatura di un massimo di 36 campioni possono essere eseguite su 1 piastra con SDA preparato in piazza piastre di Petri con griglia regolabile e una pipetta multicanale spaziatura.
- Enumerare le unità formanti colonia (CFU), dopo incubazione a 34 ° C fo 48 h.
4. Estrazione del tessuto vaginale
- Seguendo la procedura lavanda vaginale, giaceva il mouse eutanasia sul dorso e saturare la zona inguinale con il 70% di etanolo. Utilizzando un paio di pinze, sollevare l'orifizio urinario verso l'alto in modo che l'apertura vaginale diventa esposti.
- Inserire un paio di pinze curve nel lume vaginale e individuare il collo dell'utero. Pur mantenendo una salda presa con la pinza, estrarre il collo dell'utero attraverso la cavità vaginale (Figura 2A-C).
- Accise la vagina alla base dell'apertura vaginale e quindi rimuovere il collo dell'utero dalla vagina con le forbici chirurgiche. Tenete presente che il tessuto vaginale è involuta (lato interno epitelio della vagina è esposta verso l'esterno). Il tessuto può essere invertita lateralmente per mantenere l'orientamento originale della vagina o aperto in un foglio facendo una incisione laterale.
Asportati tessuti vaginali possono essere utilizzati per 1) l'estrazione dei linfociti collage seguentidigestione nase (~ 1 × 10 4 / mouse) 40, 2) isolamento delle cellule epiteliali dopo digestione dispasi (~ 5 × 10 4 / mouse) 28, 3) i preparati congelati o inclusi in paraffina per le analisi istologiche 25.
5. Lombare linfa escissione nodo
- Seguendo la procedura lavanda vaginale, giaceva il mouse eutanasia sul dorso e saturare l'addome con il 70% di etanolo. Effettuare una incisione laterale a partire dal basso ventre al petto ed esporre gli organi interni. Usando un paio di pinze con entrambe le mani, spostare l'intestino verso l'alto in modo che i vasi sanguigni diventano visibili centrale.
- Individuare la vena cava inferiore e aorta addominale. Normalmente, un paio di linfonodi lombari possono essere identificati adiacente alla aorta addominale, che si trova circa a metà strada tra l'origine delle arterie iliache renali e comuni 39. Questi linfonodi possono essere visivamente distinti da tessuto adiposo dalla texture elasticae sono più leggeri e più opaco di colore rispetto al tessuto adiposo (Figura 3). Questi linfonodi sono notevolmente più grandi di animali infetti rispetto agli animali non inoculata.
- Accise linfonodi mettendo microforceps sotto il nodo e tirare dolcemente fino a separarsi dal tessuto circostante.
6. Isolamento di cellule linfoidi in cella singola sospensioni
- Trasferimento linfonodi su uno schermo sterile rete metallica (circa 3 x 3 cm 2 di dimensioni) posto all'interno di un piatto di vetro Petri sterile contenente circa 10 ml di soluzione salina bilanciata Hanks '(HBSS) (Figura 4).
- Con la capsula di Petri leggermente inclinato, premere i linfonodi contro lo schermo con una testa stantuffo della siringa. Assicurati di rompere tutti i linfonodi in modo che il contenuto cellulare dei nodi passa attraverso lo schermo, mentre il componenti non cellulari dei nodi (cioè le membrane, stroma, grasso) rimangono sullo schermo.
- Utilizzando il pistone stesso e siringa, aspirare tha HBSS cellule contenenti. Lavare lo schermo con ~ 5 ml HBSS e raccogliere il liquido rimanente in un tubo da 15 ml.
- Centrifugare a 800 xg per 10 min. Aspirare qualsiasi depositi di grasso nella parte alta del liquido con una pipetta prima di scartare il liquido. Lavare i pellet tre volte con HBSS. Risospendere il pellet in 1 ml di HBSS ed enumerare cellule vitali per esclusione trypan colorante blu.
7. Rappresentante dei risultati:
Le frazioni cellulari del liquido di lavaggio vaginale da> 4 giorni topi inoculati tipicamente costituiti da Candida, le cellule epiteliali e infiltrati cellulari (Figura 5). Da bagnato-mount microscopia, Candida può essere visivamente identificato dalla presenza di ife e lieviti (Figura 5A). Preparazioni striscio vaginale di liquido di lavaggio può essere colorato con Papanicolaou tecnica per esaminare le cellule epiteliali e leucociti infiltranti, di cui le cellule principali sono neutrofili identificati dal tri-nuclelobi ar (Figura 5B). Neutrofili molto pochi, se del caso, vengono rilevati nei topi non inoculate (Figura 5C) 41.
Un esempio di peso vaginale da funghi è mostrato in Figura 6. Liquido di lavaggio vaginale raccolti in punti temporali specifici sono coltivate per il conteggio CFU (Figura 6A). Colonizzazione vaginale / infezione da Candida persiste per settimane nei topi inoculati estrogeno-trattati (Figura 6B), mentre Candida non riesce a stabilire la colonizzazione vaginale inoculati nei topi non trattati con estrogeni (Figura 6C). Non inoculate nei topi trattati con estrogeni rimane negativo per Candida per tutto il tempo (dati non riportati). Inoltre, lavaggi vaginali possono essere eseguite una sola volta sui topi separati in ogni fase o longitudinalmente nei topi stessi sotto anestesia.
I linfonodi lombari sono i nodi principali linfodrenante del tratto genitale e il sito più rilevanti per la valutazione sistemica per la risposta immunitaria a una sfida vaginale. Note che questi linfonodi possono diventare allargata nei topi inoculati mentre normalmente appaiono abbastanza piccola non inoculate nei topi. Recuperi cellulare dei leucociti in genere varia da 8 × 10 5 mouse / non inoculate fino a 5 × 10 6 mouse / inoculato. Oltre ai linfonodi lombari, linfonodi inguinali, popliteo e mesenterici può anche essere usato.
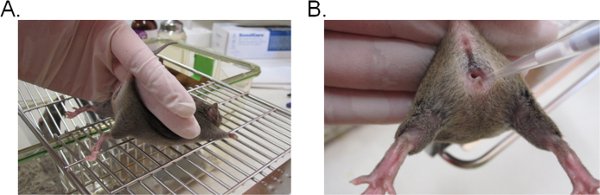
Figura 1. Inoculazione vaginale da Candida. A) Un mouse trattenuto per l'inoculazione. Il mouse è posizionato su un inserto gabbietta e detenute dalla base della coda, leggermente verso l'alto per sollevare le gambe ed esporre l'apertura vaginale. L'anca del mouse può essere stabilizzata con la stessa mano che tenta di resistere alla moderazione coda. B) Introduzione di inoculo nel lume vaginale. Il puntale è delicatamente inserito circa 5 mm di profondità nel lume vaginale. L'inoculo sospensione viene poi depositato.
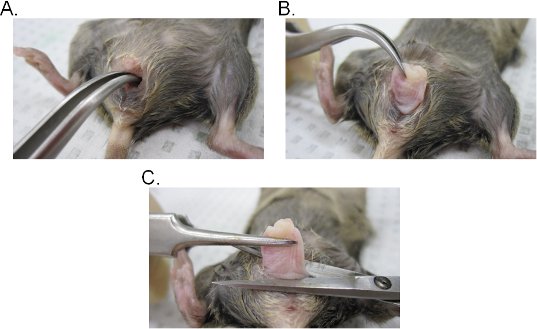
Figura 2. Estrazione del tessuto vaginale. AB) Estrazione della cervice. La cervice si trova con una pinza ricurva ed esposta verso l'esterno attraverso la cavità vaginale. Una volta fuori della cavità vaginale, il collo dell'utero è ulteriormente tirato verso l'esterno per esporre completamente la vagina. C) Estrazione della vagina. La vagina è asportato dalla vulva con le forbici. Una volta staccato, rimuovere il collo dell'utero dalla vagina.

Figura 3. Identificazione dei linfonodi lombari. La posizione dei linfonodi lombare tra gli organi circostanti / vasi sanguigni in prossimità del bacino è indicato. A, aorta addominale. B, della vescica urinaria. C, arteria iliaca comune. Io, intestino. L, fegato. R, retto. S, milza. U, uteri.

Figura 4. I linfonodi lombare posto su uno schermo di rete metallica. I linfonodi sono raggruppati sullo schermo posto in una capsula di Petri con HBSS. I linfonodi sono premuti contro lo schermo con un stantuffo della siringa per ottenere cellule linfoidi in cella singola sospensioni.
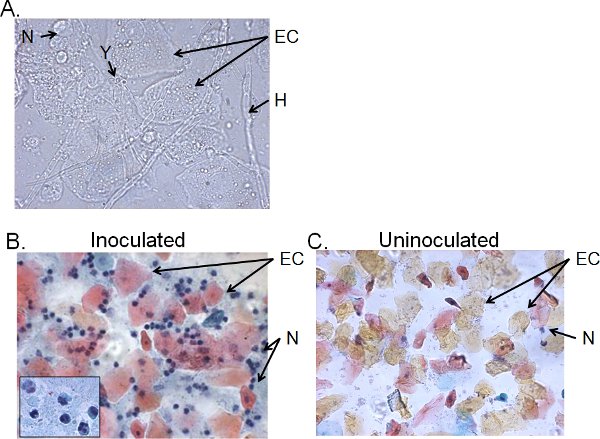
Figura 5. Frazioni cellulari di liquido di lavaggio vaginale dai topi inoculati. Pap A) Wet-mount e B) si preparano strisci di campioni lavanda vaginale raccolto 4 giorni dopo l'inoculazione e C) dai topi non inoculata. Le immagini vengono visualizzate a 1000 × (A) o 400 × (B, C) ingrandimento. L'inserto in B mostra la morfologia nucleare dei neutrofili vaginale a 1000 ×. Lievito Candida (Y) e ife (H), cellule epiteliali (CE) e neutrohils (N) sono indicati.
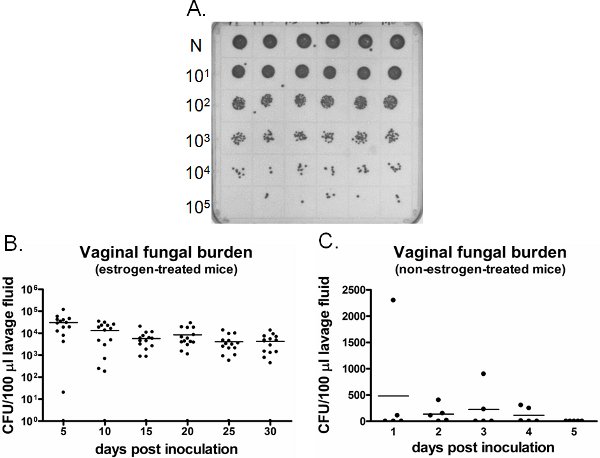
Figura 6. Detectioni di peso vaginale da funghi. A) Rappresentante C. albicans colonie coltivate su un piatto SDA. Neat (N) campioni di lavaggio provenienti da sei diversi tipi di mouse inoculati (riga in alto) sono stati diluiti in serie e coltivate per il conteggio CFU. B) Quantificazione degli vaginale carica fungina nel estrogeno-trattati e C) non estrogeno-topi trattati. Ufc/100 ml di liquido di lavaggio da topi inoculati è stata valutata sui punti di tempo indicato.
Discussione
Un modello murino sperimentale di vaginite da Candida è stata stabilita e storicamente usato per gli ultimi decenni a studiare la risposta mucosale ospite Candida, nonché per testare le terapie antimicotiche 3,4,11,13,16,17,19,21,24, 25,37. I protocolli presentati qui incorporare efficiente e metodi meno alta intensità di lavoro, e sembrano essere uno dei sistemi modello più ottimizzata di Candida vaginite descritto fino ad oggi. Queste tecniche consentono la quantificazione rap...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato supportato da R01 AI32556 (NIAID, National Institute of Health). Questo lavoro è stato sostenuto in parte dalla Louisiana vaccino Centro e Sud della Louisiana Istituto di ricerca sulle malattie infettive promossa dal Consiglio dei Reggenti della Louisiana.
Materiali
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| Femmina CBA / J topi | Charles River Laboratories | 01C38 | 5-6 settimane di età |
| Candida albicans (3153A) | Collezione nazionale di funghi patogeni, Regno Unito | NCPF3153 | |
| Olio di sesamo | Sigma-Aldrich | S3547 | Non ha bisogno di essere pre-sterilizzati prima dell'uso |
| Β-17-estradiolo valerato | Sigma-Aldrich | E1631 | 0.1-0.5mg in olio di sesamo |
| Phytone peptone | Becton Dickinson | 211906 | Supplemento con 0,1% di glucosio |
| Blu tripano soluzione | Sigma-Aldrich | T8154 | |
| Sabouraud destrosio agar | Becton Dickinson | 211584 | |
| Collagenasi di tipo IV | Sigma-Aldrich | C5138 | 0,25% |
| Dispasi | Invitrogen | 17105-041 | 1,7 U / ml |
| Reti metalliche schermi | TWP | 060X060S0065W36T | N. 60 mesh, inox |
| Sale Hanks 'soluzione equilibrata | Invitrogen | 24020-117 | |
| CytoPrep fissativo | Fisher Scientific | 12-570-10 | Conserve diapositive striscio |
| Papanicolaou macchia EA-65 | EMD chimici | 7054X-85 | |
| Papanicolaou macchia OG-6 | EMD chimici | 7052X-85 | |
| Alum Harris 'ematossilina | EMD chimici | 638A-85 | |
| Isoflurano | Baxter Healthcare | NDC 10019-773-60 | Utilizzato con vaporizzatore isoflurano o in un sistema chiuso goccia anestetico da camera |
Riferimenti
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon