Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Protocoles pour l'inoculation vaginale et prélèvement d'échantillons dans le modèle expérimental chez la souris des Candida Vaginite
Dans cet article
Résumé
Techniques clés à utiliser dans l'évaluation des Candida dans un modèle animal expérimental sont décrits. Les méthodes permettant la collecte rapide des échantillons vaginaux et des lymphocytes de ganglions lymphatiques lombaires. Ces techniques pourraient donner lieu à des souris modèles de d'autres maladies dans le tractus génital féminin inférieur.
Résumé
Vulvo-vaginale candidose (VVC), causée par les espèces de Candida, est une infection fongique des voies génitales inférieures femelles qui affecte environ 75% des femmes en bonne santé pendant leurs années reproductives 18,32-34. Les facteurs prédisposants comprennent l'utilisation des antibiotiques, le diabète non contrôlé et la perturbation des niveaux d'hormones de reproduction en raison de la grossesse, contraceptifs oraux ou traitements hormonaux substitutifs 33,34. VVC récurrente (RVVC), définie comme trois épisodes ou plus par an, affecte un 5 séparée à 8% des femmes sans facteurs prédisposants 33.
Un modèle expérimental chez la souris de VVC a été établi et utilisé pour étudier la pathogenèse et la réponse de l'hôte des muqueuses à Candida 3,4,11,16,17,19,21,25,37. Ce modèle a également été employée pour tester le potentiel de traitements antifongiques in vivo 13,24. Le modèle exige que les animaux soient maintenus dans un état de pseudoestrus pour optiMAL Candida colonisation / infection 6,14,23. Dans ces conditions, les animaux inoculés aura détectable vaginale charge fongique pendant des semaines ou des mois. Des études antérieures montrent un parallèle extrêmement élevée entre le modèle animal et l'infection humaine par rapport à des propriétés immunologiques et physiologiques 3,16,21. Les différences, cependant, incluent un manque de Candida flore vaginale normale et un pH neutre vaginale chez la souris.
Ici, nous démontrons une série de méthodes clés dans le modèle de la souris vaginite qui incluent l'inoculation vaginale, la collecte rapide des échantillons vaginaux, évaluation de la charge fongique vaginale, et des préparations de tissus cellulaires pour l'extraction / isolement. Il est suivi par des résultats représentatifs pour constituants de liquide de lavage vaginal, charge fongique, et le drainage des ganglions lymphatiques rendements des leucocytes. Avec l'utilisation d'anesthésiques, des échantillons de lavage peuvent être collectées à plusieurs moments sur les mêmes souris pour l'évaluation longitudinale deinfection / colonisation. Par ailleurs, ce modèle ne nécessite pas des agents immunosuppresseurs pour déclencher l'infection, permettant des études immunologiques dans des conditions d'accueil définie. Enfin, le modèle et chaque technique présenté ici pourrait donner lieu à l'utilisation des méthodologies d'examiner d'autres maladies infectieuses du tractus génital inférieur féminine (bactériennes, parasitaires, virales) et défenses de l'hôte respectifs locales ou systémiques.
Protocole
1. L'inoculation vaginale avec Candida albicans
- Trois jours avant l'inoculation, tout en limitant l'animal afin d'exposer l'abdomen, injecter 100 ml d'huile de sésame contient de 0.1 à 0.5 mg de β-estradiol par voie sous cutanée dans l'abdomen inférieur. Avancer l'aiguille d'environ 5 à 10 mm latéral à la peau pour limiter les fuites au site d'injection.
L'administration sous-cutanée d'œstrogènes dans le bas-ventre est optimale dans ce modèle en raison de la proximité de l'appareil génital. Les doses efficaces peuvent varier selon les souches de souris, les âges ou les dérivés de l'œstrogène. Dans des études précédentes utilisant l'ABC-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 b), Balb / c (H-2 d), DBA / 2 (H- 2 d), SJL (H-2 s) des souris à 6-8 semaines d'âge, 0,1 mg/100 ul a été trouvé efficace en témoigne l'épaississement de la paroi vaginale, diminution du mucus vaginal etaugmenté mue des cellules épithéliales. Souris-dessus traitée avec de l'oestrogène à cette concentration d'exposition cohérents colonisation vaginale par Candida. Pour l'inoculation des souris d'autres souches et l'âge, une étude pilote est recommandé pour garantir l'efficacité de l'œstrogène dans les conditions modifiées et d'augmenter la dose d'œstrogène si nécessaire.
La solution d'œstrogènes doit être préparé à chaque fois le jour de l'injection. Pour assurer une solubilité complète de l'oestrogène dans l'huile de sésame, bien mélanger la solution en utilisant un mélangeur à vortex et de la chaleur par intermittence à 37 ° C. Répéter l'injection hebdomadaire pendant toute la période d'étude. - Pour préparer l'inoculum, ajouter une anse de C. albicans blastoconidia partir d'une préparation subculture récents sur Sabouraud-dextrose agar (SDA) dans 10 ml de bouillon de peptone-phytone complété avec 0,1% de glucose. Incuber le bouillon de culture à la phase stationnaire pendant 18 h à 25 ° C dans un bain d'eau agité.
- Après l'incubation, de recueillir èmebouillon de culture électronique dans un tube de 15 ml conique et centrifuger à 800 xg pendant 5 min. Laver le culot à deux reprises avec du PBS stérile.
- Énumérer blastoconidia viable sur un hémocytomètre par bleu trypan exclusion. Ajuster la concentration cellulaire à 2,5 x 10 6 / ml (ou à une concentration de l'inoculum désiré) dans du PBS stérile.
- Pour stabiliser la souris, maintenez la base de la queue avec deux doigts et soulevez les hanches vers le haut afin que l'ouverture vaginale est tourné vers vous (Figure 1A). Elle est idéale si la souris est placé sur une surface plane râpé (sommet de cage par exemple) afin que les souris peuvent fournir une résistance contre les restrictions de la queue.
- Pipeter 20 pl (ou un volume souhaité de ne pas dépasser 20 pi) de la suspension inoculum en insérant la pointe de la pipette d'environ 5 mm de profondeur dans la lumière vaginale (figure 1B). Terminez cette étape aussi rapidement et doucement que possible pour minimiser la détresse chez la souris.
2. Lavages vaginaux
- Après l'euthanasie (ou l'anesthésie), hanciens de la souris vers le bas par la base de la queue avec deux doigts pour que l'ouverture vaginale est exposée.
- Lavage de la lumière vaginale en introduisant 100 ul de PBS stérile avec l'aspiration répétée et agitation avec une pointe de pipette. La pointe de la pipette peut devenir obstrués par les cellules. Si cela se produit, passer les cellules obstruction et continuer avec le reste lavaging PBS dans le vagin. Recueillir le liquide de lavage dans un tube à centrifuger.
- Alternativement, lavages vaginaux peuvent être effectuées sur des souris anesthésiées à l'anesthésie par inhalation d'isoflurane. Pour cela, exposer des souris à l'isoflurane vaporisé jusqu'à ce qu'ils soient pleinement mis sous sédation (~ 30 sec.). Tenez la souris vers le bas par la base de la queue et doucement la lumière lavage vaginal avec 50 ul de PBS stérile. Veillez à éviter l'agitation sévère avec un embout de pipette pour minimiser les traumatismes du vagin pendant cette procédure. Souris Sedated devrait remettre de l'anesthésie dans les 30 secondes d'exposition à l'air ambiant.
L'isofluranepeut être vaporisé en utilisant un vaporisateur d'isoflurane et O 2 (de préférence) ou un système de chute standard chambre fermée anesthésie sans le système de vaporisateur (nécessite une surveillance étroite de l'animal tout en sédation pour éviter la détresse respiratoire).
Lavages vaginaux sur les souris anesthésiées devrait être la méthode de choix pour les échantillons de lavage longitudinale sur les mêmes souris. Lavaging consécutives ne pas influencer l'évaluation de la charge fongique dans le temps 41.
- Pour les préparations humides de montage, le transfert 10 pl de la liquide de lavage sur une lame de verre et observer à un grossissement de 400-1000x par microscopie optique. En outre, les fractions cellulaires du liquide de lavage peut être teinté d'examiner des cellules et des morphologies nucléaires. Pour les préparations de frottis, le transfert de 10 ul du liquide de lavage sur une lame de verre et écartez doucement à l'aide de la paroi extérieure d'une extrémité de la pipette. Préserver les échantillons de frottis avec fixateur CYTOPREP et tacher par la technique de Papanicolaou standard (test de Pap). Observez à un grossissement de 400 par microscopie optique.
3. Quantification de la charge fongique vaginale
- Dans une 96 puits à fond rond plaque, transférer le liquide de lavage dans un puits de la rangée du haut et 180 ul de PBS stérile dans le puits 5 à la suite de cette colonne (bas de la plaque).
- Faire 1:10 dilutions successives de liquide de lavage vaginal en transférant les 20 ul du fluide pour le bien dans la colonne suivante. Mélanger soigneusement par aspiration répétée avant chaque transfert. Des dilutions en série d'un maximum de 12 échantillons de lavage (une ligne complète horizontale) peut être réalisée simultanément à l'aide d'une pipette 12 canaux.
- A partir de la dilution la plus faible, le transfert 10 ul de l'échantillon sur Sabouraud-dextrose agar (SDA). Placage de jusqu'à 36 échantillons peuvent être effectuées sur une plaque à l'aide SDA préparé en boîtes de Pétri carrées avec une grille et d'une pipette multicanaux écartement réglable.
- Énumérer unités formant colonie (UFC) après incubation à 34 ° C fou 48 h.
4. L'extraction des tissus vaginaux
- Suite à la procédure de lavage vaginal, poser la souris euthanasiées sur son dos et de saturer la région de l'aine à l'éthanol 70%. En utilisant une paire de pinces, soulever l'orifice urinaire vers le haut afin que l'ouverture vaginale est exposée.
- Insérer une paire de pinces courbées dans la lumière vaginale et de localiser le col. Tout en conservant une prise ferme avec la pince, extrait de l'utérus à travers la cavité vaginale (figure 2A-C).
- D'accise dans le vagin à la base de l'ouverture du vagin, puis retirez le col du vagin avec des ciseaux chirurgicaux. Gardez à l'esprit que le tissu vaginal est involué (intérieur de l'épithélium du vagin côté est exposé vers l'extérieur). Le tissu peut être soit latéralement inversée pour maintenir l'orientation de l'original du vagin ou ouvert dans une feuille en faisant une incision latérale.
Excisées tissus vaginaux peuvent être utilisées pour 1) le collage des lymphocytes suite à l'extractionla digestion nase (~ 1 × 10 4 / souris) 40, 2) l'isolement des cellules épithéliales dispase après digestion (~ 5 × 10 4 / souris) 28, 3) les préparations congelées ou en paraffine pour des analyses histologiques 25.
5. Lombaire excision des ganglions lymphatiques
- Suite à la procédure de lavage vaginal, poser la souris euthanasiées sur le dos et saturer l'abdomen avec 70% d'éthanol. Faire une incision latérale à partir du bas-ventre à la poitrine et d'exposer les organes internes. En utilisant une paire de pince à deux mains, de déplacer les intestins vers le haut afin que les vaisseaux sanguins deviennent visibles centrale.
- Localisez la veine cave inférieure et l'aorte abdominale. Normalement, une paire de ganglions lymphatiques lombaires peuvent être identifiés à côté de l'aorte abdominale, située à environ mi-chemin entre l'origine des artères iliaques communes rénale et 39. Ces ganglions lymphatiques peuvent être distinguées visuellement des tissus adipeux par la texture élastiqueet sont plus légers et plus opaques de couleur par rapport au tissu adipeux (figure 3). Ces ganglions lymphatiques sont sensiblement plus grandes chez les animaux infectés par rapport aux animaux non inoculés.
- Accise les ganglions lymphatiques en plaçant microforceps sous le nœud, puis tirez doucement jusqu'à se séparer de tissus environnants.
6. Isolement des cellules lymphoïdes dans une seule cellule suspensions
- Transfert des ganglions lymphatiques sur un grillage stérile (environ 3 x 3 cm 2 en taille) placé à l'intérieur une boîte de Pétri stérile en verre contenant environ 10 ml de solution de Hanks saline équilibrée (HBSS) (figure 4).
- Avec la boîte de Pétri légèrement incliné, appuyez sur les ganglions lymphatiques contre l'écran avec une tête de piston de la seringue. Assurez-vous de briser tous les ganglions lymphatiques afin que le contenu cellulaire des ganglions passer par l'écran alors que les composantes non cellulaires des nœuds (ie, les membranes, le stroma, la graisse) restent à l'écran.
- En utilisant le piston et la seringue même, aspirer tIl HBSS cellules contenant. Laver l'écran avec ~ HBSS 5 ml et recueillir le liquide restant dans un tube de 15 ml conique.
- Centrifuger à 800 xg pendant 10 min. Aspirer les dépôts gras dans le haut du liquide avec une pipette avant de jeter le liquide. Laver le culot cellulaire à trois reprises avec HBSS. Reprendre le culot dans 1 ml de HBSS et énumérer les cellules viables par l'exclusion bleu trypan.
7. Les résultats représentatifs:
Les fractions cellulaires du liquide de lavage vaginal de> 4-jours des souris inoculées sont généralement constitués de Candida, les cellules épithéliales et des infiltrats cellulaires (figure 5). Par humides montage microscopique, Candida peut être identifié visuellement par la présence d'hyphes ainsi que la levure (figure 5A). Étaler la préparation du liquide de lavage vaginal peut être coloré par la technique de Papanicolaou pour examiner les cellules épithéliales et les leucocytes infiltrant, dont les principales cellules neutrophiles sont identifiés par le tri-nuclelobes ar (figure 5B). Très peu de neutrophiles, le cas échéant, sont détectés chez les souris inoculées (figure 5C) 41.
Un exemple de charge fongique vaginale est montré dans la figure 6. Le liquide de lavage vaginal prélevés à des moments spécifiques sont cultivées pour l'énumération UFC (figure 6A). Colonisation vaginale / infection à Candida persiste pendant des semaines dans des œstrogènes chez les souris traitées inoculé (figure 6B), tandis que le Candida ne parvient pas à établir la colonisation vaginale chez les non-oestrogène-traitée souris inoculées (figure 6C). L'œstrogène chez les souris traitées non inoculés restent négatives pour le Candida dans le temps (données non présentées). En outre, les lavages vaginaux peuvent être effectuées soit une seule fois sur des souris séparées à chaque point du temps ou longitudinalement dans les mêmes souris sous anesthésie.
Les ganglions lymphatiques lombaires sont les nœuds lymphatiques drainant primaires du tractus génital et le site le plus pertinent pour évaluer des réponses immunitaires à un défi vaginale. Note que ces ganglions peuvent devenir élargie chez les souris inoculées pendant qu'ils apparaissent normalement assez faible chez les souris inoculées. Leucocytes recouvrements cellulaires varient généralement de 8 x 10 5 / souris inoculées à 5 × 10 6 souris / inoculé. En plus de ganglions lymphatiques lombaires, les ganglions lymphatiques inguinaux, poplité et mésentériques peuvent également être utilisés.
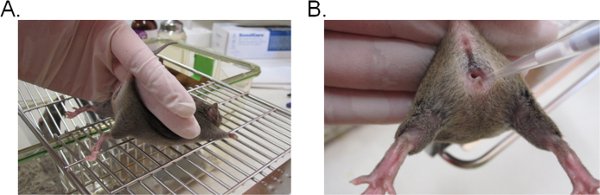
Figure 1. Inoculation vaginale à Candida. A) Une souris retenue pour l'inoculation. La souris est placée sur un insert cage métallique et détenus par la base de la queue, légèrement vers le haut pour soulever les jambes et d'exposer l'orifice vaginal. La hanche de la souris peut être stabilisée avec la même main, car il tente de résister à la contrainte de la queue. B) l'introduction de l'inoculum dans la lumière vaginale. Une extrémité de la pipette est doucement introduit à environ 5 mm de profondeur dans la lumière vaginale. L'inoculum de suspension est ensuite déposée.
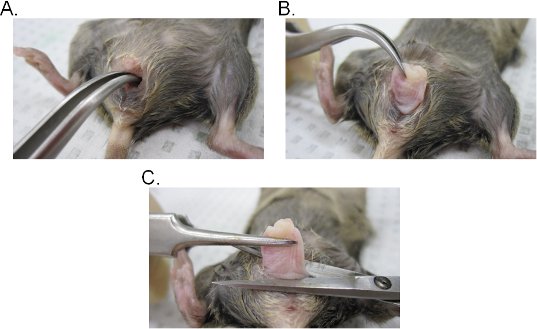
Figure 2. Extraction de tissu vaginal. AB) Extraction de l'utérus. Le col est situé à la pince incurvée et exposés à l'extérieur par la cavité vaginale. Une fois sorti de la cavité vaginale, le col est encore tiré vers l'extérieur pour exposer entièrement le vagin. C) Extraction du vagin. Le vagin est excisé de la vulve avec des ciseaux. Une fois détaché, retirez le col du vagin.

Figure 3. Identification des ganglions lymphatiques lombaires. L'emplacement des ganglions lymphatiques lombaires entre les organes environnants / vaisseaux sanguins dans les environs du bassin est indiquée. Une aorte, abdominaux. B, de la vessie. C, artère iliaque commune. I, intestins. L, le foie. R, rectum. S, de la rate. U, utérus.

Figure 4. Les ganglions lymphatiques lombaires placé sur un grillage. Les ganglions lymphatiques sont regroupés sur l'écran placé dans une boîte de Pétri avec HBSS. Les ganglions lymphatiques sont pressés contre la grille avec un piston de la seringue pour obtenir des cellules lymphoïdes dans une seule cellule suspensions.
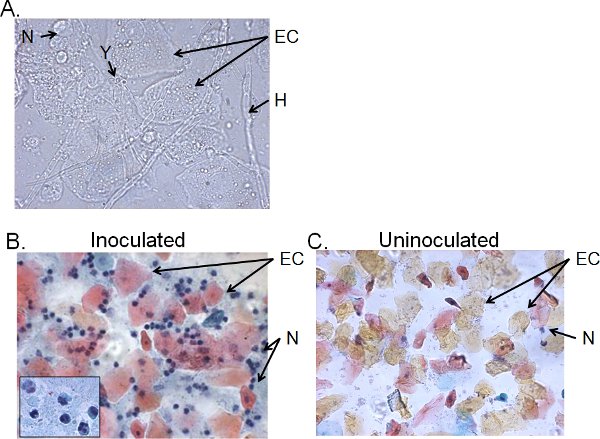
Figure 5. Fractions cellulaires du liquide de lavage vaginal de souris inoculées. Une préparation) Mouiller montage et B) frottis vaginaux des échantillons recueillis lavage 4 jours post-inoculation et C) chez des souris inoculées. Les images sont montré à 1000 × (A) ou 400 × (B, C) grossissement. L'insert en B montre la morphologie nucléaire des neutrophiles vaginale à 1000 ×. Levure Candida (Y) et des hyphes (H), les cellules épithéliales (CE) et neutrohils (N) sont indiqués.
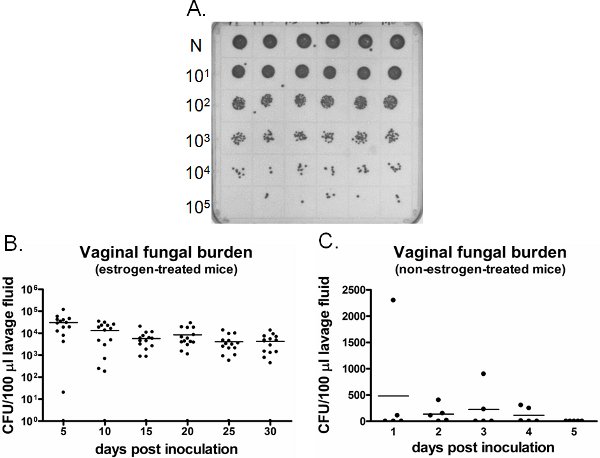
Figure 6. Détecterion de charge fongique vaginale. A) Les colonies de C. albicans représentant cultivé sur une plaque SDA. Neat échantillons de lavage (N) à partir de six différents souris inoculées (rangée du haut) ont été dilués en série et de culture pour le dénombrement des UFC. B) Quantification de la charge fongique vaginale d'œstrogène-traitées et C) la non-oestrogènes chez les souris traitées. UFC/100 ul du liquide de lavage des souris inoculées ont été évalués sur des points de temps indiquée.
Discussion
Un modèle expérimental chez la souris de Candida vaginite a été établi et historiquement utilisé pour les dernières décennies pour étudier la réponse d'hôte des muqueuses à Candida ainsi que pour les tests traitements antifongiques 3,4,11,13,16,17,19,21,24, 25,37. Les protocoles présentés ici intègrent des méthodes efficaces et moins de main-d'œuvre, et semblent être l'un des systèmes modèle le plus optimisé de Candida vaginite décrites à ce jour. ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par R01 AI32556 (NIAID, Institut national de santé). Ce travail a également été soutenu en partie par la Louisiane Vaccine Center et sud de la Louisiane Institut de recherche sur les maladies infectieuses commandité par le Conseil ontarien des affaires collégiales en Louisiane.
matériels
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| Femme souris CBA / J | Charles River Laboratories | 01C38 | 5-6 semaines d'âge |
| Candida albicans (3153A) | Collection nationale des champignons pathogènes, au Royaume-Uni | NCPF3153 | |
| L'huile de sésame | Sigma-Aldrich | S3547 | N'a pas besoin d'être pré-stérilisés avant leur utilisation |
| Β-estradiol 17-valérate | Sigma-Aldrich | E1631 | 0.1-0.5mg dans l'huile de sésame |
| Phytone peptonée | Becton Dickinson | 211906 | Supplément avec 0,1% de glucose |
| Solution de bleu trypan | Sigma-Aldrich | T8154 | |
| Sabouraud Dextrose Agar | Becton DickInson | 211584 | |
| Collagénase de type IV | Sigma-Aldrich | C5138 | 0,25% |
| Dispase | Invitrogen | 17105-041 | 1,7 U / ml |
| L'installation de grillages | TWP | 060X060S0065W36T | N ° 60 mesh, inox |
| Hanks solution saline équilibrée | Invitrogen | 24020-117 | |
| CYTOPREP fixateur | Fisher Scientific | 12-570-10 | Préserve lames de frottis |
| Papanicolaou EA-65 | EMD Chemicals | 7054X-85 | |
| Papanicolaou OG-6 | EMD Chemicals | 7052X-85 | |
| Alun hématoxyline de Harris | EMD Chemicals | 638A-85 | |
| L'isoflurane | Baxter Healthcare | NDC 10019-773-60 | Utilisé avec vaporisateur isoflurane ou dans un système de goutte fermée anesthésie chambre |
Références
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon