Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Protokolle für Vaginal Inokulation und Probenahme in der Experimental-Maus-Modell der Candida Vaginitis
In diesem Artikel
Zusammenfassung
Key-Techniken, um bei der Auswertung der verwendet werden Candida Vaginitis in einem experimentellen Tiermodell beschrieben sind. Die Methoden werden schnelle Sammlung von vaginalen Proben und Lymphozyten aus Trockenlegung lumbalen Lymphknoten zu ermöglichen. Diese Techniken könnten zu Mausmodellen von anderen Krankheiten in der weiblichen unteren Genitaltraktes geben.
Zusammenfassung
Vulvovaginalkandidose (VVC), durch Candida-Arten verursacht werden, ist eine Pilzinfektion der unteren weiblichen Genitaltrakt, dass ca. 75% der ansonsten gesunden Frauen betrifft während ihrer reproduktiven Jahre 18,32-34. Prädisponierende Faktoren sind der Gebrauch von Antibiotika, unkontrollierte Diabetes und Störungen im Bereich der reproduktiven Hormone wegen Schwangerschaft, orale Kontrazeptiva oder Hormonersatztherapien 33,34. Wiederkehrende VVC (RVVC), als drei oder mehr Episoden pro Jahr festgelegt, wirkt sich eine separate 5 bis 8% der Frauen ohne prädisponierende Faktoren 33.
Ein experimentelles Mausmodell der VVC wurde eingerichtet und verwendet werden, um die Pathogenese und Schleimhaut-Host-Reaktion auf Candida 3,4,11,16,17,19,21,25,37 studieren. Dieses Modell wurde auch eingesetzt, um potentielle Antimykotika in vivo 13,24 zu testen. Das Modell setzt voraus, dass die Tiere in einen Zustand der pseudoestrus für opt beibehalten werdenimal Candida-Besiedlung / Infektion 6,14,23. Unter solchen Bedingungen wird geimpften Tieren nachweisbare vaginale Pilzinfektionen Belastung für Wochen bis Monate. Frühere Studien zeigen eine extrem hohe Parallelität zwischen dem Tiermodell und menschliche Infektion in Bezug auf immunologische und physiologische Eigenschaften 3,16,21. Unterschiede, aber auch ein Mangel an Candida als normale Vaginalflora und eine neutrale vaginalen pH-Wert in den Mäusen.
Hier zeigen wir eine Reihe von wichtigen Methoden in der Maus Vaginitis Modell, das vaginale Impfung schnelle Sammlung von vaginalen Präparate, die Beurteilung der vaginalen Pilzinfektionen zu reduzieren und das Gewebe Vorbereitungen für zelluläre Extraktion / Trennung beinhalten. Dies wird durch repräsentative Ergebnisse für Bestandteile der vaginalen Lavage-, Pilz-Belastung und Lymphknoten Leukozyten Erträge gefolgt. Mit dem Einsatz von Anästhetika kann Lavage-Proben zu mehreren Zeitpunkten auf dem gleichen Mäuse für Längs-Auswertung gesammelt werdenInfektion / Kolonisation. Darüber hinaus erfordert dieses Modell keine Immunsuppressiva auf eine Infektion zu initiieren, so dass immunologische Untersuchungen unter definierten Bedingungen Host. Schließlich stellte das Modell und jede Technik könnte hier möglicherweise zu der Methoden verwenden, um andere Infektionskrankheiten der unteren weiblichen Genitaltrakt (bakterielle, parasitäre, virale) und den jeweiligen lokalen oder systemischen Immunabwehr zu untersuchen.
Protokoll
1. Vaginal Inokulation mit Candida albicans
- Drei Tage vor der Inokulation, während einstweilige das Tier auf den Bauch setzen, injizieren 100 ul Sesamöl mit 0,1-0,5 mg des β-Estradiol subkutan in den Unterleib. Schieben Sie die Nadel über 5 bis 10 mm seitlich an der Haut, um das Auslaufen aus der Injektionsstelle zu minimieren.
Die subkutane Verabreichung von Östrogen in den Unterleib ist in diesem Modell aufgrund der Nähe zu den Genitaltrakt optimal. Effektive Dosen kann durch Mausstämme, Alters-oder Östrogen-Derivate variieren. In früheren Studien mit CBA-J (H-2 κ), C3H/HeN (H-2 κ), C57BL / 6 (H-2 b), Balb / c (H-2 d), DBA / 2 (H- 2 d), SJL (H-2 s) Mäuse bei 6-8 Wochen alt, 0,1 mg/100 ul gefunden wurde wirksam belegt durch Verdickung der Scheidenwand, reduziert Vaginalschleim underhöhte Epithelzelle Häutung. Mäuse oben mit Östrogen bei dieser Konzentration behandelt weisen konsistente vaginale Besiedlung mit Candida. Zur Inokulation in Mäusen anderer Stämme und Alter, ist ein Pilot-Studie wurde empfohlen, um die Wirksamkeit von Östrogen unter den veränderten Bedingungen zu gewährleisten und steigern die Östrogen-Dosis, falls erforderlich.
Die Östrogen-Lösung sollte frisch jedes Mal am Tag der Injektion vorbereitet werden. Um eine vollständige Löslichkeit von Östrogen in Sesamöl, gründlich mischen die Lösung mit dem Vortex-Mixer und Wärme zeitweise bei 37 ° C. Wiederholen Sie die Injektion pro Woche während der gesamten Studiendauer. - Zur Vorbereitung des Inokulums, fügen Sie eine Öse C. albicans Blastokonidien aus einer aktuellen Subkultur Vorbereitung auf Sabouraud-Dextrose-Agar (SDA) in 10 ml Phyton-Pepton-Bouillon mit 0,1% Glucose. Inkubieren Sie die Bouillonkultur bis zur stationären Phase für 18 h bei 25 ° C in einem Schüttel-Wasserbad.
- Nach der Inkubation, sammeln the Bouillonkultur in einem 15 ml konischen Röhrchen und zentrifugieren bei 800 xg für 5 min. Waschen des Pellets zweimal mit sterilem PBS.
- Enumerate lebensfähig Blastokonidien auf einer Zählkammer nach Trypanblau Ausgrenzung. Passen Sie die Zellkonzentration auf 2,5 x 10 6 / ml (oder zu einem gewünschten Inokulumkonzentration) in sterile PBS.
- Zur Stabilisierung der Maus, halten Sie die Basis des Schwanzes mit zwei Fingern und heben Sie die Hüfte nach oben, so dass die vaginale Öffnung zu Ihnen (Abbildung 1A) Gesichter. Es ist ideal, wenn die Maus auf einer ebenen Oberfläche gerieben (zB Käfig oben) platziert, so dass die Maus kann der Widerstand gegen das Heck Zurückhaltung geben.
- Je 20 ul (oder eine gewünschte Lautstärke nicht bis 20 ul überschreiten) der Inokulumsuspension, indem Sie die Pipettenspitze ca. 5 mm tief in die Scheide Lumen (Abbildung 1B). Führen Sie diesen Schritt so schnell und schonend wie möglich, dass Ängste in der Maus zu minimieren.
2. Vaginal Spülflüssigkeiten
- Nach Euthanasie (oder Anästhesie), halt die Maus nach unten durch die Basis des Schwanzes mit zwei Fingern, so dass die vaginale Öffnung freigelegt wird.
- Lavage die vaginale Lumen, indem 100 ul sterilem PBS mit wiederholter Aspiration und Rühren mit einer Pipettenspitze. Die Pipettenspitze kann verstopft werden mit Zellen. Wenn dies geschieht, verzichten die Behinderung Zellen und weiterhin lavaging mit den verbleibenden PBS in der Vagina. Sammeln Sie die Spülflüssigkeit in ein Mikrozentrifugenröhrchen.
- Alternativ können vaginal Spülungen an narkotisierten Mäusen, die mit Isofluran inhalant Betäubung durchgeführt werden. Dafür setzen die Mäuse zu verdampfende Isofluran, bis sie vollständig sind sediert (~ 30 sek.). Halten Sie die Maus nach unten durch die Basis des Schwanzes und sanft Spülung der Vaginallumen mit 50 ul sterilem PBS. Achten Sie darauf, harte Rühren mit einer Pipettenspitze zu vermeiden Verletzungen der Vagina zu minimieren während dieses Vorgangs. Sedated Mäuse sollten aus der Narkose innerhalb von 30 Sekunden der Exposition gegenüber Umgebungsluft erholen.
Isoflurankann verdampft mit einem Isofluran Verdampfer und O 2 (bevorzugt) oder eine Standard-Drop-System geschlossen Betäubung Kammer ohne Verdampfer-System (erfordert eine enge Überwachung des Tieres während sediert, um Atemnot zu vermeiden).
Vaginal Spülungen an narkotisierten Mäusen sollte die Methode der Wahl für Längs-Lavage-Proben auf dem gleichen Mäusen werden. Fortlaufende lavaging hat keinen Einfluss auf Einschätzung von Pilz-Belastung im Laufe der Zeit 41.
- Für Nass-Mount-Präparaten, Transfer 10 ul der Spülflüssigkeit auf einen Objektträger und beobachten bei 400-1000facher Vergrößerung unter dem Lichtmikroskop. Darüber hinaus können Zellfraktionen der Spülflüssigkeit gefärbt, um Zell-und Kern-Morphologie zu untersuchen. Für Abstrichpräparaten, Transfer 10 ul der Spülflüssigkeit auf einen Objektträger und sanft verteilt über die Außenwand einer Pipettenspitze. Erhalten Sie den Abstrich-Proben mit CytoPrep Fixiermittel und Flecken von der Norm Papanicolaou-Technik (Pap-Abstrich). Beachten Sie bei 400-facher Vergrößerung unter dem Lichtmikroskop.
3. Die Quantifizierung von vaginalen Pilzinfektionen Belastung
- In einer 96-Well Rundboden-Platte, übertragen Sie die Spülflüssigkeit in einen Brunnen in der obersten Zeile und 180 ul sterilem PBS in den folgenden 5 Brunnen dieser Spalte (auf der Platte).
- Machen 1.10 serielle Verdünnungen der vaginalen Lavage durch die Übertragung der 20 ul der Flüssigkeit zum nächsten Brunnen in der Spalte. Nach gründlichem Mischen durch wiederholte Aspiration vor jeder Übertragung. Serielle Verdünnungen von bis zu 12 Lavage-Proben (eine volle horizontale Reihe) können gleichzeitig durchgeführt werden mit einem 12-Kanal-Pipette.
- Beginnend mit der niedrigsten Verdünnung, Transfer 10 ul der Probe auf Sabouraud-Dextrose-Agar (SDA). Plating von bis zu 36 Proben können auf 1 Platte mit SDA in eckigen Petrischalen mit Gitter und einen einstellbaren Abstand Mehrkanalpipette vorbereitet durchgeführt werden.
- Enumerate Kolonie bildenden Einheiten (KBE) nach Inkubation bei 34 ° C foder 48 h.
4. Vaginal Gewebeentnahme
- Nach der vaginalen Lavage Verfahren, lag die eingeschläfert Maus auf den Rücken und sättigen die Leistengegend mit 70% Ethanol. Mit einer Pinzette, heben Sie den Urin Öffnung nach oben, so dass die vaginale Öffnung freigelegt wird.
- Legen Sie ein Paar gebogenen Pinzette in die Vaginallumen und suchen Sie den Gebärmutterhals. Unter Beibehaltung fest im Griff mit der Zange, extrahieren Sie die Zervix durch die Vagina (Abbildung 2a-c).
- Excise der Scheide an der Basis der vaginalen Öffnung und entfernen Sie dann den Muttermund aus der Scheide mit chirurgischer Schere. Denken Sie daran, dass der vaginalen Gewebe zurückgebildet wird (innere Epithel-Seite der Vagina nach außen ausgesetzt ist). Das Gewebe kann entweder seitlich umgedreht werden, um die ursprüngliche Ausrichtung der Vagina zu erhalten oder geöffnet in eine Folie, indem Sie einen seitlichen Schnitt.
Abgeschnittene vaginalen Gewebe kann für 1 verwendet werden) Lymphozyten Extraktion folgende Collagenase Verdauung (~ 1 × 10 4 / Maus) 40, 2) epithelialen Zell-Isolierung nach Dispase Verdauung (~ 5 × 10 4 / Maus) 28, 3) eingefroren oder in Paraffin eingebetteten Präparate für die histologische Analyse 25.
5. Lumbar Lymphknoten Exzision
- Nach der vaginalen Lavage Verfahren, lag die eingeschläfert Maus auf den Rücken und sättigen den Bauch mit 70% Ethanol. Machen Sie einen seitlichen Einschnitt ausgehend von der unteren Bauch, die Brust und setzen die inneren Organe. Mit einer Pinzette in beide Hände, bewegen Sie den Darm nach oben, so dass die zentrale Blutgefäße sichtbar werden.
- Suchen Sie die untere Hohlvene und Bauchaorta. Normalerweise kann ein Paar von lumbalen Lymphknoten identifiziert benachbart zu der abdominalen Aorta, liegt etwa auf halbem Weg zwischen der Herkunft der Nieren-und iliacae communes 39. Diese Lymphknoten können optisch von Fettgewebe werden durch die elastische Textur unterscheidenund sind leichter und undurchsichtig in der Farbe im Vergleich zum Fettgewebe (Abbildung 3). Diese Lymphknoten sind deutlich größer in infizierten Tieren im Vergleich zu ungeimpften Tieren.
- Excise den Lymphknoten, indem microforceps unter dem Knoten und ziehen Sie dann sanft vom umgebenden Gewebe zu trennen.
6. Isolierung von lymphoiden Zellen in Einzel-Zellsuspensionen
- Transfer-Lymphknoten auf eine sterile Drahtgitter (ca. 3 x 3 cm 2 in der Größe) in einem sterilen Glas-Petrischale mit ~ 10 ml balanced salt Hanks 'Lösung (HBSS) (Abbildung 4) platziert.
- Mit der Petrischale leicht nach, drücken Sie die Lymphknoten vor dem Bildschirm mit einem Spritzenkolben Kopf. Achten Sie darauf, alle Lymphknoten zu brechen, so dass die zellulären Inhalt der Knoten durch das Sieb passieren, während die nicht-zellulären Komponenten der Knoten (dh Membranen, Stroma-, Fett) auf dem Bildschirm bleiben.
- Mit dem gleichen Kolben und Spritze absaugen ter HBSS enthaltenden Zellen. Waschen Sie den Bildschirm mit ~ 5 ml HBSS und sammeln Sie die restliche Flüssigkeit in einen 15 ml konischen Röhrchen.
- Zentrifugation bei 800 xg für 10 min. Saugen Sie keine Fettablagerungen an der Spitze der Flüssigkeit mit einer Pipette vor Verwerfen der Flüssigkeit. Waschen Sie die Zellpellet dreimal mit HBSS. Das Pellet in 1 ml HBSS und aufzählen lebensfähigen Zellen durch Trypanblau Ausgrenzung.
7. Repräsentative Ergebnisse:
Die Zellfraktionen der vaginalen Lavage von> 4-Tages-inokulierten Mäusen bestehen typischerweise aus Candida-, Epithel-Zellen und zelluläre Infiltrate (Abb. 5). Durch nasse-mount-Mikroskopie kann Candida visuell durch das Vorhandensein von Hyphen sowie Hefe (5A) identifiziert werden. Smear Vorbereitungen der vaginalen Lavage kann durch Papanicolaou-Technik angefärbt werden, um Epithelzellen und Leukozyten infiltriert, von denen die wichtigsten Zellen sind Neutrophile durch die tri-Keimbildung identifiziert untersuchenar Lappen (Abbildung 5B). Sehr wenige Neutrophile, wenn überhaupt, in ungeimpften Mäusen (Abbildung 5C) 41 erkannt.
Ein Beispiel für vaginale Pilzinfektionen Belastung ist in Abbildung 6 dargestellt. Vaginal Spülflüssigkeit zu bestimmten Zeitpunkten erhoben werden für die CFU-Enumeration (Abbildung 6A) kultiviert. Vaginal Kolonisierung / Infektion mit Candida weiterhin für Wochen in Östrogen-behandelten Mäuse geimpft (6B), während Candida nicht vaginal Besiedlung in nicht-Östrogen-behandelten Mäuse geimpft (Abbildung 6C) zu etablieren. Östrogen-behandelten Mäusen unbeimpfte bleiben Candida negativ im Laufe der Zeit (Daten nicht gezeigt). Darüber hinaus können vaginal Spülungen entweder durchgeführt werden einmal auf separaten Mäusen zu jedem Zeitpunkt oder in Längsrichtung in den gleichen Mäusen unter Narkose.
Die lumbale Lymphknoten sind die primären Lymphknoten im Genitalbereich und die wichtigsten Standort für systemische Immunantwort auf eine vaginale Herausforderung zu bewerten. Note, dass diese Lymphknoten können vergrößert werden, in geimpften Mäusen, während sie normalerweise erscheinen recht klein in ungeimpften Mäusen. Leukocyte zellulären Erholungen typischerweise im Bereich von 8 x 10 5 / unbeimpfte Maus bis 5 × 10 6 / geimpft Maus. Neben lumbalen Lymphknoten können Leisten-, Kniekehlen-und mesenterialen Lymphknoten ebenfalls verwendet werden.
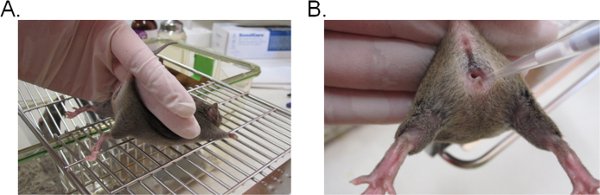
Abbildung 1. Vaginal Inokulation mit Candida. A) Eine Maus für die Impfung zurückhaltend. Die Maus befindet sich auf einem Drahtkäfig einfügen gelegt und durch die Basis des Schwanzes, leicht nach oben, um die Beine heben und setzen die vaginale Öffnung. Die Hüfte der Maus kann mit der gleichen Hand stabilisiert werden, wie es um den Schwanz Zurückhaltung zu widerstehen versucht. B) Die Einführung des Inokulums in die vaginale Lumen. Eine Pipettenspitze vorsichtig ca. 5 mm tief in die Scheide Lumen eingesetzt. Die Suspension Inokulum wird dann abgeschieden.
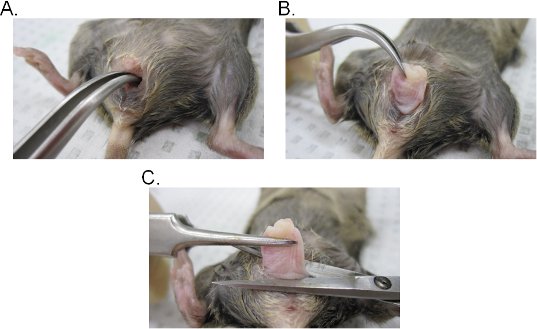
Abbildung 2. Vaginal Gewebeentnahme. AB) Extraktion des Gebärmutterhalses. Der Gebärmutterhals ist mit einer gebogenen Pinzette entfernt und nach außen durch die Vagina ausgesetzt. Einmal aus der Vagina, ist der Muttermund weiter nach außen gezogen, um vollständig freizulegen der Vagina. C) Extraktion der Vagina. Die Vagina ist aus der Vulva mit der Schere ausgeschnitten. Einmal abgetrennt, entfernen Sie die Zervix von der Vagina.

Abbildung 3. Identification der Lenden-Lymphknoten. Die Lage der Lenden-Lymphknoten unter den umliegenden Organe / Blutgefäße in der Nähe des Beckens wird angezeigt. A, Bauchaorta. B, Harnblase. C, A. iliaca communis. I, Darm. L-, Leber. R, Rektum. S, Milz. U, Uteri.

Abbildung 4. Die lumbale Lymphknoten auf einem Drahtgitter angebracht. Die Lymphknoten sind auf den Bildschirm in eine Petrischale mit HBSS gelegt gebündelt. Die Lymphknoten sind gegen den Bildschirm mit einem Spritzenkolben an lymphoiden Zellen in Einzel-Zell-Suspensionen zu erhalten gedrückt.
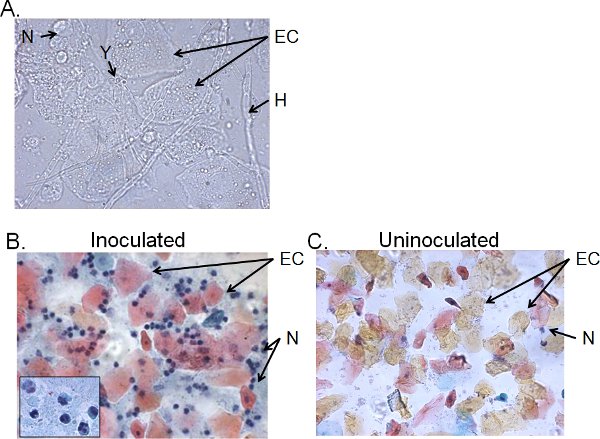
Abbildung 5. Zellfraktionen der vaginalen Lavage von geimpften Mäusen. A) Wet-mount und B) Pap-Abstrich Vorbereitungen der vaginalen Lavage-Proben gesammelt 4 Tage nach der Inokulation und C) von ungeimpften Mäusen. Die Bilder werden bei 1000 × (A) oder 400 gezeigt × (B, C) Vergrößerung. Der Einsatz in B zeigt die nukleare Morphologie der vaginalen Neutrophilen bei 1000 ×. Candida Hefe (Y) und Hyphen (H), Epithelzellen (EC) und neutrohils (N) angegeben sind.
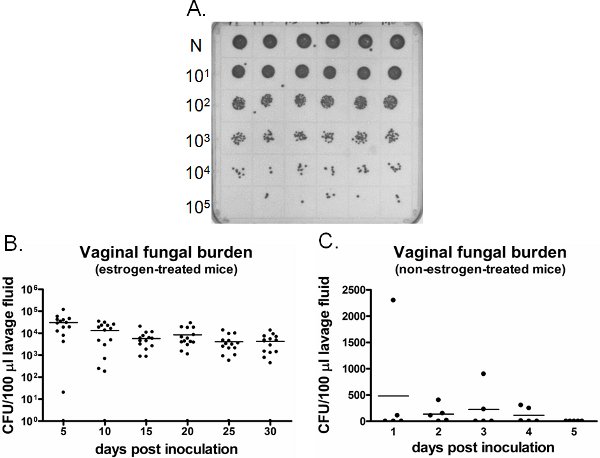
Abbildung 6. Detection von vaginalen Pilzinfektionen Belastung. A) Repräsentative C. albicans Kolonien auf einem SDA Platte gewachsen. Neat (N) Lavage-Proben aus sechs verschiedenen geimpft Mäusen (obere Reihe) wurden seriell verdünnt und für CFU-Enumeration. B) Quantifizierung der vaginalen Pilzinfektionen Belastung in Östrogen-behandelten und C) nicht-Östrogen-behandelten Mäusen. CFU/100 ul der Spülflüssigkeit aus geimpften Mäusen wurde am angegebenen Zeitpunkten bewertet.
Diskussion
Ein experimentelles Mausmodell für Candida Vaginitis wurde eingerichtet und historisch für den letzten Jahrzehnten zur Schleimhaut Host Reaktion auf Candida sowie Studien zur Prüfung von Antimykotika 3,4,11,13,16,17,19,21,24, 25,37. Die Protokolle hier vorgestellten integrieren effizienter und weniger arbeitsintensive Methoden und scheinen eine der optimierten Modell-Systeme von Candida Vaginitis bisher beschriebenen. Diese Techniken ermöglichen eine schnelle Quantifizierung von...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von R01 AI32556 (NIAID, National Institute of Health) unterstützt. Diese Arbeit wurde zum Teil auch von Louisiana Vaccine Center und South Louisiana Institute for Infectious Disease Research von der Louisiana Board of Regents gesponsert unterstützt.
Materialien
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Weibliche CBA / J-Mäusen | Charles River Laboratories | 01C38 | 5-6 Wochen alt |
| Candida albicans (3153A) | National Collection von pathogenen Pilzen, UK | NCPF3153 | |
| Sesamöl | Sigma-Aldrich | S3547 | Braucht nicht vor dem Einsatz vor sterilisiert werden |
| Β-Estradiol 17-valerat | Sigma-Aldrich | E1631 | 0,1-0.5mg in Sesamöl |
| Phyton Pepton | Becton Dickinson | 211906 | Supplement mit 0,1% Glucose |
| Trypanblau-Lösung | Sigma-Aldrich | T8154 | |
| Sabouraud-Dextrose-Agar | Becton Dickinson | 211584 | |
| Collagenase Typ IV | Sigma-Aldrich | C5138 | 0,25% |
| Dispase | Invitrogen | 17105-041 | 1,7 U / ml |
| Maschendraht-Bildschirme | TWP | 060X060S0065W36T | Nr. 60 mesh, Edelstahl |
| Hanks 'balanced salt solution | Invitrogen | 24020-117 | |
| CytoPrep Fixativ | Fisher Scientific | 12-570-10 | Behält Abstrich Dias |
| Papanicolaou-Färbung EA-65 | EMD Chemicals | 7054X-85 | |
| Papanicolaou-Färbung OG-6 | EMD Chemicals | 7052X-85 | |
| Harris 'Hämatoxylin Alum | EMD Chemicals | 638A-85 | |
| Isofluran | Baxter Healthcare | NDC 10019-773-60 | Gebrauchte mit Isofluran Verdampfer oder in einem Drop-System geschlossen Betäubung Kammer |
Referenzen
- Abraham, M. C. Inducible immunity to Trichomonas vaginalis in a mouse model of vaginal infection. Infect. Immun. 64, 3571-3571 (1996).
- Black, C. A. Major histocompatibility haplotype does not impact the course of experimentally induced murine vaginal candidiasis. Lab. Anim. Sci. 49 (6), 668-668 (1999).
- Black, C. A. Acute neutropenia decreases inflammation associated with murine vaginal candidiasis but has no effect on the course of infection. Inf. Immun. 66, 1273-1273 (1998).
- Black, C. A. Increased severity of Candida vaginitis in BALB/c nu/nu mice versus the parent strain is not abrogated by adoptive transfer of T cell enriched lymphocytes. J. Reprod. Immunol. 45, 1-1 (1999).
- Buchannan, D. L. Role of stromal and epithelial estrogen receptors in vaginal epithelial proliferation, stratification, and cornification. Endocrinology. 139 (10), 4345-4345 (1998).
- Clemons, K. V. Genetic susceptibility of mice to Candida albicans vaginitis correlates with host estrogen sensitivity. Infect. Immun. 72, 4878-4878 (2004).
- Conrady, C. D., Halford, W. P., Carr, D. J. Loss of the type I interferon pathway increases vulnerability of mice to genital Herpes simplex virus 2 infection. J. Virol. 85 (4), 1625-1625 (2011).
- Cunha, G. R., Cooke, P. S., Kurita, T. Role of estromal-epithelial interaction in hormonal responses. Arch Histol Cytol. 67 (5), 417-417 (2004).
- Enjalbert, B. A multifunctional, synthetic Caussia princeps luciferase reporter for live imaging of Candida albicans infections. 77 (11), 4847-4847 (2009).
- Feinen, B. Critical role of Th17 responses in a murine model of Neisseria gonorrhoeae genital infection. Mucosal Immunol. 3 (3), 312-312 (2010).
- Fidel, P. L. Distinct protective host defenses against oral and vaginal candidiasis. Med. Mycol. 40, 359-359 (2002).
- Fidel, P. L. An intravaginal live Candida challenge in humans leads to new hypotheses for the immunopathogenesis of vulvovaginal candidiasis. Infect. Immun. 72, 2939-2939 (2004).
- Fidel, P. L., Cutright, J. L., Sobel, J. D. Efficacy of D0870 treatment of experimental Candida vaginitis. Antimicrob. Agents. Chemother. 41, 1455-1455 (1997).
- Fidel, P. L., Cutright, J. L., Steele, C. Effects of Reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68, 651-651 (2000).
- Fidel, P. L. A murine model of Candida glabrata vaginitis. J. Inf. Dis. 173, 425-425 (1996).
- Fidel, P. L. Analysis of vaginal cell populations during experimental vaginal candidiasis. Inf. Immun. 67, 3135-3135 (1999).
- Fidel, P. L., Lynch, M. E., Sobel, J. D. Candida-specific cell-mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61, 1990-1990 (1993).
- Fidel, P. L., Sobel, J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin. Microbiol. Rev. 9. 9, 335-335 (1996).
- Fidel, P. L., Sobel, J. D., Zak, O., Sande, M. . Murine Models of Candida Vaginal Infections, In Experimental models in antimicrobial chemotherapy. , 741-748 (1999).
- Fidel, P. L., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev. 12, 80-80 (1999).
- Fulurija, A., Ashman, R. B., Papadimitriou, J. M. Neutrophil depletion increases susceptibility to systemic and vaginal candidiasis in mice, and reveals differences between brain and kidney in mechanisms of host resistance. Microbiology. 142, 3487-3487 (1996).
- Gill, N. NK cells require type I IFN receptor for antiviral responses during genital HSV-2 infection. Cell Immunol. 269 (1), 29-29 (2011).
- Hamad, M., Abu-Elteen, K. H., Ghaleb, M. Estrogen-dependent induction of persistent vaginal candidosis in naive mice. Cell. Immunol. 47 (7), 304-304 (2004).
- Hamad, M. Utility of the oestrogen-dependent vaginal candidosis murine model in evaluating the efficacy of various therapies against vaginal Candida albicans infection. Mycoses. 49 (2), 104-104 (2006).
- LeBlanc, D. M., Barousse, M. M., Fidel, P. L. A role for dendritic cells in immunoregulation during experimental vaginal candidiasis. Infect. Immun. 74, 3213-3213 (2006).
- McGrory, T., Garber, G. E. Mouse intravaginal infection with Trichomonas vaginalis and role of Lactobacillus acidophilus in sustaining infection. Infect. Immun. 60, 2375-2379 (1992).
- Naglik, J. R., Fidel, P. L., Odds, F. C. Animal models of mucosal Candida infection. FEMS. Microbiol. Lett. 283 (2), 129-129 (2008).
- Nomanbhoy, F. Vaginal and oral epithelial cell anti-Candida activity. Inf. Immun. 70, 7081-7081 (2002).
- Pietrella, D. A beta-glucan-conjugate vaccine and anti-beta-glucan antibodies are effective against murine vaginal candidiasis as assessed by a novel in vivo imaging technique. Vaccine. 28 (7), 1717-1717 (2010).
- Redondo-Lopez, V., Cook, R. N., Sobel, J. D. Emerging role of Lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev Infect Dis. 12 (5), 856-856 (1990).
- Saavedra, M. Local production of chemokines during experimental vaginal candidiasis. Inf. Immun. 67, 5820-5820 (1999).
- Sobel, J. D. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544, 547-547 (1988).
- Sobel, J. D. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14, S148-S153 (1992).
- Sobel, J. D. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations. Am. J. Obstet. Gynecol. 178 (2), 203-203 (1998).
- Song, W. Local and humoral immune responses against primary and repeat Neisseria gonorrhoeae genital tract infections of 17β-estradiol-treated mice. Vaccine. 26, 5741-5741 (2008).
- Taylor, B. N. In vivo virulence of Candida albicans isolates causing mucosal infections in people infected with the human immunodeficiency virus. J. Infect. Dis. 182, 955-955 (2000).
- Taylor, B. N., Saavedra, M., Fidel, P. L. Local Th1/Th2 cytokine production during experimental vaginal candidiasis. Med. Mycol. 38, 419-419 (2000).
- Tirabassi, R. S. A mucosal vaccination approach for herpes simplex virus type 2. Vaccine. 29 (5), 1090-1090 (2011).
- Broeck, W. V. a. n. d. e. n., Derore, A., Simoens, P. Anatomy and nomenclature of murine lymph nodes: descriptive and nomenclatory standardization in BALB/cAnNCrl mice. J. Immunol. Methods. 312 (1-2), 12-12 (2006).
- Wormley, F. L., Chaiban, J., Fidel, P. L. Cell adhesion molecule and lymphocyte activation marker expression during experimental vaginal candidiasis. J. Immunol. Methods. 69, 5072-5072 (2001).
- Yano, J. Epithelial cell-derived S100 calcium-binding proteins as key mediators in the hallmark acute neutrophil response during Candida vaginitis. Infect. Immun. 78 (12), 5126-5126 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten