A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השימוש בCystometry במכרסמים קטנים: חקר Chemosensation שלפוחית השתן
In This Article
Summary
Cystometry היא טכניקה יעילה למדידת תפקוד שלפוחית שתן של בעלי חיים קטנים In vivo. השלפוחית הוא החדיר ברציפות בשיעורים נשלטו באמצעות צנתר intravesical, ואילו השופכה תישאר חופשיה להשתנה. זה מאפשר לחוזר, מלא ורוק של שלפוחית השתן, בעוד שלחץ intravesical ונפח בטל נרשמים.
Abstract
Protocol
1. חיות מעבדה
- בעלי חיים (עכברים, חולדות) הם שוכנו במתקן בעלי חיים מיוחד עם מחזור 12-שעתי אור כהה וגישה כרצונך למים וכדורי מזון הרגילים. שניהם גיל ומין של בעלי החיים הם פרמטרים חשובים שצריכה להיות אחיד, בהתאם לצרכימים. אנחנו בדרך כלל לבצע cystometry ב 10 - 12 בעלי חיים ממין נקבה ישנים בשבוע 5,6.
- כל הניסויים בבעלי החיים מתבצעים בהתאם להנחיות האיחוד האירופיות קהילת המועצה ואושרו על ידי ועדת האתיקה המקומית.
2. הרדמה
- הרדמת isoflurane משמשת לביצוע פרוצדורות כירורגיות קטנות, מכיוון שהוא קל למינון עקב מחצית החיים שלו קצר. הוא גז הפסולת המתאים הדחה הכרחי בעת שימוש isoflurane.
- בעלי חיים מונחים בקופסה סגורה, בגז עם 5% isoflurane בחמצן טהור (1 הליטר / דקה).
- אחרי גיוס, בהרדמת l המתאיםEvel מתוחזק על ידי מסיכה קטנה (10 מיליליטר מזרק חתוך) של 0.8 - 1 ליטר / חמצן דקות עם 1 - 1.5% מisoflurane.
- לעכברים, הרדמת urethane משמשת במהלך הקלטות תפקודיות (cfr. אינפרא). הרדמת urethane משמשת במהלך הקלטות פונקציונליות, משום שבניגוד למרבית חומרי הרדמה אחרים, רפלקס ההשתנה לא דוכא על ידי סוכן ההרדמה 4. משקל urethane 1.2 גרם / קילו משקל גוף מנוהל תת עורי (sc) 60 דקות לפני תחילת ההקלטות. במידת צורך, במינון של urethane הנדרשים להשגת הרדמה נכונה ניתן טיטרציה על ידי מתן מנות נוספות (0.1 ג'/ ק"ג) תת עורי. יש לציין, עם זאת, כי הרדמה נוספת עשויה לשנות את יעילות הרקה וכתוצאה מכך תדירות השתנת 7,8. לפיכך, את הקלטות cystometric צריכים להיות תחת פיקוח הדוק והושלכו בכל פעם סטיות משמעותיות מהתנהגות השליטה הם נצפו. לא צריכה להיות מנוהלת הרדמה תוך בדיקהתרכובות מיושמות כדי למנוע פרשנות שגויה של הנתונים.
3. הליך כירורגי - השתלת צנתר בשלפוחית שתן
- מכשירי ניתוח העיקור בחיטוי לפני שימוש. לגלח את הבטן של החיה, לחטא עם 70% אתנול ולבצע laparotomy קו אמצע נמוך לחשוף את שלפוחית השתן.
- תחת מיקרוסקופ ניתוחי, הנח תפר ארנק מחרוזת בכיפת שלפוחית שימוש, תפר monofilament לא נספג (גודל 6-0).
- בצע cystostomy קטן (אנו מעדיפים להשתמש במחט 18 G) בתוך מחרוזת הארנק ולהכניס את צנתר פוליאתילן PE 50, עם שרוול קטן בקצה (שהושג על ידי חימום הצינורות בזהירות) דרך החור הזה. בידות שלנו, צינורות דקים (PE 10) יש עמידות גבוהה יותר ומשתנה יותר. הצינורות ניתן לחטא על ידי הכנסתו בפתרון אתנול 70% או לעקר ב חיטוי. לפני ההשתלה, הצינור צריך להיות סמוק עם תמיסת מלח.
- Secure str הארנקing סביב הצינור עם הקשר של מנתח. משוך בעדינות את הקטטר החוצה עד שקצה הפעמון ממוקם ממש מתחת לתפר. לדחוף חתיכת קטטר G 18 לכיוון התפר כדי למנוע דליפה.
- להשרות נפח קטן של תמיסת מלח (100-200 μl) בעדינות כדי לבדוק אם קיים דליפה. אם הדלפות הן הווה, תפר נוסף צריך להיות ממוקם.
- סגור את שרירי הבטן באמצעות תפרי monofilament, השארה מעבר לקטטר בחלק העליון של החתך.
- מנהרת הרכבת התחתית לאזור interscapular באמצעות מוט מתכת חלולה, ובכך למנוע את החיות לנשוך את הצינור במהלך הניסוי.
- העור נסגר באמצעות תפרים, monofilament לא נספגים. קטטר המושתל הוא הסמיק עם מלח כדי לבדוק החדירות שלה.
- לפני החיות להתעורר, משככי כאבים ניתנים מתחת לעור (עצירות, 0.05 מ"ג / ק"ג).
4. ההתקנה וCystometry
- בהתאם questi הניסיוניעל (ואת המינים בשימוש) cystometry מתבצע בערים (איפוק או unrestraint) או urethane-הרדים חיות. בעוד cystometry הוא אפשרי בהחלט בחולדות מודעות, אשר נוטות להישאר רגוע בסביבה מאופקת, אנחנו בדרך כלל לבצע cystometry תחת הרדמת urethane (1.2 מ"ג / ק"ג, תת עורי) בעת השימוש בעכברים 3,5,6,9.
- בעכברים מורדמים, טמפרטורת גוף מעקב שוטף והמשיכה ב36.5 ° C ± 0.2 ° C באמצעות בדיקת טמפרטורה ומנורת חימום.
- ההגדרה מכוילת לפני כל ניסוי בהתאם להוראות היצרנים.
- קטטר המושתל מחובר על ידי בדל luer לברז 3-way, שמחובר למתמר הלחץ (Edwards LifeSciences) בצד אחד ומשאבת עירוי על השני (Apparatus הרווארד). מתמר הלחץ מחובר דרך מגבר (78534c המוניטור, היולט פקארד) למערכת איסוף הנתונים (DI-730-USB, Dataq מכשירים) ושיתוףmputer. תוכנת Windaq / לייט יכולה לשמש להקלטה.
- משאבת העירוי הוא התחיל, ומאפשר לעירוי של מי מלח או PBS ב, למשל, 100 μl / דקות (בחולדות) או 20 μl / דקה (בעכברים). כשלפוחית כזה תהיה מלא בקצב קבוע, ואילו לחץ intravesical מוקלט.
- איור 5 מציג עקבות לחץ אופייניות: במהלך עירוי נוזלים, יש הצטברות איטית לחץ בשלפוחית, עד נפח מסוים / לחץ הוא הגיע, סף ההשתנה. ברגע שהוא הגיע לסף זה, שלפוחית השתן תהיה חוזה ולאחר מכן סוגר השתן ייפתח, ומאפשר מעבר של שתן דרך השופכה. ככזה, השלפוחית מתרוקנת, ההתכווצות תפסיק ולחץ ירד שוב לרמה "הבסיסית".
- כעכברוש שם בכלוב חילוף חומרים ומעל לאיזון דיגיטלי, נפח הבטלה ניתן למדוד בו זמנית, נותן מידע לגבי נפח הבטלה. בשל הפניות המרוקנות הקטן במיילce, זה יכול להיות מאוד מאתגר באמצעות מערכת זו. לכן, נפח בטל נקבע באמצעות ניירות סינון קטנים שקלו לפני ואחרי ההתרוקנות.
- בדרך כלל, אנחנו נותנים למערכת לאזן למשך 30 דקות, ואחרי תקופת הקלטה של 30 דקות. ואז, תרופות ניתן באופן מערכתי או intravesically ועוד 30 דקות נרשמות.
- נתונים שנרשמו ניתן לייצא כקבצים. csv שניתן לייבא לתוך תוכנה מיוחדת לניתוח כמוני. אנחנו בדרך כלל להשתמש במקור (OriginLab תאגיד, מסצ'וסטס, ארה"ב).
- לאחר ניסויים, בעלי חיים מוקרבים על ידי נקע צוואר רחם (עכברים) או 2 הרעלת CO (חולדות).
5. נציג תוצאות

איור 1. סקירת laparotomy. א) הנח את העכבר במצב שכיבה. B) גילוח וחיטוי להכין את האתר כירורגית. ג) חתך של העור. ד) חתך of את שרירי הבטן וחשיפת שלפוחית שתן.

איור 2. תפר ארנק מחרוזת.

איור 3. השתלת צנתר.
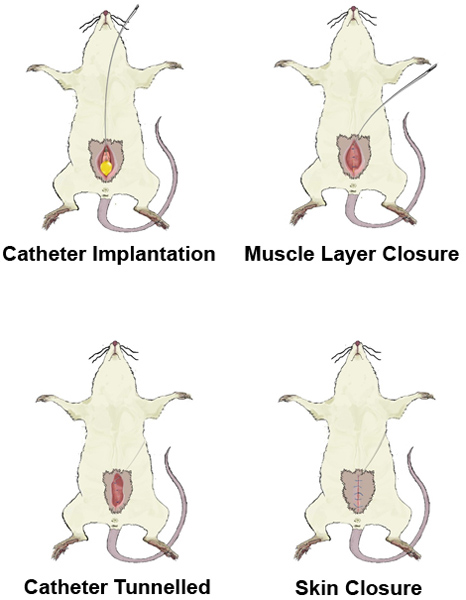
איור 4. נהור של קטטר.
דוגמאות למדידת לחץ שהושגה במהלך זלוף intravesical של מלח בעכברוש מודע ועכבר הרדימו מוצגות באיור 5. מספר רבים של פרמטרים ניתן לחלץ מאותות הלחץ (למשל מרווח intercontractile, לחץ הבסיסי ולחץ הסף). לקבלת תיאור מקיף של פרמטרים אלה, ראה אנדרסון et al. (נ"צ 4) וYoshiyama et al. ( נ"צ 10).
יש לנו בשימוש לאחרונה cystometry לזהות את המטרות המולקולריות של שמן חרדל (MO), תרכובת תגובתי כי כבר זמן רב בשימוש במודלי ניסויים של דלקת וhyperalgesia של איברים פנימיים כמו שלפוחית השתן 11,12. עירוי Intravesical של 10 המ"מימ MO גרם לעלייה חזקה בתדירות הרקה (ירידה במרווח intercontractile) בעכברים מסוג בר (איור 6 א ', ב') וירידה של הנפח בטל 6. מעניין, MO מושרה שינויים דומים בעכברים חסרי הקולטן של MO TRPA1. בניגוד לכך, מיזורי גרמה שינויים הרבה יותר חלשים בפרמטרי cystometric בעכברי TRPV1 ק.א. מאשר בעכברי WT והיה ללא כל השפעה בעכברי Trpa1/Trpv1 KO. יחד עם מדידות של שחרורו של ג'ין קלציטונין הקשור פפטיד (CGRP) 6, נתונים אלה מצביעים להוכיח כי TRPV1 עשוי לשחק תפקיד מפתח בגירוי קרבי הנגרם על ידי MO.
ve_content ">
איור 5. עקבות יציגות של לחץ intravesical נרשם בחולדת נקבה מודעת () ובעכבר נקבה מורדם (B). הלחץ הנמוך ביותר מוגדר כ" לחץ הבסיסי "(חיצים אדומים). הלחץ בסוף שלב המילוי מסומן בחצים כחולים. נפחיו של נוזל רוויים בין שתי הנקודות האלה, מחולקות בהבדלי לחץ, המאפשרים חישוב העמידה של קיר שלפוחית השתן (עמידה = חדור נפח / (לחץ סף -. לחץ בסיסי) "מרווח intercontractile" (ICI) היא הזמן שבין 2 צירי רקה.
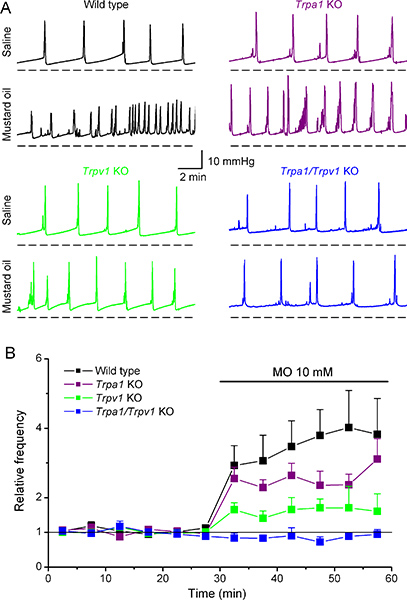
איור 6. השפעות של יישום intravesical של שמן חרדל על דפוס cystometry בסוג פרוע ועכברי Trpa1, TRPV1 וTrpa1/Trpv1 נוקאאוט.() דוגמאות מייצגות של שינויים בלחץ intravesical נרשמו בWT, Trpa1 KO, TRPV1 KO ועכברי Trpa1/Trpv1 ק.א. בתגובה לעירוי של מי מלח ו10 mM MO. (ב) כמובן זמן של התדר הרגעי הרקה הממוצעת לפני ובמהלך עירוי intravesical של מיזורי. לכל העכברים, הנתונים היו מנורמלים התדירות הממוצעת שהושגה במהלך עירוי תמיסת מלח. נתונים אלה מותאמים Everaerts et al. (6 ref), באישור Elsevier.
Access restricted. Please log in or start a trial to view this content.
Discussion
טכניקת cystometry הציגה כאן מאפשרת ביצוע מדידות בvivo של תפקוד שלפוחית שתן במודלים של בעלי חיים. חולדות הן כנראה מודל החיה הנפוצה ביותר. עכברים הם יותר קשים לשליטה, אבל מציעים את היתרון של שימוש בבעלי חי מניפולציות גנטיות. בגלל הקושי הטכני של שימוש בעכברים מודעים, אש...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהממשלה הבלגית הפדרלית (IUAP P6/28), קרן המחקר, פלנדריה (FWO) (G.0565.07 וG.0686.09), פרס הקרן האירופית Astellas 2009 ומועצת המחקר של KU Leuven (GOA 2009/07, וEF/95/010 PFV/10/006). פו ואנו דוקטורנטים של קרן המחקר-פלנדריה (FWO). מגה הוא עמית מארי קירי. DDR בחור יסודי קליני של FWO.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב | שם מסחרי, חברה, | מספר קטלוגים | תגובות |
| urethane | Urethane, סיגמה אולדריץ | 315419 | קבוצת 2B מסרטן |
| isoflurane | Isoba, בריאות בעלי החיים שרינג פלאו | ||
| קטטר פוליאתילן | Intramedic פוליאתילן הצינורות PE50, הקיטון דיקינסון | 427411 | |
| מיקרוסקופ הניתוחי | אופ-Mi 6, Carl Zeiss | אופ-Mi 6 | |
| תפר ארנק מחרוזת | Prolene 6/0, Ethicon | 8610H | |
| fascia ותפר עור | Ethilon 4/0 או 5/0, Ethicon | 662G או 661G | |
| משככי כאבים לאחר ניתוח | Temgesic, בריאות בעלי החיים שרינג פלאו | מינון מומלץ לחולדות: 0.05 מ"ג / ק"ג | |
| מגבר | 78534c מוניטור, היולט פקארד | ||
| יתרות אנליטיים ותוכנת רכישת נתוני איזון | פ.צ. 300i, ופיתוח | פ.צ.-300i | |
| משאבות אינפוזיה | משאבה 33, הרווארד מנגנון | HA33 | |
| מערכת הקלטת cystometry | מכשירי Dataq, DI-730 סדרה וWindaq / לייט | DI-730-USB Windaq / לייט | |
| רישום טמפרטורה | פלוק 52 KJ מדחום | 52 KJ | |
| מתמרי לחץ | אדוארדס LifeSciences, סט ניטור לחץ | T322247A |
References
- Everaerts, W., Gevaert, T., Nilius, B., De Ridder, D. On the origin of bladder sensing: Tr(i)ps in urology. Neurourol. Urodyn. 27, 264-2673 (2008).
- Fry, C. H. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol. Urodyn. 29, 603-608 (2010).
- Gevaert, T. Deletion of the transient receptor potential cation channel TRPV4 impairs murine bladder voiding. J. Clin. Invest. 117, 3453-3462 (2007).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Everaerts, W. Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis. Proc. Natl. Acad. Sci. U.S.A. 107, 19084-19089 (2010).
- Everaerts, W. The capsaicin receptor TRPV1 is a crucial mediator of the noxious effects of mustard oil. Curr. Biol. 21, 316-321 (2011).
- Yoshiyama, M., Roppolo, J. R., Thor, K. B., de Groat, W. C. Effects of LY274614, a competitive NMDA receptor antagonist, on the micturition reflex in the urethane-anaesthetized rat. Br. J. Pharmacol. 110, 77-86 (1993).
- Yoshiyama, M., Roppolo, J. R., de Groat, W. C. Effects of MK-801 on the micturition reflex in the rat--possible sites of action. J. Pharmacol. Exp. Ther. 265, 844-850 (1993).
- Boudes, M. Functional Characterization of a Chronic Cyclophosphamide-Induced Overactive Bladder Model in mice. Neurourol. Urodyn. , (2011).
- Yoshiyama, M. Sex-related differences in activity of lower urinary tract in response to intravesical acid irritation in decerebrate unanesthetized mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 295, R954-R960 (2008).
- McMahon, S. B., Abel, C. A model for the study of visceral pain states: chronic inflammation of the chronic decerebrate rat urinary bladder by irritant chemicals. Pain. 28, 109-127 (1987).
- Du, S., Araki, I., Yoshiyama, M., Nomura, T., Takeda, M. Transient receptor potential channel A1 involved in sensory transduction of rat urinary bladder through C-fiber pathway. Urology. 70, 826-831 (2007).
- Streng, T., Santti, R., Talo, A. Similarities and differences in female and male rat voiding. Neurourol. Urodyn. 21, 136-141 (2002).
- Igawa, Y. Cystometric findings in mice lacking muscarinic M2 or M3 receptors. J. Urol. 172, 2460-2464 (2004).
- Schroder, A., Newgreen, D., Andersson, K. E. Detrusor responses to prostaglandin E2 and bladder outlet obstruction in wild-type and Ep1 receptor knockout mice. J. Urol. 172, 1166-1170 (2004).
- Chen, Q. Function of the lower urinary tract in mice lacking alpha1d-adrenoceptor. J. Urol. 174, 370-374 (2005).
- May, V., Vizzard, M. A. Bladder dysfunction and altered somatic sensitivity in PACAP-/- mice. J. Urol. 183, 772-779 (2010).
- Thorneloe, K. S., Meredith, A. L., Knorn, A. M., Aldrich, R. W., Nelson, M. T. Urodynamic properties and neurotransmitter dependence of urinary bladder contractility in the BK channel deletion model of overactive bladder. Am. J. Physiol. Renal. Physiol. 289, 604-610 (2005).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved