É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
O Uso de cistometria em pequenos roedores: Um Estudo de Chemosensation Bexiga
Neste Artigo
Resumo
Cistometria é uma técnica eficiente para medir a função da bexiga em animais de pequeno porte In vivo. A bexiga é infundida continuamente a taxas controladas por meio de um cateter intravesical, ao passo que a uretra é deixado livre para a micção. Isto permite a repetição de enchimento e esvaziamento da bexiga, enquanto a pressão intravesical e volume vazio são gravadas.
Resumo
Protocolo
1. Animais de Laboratório
- Os animais (ratos, ratazanas) estão alojados numa instalação para animais com um especializado 12 horas de ciclo claro-escuro e acesso ad libitum a água e alimentos granulados convencionais. Tanto a idade e sexo do animal, são parâmetros importantes, que devem ser normalizadas, de acordo com as necessidades. Nós normalmente executam cistometria em 10 - 12 semanas de idade fêmeas 5,6.
- Todos os experimentos com animais são realizadas de acordo com as orientações comunitárias da União Europeia do Conselho e aprovado pelo comitê de ética local.
2. Anestesia
- Anestesia com isoflurano é utilizado para a realização de pequenas intervenções cirúrgicas, uma vez que é fácil de dose devido ao seu curto tempo de meia-vida. Gás adequado de lixo de limpeza é necessário quando se utiliza o isoflurano.
- Os animais são colocados dentro de uma caixa fechada, gaseificada com 5% de isoflurano em oxigénio puro (1 l / min).
- Após indução da anestesia, a l apropriadaevel é mantido por uma pequena máscara (um corte seringa de 10 ml) por 0,8-1 l / min de oxigénio com 1 - 1,5% de isoflurano.
- Para ratos, anestesia com uretana é usado durante as gravações funcionais (cfr. Infra). Anestesia com uretana é utilizado durante a gravação funcionais, porque, em contraste com a maioria dos outros tipos de anestésicos, o reflexo de micção não é suprimida por este agente anestésico 4. Uretano 1,2 g de peso corporal / kg é administrada por via subcutânea (sc) 60 min antes do início da gravação. Se necessário, a dose de uretano necessária para a obtenção de anestesia adequada pode ser ajustada através da administração de doses de reforço (0,1 g / kg), por via subcutânea. Deve-se notar, no entanto, que a anestesia adicional pode alterar a eficiência de esvaziamento e, consequentemente, a frequência de micção 7,8. Assim, as gravações cistométrica devem ser cuidadosamente monitorizados e descartados sempre que desvios significativos do comportamento de controle são observados. Anestésicos não deve ser administrado durante o testeOs compostos são aplicados para evitar uma má interpretação dos dados.
3. Procedimento cirúrgico - Implantação do Cateter Bexiga
- Os instrumentos cirúrgicos são esterilizados em autoclave antes da sua utilização. Raspar o abdômen do animal, desinfectar com álcool 70% e executar uma laparotomia mediana baixo para expor a bexiga.
- Sob um microscópio cirúrgico, colocar uma sutura em bolsa na cúpula da bexiga com uma sutura não absorvível, monofilamentos (tamanho 6-0).
- Realizar uma cistostomia pequenos (preferencialmente utilizar um agulha 18 G) no interior do fio de bolsa e inserir um cateter de polietileno PE 50, com uma pequena braçadeira no final (obtido aquecendo com cuidado a tubagem) através deste orifício. Nas nossas mãos, os tubos mais finos (PE 10) ter uma resistência mais elevada e mais variável. A tubagem pode ser desinfectado, colocando-o em uma solução de etanol a 70% ou esterilizados em autoclave. Antes da implantação, a tubagem deve ser lavada com solução salina.
- Fixe o str bolsação em torno do tubo, com um nó cirurgião. Puxar o cateter delicadamente para fora, até que a ponta em forma de sino é posicionado logo abaixo da sutura. Empurrar um pedaço de 18 G para o cateter de sutura para evitar fugas.
- Infundir um pequeno volume de solução salina (100 - 200 ul) com cuidado para verificar a existência de fugas. Se os vazamentos estão presentes, uma sutura adicional deve ser colocado.
- Feche os músculos abdominais, utilizando suturas de monofilamento, deixando uma passagem para o cateter na parte superior da incisão.
- Túnel do tubo na região interescapular usando uma haste oca de metal, evitando assim os animais para morder o tubo durante a experiência.
- A pele é fechada com fios não absorvíveis, monofilamentos. O cateter de implante é lavado com solução salina para verificar a sua permeabilidade.
- Antes de os animais acordar, analgésicos são administradas por via subcutânea (buprenorfina, 0,05 mg / kg).
4. Configuração e cistometria
- Dependendo do questi experimentalem (e das espécies utilizadas) é realizada de cistometria acordada (retenção ou incontinência) ou de uretano-anestesiadas animais. Considerando cistometria é perfeitamente viável em ratos conscientes, que tendem a manter a calma em um ambiente contido, que normalmente executam cistometria sob anestesia com uretana (1,2 mg / kg, por via subcutânea) quando utilizando camundongos 3,5,6,9.
- Em ratos anestesiados, a temperatura do corpo é constantemente monitorizado e mantido a 36,5 ° C ± 0,2 ° C por meio de uma sonda de temperatura e uma lâmpada de aquecimento.
- A configuração é calibrado antes de cada experiência de acordo com as instruções dos fabricantes.
- O cateter de implante é ligado por um topo luer a uma torneira de 3 vias, que está ligado ao transdutor de pressão (Edwards Lifesciences) de um lado e uma bomba de perfusão, por outro (Harvard Apparatus). O transdutor de pressão é ligado através de um amplificador (78534c monitor, Hewlett Packard) com o sistema de aquisição de dados (DI-730-USB, Dataq instrumentos) e um co-mputer. Windaq / Lite software pode ser utilizado para gravação.
- A bomba de infusão é iniciado, permitindo a infusão de solução salina ou PBS a, por exemplo, 100 ul / min (em ratos) ou 20 ^ L / min (em ratos). Como tal a bexiga será preenchida a uma velocidade constante, enquanto a pressão intravesical é gravado.
- A Figura 5 representa um traço típico de pressão: durante a infusão de fluidos, existe uma acumulação de pressão lento na bexiga, até um certo volume / pressão é alcançada, o limiar de micturição. Uma vez que esse limite for atingido, a bexiga e, posteriormente, irão contrair o esfíncter urinário se abre, permitindo a passagem da urina através da uretra. Como tal, a bexiga é esvaziada, a contracção irá parar e a pressão irá cair de novo para o nível "basal".
- À medida que o rato é colocado numa gaiola metabólica e, acima de uma balança digital, do volume vazio pode ser medido ao mesmo tempo, dando informações sobre o volume vazio. Devido às pequenas quantidades anuladas em milhasce, pode ser muito difícil usar este sistema. Portanto, o volume anulada é determinada utilizando pequenos filtros de papel pesado antes e após a micção.
- Tipicamente, é permitir que o sistema equilibrar durante 30 min, seguido de um período de registo de 30 minutos. Em seguida, a droga pode ser administrada sistemicamente ou intravesical e mais 30 min são gravadas.
- Os dados gravados podem ser exportados como arquivos. CSV que podem ser importados para um software especializado para análise quantitativa. Normalmente usamos Origem (Origin Corporation, MA, EUA).
- Depois de experiências, os animais são sacrificados por deslocamento cervical (ratos) ou intoxicação CO 2 (ratos).
5. Resultados representativos

Figura 1. Visão geral laparotomia. A) Coloque o rato na posição supina. B) Shave e antiseptically preparar o local da cirurgia. Incisão C) da pele. D) Incisão of os músculos abdominais, e exposição da bexiga.

Figura 2. Uma sutura em bolsa.

Figura 3. Implantação do cateter.
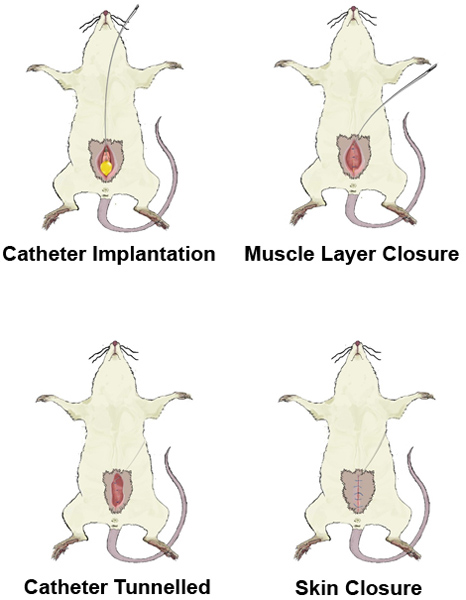
Figura 4. Escavação de túneis do cateter.
Exemplos de medidas da pressão intravesical obtidos durante a perfusão de uma solução salina em ratos conscientes e um rato anestesiado são mostrados na Figura 5. Vários parâmetros podem ser extraídos a partir do sinal de pressão (por exemplo, o intervalo de intercontractile, a pressão de linha de base e a pressão de limiar). Para descrições completas desses parâmetros, consulte Andersson et al. (Ref 4) e Yoshiyama et al. ( ref 10).
Nós temos utilizado recentemente cistometria para identificar os alvos moleculares de óleo de mostarda (MO), um composto muito reactivo que tem sido muito utilizada em modelos experimentais de inflamação e a hiperalgesia de órgãos viscerais, como a bexiga urinária 11,12. Infusão intravesical de 10 mM PB induziu um forte aumento da frequência de micção (diminuição do intervalo intercontractile) em ratinhos do tipo selvagem (Figura 6A, B) e uma diminuição do volume vazio 6. Curiosamente, MO induziu alterações semelhantes em ratos deficientes do receptor de MO TRPA1. Em contraste, MO induziu alterações muito mais fracos em parâmetros cistométricos em ratinhos KO TRPV1 que em ratinhos WT e não tinha qualquer efeito nos ratinhos KO Trpa1/Trpv1. Juntamente com as medições de libertação do gene da calcitonina Related Peptide (CGRP), 6, estes dados indicam que demonstram TRPV1 pode desempenhar um papel-chave na irritação visceral induzida por MO.
ve_content ">
Figura 5. Traços representativos de pressão intravesical registados num rato consciente fêmea (A) e num rato anestesiado fêmea (B). A menor pressão é definida como a "pressão de linha de base" (setas vermelhas). A pressão no final da fase de enchimento é marcada com setas azuis. O volume de fluido administrado entre estes pontos, dividida pela diferença de pressão, permite o cálculo da complacência da parede da bexiga (compliance = infusão volume / (pressão limite -. Pressão de linha de base) O "intervalo intercontractile" (ICI) é o tempo entre duas contrações micção.
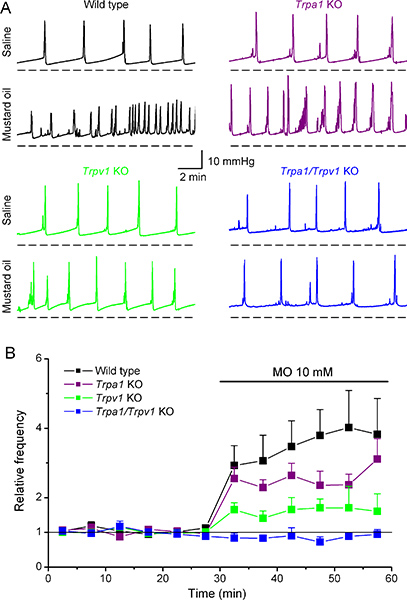
Figura 6. Efeitos da aplicação intravesical de óleo de mostarda sobre o padrão de cistometria no tipo selvagem e camundongos knockout TRPA1, TRPV1 e Trpa1/Trpv1.(A) Os exemplos representativos de mudanças na pressão intravesical gravados no WT, KO TRPA1, KO TRPV1 e ratinhos KO Trpa1/Trpv1 em resposta à infusão de solução salina e 10 mM MO. (B) Tempo de decurso da frequência de micção instantâneo médio antes e durante a infusão intravesical de MO. Para todos os ratinhos, os dados foram normalizados para a frequência média obtida durante a infusão de solução salina. Estes dados são adaptados a partir de Everaerts et al. (Ref 6), com a permissão da Elsevier.
Discussão
A técnica aqui apresentada permite cistometria realizar as medições in vivo da função da bexiga em modelos animais. Os ratos são, provavelmente, o modelo animal mais utilizado. Os ratinhos são mais difíceis de manusear, mas oferece a vantagem de utilizar animais geneticamente manipulados. Por causa da dificuldade técnica de usar ratos conscientes, que tendem a ser muito ativos, resultando em afrouxamento do cateter implantado e alterações nas pressões intra-abdominais que podem influenciar ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi suportado por concessões do Governo federal belga (IUAP P6/28), a Fundação de Pesquisa de-Flandres (FWO) (G.0565.07 e G.0686.09), o Prêmio Fundação Europeia Astellas 2009 e do Conselho de Pesquisa da KU Leuven (GOA 2009/07, e EF/95/010 PFV/10/006). PU e WE são bolsistas de doutorado da Fundação de Pesquisa de-Flandres (FWO). MB é um companheiro Marie Curie. DDR companheiro fundamental clínica do FWO.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Nome comercial, a empresa, | Número de catálogo | Comentários |
| uretano | Uretano, Sigma-Aldrich | 315419 | grupo 2B cancerígena |
| isoflurano | Isoba, Saúde Animal Schering-Plough | ||
| cateter de polietileno | Intramedic tubagem de polietileno PE50, Becton Dickinson | 427411 | |
| microscópio cirúrgico | Op-Mi 6, Carl Zeiss | Op-Mi 6 | |
| bolsa-corda sutura | Prolene 6/0, Ethicon | 8610H | |
| fáscia e sutura da pele | Ethilon 4/0 e 5/0, Ethicon | 662G ou 661G | |
| analgésicos no pós-operatório | Temgesic, Saúde Animal Schering-Plough | dosagem para ratos: 0,05 mg / kg | |
| amplificador | 78534c monitor, Hewlett Packard | ||
| balanças analíticas e equilíbrio de software de aquisição de dados | FZ 300i, A & D | FZ-300i | |
| bombas de infusão | bomba 33, Harvard Apparatus | HA33 | |
| sistema de gravação cistometria | Instrumentos Dataq, DI-730 e série Windaq / Lite | DI-730-USB Windaq / Lite | |
| Registro de temperatura | Fluke 52 KJ termômetro | 52 KJ | |
| transdutores de pressão | Edwards Lifesciences, conjunto de monitoramento de pressão | T322247A |
Referências
- Everaerts, W., Gevaert, T., Nilius, B., De Ridder, D. On the origin of bladder sensing: Tr(i)ps in urology. Neurourol. Urodyn. 27, 264-2673 (2008).
- Fry, C. H. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol. Urodyn. 29, 603-608 (2010).
- Gevaert, T. Deletion of the transient receptor potential cation channel TRPV4 impairs murine bladder voiding. J. Clin. Invest. 117, 3453-3462 (2007).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Everaerts, W. Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis. Proc. Natl. Acad. Sci. U.S.A. 107, 19084-19089 (2010).
- Everaerts, W. The capsaicin receptor TRPV1 is a crucial mediator of the noxious effects of mustard oil. Curr. Biol. 21, 316-321 (2011).
- Yoshiyama, M., Roppolo, J. R., Thor, K. B., de Groat, W. C. Effects of LY274614, a competitive NMDA receptor antagonist, on the micturition reflex in the urethane-anaesthetized rat. Br. J. Pharmacol. 110, 77-86 (1993).
- Yoshiyama, M., Roppolo, J. R., de Groat, W. C. Effects of MK-801 on the micturition reflex in the rat--possible sites of action. J. Pharmacol. Exp. Ther. 265, 844-850 (1993).
- Boudes, M. Functional Characterization of a Chronic Cyclophosphamide-Induced Overactive Bladder Model in mice. Neurourol. Urodyn. , (2011).
- Yoshiyama, M. Sex-related differences in activity of lower urinary tract in response to intravesical acid irritation in decerebrate unanesthetized mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 295, R954-R960 (2008).
- McMahon, S. B., Abel, C. A model for the study of visceral pain states: chronic inflammation of the chronic decerebrate rat urinary bladder by irritant chemicals. Pain. 28, 109-127 (1987).
- Du, S., Araki, I., Yoshiyama, M., Nomura, T., Takeda, M. Transient receptor potential channel A1 involved in sensory transduction of rat urinary bladder through C-fiber pathway. Urology. 70, 826-831 (2007).
- Streng, T., Santti, R., Talo, A. Similarities and differences in female and male rat voiding. Neurourol. Urodyn. 21, 136-141 (2002).
- Igawa, Y. Cystometric findings in mice lacking muscarinic M2 or M3 receptors. J. Urol. 172, 2460-2464 (2004).
- Schroder, A., Newgreen, D., Andersson, K. E. Detrusor responses to prostaglandin E2 and bladder outlet obstruction in wild-type and Ep1 receptor knockout mice. J. Urol. 172, 1166-1170 (2004).
- Chen, Q. Function of the lower urinary tract in mice lacking alpha1d-adrenoceptor. J. Urol. 174, 370-374 (2005).
- May, V., Vizzard, M. A. Bladder dysfunction and altered somatic sensitivity in PACAP-/- mice. J. Urol. 183, 772-779 (2010).
- Thorneloe, K. S., Meredith, A. L., Knorn, A. M., Aldrich, R. W., Nelson, M. T. Urodynamic properties and neurotransmitter dependence of urinary bladder contractility in the BK channel deletion model of overactive bladder. Am. J. Physiol. Renal. Physiol. 289, 604-610 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados