JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
작은 쥐의 Cystometry의 사용 : 방광 Chemosensation의 연구
요약
Cystometry 작은 동물의 방광 기능을 측정 할 수있는 효과적인 방법입니다 생체 내. 방광은 지속적으로 요도가 방뇨를위한 무료 남지 반면, intravesical 카테터를 통해 제어 속도로 주입된다. 이 intravesical 압력과 voided 볼륨이 기록되는 동안, 반복에 입력하고 방광의 비우는 수 있습니다.
초록
프로토콜
1. 실험실 동물
- 동물 (마우스, 쥐)이 12 시간 빛 어두운주기 물과 표준 식품 펠릿에 광고 libitum 접속 설비를 갖춘 전문 동물 시설에 자리 잡고 있습니다. 동물의 연령 및 성별 모두 필요에 따라 표준화해야합니다 중요한 매개 변수입니다. 12주 세 여성 동물 5,6 - 우리가 일반적으로 10 cystometry을 수행합니다.
- 모든 동물 실험은 유럽 연합 (EU) 지역위원회 지침에 따라 수행과 지역 윤리위원회에 의해 승인됩니다.
2. 마취
- 그 반감기는 짧은으로 인해 복용에 쉽게이기 때문에 Isoflurane 마취는 작은 수술 절차를 수행하는 데 사용됩니다. isoflurane을 사용하면 소기 적절한 폐기물 가스가 필요합니다.
- 동물 순수 산소 isoflurane 5퍼센트 (1 L / 분)와 가스에 폐쇄 상자에 배치됩니다.
- 해당 리터의 유도, 마취 후1리터 / 1 분 산소 - - isoflurane 1.5 % 거시기는 0.8의 작은 마스크 (컷 10 ML의 주사기)에 의해 유지됩니다.
- 마우스의 경우, 우레탄 마취는 기능 녹음 (cfr. 인프라)에 사용됩니다. 대부분의 다른 anesthetics는 대조적으로, 방뇨 반사이 마취 에이전트 사에 의해 억압되지 때문에 우레탄 마취는 기능 녹음하는 동안 사용됩니다. 우레탄 1.2 g / kg의 체중은 (SC) 60 분 녹음이 시작되기 전에 피하 관리합니다. 필요한 경우, 적절한 마취를 얻기 위해 필요한 우레탄의 복용은 피하에 추가 용량을 (0.1 g / kg) 관리에 의해 titrated 할 수 있습니다. 이것은 주목해야하지만, 그 추가 마취 voiding 효율성과 결과적으로 방뇨 주파수 7,8을 변경할 수 있습니다. 따라서, cystometric 녹음 면밀히 모니터하고 제어 동작에서 상당한 편차가 관찰 될 때마다 폐기해야합니다. 동안 Anesthetics가 관리하지 않아야 테스트화합물은 데이터의 오해를 피하기 위해 적용됩니다.
3. 수술 - 방광 카테터에 주입
- 수술기구는 사용하기 전에 압력솥에 소독되어 있습니다. , 동물의 복부를 면도 에탄올 70%로 소독하고 방광을 노출 할 수있는 낮은 중간 선을 개복술을 수행합니다.
- 수술 현미경에서 비 흡수성, 모노 필라멘트의 봉합을 (크기 6-0)를 사용하여 방광 돔에서 지갑 문자열 봉합을 배치합니다.
- 지갑 문자열 안에 작은 cystostomy을 (우리는 우선적으로 18 G 바늘을 사용)을 수행하고이 구멍을 통해 끝 부분에 작은 커프 (조심스럽게 튜브를 가열하여 얻은)로, PE 50 폴리에틸렌 카테 테르를 삽입합니다. 손에 얇은 튜브 (PE 10) 높은 더 많은 변수 저항이 있습니다. 튜브는 에탄올 70 % 용액을 넣어하거나 압력솥에 소독하여 소독 할 수 있습니다. 주입하기 전에 튜브는 식염수에 플러시해야합니다.
- 지갑으로 str을 확보외과 의사의 매듭과 관 주위에 들죠. 종 모양의 팁까지 부드럽게 바깥쪽으로는 바로 봉합 아래 위치 카테터를 당겨. 누출 방지 할 수있는 봉합에 대한 18 G 카테터의 일부를 밀어 넣습니다.
- 부드럽게 누수를 확인하기 위해 - 생리의 작은 볼륨 (200 μl 100) 달이다. 누수가 존재하면, 추가로 봉합을 배치해야합니다.
- 절개의 위쪽 부분에있는 카테 테르를위한 통로를두고, 모노 필라멘트의 봉합을 사용하여 복부 근육을 닫습니다.
- 터널 속이 빈 금속 막대를 사용하여 interscapular 지역 관은,이를 실험이 진행되는 동안 튜브를 물에 동물을 방지한다.
- 피부는 비 흡수성, 모노 필라멘트의 봉합을 사용하여 문을 닫습니다. 주입 카테터은 그 투자율을 확인하는 식염수 플러싱된다.
- 동물 각성하기 전에, 진통제는 (buprenorphine, 0.05 밀리그램 / kg) 피하 주어집니다.
4. 설치 및 Cystometry
- 실험 questi에 따라(그리고 종 사용)에 cystometry가 깨어 (구속 또는 무제한) 또는 우레탄 - anesthetized 동물에 수행됩니다. cystometry은 절제된 환경에서 침착하는 경향이 의식 쥐에 완벽하게 가능한 반면 마우스 3,5,6,9를 사용할 때, 우리는 일반적으로 우레탄 마취 (피하 1.2 밀리그램 / kg)에서 cystometry을 수행합니다.
- anesthetized 마우스에서 몸의 온도가 지속적으로 모니터링하고 36.5에 보관됩니다 ° C ± 0.2 ° C의 온도 프로브 및 가열 램프에 의해.
- 설정은 제조업체의 지시에 따라 모든 실험을하기 전에 교정된다.
- 주입 카테터는 한쪽과 (하버드 장치), 다른 한편으로는 주입 펌프에 압력 변환기 (에드워즈 Lifesciences)에 연결되는 3 방향 탭에 luer 스텁에 의해 연결되어 있습니다. 압력 변환기는 데이터 수집 시스템 (DI-730-USB, Dataq 악기)에 증폭기 (78534c 모니터, 휴렛 패커드)과 공동 통해 연결되어mputer. Windaq / 라이트 소프트웨어는 녹음에 사용할 수 있습니다.
- 주입 펌프 예를 들어,에서 염분이나 PBS의 주입을 가능하게 시작, 100 μl / 분 (쥐)을 20 μl / 분 (쥐). intravesical 압력이 녹화되는 동안 같은 방광은 일정한 속도로 입력됩니다.
- 그림 5는 일반적인 압력 추적 묘사 : 특정 볼륨 / 압력 도달 할 때까지 유체 주입하는 동안, 방광의 느린 압력 축적은 방뇨 기준 액에 도달이 있습니다. 일단이 기준 액은 방광이 축소됩니다에 도달하고 이후 요도 조임근이 열립니다, 요도를 통해 소변의 흐름을 수 있도록합니다. 따라서, 방광이납니다, 수축이 중지되고 압력은 '기초'수준으로 다시 떨어질 것이다.
- 쥐가 신진 대사 케이지와 디지털 균형을 위의 위치에 따라, voided 볼륨이 voided 볼륨에 대한 정보를 제공 동시에 측정 할 수 있습니다. 마일의 작은 voided 볼륨으로 인해CE는, 그것은이 시스템을 사용하여 매우 도전이 될 수 있습니다. 따라서 voided 볼륨이 voiding 전후 무게가 작은 여과지를 사용하여 결정됩니다.
- 일반적으로, 우리는 시스템이 30 분의 녹화 기간이 다음 30 분에 대한 평형 보자. 그런 다음, 약물이 체계적으로 또는 intravesically 관리 할 수 있으며, 또 다른 30 분이 기록되어 있습니다.
- 기록 된 데이터는 정량 분석을위한 전문 소프트웨어로 가져올 수 있습니다. csv 파일로 내보낼 수 있습니다. 우리는 일반적으로 (OriginLab 공사, MA, USA) 오리진을 사용합니다.
- 실험 후, 동물 자궁 경부 전위 (마우스) 또는 CO 2 중독증 (쥐)에 의해 희생되어 있습니다.
5. 대표 결과

그림 1. 개복술 개요. A) 위로 향한 위치에 쥐를 놓습니다. B) 워시와 antiseptically 외과 사이트를 준비합니다. 피부의 C) 절개. D) 절개 OF 복부 근육과 방광 노출.

그림 2. 지갑 문자열 봉합.

3. 카테 테르의 주입을 그림.
그림 4. 카테 테르의 Tunnelling.
의식 쥐와 anesthetized 마우스 생리의 intravesical 재관류 동안 얻은 압력 측정치의 예는 그림 5에 표시됩니다. 여러 개의 매개 변수는 압력 신호 (intercontractile 간격, 기준 압력과 임계 압력을 예를 들어)에서 추출 할 수 있습니다. 이 매개 변수의 포괄적 인 설명을 보려면 앤더슨 외. (심판 4) 및 Yoshiyama 외를 참조하시기 바랍니다. ( 심판이 10).
우리는 최근에 겨자 오일의 분자 타겟 (MO), 긴 염증과 같은 방광 11,12 등의 내장 기관의 hyperalgesia의 실험 모델에 사용 된 반응성이 매우 높은 화합물을 식별 할 수 cystometry를 사용하고 있습니다. 10 MM MO의 Intravesical 주입은 야생 형 생쥐의 voiding 주파수에 강한 증가 (intercontractile 간격의 감소) (그림 6A, B)와 voided 볼륨 6 감소 유도. 흥미롭게도, MO는 MO 수용체 TRPA1의 결핍 쥐에서 유사한 변화를 유도. 반면에, MO는 WT 마우스에 비해 Trpv1 KO 마우스의 cystometric 매개 변수의 많은 약한 변화를 유도하고 Trpa1/Trpv1 KO 마우스에 영향없이했습니다. 함께 펩타이드 (CGRP) 6 관련 칼시토닌 유전자의 릴리스 측정이 데이터는 TRPV1은 MO에 의해 유도 내장 염증에 중요한 역할을 할 수 있다는 것을 입증 나타냅니다.
ve_content ">
그림 5. 의식 좋아하지 (A)와 anesthetized 여성 마우스 (B)에 기록 intravesical 압력의 대표 흔적. 낮은 압력 "기준 압력"(빨간색 화살표)로 정의됩니다. 충전 단계의 끝에서 압력이 파란색 화살표로 표시되어있다. 압력 차이에 의해 구분이 점, 사이에 주입 유체의 볼륨 수있는 방광 벽의 준수 (컴플라이언스는 = 주입 볼륨 / (임계 압력의 계산 -. 기준 압력) "intercontractile 간격"(- 이리)이 사이의 시간 이 voiding 수축.
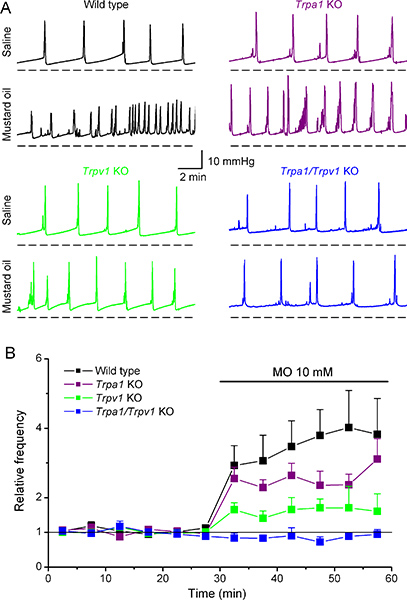
야생 유형과 Trpa1, Trpv1 및 Trpa1/Trpv1 녹아웃 마우스에서 cystometry 패턴에 겨자 기름의 intravesical 응용 프로그램의 그림 6. 효과.(A) 생리와 10 MM MO의 주입에 대응 WT, Trpa1 KO, Trpv1 KO와 Trpa1/Trpv1 KO 마우스에 기록 intravesical 압력 변화를 대표 예. 전, MO의 intravesical 주입 과정에서의 평균 순간 voiding 주파수의 (B) 시간 코스입니다. 모든 마우스의 경우, 데이터는 생리 주입하는 동안 얻은 평균 주파수로 표준화되었다. 이러한 데이터는 Elsevier의 허가와 함께 Everaerts 외. (심판 6)에서 구성된다.
토론
여기에 제시된 cystometry 기술은 동물 모델에서 방광 기능의 생체 측정에 수행 할 수 있습니다. 쥐가 아마도 가장 많이 사용되는 동물 모델이다. 마우스가 처리 할 더 어렵습니다하지만, 유전자 조작 동물을 사용하는 이점을 제공합니다. 때문에 주입 카테터와 intravesical 압력에 영향을 미칠 수있는 내부 - 복부 압력의 변화 느슨해의 결과로 매우 활성화하는 경향이 의식 마우스를 사용할 수있?...
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
이 작품은 벨기에 연방 정부 (IUAP P6/28), 학술 진흥 재단 - 플랑드르 (FWO) (G.0565.07 및 G.0686.09), Astellas 유럽 재단 상 수상 2009 구 Leuven의 연구위원회에서 보조금에 의해 지원되었다 (고아 2009 / 07, EF/95/010 및 PFV/10/006). PU 우리는 학술 진흥 재단 - 플랑드르 (FWO)의 박사 동문입니다. 메가바이트은 마리 퀴리의 동료입니다. FWO의 DDR은 기본 - 임상 동료.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 상업 이름, 회사, | 카탈로그 번호 | 코멘트 |
| 우레탄 | 우레탄, 시그마 - 알드리치 | 315419 | 그룹 2B 발암 물질 |
| isoflurane | Isoba, Schering-북두칠성 동물 건강 | ||
| 폴리에틸렌 카테 테르 | Intramedic 폴리에틸렌 튜브 PE50, Becton 디킨슨 | 427411 | |
| 수술 현미경 | 사설 미 6, 칼 Zeiss | 사설 미 6 | |
| 지갑 문자열 봉합 | Prolene 6 / 0, Ethicon | 8610H | |
| 근막과 피부 봉합 | Ethilon 4 / 0 또는 5 / 0, Ethicon | 662G 또는 661G | |
| 수술 후 진통제 | Temgesic, Schering-북두칠성 동물 건강 | 쥐에 대한 투여 : 0.05 밀리그램 / kg | |
| 증폭기 | 78534c 모니터, 휴렛 패커드 | ||
| 분석 균형과 밸런스 데이터 수집 소프트웨어 | FZ 300i, A & D | FZ-300i | |
| 주입 펌프 | 펌프 33, 하버드 장치 | HA33 | |
| cystometry 기록 시스템 | Dataq 악기, DI-730 시리즈와 Windaq / 라이트 | DI-730-USB Windaq / 라이트 | |
| 온도 등록 | 재수 52 KJ 온도계 | 52 KJ | |
| 압력 트랜스 듀서 | 에드워즈 Lifesciences, 압력 모니터링 세트 | T322247A |
참고문헌
- Everaerts, W., Gevaert, T., Nilius, B., De Ridder, D. On the origin of bladder sensing: Tr(i)ps in urology. Neurourol. Urodyn. 27, 264-2673 (2008).
- Fry, C. H. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol. Urodyn. 29, 603-608 (2010).
- Gevaert, T. Deletion of the transient receptor potential cation channel TRPV4 impairs murine bladder voiding. J. Clin. Invest. 117, 3453-3462 (2007).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Everaerts, W. Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis. Proc. Natl. Acad. Sci. U.S.A. 107, 19084-19089 (2010).
- Everaerts, W. The capsaicin receptor TRPV1 is a crucial mediator of the noxious effects of mustard oil. Curr. Biol. 21, 316-321 (2011).
- Yoshiyama, M., Roppolo, J. R., Thor, K. B., de Groat, W. C. Effects of LY274614, a competitive NMDA receptor antagonist, on the micturition reflex in the urethane-anaesthetized rat. Br. J. Pharmacol. 110, 77-86 (1993).
- Yoshiyama, M., Roppolo, J. R., de Groat, W. C. Effects of MK-801 on the micturition reflex in the rat--possible sites of action. J. Pharmacol. Exp. Ther. 265, 844-850 (1993).
- Boudes, M. Functional Characterization of a Chronic Cyclophosphamide-Induced Overactive Bladder Model in mice. Neurourol. Urodyn. , (2011).
- Yoshiyama, M. Sex-related differences in activity of lower urinary tract in response to intravesical acid irritation in decerebrate unanesthetized mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 295, R954-R960 (2008).
- McMahon, S. B., Abel, C. A model for the study of visceral pain states: chronic inflammation of the chronic decerebrate rat urinary bladder by irritant chemicals. Pain. 28, 109-127 (1987).
- Du, S., Araki, I., Yoshiyama, M., Nomura, T., Takeda, M. Transient receptor potential channel A1 involved in sensory transduction of rat urinary bladder through C-fiber pathway. Urology. 70, 826-831 (2007).
- Streng, T., Santti, R., Talo, A. Similarities and differences in female and male rat voiding. Neurourol. Urodyn. 21, 136-141 (2002).
- Igawa, Y. Cystometric findings in mice lacking muscarinic M2 or M3 receptors. J. Urol. 172, 2460-2464 (2004).
- Schroder, A., Newgreen, D., Andersson, K. E. Detrusor responses to prostaglandin E2 and bladder outlet obstruction in wild-type and Ep1 receptor knockout mice. J. Urol. 172, 1166-1170 (2004).
- Chen, Q. Function of the lower urinary tract in mice lacking alpha1d-adrenoceptor. J. Urol. 174, 370-374 (2005).
- May, V., Vizzard, M. A. Bladder dysfunction and altered somatic sensitivity in PACAP-/- mice. J. Urol. 183, 772-779 (2010).
- Thorneloe, K. S., Meredith, A. L., Knorn, A. M., Aldrich, R. W., Nelson, M. T. Urodynamic properties and neurotransmitter dependence of urinary bladder contractility in the BK channel deletion model of overactive bladder. Am. J. Physiol. Renal. Physiol. 289, 604-610 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유