このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
小型げっ歯類における膀胱内圧測定の使用:膀胱Chemosensationの研究
要約
膀胱内圧測定では、小動物の膀胱機能を測定するための効率的な手法である。膀胱は、継続的に尿道が排尿のための無料の残っているのに対し、膀胱カテーテルを介して制御された速度で注入されています。これは、膀胱内圧と排尿量が記録されている間、繰り返しのために充填し、膀胱を空にすることができます。
要約
プロトコル
1。実験動物
- 動物(マウス、ラット)が12時間明暗サイクルと水と標準食物ペレットへの不断のアクセス権を持つ専門の動物施設に収容されています。動物の年齢や性別はどちらもニーズに応じて標準化されるべき重要なパラメータである。 12週齢の雌の動物5,6 -我々は、典型的には10で膀胱内圧測定を行います。
- 全ての動物実験は、欧州連合コミュニティ協議会のガイドラインに従って実施され、地域の倫理委員会によって承認されています。
2。麻酔
- それはその短い半減期のために投与量に容易であるのでイソフルレン麻酔は、小さな外科的処置を行うために使用されます。イソフルランを使用するときに適切な清掃、廃ガスが必要です。
- 動物は純粋な酸素でイソフルラン5%(1リットル/分)でガス、密閉ボックス内に配置されます。
- 適切なlの誘導後、麻酔1と1リットル/分の酸素 - - イソフルランの1.5%を0.8 evelによって小さなマスク(カット10mlシリンジ)によって維持されています。
- マウスの場合、ウレタン麻酔は機能録音(cfr.赤外線)中に使用されます。ほとんどの他の麻酔薬とは対照的に、排尿反射がこの麻酔剤4によって抑制されていない、ので、ウレタン麻酔は、機能録音時に使用されます。ウレタン1.2グラム/ kg体重は60分の録音が開始される前に皮下(sc)投与される。必要に応じて、適切な麻酔を得るために必要なウレタンの用量を皮下に追加投与(0.1 g / kg)を投与することにより、滴定することができる。それは注意すべきである、しかし、その追加の麻酔は排尿効率ひいては排尿頻度7,8を変更することがあります。したがって、cystometric録音が密接に監視および制御動作からの有意な偏差が観察されたときに破棄されるべきである。麻酔薬は、試験中に投与してはならない化合物は、データの誤解釈を避けるために適用されます。
3。外科手術 - 膀胱カテーテル注入
- 外科用器具は、使用前にオートクレーブで滅菌されています。 、動物の腹部を剃る70%エタノールで消毒し、膀胱を露出させるために低正中開腹を行う。
- 手術用顕微鏡下では、非吸収性モノフィラメント縫合糸(サイズ6-0)を使用して膀胱に巾着縫合を置きます。
- 巾着の中に小さな膀胱を(我々が優先的に18Gの針を使用)を実行し、この貫通孔の端の小さなカフ(慎重にチューブを加熱することによって得られる)と、PE 50ポリエチレンカテーテルを挿入します。我々の手で、より薄いチューブ(PE 10)は、より高く、より可変抵抗を持っています。チューブはエタノール70%溶液に入れ、オートクレーブで滅菌することによって消毒することができます。注入前に、チューブを生理食塩水でフラッシュする必要があります。
- 財布strを確保外科医の結び目で管の周囲ING。釣鐘型の先端が右縫合下に配置されるまでゆっくりと外側にカテーテルを引き抜きます。漏れを防ぐために、縫合糸に向かって18Gのカテーテルの部分を押し込みます。
- 漏れがないか確認するために静かに - 生理食塩水を少量(200μlの100)を吹き込む。漏れがある場合は、追加の縫合糸は、配置する必要があります。
- 切開の上部にカテーテルの通路を残して、モノフィラメント縫合糸を用いて腹部の筋肉を閉じます。
- トンネル中空の金属棒を使って肩甲間部にチューブが、それによって実験中にチューブを噛まないように動物を防ぐ。
- 皮膚は非吸収性モノフィラメント縫合糸を使用して閉じられます。移植されたカテーテルは、その透過性を確認するために、生理食塩水でフラッシュされます。
- 動物が目覚める前に、鎮痛薬(ブプレノルフィン、0.05 mg / kg)を皮下投与されています。
4。セットアップと膀胱内圧測定
- 実験クエスティに応じて(そして、種が使用される)に膀胱内圧測定は、目を覚まして(拘束またはunrestraint)またはウレタン麻酔動物で行われます。膀胱内圧測定が拘束環境で冷静さを保つ傾向にある意識下ラットにおいて、完全に可能であるのに対し、マウス3,5,6,9を使用しているとき、我々は通常、ウレタン麻酔(1.2 mg / kgの皮下)の下で膀胱内圧測定を行います。
- 麻酔したマウスでは、体温を常に監視し、36.5に保たれている℃±0.2℃の温度プローブと加熱ランプを用いた。
- セットアップは、製造元の指示に従って、すべての実験の前に校正されています。
- 移植されたカテーテルは、一方の側の圧力変換器(エドワーズライフサイエンス)およびその他(ハーバード装置)上の輸液ポンプに接続されている3ウェイタップにルアースタブによって接続されています。圧力トランスデューサは、データ収集システム(DI-730-USB Dataq楽器)と共同にアンプ(78534cモニター、ヒューレットパッカード)を介して接続されているmputer。 Windaq / Liteソフトウェアは、記録のために使用することができます。
- 輸液ポンプは、例えば、生理食塩水またはPBSの注入を可能にし、開始され、100μl/分(ラット)または20μl/分(マウス)。膀胱内圧が記録されている間などの膀胱は、一定の割合で満たされるでしょう。
- 図5は、標準的な圧力のトレースを表しています特定のボリューム/圧力に到達するまで、輸液中、遅い圧力上昇は、排尿閾値は、膀胱内にあります。このしきい値に達すると、膀胱が収縮し、その後尿道括約筋は尿道を通って尿の通過を可能にする、オープンします。このように、膀胱が空になると、収縮が停止し、圧力が "基礎"レベルに再び低下します。
- ラットを代謝ケージ内とデジタルのバランスの上に置かれたように、排尿量は排尿量についての情報を与え、同時に測定することができます。マイルの小さなボイドボリュームに起因するceが、それは、このシステムを使用して非常に困難な場合があります。したがって、排尿量は排尿の前後に計量し、小さなろ紙を用いて決定される。
- 通常、我々は、システムが30分間の記録期間が続く30分間平衡化しましょう。その後、薬は全身的または膀胱内投与することができ、さらに30分が記録されている。
- 記録されたデータは、定量分析に特化したソフトウェアにインポートすることができます。csvファイルとしてエクスポートすることができます。我々は一般的に(OriginLabのコーポレーション、米国マサチューセッツ州)原点を使用しています。
- 実験の後、動物を頸椎脱臼(マウス)またはCO 2中毒(ラット)で屠殺する。
5。代表的な結果

図1:開腹概要。 A)は仰臥位でラットを置きます。 B)を剃ると殺菌して手術部位を準備します。皮膚のC)を切開。 D)を切開OF腹筋、膀胱暴露。

図2:巾着縫合。

(3)カテーテル注入図 。
図4カテーテルのトンネリング。
覚醒ラット及び麻酔マウスに生理食塩水の膀胱内灌流の間に得 られた圧力測定の例を図5に示す。複数のパラメータが圧力信号(intercontractile間隔、基準圧力と閾値圧力など )から抽出することができます。これらのパラメータの包括的な説明については、。Anderssonらを参照してください(参考文献4)と吉山ら ( REF 10)。
我々は最近、マスタードオイル(MO)で、長い間、膀胱11,12などの内臓器官の炎症や痛覚過敏の実験モデルで使用されてきた非常に反応性の高い化合物の分子標的を同定するために膀胱内圧測定を使用している。 10mMのMOの膀胱内注入は、野生型マウスにおける排尿頻度の大幅な上昇(intercontractile間隔の減少)( 図6A、B)及び排尿量6の減少を誘発した。興味深いことに、MOはMOのTRPA1受容体の欠損マウスでも同様の変更を誘導した。これとは対照的に、MOはWTマウスに比べてTRPV1 KOマウスにおいてcystometricパラメータのはるかに弱い変化を誘導し、Trpa1/Trpv1 KOマウスで任意の効果がなかった。一緒にペプチド(CGRP)6カルシトニン遺伝子関連のリリースの測定値と、これらのデータは、TRPV1は、MOにより誘発される内臓炎症に重要な役割を果たしている可能性があることを示していることを示します。
ve_content ">
図5に配慮した雌ラット()で、麻酔雌マウス(B)に記録された膀胱内圧の代表痕跡。最低圧力は "ベースライン圧力"(赤矢印)として定義されています。充填段階の終わりでの圧力は青い矢印でマークされています。ベースラインの圧力) "intercontractile間隔"(ICI)の間の時間です - 圧力差で割ったもの、これらの点の間に注入された流体の体積は、膀胱壁のコンプライアンスの計算(コンプライアンス=注入量/が(閾値圧力を可能2排尿収縮。
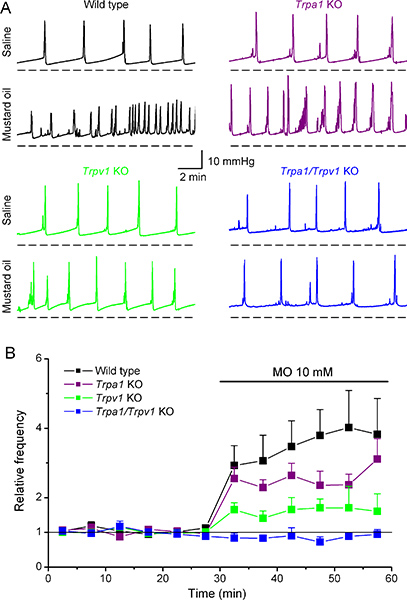
図6野生型における膀胱内圧測定パターンとTRPA1、TRPV1とTrpa1/Trpv1ノックアウトマウスにマスタードオイルの膀胱内のアプリケーションの影響。(A)は、生理食塩水および10mM MOの注入に応答して、WT、KO TRPA1、TRPV1 KOおよびTrpa1/Trpv1 KOマウスに記録されている膀胱内圧の変化の代表的な例。前とMOの膀胱内注入時の平均排尿瞬時周波数の(B)の時間経過。すべてのマウスでは、データは生理食塩水注入の間に得られた平均周波数に正規化された。これらのデータは、エルゼビアの許可を得て、Everaerts ら (文献6)から適合させられます。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここに提示され膀胱内圧測定技術は、動物モデルにおける膀胱機能の in vivo測定で行うことができます。ラットは、おそらく最もよく使われる動物モデルである。マウスのほうが扱いは難しいですが、遺伝子操作された動物を使用することの利点を提供します。なぜなら埋め込まれたカテーテルと膀胱内圧に影響を与える可能性が腹腔内圧力の変化の緩み、その結果非常に活発?...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、ベルギー連邦政府(IUAP P6/28)、研究財団·フランダース(FWO)(G.0565.07とG.0686.09)、アステラス欧州財団賞2009とKU Leuvenの研究評議会からの補助金によって支えられて(GOA 2009/07、EF/95/010とPFV/10/006)。 PUと我々は、研究財団フランダース(FWO)のポスドクです。 MBは、マリー·キュリー·フェローでもある。 DDR FWOの基本的な臨床の仲間。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 商品名、会社名、 | カタログ番号 | 注釈 |
| ウレタン | ウレタン、シグマアルドリッチ | 315419 | グループ2B発がん物質 |
| イソフルレン | Isoba、シェリング·プラウアニマルヘルス | ||
| ポリエチレンカテーテル | IntramedicポリエチレンチューブPE50、ベクトン·ディッキンソン | 427411 | |
| 外科用顕微鏡 | OP-MI 6、カールツァイス | OP-MI 6 | |
| 巾着縫合 | プロレン6/0、エチコン | 8610H | |
| 筋膜と皮膚の縫合 | Ethilon 4/0または5/0、エチコン | 662Gまたは661G | |
| 術後の鎮痛薬 | Temgesic、シェリング·プラウアニマルヘルス | ラットの投与量:0.05 mg / kgで | |
| アンプ | 78534cモニター、ヒューレットパッカード | ||
| 分析天びんとバランスデータ収集ソフト | FZ 300iは、A&D | FZ-300I | |
| 輸液ポンプ | ポンプ33、ハーバード装置 | HA33 | |
| 膀胱内圧測定記録システム | Dataq楽器、DI-730シリーズとWindaq /ライト | DI-730-USB Windaq /ライト | |
| 温度の登録 | フルーク52 KJ体温計 | 52 KJ | |
| 圧力トランスデューサ | エドワーズライフサイエンス、圧力監視セット | T322247A |
参考文献
- Everaerts, W., Gevaert, T., Nilius, B., De Ridder, D. On the origin of bladder sensing: Tr(i)ps in urology. Neurourol. Urodyn. 27, 264-2673 (2008).
- Fry, C. H. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol. Urodyn. 29, 603-608 (2010).
- Gevaert, T. Deletion of the transient receptor potential cation channel TRPV4 impairs murine bladder voiding. J. Clin. Invest. 117, 3453-3462 (2007).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Everaerts, W. Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis. Proc. Natl. Acad. Sci. U.S.A. 107, 19084-19089 (2010).
- Everaerts, W. The capsaicin receptor TRPV1 is a crucial mediator of the noxious effects of mustard oil. Curr. Biol. 21, 316-321 (2011).
- Yoshiyama, M., Roppolo, J. R., Thor, K. B., de Groat, W. C. Effects of LY274614, a competitive NMDA receptor antagonist, on the micturition reflex in the urethane-anaesthetized rat. Br. J. Pharmacol. 110, 77-86 (1993).
- Yoshiyama, M., Roppolo, J. R., de Groat, W. C. Effects of MK-801 on the micturition reflex in the rat--possible sites of action. J. Pharmacol. Exp. Ther. 265, 844-850 (1993).
- Boudes, M. Functional Characterization of a Chronic Cyclophosphamide-Induced Overactive Bladder Model in mice. Neurourol. Urodyn. , (2011).
- Yoshiyama, M. Sex-related differences in activity of lower urinary tract in response to intravesical acid irritation in decerebrate unanesthetized mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 295, R954-R960 (2008).
- McMahon, S. B., Abel, C. A model for the study of visceral pain states: chronic inflammation of the chronic decerebrate rat urinary bladder by irritant chemicals. Pain. 28, 109-127 (1987).
- Du, S., Araki, I., Yoshiyama, M., Nomura, T., Takeda, M. Transient receptor potential channel A1 involved in sensory transduction of rat urinary bladder through C-fiber pathway. Urology. 70, 826-831 (2007).
- Streng, T., Santti, R., Talo, A. Similarities and differences in female and male rat voiding. Neurourol. Urodyn. 21, 136-141 (2002).
- Igawa, Y. Cystometric findings in mice lacking muscarinic M2 or M3 receptors. J. Urol. 172, 2460-2464 (2004).
- Schroder, A., Newgreen, D., Andersson, K. E. Detrusor responses to prostaglandin E2 and bladder outlet obstruction in wild-type and Ep1 receptor knockout mice. J. Urol. 172, 1166-1170 (2004).
- Chen, Q. Function of the lower urinary tract in mice lacking alpha1d-adrenoceptor. J. Urol. 174, 370-374 (2005).
- May, V., Vizzard, M. A. Bladder dysfunction and altered somatic sensitivity in PACAP-/- mice. J. Urol. 183, 772-779 (2010).
- Thorneloe, K. S., Meredith, A. L., Knorn, A. M., Aldrich, R. W., Nelson, M. T. Urodynamic properties and neurotransmitter dependence of urinary bladder contractility in the BK channel deletion model of overactive bladder. Am. J. Physiol. Renal. Physiol. 289, 604-610 (2005).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved