Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük Kemirgenler sistometri ve Kullanımı: Mesane Chemosensation Çalışması
Bu Makalede
Özet
Sistometriler küçük hayvanların mesane fonksiyonu ölçmek için etkili bir tekniktir In vivo. Mesane sürekli idrar işeme için serbest bırakılmalıdır ise, intravezikal kateter yoluyla kontrol fiyatla demlenir. Bu intravezikal basıncı ve işeme hacmi kaydedilir iken, tekrarlayan için doldurma ve mesane boşaltılmasını sağlar.
Özet
Protokol
1. Laboratuvar Hayvanları
- Hayvanlar (fare, sıçan) 12 saat ışık-karanlık döngüsü, su ve standart gıda granül ad libitum erişimi ile özel bir hayvan tesisi içinde muhafaza edilir. Hayvanların yaş ve cinsiyet Hem ihtiyaçlarına göre standardize edilmelidir önemli parametrelerdir. 12 haftalık dişi hayvanlarda 5,6 - Biz genellikle 10 sistometri gerçekleştirin.
- Tüm hayvan deneyleri Avrupa Birliği Topluluğu Konseyi kurallarına uygun olarak yürütülen ve yerel etik kurul tarafından onaylanmıştır.
2. Anestezi
- Bu yarı-ömrü kısa olması nedeniyle doza kolay olduğundan İzofluran anestezi, küçük bir cerrahi işlemlerin gerçekleştirilmesi için kullanılır. Izofluran kullanırken süpürücü Uygun atık gaz gereklidir.
- Hayvanlar saf oksijen izofluran% 5 (1 l / dk) ile gazlandırılan kapalı bir kutu, yerleştirilir.
- Uygun l indüksiyon, anestezi sonrası1 l / 1 dak oksijen - - izofluran% 1.5 evel 0,8 oranında küçük bir maske (bir kesim 10 ml şırınga) tarafından yapılmaktadır.
- Fareler için, fonksiyonel üretan anestezi kayıtları (cfr. Kızılötesi) sırasında kullanılır. Diğer birçok anestetik aksine, işeme refleks bu anestezik madde 4 ile bastırılmış değildir, çünkü anestezi fonksiyonel üretan kayıt sırasında kullanılır. Üretan 1.2 g / kg vücut ağırlığı (sc) 60 dakikalık kayıtların başlamasından önce deri altından tatbik edilmektedir. Eğer gerekirse, uygun anestezi elde etmek için gerekli olan, üretan ve subkütan olarak ek doz (0.1 g / kg) verilerek titre edilebilir. Bu belirtmek gerekir, ancak, bu ek anestezi işeme verimlilik ve dolayısıyla işeme frekans 7,8 değiştirebilir. Dolayısıyla, mesane kayıtları yakından takip ve kontrol davranışı önemli sapmaların tespit edildiği anda atılmalıdır. Ederken Anestezikler uygulanmamalıdır testibileşiklerin veri yorumlanmasına önlemek için uygulanır.
3. Cerrahi Prosedür - Mesane Kateteri İmplantasyonu
- Cerrahi aletler kullanmadan önce otoklavda sterilize edilir. , Hayvanın karın Tıraş etanol% 70 ile dezenfekte ve mesane maruz düşük bir orta hat laparotomi uygulandı.
- Cerrahi mikroskop altında, bir emilmeyen, monofilaman sütür (boyut 6-0) kullanarak mesane kubbesi bir çanta-string sütür koyun.
- Çanta dize içinde küçük bir sistostomi (biz tercihen 18 G iğne kullanın) gerçekleştirin ve bu delikten sonunda küçük bir manşet (dikkatle tüp ısıtılmasıyla elde edilen) ile, PE 50 Polietilen kateter yerleştirin. Bizim ellerde, ince borular (PE 10) daha yüksek ve değişken direnç var. Tüp, etanol% 70 solüsyon koyarak veya bir otoklavda sterilize ile dezenfekte edilebilir. Takılmadan önce boru tuzlu su ile yıkanması gerekir.
- Çanta str sabitleyinBir cerrahın düğüm ile tüp etrafında ing. Çan şeklinde ucu kadar yavaşça dışarıya doğru dikiş altında konumlandırılmış kateter çekin. Sızıntı önlemek için dikiş doğru 18 G kateter bir parça itin.
- Yavaşça sızıntı olup olmadığını kontrol etmek - salin küçük hacimli (200 ul 100) Infuse. Sızıntı varsa, bir ek sütür konulmalıdır.
- Kesi üst kısmında kateter için bir geçit bırakarak monofilaman sütürler kullanılarak karın kaslarının kapatın.
- Tünel içi boş bir metal çubuk kullanılarak interskapular için tüp, böylece deney sırasında boru ısırmak için hayvanlar önler.
- Cilt emilmeyen, monofilaman sütürler kullanılarak kapatılır. Implante kateter geçirgenliğini kontrol etmek için tuzlu su ile temizlenir.
- Hayvanlar uyandırmak önce, analjezikler (buprenorfin, 0.05 mg / kg) deri altından verilmiştir.
4. Kurulum ve Sistometriler
- Deneysel Questi bağlı olarak,(ve tür kullanılan) üzerinde sistometri uyanık (kısıtlama ya da serbestlik) veya üretan-anestezi uygulanmış hayvanlarda gerçekleştirilir. Sistometri bir ölçülü ortamda sakin olmaya eğilimi bilinçli sıçanlarda, mükemmel mümkündür Oysa fareler 3,5,6,9 kullanırken, biz genellikle üretan anestezisi (subkütan 1.2 mg / kg) altında sistometri gerçekleştirin.
- Anestezi farelerde vücut sıcaklığı sürekli olarak izlenir ve 36.5 'da tutulmaktadır ° C ± 0.2 ° C arasında bir sıcaklık probu ve bir ısıtma lambası aracılığı ile.
- Set-up üreticinin talimatlarına göre her deneyden önce kalibre edilir.
- Implante kateter bir tarafında ve (Harvard Apparatus) başka bir enfüzyon pompası üzerinde basınç transdüktör (Edwards Lifesciences) bağlı olan 3-yollu bir musluk için bir luer saplama ile bağlıdır. Basınç dönüştürücü veri toplama sistemi (DI-730-USB, Dataq araçlar) için bir amplifikatör (78534c monitör, Hewlett Packard) ve bir ortak ile bağlandığındamputer. Windaq / Lite yazılım kayıt için de kullanılabilir.
- Enfüzyon pompası, örneğin salin ya da PBS içinde infüzyon sağlayan başlatıldığında, 100 ul / dakika (sıçanlar) ya da 20 ul / dk (farelerde). Intravesikal basınç kaydedilirken gibi mesane, sabit bir oranda doldurulur.
- Şekil 5 tipik bir basınç izleme gösteriyor: belirli bir hacim / basıncına ulaşılana kadar sıvı infüzyonu sırasında, mesane yavaş bir baskı birikimini miksiyon eşiği vardır. Bir kez bu eşiği, mesane sözleşme ulaşılması ve daha sonra üriner sfinkter açılır, üretra yoluyla idrarın geçişine izin. Bu nedenle, mesane boşaltılır, daralma duracak ve basınç "bazal" seviyesine tekrar düşecek.
- Bir sıçan metabolik kafesinde ve bir dijital denge üstüne yerleştirilir gibi, idrar hacmi idrar hacmi ile ilgili bilgi vererek, eşzamanlı olarak ölçülebilir. Mil içinde küçük işeme hacimleri nedeniyle,ce, bu sistemi kullanarak çok zor olabilir. Bu nedenle, idrar hacmi işeme önce ve hemen sonra tartılmış küçük bir filtre kağıdı kullanılarak tespit edilir.
- Genellikle, sistem 30 dakika arasında bir süre kayıt ardından, 30 dakika için denge sağlar. Sonra, ilaç sistemik veya intravesikal tatbik edilebilir ve bir 30 dakika daha kaydedilir.
- Kaydedilmiş veriler nicel analiz için özel bir yazılım alınabilir. Csv dosyaları olarak ihraç edilebilir. Biz genellikle (originlab Corporation, MA, ABD) Menşe kullanın.
- Deneylerden sonra, hayvanlar servikal dislokasyon (fare) veya CO 2 zehirlenmesi (sıçan) tarafından kurban edilir.
5. Temsilcisi Sonuçlar

Şekil 1. Laparotomi bakış. A) yatar pozisyonda sıçan yerleştirin. B) Tıraş ve antiseptically cerrahi sitesi hazırlamak. Cilt C) İnsizyonunun. D) Kesi of karın kasları, mesane ve pozlama.

Şekil 2. A purse-string sütür.

3. Kateter implantasyonu Şekil.
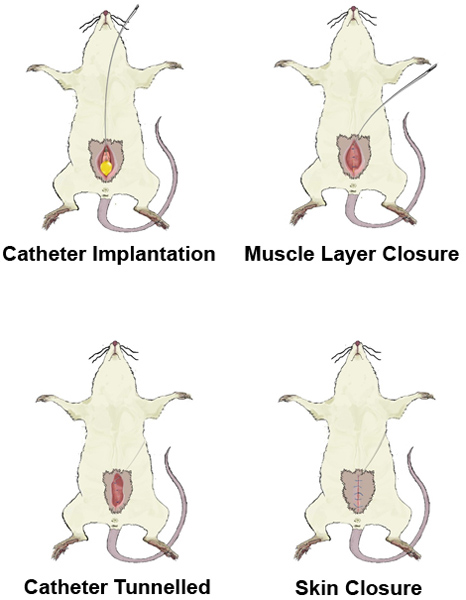
Şekil 4,. Kateterin tip tünel.
Bilinçli bir sıçan ve anestezi uygulanmış bir farenin salin intravesikal basınç perfüzyon sırasında elde edilen ölçüm örnekleri Şekil 5 'de gösterilmiştir. Birden çok parametreler basınç sinyali (intercontractile aralık, temel eşik basınç ve basınç gibi) dan elde edilebilir. Bu parametrelerin tanımları için kapsamlı, Andersson, et al. (Ref 4) ve Yoshiyama ve diğerleri bakınız. ( ref 10).
Biz son zamanlarda hardal yağı moleküler hedeflerin (MO), uzun inflamasyon ve bu mesane 11,12 olarak visseral organların hiperaljezi deneysel modellerinde kullanılan bir yüksek reaktif bileşiği tanımlamak için sistometri kullandık. 10 mM MO İntravezikal infüzyon vahşi tip farelerde işeme sıklığı güçlü bir artış (intercontractile aralığında düşüş) (Şekil 6A, B) ve işeme hacmi 6 azalma indüklenen. İlginçtir, MO MO reseptör TRPA1 arasında eksik farelerde benzer değişiklikler indüklenen. Buna karşılık, MO WT farelere kıyasla daha TRPV1 KO fareleri içinde mesane parametreleri çok daha zayıftır değişimlere neden olan ve Trpa1/Trpv1 KO fareleri içinde herhangi bir etkisi yoktu. Birlikte Peptid (CGRP) 6 İlişkin Kalsitonin Gen verildiği ölçümleri ile, bu veriler TRPV1 MO tarafından indüklenen visseral tahriş önemli bir rol oynayabileceğini göstermektedir göstermektedir.
ve_content ">
Şekil 5. Bilinçli bir dişi sıçan (A) ve anestezi dişi fare (B) kaydedilmiş intravezikal basınç Temsilcisi izleri. En düşük basınç "taban baskısı" (kırmızı oklar) olarak tanımlanır. Doldurma aşamasının sonunda, basınç mavi oklarla işaretlenmiştir. Basınç farkı bölünmesiyle bu noktaların arasındaki infüzyon sıvı hacmi sağlayan mesane duvarının uyum (uyum = infüzyon hacmi / (eşik basıncı hesabı -. Bazal çizgi basıncı) "intercontractile aralığı" (ICI) arasındaki zaman iki işeme kasılmalar.
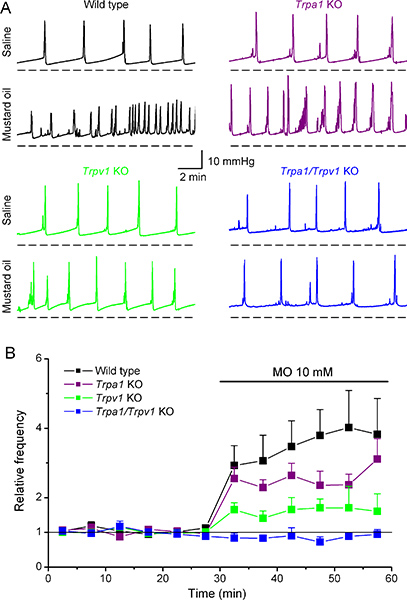
Vahşi tip ve Trpa1, TRPV1 ve Trpa1/Trpv1 knockout farelerde sistometri desen üzerine hardal yağı intravezikal uygulama Şekil 6. Etkileri.(A) ve 10 mM salin infüzyonu, MO yanıt olarak WT, Trpa1 KO, TRPV1 KO ve Trpa1/Trpv1 KO fareleri içinde kaydedilmiş intravesikal basınç değişiklikleri temsil eden örnekler. Öncesi ve MO intravezikal infüzyon sırasında ortalama anlık işeme sıklığı (B) Zaman kursu. Tüm fareler için, veri salin infüzyonu sırasında elde edilen ortalama frekans için normalize edildi. Bu veriler, Elsevier izni ile Everaerts ve ark. (Ref 6) uyarlanmıştır.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada sunulan sistometri tekniği hayvan modellerinde mesane fonksiyonu in vivo ölçümleri performans sağlar. Sıçanlar belkide en çok kullanılan hayvan modeli vardır. Fare işlemek için daha zor, ama genetik olarak manipüle hayvanları kullanmanın avantajı sunuyoruz. Çünkü implante kateter ve intravezikal basıncı etkileyebilir karın içi basınç değişiklikleri gevşemesi sonucunda çok aktif olma eğilimi bilinçli fareler kullanarak teknik zorluk, biz tam sistometrisi sırasında üretan ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu eser Belçika Federal Hükümeti (IUAP P6/28), Araştırma Vakfı-Flanders (FWO) (G.0565.07 ve G.0686.09), Astellas Avrupa Vakfı Ödülü 2009 ve KU Leuven Araştırma Konseyi bağışları ile desteklenmiştir (GOA 2009/07, EF/95/010 ve PFV/10/006). PU ve BİZ Araştırma Vakfı-Flanders (FWO) ve doktora öğrencisinin vardır. MB Marie Curie akademisyendir. FWO DDR temel-klinik fellow.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Ticari adı, şirket, | Katalog numarası | Yorumlar |
| üretan | Üretan, Sigma-Aldrich | 315419 | Grup 2B kanserojen |
| izofluran | Isoba, Schering-Plough Hayvan Sağlığı | ||
| polietilen kateter | Intramedic polietilen boru PE50, Becton Dickinson | 427411 | |
| Cerrahi mikroskop | Op-Mi 6, Carl Zeiss | Op-Mi 6 | |
| purse-string sütür | Prolen 6/0, Ethicon | 8610H | |
| fasya ve cilt sütür | Ethilon 4/0 veya 5/0, Ethicon | 662G veya 661G | |
| postoperatif analjezik | Temgesic, Schering-Plough Hayvan Sağlığı | fareler için doz: 0.05 mg / kg ' | |
| amplifikatör | 78534c monitör, Hewlett Packard | ||
| analitik dengeleri ve denge veri toplama yazılımı | FZ 300i, A & D | FZ-300i | |
| infüzyon pompaları | Pompa 33, Harvard Apparatus | HA33 | |
| sistometri kayıt sistemi | Dataq aletleri, DI-730 serisi ve Windaq / Lite | DI-730-USB Windaq / Lite | |
| sıcaklık kaydı | Fluke 52 KJ termometre | 52 KJ | |
| basınç dönüştürücüler | Edwards Lifesciences, basınç izleme seti | T322247A |
Referanslar
- Everaerts, W., Gevaert, T., Nilius, B., De Ridder, D. On the origin of bladder sensing: Tr(i)ps in urology. Neurourol. Urodyn. 27, 264-2673 (2008).
- Fry, C. H. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol. Urodyn. 29, 603-608 (2010).
- Gevaert, T. Deletion of the transient receptor potential cation channel TRPV4 impairs murine bladder voiding. J. Clin. Invest. 117, 3453-3462 (2007).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Everaerts, W. Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis. Proc. Natl. Acad. Sci. U.S.A. 107, 19084-19089 (2010).
- Everaerts, W. The capsaicin receptor TRPV1 is a crucial mediator of the noxious effects of mustard oil. Curr. Biol. 21, 316-321 (2011).
- Yoshiyama, M., Roppolo, J. R., Thor, K. B., de Groat, W. C. Effects of LY274614, a competitive NMDA receptor antagonist, on the micturition reflex in the urethane-anaesthetized rat. Br. J. Pharmacol. 110, 77-86 (1993).
- Yoshiyama, M., Roppolo, J. R., de Groat, W. C. Effects of MK-801 on the micturition reflex in the rat--possible sites of action. J. Pharmacol. Exp. Ther. 265, 844-850 (1993).
- Boudes, M. Functional Characterization of a Chronic Cyclophosphamide-Induced Overactive Bladder Model in mice. Neurourol. Urodyn. , (2011).
- Yoshiyama, M. Sex-related differences in activity of lower urinary tract in response to intravesical acid irritation in decerebrate unanesthetized mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 295, R954-R960 (2008).
- McMahon, S. B., Abel, C. A model for the study of visceral pain states: chronic inflammation of the chronic decerebrate rat urinary bladder by irritant chemicals. Pain. 28, 109-127 (1987).
- Du, S., Araki, I., Yoshiyama, M., Nomura, T., Takeda, M. Transient receptor potential channel A1 involved in sensory transduction of rat urinary bladder through C-fiber pathway. Urology. 70, 826-831 (2007).
- Streng, T., Santti, R., Talo, A. Similarities and differences in female and male rat voiding. Neurourol. Urodyn. 21, 136-141 (2002).
- Igawa, Y. Cystometric findings in mice lacking muscarinic M2 or M3 receptors. J. Urol. 172, 2460-2464 (2004).
- Schroder, A., Newgreen, D., Andersson, K. E. Detrusor responses to prostaglandin E2 and bladder outlet obstruction in wild-type and Ep1 receptor knockout mice. J. Urol. 172, 1166-1170 (2004).
- Chen, Q. Function of the lower urinary tract in mice lacking alpha1d-adrenoceptor. J. Urol. 174, 370-374 (2005).
- May, V., Vizzard, M. A. Bladder dysfunction and altered somatic sensitivity in PACAP-/- mice. J. Urol. 183, 772-779 (2010).
- Thorneloe, K. S., Meredith, A. L., Knorn, A. M., Aldrich, R. W., Nelson, M. T. Urodynamic properties and neurotransmitter dependence of urinary bladder contractility in the BK channel deletion model of overactive bladder. Am. J. Physiol. Renal. Physiol. 289, 604-610 (2005).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır