Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'utilisation de la cystomanométrie chez les petits rongeurs: une étude de la vessie Chemosensation
Dans cet article
Résumé
Cystomanométrie est une technique efficace pour mesurer la fonction de la vessie de petits animaux In vivo. La vessie est perfusé en continu à des vitesses contrôlées par un cathéter intra-vésicale, tandis que l'urètre est laissée libre pour la miction. Ceci permet de répétition de remplissage et de vidange de la vessie, tandis que la pression intravésicale volume évacué et sont enregistrées.
Résumé
Protocole
1. Animaux de laboratoire
- Animaux (souris, rats) sont logés dans une animalerie spécialisée avec un 12-hr cycle lumière-obscurité et l'accès ad libitum à l'eau et boulettes de nourriture standard. L'âge et le sexe des animaux sont des paramètres importants qui devraient être normalisés en fonction des besoins. Nous effectuent généralement la cystomanométrie de 10 - 12 semaines les femelles âgées 5,6.
- Toutes les expériences sur les animaux sont effectuées en conformité avec les directives de l'Union européenne Conseil de la Communauté et approuvée par le comité d'éthique local.
2. Anesthésie
- Anesthésie à l'isoflurane est utilisé pour effectuer de petites interventions chirurgicales, car elle est facile à doser en raison de sa courte demi-vie. Effluents gazeux approprié balayage est nécessaire lorsque vous utilisez l'isoflurane.
- Les animaux sont placés dans une boîte fermée, gazé avec de l'isoflurane 5% dans de l'oxygène pur (1 l / min).
- Après l'induction de l'anesthésie appropriée à la level est maintenue par un petit masque (une coupe seringue de 10 ml) de 0,8 - 1 l / min d'oxygène avec 1 - 1,5% d'isoflurane.
- Pour les souris, anesthésie à l'uréthane est utilisé lors des enregistrements fonctionnels (cf. infra). Anesthésie à l'uréthane est utilisé lors des enregistrements fonctionnels parce que, contrairement à la plupart des autres anesthésiques, le réflexe de miction n'est pas supprimée par cet agent anesthésique 4. Uréthane 1,2 Poids g de corps / kg est administrée par voie sous cutanée (sc) 60 min avant le début des enregistrements. Si nécessaire, la dose d'uréthane nécessaire pour obtenir une anesthésie appropriée peut être augmentée par l'administration de doses supplémentaires (0,1 g / kg) par voie sous cutanée. Il convient de noter, cependant, que l'anesthésie supplémentaire peut altérer l'efficacité de la miction et par conséquent la fréquence de la miction 7,8. Ainsi, les enregistrements cystométriques doivent être étroitement surveillés et mis au rebut chaque fois que des écarts importants par rapport au comportement de contrôle sont respectées. Anesthésiques doit pas être administré tant que le testcomposés sont appliqués afin d'éviter une mauvaise interprétation des données.
3. Procédure chirurgicale - Implantation sonde vésicale
- Les instruments chirurgicaux sont stérilisés à l'autoclave avant de l'utiliser. Raser l'abdomen de l'animal, désinfecter avec de l'éthanol à 70% et d'effectuer une laparotomie médiane bas pour exposer la vessie.
- Sous un microscope chirurgical, placer une suture en bourse dans le dôme de la vessie à l'aide d'une suture non résorbable monofilament, (taille 6-0).
- Effectuer une cystostomie petite (nous avons privilégié l'utilisation d'une aiguille de 18 G) à l'intérieur de la chaîne de sac à main et insérer un cathéter en polyéthylène PE 50, avec un petit brassard à la fin (obtenu en chauffant avec précaution le tube) à travers ce trou. Dans nos mains, plus minces tubes PE (10) présentent une résistance élevée et plus variable. Le tube peut être désinfecté en le mettant dans une solution d'éthanol à 70% ou stérilisé dans un autoclave. Avant l'implantation, la tubulure doit être rincée avec une solution saline.
- Fixez le sac strtion autour du tube avec un noeud de chirurgien. Tirez délicatement vers l'extérieur du cathéter jusqu'à l'extrémité en forme de cloche est positionné juste sous la suture. Poussez une pièce de 18 G cathéter vers la suture pour éviter les fuites.
- Faire infuser un petit volume de solution saline (100 - 200 pi) doucement pour vérifier s'il ya des fuites. Si des fuites sont présentes, une suture supplémentaire doit être placé.
- Fermer les muscles abdominaux en utilisant monofilament, laissant un passage pour le cathéter dans la partie supérieure de l'incision.
- Le tube de tunnel à la région interscapulaire aide d'une tige métallique creuse, ce qui empêche les animaux de mordre le tube au cours de l'expérience.
- La peau est refermée à l'aide non résorbable monofilament. Le cathéter implanté est rincée avec une solution saline pour vérifier sa perméabilité.
- Avant que les animaux se réveillent, des analgésiques sont administrés par voie sous (buprénorphine, 0,05 mg / kg).
4. Configuration et cystomanométrie
- Selon la questi expérimentalesur (et les espèces utilisées) cystomanométrie est réalisée en éveil (retenue ou Unrestraint) ou uréthane anesthésié les animaux. Alors que la cystomanométrie est parfaitement possible chez des rats conscients, qui ont tendance à rester calme dans un environnement restreint, nous avons l'habitude effectuer la cystomanométrie sous anesthésie à l'uréthane (1,2 mg / kg, voie sous-cutanée) lorsque vous utilisez la souris 3,5,6,9.
- Chez les souris anesthésiées, la température du corps est constamment surveillée et maintenue à 36,5 ° C ± 0,2 ° C à l'aide d'une sonde de température et une lampe de chauffage.
- Le set-up est calibré avant chaque expérience selon les instructions du fabricant.
- Le cathéter implanté est relié par un embout Luer à un robinet 3-voies, qui est relié au transducteur de pression (Edwards Lifesciences) sur un côté et une pompe de perfusion sur l'autre (Harvard Apparatus). Le transducteur de pression est relié par l'intermédiaire d'un amplificateur (78534c moniteur, Hewlett Packard) au système d'acquisition de données (DI-730-USB, DATAQ instruments) et un computer. Windaq / Lite logiciel peut être utilisé pour l'enregistrement.
- La pompe à perfusion est lancé, permettant la perfusion de solution saline ou PBS à, par exemple, 100 l / min (chez le rat) ou 20 l / min (chez la souris). En tant que tel la vessie sera remplie à un taux constant, tandis que la pression intravésicale est enregistrée.
- La figure 5 représente un tracé de pression typique: pendant la perfusion de fluide, il existe une accumulation de pression dans la vessie lente, jusqu'à un certain volume / pression est atteinte, le seuil de la miction. Une fois que ce seuil est atteint, la vessie se contracte et par la suite le sphincter urinaire s'ouvre, permettant le passage de l'urine par l'urètre. En tant que tel, la vessie est vidée, la contraction s'arrête et la pression chute à nouveau à la «base» de niveau.
- Comme le rat est placé dans une cage métabolique et au-dessus d'une balance numérique, le volume uriné peuvent être mesurés simultanément, donnant des informations sur le volume uriné. En raison de la faiblesse des volumes annulés à mice, il peut être très difficile avec ce système. Par conséquent, volume uriné est déterminée à l'aide de petits papiers filtres pesés avant et après la miction.
- En général, on laisse le système s'équilibrer pendant 30 min, suivie d'une période d'enregistrement de 30 minutes. Ensuite, les médicaments peuvent être administrés par voie systémique ou par voie intravésicale et un autre 30 minutes sont enregistrés.
- Les données enregistrées peuvent être exportées sous forme de fichiers csv. Qui peuvent être importés dans un logiciel spécialisé pour l'analyse quantitative. Nous utilisons généralement origine (OriginLab Corporation, MA, USA).
- Après les expériences, les animaux sont sacrifiés par dislocation cervicale (souris) ou l'intoxication CO 2 (rats).
5. Les résultats représentatifs

Figure 1. Aperçu laparotomie. A) Placez le rat en décubitus dorsal. B) Rasage et antiseptique préparer le site chirurgical. C) Incision de la peau. Incision D) of les muscles abdominaux, et l'exposition de la vessie.

Figure 2. Un suture en bourse.

Figure implantation du cathéter. 3.
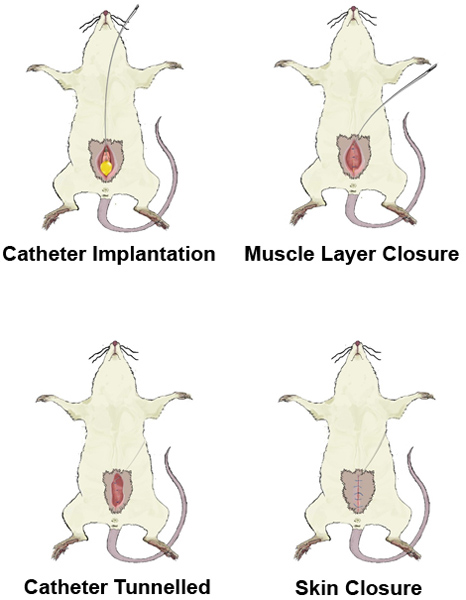
La figure 4. Tunnelier du cathéter.
Des exemples de mesures de pression obtenues pendant la perfusion de solution saline par voie intravésicale chez le rat conscient et une souris anesthésiée sont présentés dans la figure 5. Plusieurs paramètres peuvent être extraits à partir du signal de pression (par exemple, l'intervalle intercontractile, la pression de référence et la pression de seuil). Pour une description détaillée de ces paramètres, s'il vous plaît voir Andersson et al. (Ref 4) et Yoshiyama et al. ( ref 10).
Nous avons récemment utilisé la cystomanométrie d'identifier les cibles moléculaires de l'huile de moutarde (MO), un composé hautement réactif qui a été longtemps utilisé dans les modèles expérimentaux d'inflammation et l'hyperalgésie des viscères tels que la vessie 11,12. Par infusion intravésicale de 10 mM MO induit une forte augmentation de la fréquence de la miction (diminution de l'intervalle intercontractile) chez les souris de type sauvage (figure 6A, B) et une diminution du volume annulé 6. Fait intéressant, MO induit des changements similaires chez les souris déficientes en récepteur de la MO TRPA1. En revanche, MO induit des changements beaucoup plus faibles dans les paramètres cystométriques chez la souris KO TRPV1 que chez les souris WT et était sans aucun effet chez les souris KO Trpa1/Trpv1. Ainsi que les mesures de la libération du gène de la calcitonine related Peptide (CGRP) 6, ces données indiquent démontrer que TRPV1 peut jouer un rôle clé dans l'irritation viscérale induite par MO.
ve_content ">
Figure 5. Traces représentatifs de la pression intravésicale enregistré dans un rat conscient femelle (A) et d'une souris anesthésiée femelle (B). La pression la plus faible est définie comme étant la "pression de base" (flèches rouges). La pression à la fin de la phase de remplissage est marqué par la flèche bleue. Le volume de liquide perfusé entre ces points, divisée par la différence de pression, permet le calcul de la conformité de la paroi de la vessie (= respect infusé volume / (pression de seuil -. Pression de base) Le «intervalle intercontractile" (ICI) est le temps entre deux contractions miction.
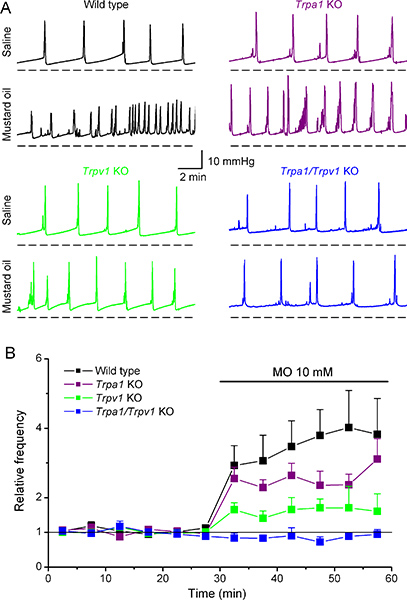
Figure 6. Effets de l'application intravésicale de l'huile de moutarde sur le modèle de la cystomanométrie de type sauvage et des souris knockout TRPA1, TRPV1 et Trpa1/Trpv1.(A) Des exemples représentatifs des variations de pression intravésicale enregistrées dans WT, TRPA1 KO, KO et Trpv1 Trpa1/Trpv1 souris KO en réponse à une perfusion de solution saline et 10 mM MO. Évolution dans le temps (B) de la fréquence de la miction instantanée moyenne avant et pendant infusion intravésicale de MO. Pour toutes les souris, les données ont été normalisées à la fréquence moyenne obtenue pendant la perfusion de solution saline. Ces données sont adaptés à partir Everaerts et al. (Ref 6), avec la permission d'Elsevier.
Access restricted. Please log in or start a trial to view this content.
Discussion
La technique présentée ici cystomanométrie permet d'effectuer des mesures in vivo de la fonction de la vessie chez des modèles animaux. Les rats sont probablement le modèle animal le plus utilisé. Les souris sont plus difficiles à manipuler, mais offrent l'avantage de l'utilisation d'animaux génétiquement modifiés. En raison de la difficulté technique de l'utilisation des souris conscientes, qui ont tendance à être très actif résultant de relâchement du cathéter imp...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par des subventions du gouvernement fédéral belge (PAI P6/28), la Fondation de la recherche-Flandre (FWO) (G.0565.07 et G.0686.09), la Fondation européenne Astellas Award 2009 et le Conseil de recherche de la KU Leuven (GOA 2009/07, EF/95/010 et PFV/10/006). PU et nous sommes doctorants de la Fondation de la recherche-Flandre (FWO). MB est un boursier Marie Curie. DDR un homme fondamental, clinique du FWO.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Nom commercial, entreprise, | Numéro de catalogue | Commentaires |
| uréthane | Uréthane, Sigma-Aldrich | 315419 | cancérogène du groupe 2B |
| isoflurane | Isoba, de la santé animale de Schering-Plough | ||
| cathéter en polyéthylène | Intramedic Tube en polyéthylène PE50, Becton Dickinson | 427411 | |
| Microscope chirurgical | Op-Mi 6, Carl Zeiss | Op-Mi 6 | |
| bourse-string suture | Prolene 6/0, Ethicon | 8610H | |
| fascia et suturer la peau | Ethilon 4/0 ou 5/0, Ethicon | 662G 661G ou | |
| analgésiques postopératoires | Temgesic, de la santé animale de Schering-Plough | dosage pour le rat: 0,05 mg / kg | |
| amplificateur | 78534c moniteur, Hewlett Packard | ||
| balances analytiques et des logiciels d'acquisition de données équilibre | FZ 300i, A & D | FZ-300i | |
| pompes à perfusion | pompe 33, Harvard appareil | HA33 | |
| système d'enregistrement cystométrie | Instruments DATAQ, DI-730 série et Windaq / Lite | DI-730-USB Windaq / Lite | |
| Enregistrement de la température | Fluke 52 KJ thermomètre | 52 KJ | |
| des transducteurs de pression | Edwards Lifesciences, jeu surveillance de la pression | T322247A |
Références
- Everaerts, W., Gevaert, T., Nilius, B., De Ridder, D. On the origin of bladder sensing: Tr(i)ps in urology. Neurourol. Urodyn. 27, 264-2673 (2008).
- Fry, C. H. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol. Urodyn. 29, 603-608 (2010).
- Gevaert, T. Deletion of the transient receptor potential cation channel TRPV4 impairs murine bladder voiding. J. Clin. Invest. 117, 3453-3462 (2007).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol. Urodyn. 30, 636-646 (2011).
- Everaerts, W. Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis. Proc. Natl. Acad. Sci. U.S.A. 107, 19084-19089 (2010).
- Everaerts, W. The capsaicin receptor TRPV1 is a crucial mediator of the noxious effects of mustard oil. Curr. Biol. 21, 316-321 (2011).
- Yoshiyama, M., Roppolo, J. R., Thor, K. B., de Groat, W. C. Effects of LY274614, a competitive NMDA receptor antagonist, on the micturition reflex in the urethane-anaesthetized rat. Br. J. Pharmacol. 110, 77-86 (1993).
- Yoshiyama, M., Roppolo, J. R., de Groat, W. C. Effects of MK-801 on the micturition reflex in the rat--possible sites of action. J. Pharmacol. Exp. Ther. 265, 844-850 (1993).
- Boudes, M. Functional Characterization of a Chronic Cyclophosphamide-Induced Overactive Bladder Model in mice. Neurourol. Urodyn. , (2011).
- Yoshiyama, M. Sex-related differences in activity of lower urinary tract in response to intravesical acid irritation in decerebrate unanesthetized mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 295, R954-R960 (2008).
- McMahon, S. B., Abel, C. A model for the study of visceral pain states: chronic inflammation of the chronic decerebrate rat urinary bladder by irritant chemicals. Pain. 28, 109-127 (1987).
- Du, S., Araki, I., Yoshiyama, M., Nomura, T., Takeda, M. Transient receptor potential channel A1 involved in sensory transduction of rat urinary bladder through C-fiber pathway. Urology. 70, 826-831 (2007).
- Streng, T., Santti, R., Talo, A. Similarities and differences in female and male rat voiding. Neurourol. Urodyn. 21, 136-141 (2002).
- Igawa, Y. Cystometric findings in mice lacking muscarinic M2 or M3 receptors. J. Urol. 172, 2460-2464 (2004).
- Schroder, A., Newgreen, D., Andersson, K. E. Detrusor responses to prostaglandin E2 and bladder outlet obstruction in wild-type and Ep1 receptor knockout mice. J. Urol. 172, 1166-1170 (2004).
- Chen, Q. Function of the lower urinary tract in mice lacking alpha1d-adrenoceptor. J. Urol. 174, 370-374 (2005).
- May, V., Vizzard, M. A. Bladder dysfunction and altered somatic sensitivity in PACAP-/- mice. J. Urol. 183, 772-779 (2010).
- Thorneloe, K. S., Meredith, A. L., Knorn, A. M., Aldrich, R. W., Nelson, M. T. Urodynamic properties and neurotransmitter dependence of urinary bladder contractility in the BK channel deletion model of overactive bladder. Am. J. Physiol. Renal. Physiol. 289, 604-610 (2005).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon