A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה לא פולשנית של פטרת מופצת הזחלים דג הזברה
In This Article
Summary
ההתפתחות המהירה, גודל קטן השקיפות של דג הזברה הם יתרונות עצומים למחקר שליטה החיסון המולדת של זיהום 1-4. כאן אנו מדגימים טכניקות הדבקה הזחלים דג הזברה באמצעות הפתוגן פטרייתי קנדידה אלביקנס על ידי microinjection, המתודולוגיה בשימוש לאחרונה לערב פעילות תא בלען NADPH אוקסידאז שולט dimorphism פטרייתי 5.
Abstract
קנדידה להפיץ נגרמת על ידי פתוגן קנדידה אלביקנס היא בעיה חשיבות קלינית אצל אנשים מאושפזים והיא קשורה עם תמותה המיוחס 30 עד 40% 6. קנדידה מערכתית נשלטת בדרך כלל על ידי חיסון מולדת, אנשים עם פגמים גנטיים מולדים רכיבי תא החיסון כגון NADPH אוקסידאז תא בלען רגישים יותר candidemia 7-9. מעט מאוד ידוע על הדינמיקה של C. אלביקנס אינטראקציה עם תאים חיסוניים מולדים in vivo. נרחב במבחנה קבעו כי מחוץ המארח ג אלביקנס germinates בתוך מקרופאגים, והוא נהרס במהירות על ידי נויטרופילים 10-14. במבחנה, אך שימושי, לא יכול לשחזר מורכבים בסביבה vivo, הכולל זמן תלויי הדינמיקה של רמות ציטוקינים, קבצים מצורפים תאי מטריקס ואנשי קשר אינטר 10, 15-18 הזחל דג הזברה מציע שורה חוליות ייחודי צדדי לחקר זיהום. במשך 30 הימים הראשונים של התפתחות הזחלים דג הזברה יש רק הגנה החיסון המולדת 2, 19-21, לפשט את חקר מחלות כמו קנדידה שהפיצו, כי הם תלויים במידה רבה חסינות מולדת. גודל שקיפות קטנה של דג הזברה הזחלים לאפשר הדמיה של הדינמיקה זיהום ברמה התאית עבור המארחת והן הפתוגן. הזחלים מהונדס עם קורנים תאים חיסוניים מולדים יכול לשמש כדי לזהות סוגים מסוימים תאים המעורבים זיהום 22-24. שונה נגד תחושת oligonucleotides (Morpholinos) ניתן להשתמש כדי להפיל רכיבים חיסוניים שונים כגון NADPH אוקסידאז תא בלען וללמוד את השינויים בתגובה fungaאני זיהום 5. בנוסף על היתרונות האתיים והמעשיים של השימוש חוליות נמוך קטן, הזחלים דג הזברה מציעה אפשרות ייחודית תמונת הקרב ודק בין הפתוגן ומארח הן intravitally וגם בצבע.
דג הזברה נעשה שימוש לזיהום מודל עבור מספר של חיידקים פתוגניים האדם, כבר סייעה התקדמות גדולה בהבנה שלנו של זיהום mycobacterial 3, 25. עם זאת, רק לאחרונה יש פתוגנים הרבה יותר גדול כמו פטריות השתמשו כדי להדביק את הזחל 5, 23, 26, ועד כה לא היתה תיאור ויזואלי מפורט של המתודולוגיה זיהום. כאן אנו מציגים טכניקות שלנו microinjection למוח האחורי החדר של דג הזברה 25 דקדקנית, כולל שינויים שלנו על הפרוטוקולים הקודמים. הממצאים שלנו תוך שימוש במודל דג הזברה הזחל על זיהום פטרייתי לסטות במבחנה ולחזק את הצורך לבחון בין מאכסן לפתוגן interaction בסביבה מורכבת של המארח ולא מערכת פשוטה של צלחת פטרי 5.
Protocol
כל הפרוטוקולים טיפול דג הזברה וניסויים שבוצעו תחת טיפול בבעלי חיים מוסדי ועדת שימוש (IACUC) פרוטוקול A2009-11-01.
1. Morpholino ומנות הזרקת הזחל
משך הניסוי: * (10-15 דקות)
דרגת הקושי: *
- על זריקות ביצים, להכין פתרון 2% agarose במים במיקרוגל סטרילית. כאשר הפתרון מתקרר לשפוך חלק ממנו לתוך צלחת פטרי נוספת עמוק (פישר סיינטיפיק) עד שהוא חצי מלא. מגניב על הקרח ולוודא צלחת שטוחה.
- לאחר המנה מתקרר, שופכים השכבה העליונה של 15 מ"ל agarose 2%. לרסס זריקה ביצה תבנית פלסטיק מחורצת (מסתגלת כלי מדעי) עם מים סטריליים מבקבוק ספריי. בזהירות להניח את הצד Groove עובש לתוך agarose חם. כאשר agarose מתקרר, השתמש מרית מתכת שטוחה (VWR מדעי) לנתק את התבנית מן התנורעלה. לאט לאט להסיר את הרשת מן agarose. העובר גלישת הזרקת מנות Parafilm (VWR מדעי) ו החנות הפוכה ב 4 ° C.
- על זריקות הזחל דגים, להכין פתרון 2% agarose כמתואר. יוצקים את הפתרון אל תוך צלחת פטרי בגודל סטנדרטי (VWR מדעי) ומניחים בצד עד שהוא מתקשה. מנות גלישת הזרקת הזחל ב Parafilm וחנות הפוך ב 4 ° C.
2. תרבות פטרייתי הכנה
משך הניסוי: ** (30 דקות)
דרגת קושי: **
- להכין תמצית שמרים, peptone, דקסטרוז (YPD) צלחות אגר: 10 גר '/ ליטר תמצית שמרים, 20 גר' / ליטר peptone, 20 גר '/ ליטר דקסטרוז, ו 20 גר' / ליטר אגר אל החיטוי ו. עבור נוזל YPD להכין 10 גרם / תמצית שמרים ליטר, 20 גר '/ ליטר peptone, 20 גר' / ליטר דקסטרוז ו החיטוי 20-30 דקות ב 121 ° C.
- יומיים לפני זיהומים דגים להכין צלחת פס מן קפואמניות של קנדידה אלביקנס תרבויות על גבי אגר YPD לקבל מושבות בודדות.
- דגירה על 37 מעלות צלזיוס למשך הלילה.
- לשים 5 מ"ל מרק YPD לתוך 150 x 16 מ"מ (תרבות צינורות VWR מדעי).
- יום לפני זיהומים דגים לאסוף 1 מושבה קטנה על אגר YPD עם לוחית עץ (VWR מדעי). שים את מקל בצינור תרבות מערבולת סביב למושבה מחדש להשעות בנוזל YPD.
- לגדול בן לילה ב 37 ° C על תוף TC-7 רקמות תרבות רולר מצויד גלגל 14 אינץ בדיקה צינור (ניו ברונסוויק מדעי).
- למחרת, ספין למטה 1 מ"ל של התרבות ב g 14000x דקה 1 בצינור 1.7 מ"ל (Axygen). הסר את supernatant ו resuspend גלולה בנוזל שיורי על ידי vortexing (VWR מדעי).
- הוסף 1 מ"ל 1x פוספט שנאגרו מלוחים (VWR מדעי) ומסובב כפי שתואר לעיל.
- חזור על לשטוף PBS 3 פעמים.
- לדלל 1:100 דילול ב 1x PBS (10 μL של שטף ג אלביקנס לתוך 990 μL 1x PBS).
- סמוך על Hemocytometer (VWR מדעי).
- מדולל ל -10 7 תאים למ"ל.
3. דג הזברה זיהומים
משך הניסוי: **** (1-3 שעות)
דרגת הקושי: ****
- איסוף עוברים לפי סעיף 5 וחנות במים ביצים, 60 מ"ג / ל 'מלחי הים מיידיות (פישר סיינטיפיק) במים deionized סטרילית.
- באמצעות מיקרוסקופ לנתח כגון SZ61 אולימפוס (Olympus), עוברים dechorionate ביום זיהום. השתמש דומון Dumoxel פינצטה (VWR מדעי) למשוך סיסית 27 מזה כמו לפתוח שקית צ'יפס, או בעדינות לתקוע את פינצטה במצב סגור לתוך סיסית ואז לאט לאט לפתוח אותם. הדג צריך לקפוץ היישר סיסית.
- מערבולת צלחת פטרי נוספת עמוקה עם מכסה על להעביר דגים למרכז הצלחת. העברת דגים מכסה של צלחת. הסר ביצה מיםלהחליף עם התקשורת טריים. הוספת דגים למדיה.
- הזרקת מנות חמות הזחל באינקובטור ב 28 מעלות ג הכן tricaine מתאן sulfonate (מערב כימיים בע"מ) דילול על 200 מיקרוגרם / מ"ל עבור anesthetizing דגים.
- לספור את המספר הרצוי של הזחלים לזיהום (20-50 דגים). את הדג בתמיסה sulfonate tricaine מתאן להמתין 1-2 דקות עד שהם מפסיקים לנוע.
- הפעל את יחידת MPPI-3 הזריקה (מכשירים מדעיים יישומית). ודא כי מתג לחץ על "הדופק" ואת "משך הדופק" מוגדר 9 עם 3 PSI עבור יחידת backpressure. פתח את שסתום למיכל חנקן עד שהלחץ על יחידת ההזרקה קורא 30 PSI.
- טען micropipette משך 28 עם 5 μL של vortexed קנדידה אלביקנס בריכוז של 1x10 7 תאים למ"ל. מניחים את micropipette בעריסה micropipette (מכשירים מדעיים יישומית). למלא צלחת ריקה נוספת פטרי עמוקה עם מים. העבר את micropipette עד קצה אניבתוך נוף של פשוט לגעת את פני המים באמצעות מיקרוסקופ לנתח ושימוש דומון Dumoxel פינצטה (VWR מדעי) לקצץ את המחט על 3 מ"מ מקצה הצינורית ומשכה.
- לחץ על מתג רגל (מכשירים מדעיים יישומית) כדי לאמת את המחט כבר מקוטע. אתה צריך לראות את הנוזל לפזר אם היית מצליח. הקוטר של בולוס נוזלים צריך להיות לא גדול יותר מאשר קוטר האישון של הזחל 25 חסודה דג הזברה (0.21 מ"מ, מניב בתחום של 4.9 NL בנפח). התאם את הלחץ בהתאם אם בולוס נוזלים גדול מדי או קטן מדי.
- להרדים את הדגים sulfonate מתאן tricaine (200 מיקרוגרם / מ"ל). ברגע דגים הפסיקו לזוז, מערבולת צלחת עם מכסה עד דגים הם במרכז. לאסוף 50 דגים בעזרת פיפטה העברה (פישר סיינטיפיק). לחץ על הצד של פיפטה ליישב את הדגים לכיוון קצה. בעדינות פיפטה הדג על צלחת agarose הזחל שימוש כנוזל שפחות.
- הקו דגים עם מוט זכוכית חלקה (להיזהר לא לרסק אותם). לשאוב כנוזל רב ככל האפשר את הצלחת. השתמש KimWipe כדי הפתיל משם כל הלחות.
- מקם את המנה הזחל agarose עם דגים מתחת למיקרוסקופ עד לקבלת תצפית טובה על דגים ועל המחט בעת ובעונה אחת. להזיז את המחט זכוכית לכיוון הדגים. קרב על הדג והן המחט תוך כדי למקם את המחט לכיוון הדגים. בזהירות להזיז את המחט אל תוך שלפוחית זכוכית otic 27, 29 (אוזן) של דגים 1. אתה תדע פעם שעברת את המחט אל תוך הדג, כי כאשר אתה לוחץ על מתג רגל (מטיריאלס מכשירים מדעיים), החדר למוח האחורי יהיה להרים מעט.
- לחץ על מתג רגל (מכשירים מדעיים יישומית) ולצפות נוזלי לפזר בתוך למוח האחורי של הדג החדר 27. חוזר בי את המחט מדגים ולעבור לדגים הבא. חזור על התהליך עד אשר הזריק את כל הדגים על הצלחת. הסר את כל דEAD דגים להזריק תחליפים כדי לשמור על המספר הנכון (50 דגים). לכל קבוצת דגים 50 מוזרק במחט microinjection החדש חייב להיות מוכן, או C. אלביקנס מתיישב התחתון של המחט סותם את זה, או זורק את הריכוז המוזרק.
- שוטפים את הדגים את המנה על ידי מטה את צלחת וריסוס ביצים מים על הדג אל צלחת נקייה נוספת פטרי עמוקה המכילה 60 מ"ל מים ביצה. חשוב לא להשאיר את הדגים על agarose יותר מ 15-20 דקות או שהם יהיו להתייבש ולמות.
- חזור על התהליך עד גמר כל זריקה. אל תשכח PBS ו פתוגניים לא שולטת הזריק.
- בסיום, לשמור את הדגים על 28 ° C.
- סגור את שסתום מיכל חנקן. להעביר את יחידת ההזרקה מתג מ "הדופק" כדי "רציפה" כדי להקל את הלחץ בתור טנק, הלחץ אמור לרדת לאפס בשלב זה. לעבור יחידת ההזרקה חזרה "דופק". כבה את יחידת ההזרקה ולנקות את אזור העבודה.
4. הכנת דגים הדמיה
משך הניסוי: ** (30 דקות)
דרגת קושי: **
- הכן sulfonate tricaine פתרון מתאן כמו קודם (200 מיקרוגרם / מ"ל). צא דגים נגוע, ולהעביר אותם tricaine.
- הכן 47.9% 0.4 מ"ל נמוכה להמיס agarose (VWR מדעית) במים, ביצה. מחממים את הפתרון על ידי במיקרוגל. מצננים 37 ° C ו-add sulfonate tricaine מתאן (200 מיקרוגרם / מ"ל) לתערובת
- ברגע דגים משותקת sulfonate מתאן tricaine, דגים פיפטה הפרט לתוך צלחת פטרי (VWR מדעית) המכיל 0.4% נמוך להמיס agarose (VWR מדעי).
- לאחר מכן, להעביר את הדגים נמוכה להמיס agarose לתוך בארות בודדים של צלחת הזכוכית התחתונה (MatTek Corporation) עבור הדמיה. השתמש מעט נמוכה להמיס agarose ככל האפשר, כך הדג שוכב בתחתית הצלחת. השתמש רק מספיק tricaine-agarose למלא בנר מעגלי צלחת תחתית הכוס.
5. שינויים הקשורים יופיטר הפרוטוקולים
Micropipettes עבור Microinjection
משך הניסוי: * (10-15 דקות)
דרגת הקושי: *
- משוך מוטות זכוכית חלולים BF120-69-10 (מכשירי סאטר) באמצעות לוהטים בראון micropipette פולר דגם P-97 (סאטר מכשירים) על פי יואן ואח'. 30. בחירת תוכנית # 7 עם חום התנאים הבאים = 470, מהירות = 120, זמן = 200. מחט המתקבל הוא 8 מ"מ מן שפוע עד קצה ו, מקוטע פעם 3 מ"מ מעל קצה זה בעל קוטר של כ 10 מיקרומטר.
- טען micropipette זכוכית לתוך הסוגריים. בחר "משוך". נימה חימום יהיה לחמם את המחט על פי פרמטרים של תוכניות ואת מוט זכוכית יפרידו לשתי micropipettes ומשכה. החנות micropipettes בתיבת אחסון פיפטה (Suttאה מכשירים).
אוסף העובר, הזרקת morpholino ותחזוקה
משך הניסוי: *** (1-2 שעות)
דרגת הקושי: ***
- איסוף עוברים לפי השיטות של רוזן ואח'. 31. השתמש מסננת פלסטיק (Wares של Knutsford) לאסוף ביצים מטנק הרבייה (בתי גידול מימיים). החזק את מסננת הפוכה על צלחת פטרי נוספת עמוק ולשטוף עם מים מיכל לאיסוף ביצים.
- להכנת morpholino, להוסיף מים סטריליים μL 300 ל -300 nanomoles של morpholino (GeneTools, LLC). זה נותן המניות עבודה של 1.0 מ"מ.
- בדוק את ריכוז morpholino באמצעות Nanodrop (Thermo Scientific). בחר "חומצות גרעין לשנות את סוג מדגם" הגל השני "עד 265. הזן קבוע על ידי הכפלת משקל מולקולרי של morpholino ב -1000 מחולק absorptivitמקדם Y מופיע בגליון המאפיינים morpholino oligo.
- Nanodrop ריקה עם 2 μL 0.1 N HCl. לדלל 5 μL של פתרון morpholino אל μL 95 של 0.1 N HCl (20x דילול). מניחים 2 μL של דילול על כן nanodrop ולמדוד לחץ. להכפיל את הריכוז פי דילול (20). זה נותן ריכוז העבודה של morpholino. כדי לחשב את ריכוז millimolar לחלק את הריכוז מתקבל על ידי משקל מולקולרי של morpholino.
- להכין מלאי של עובד morpholino ב Danieau חיץ (58 mM NaCl, KCl 0.7 מ"מ, 0.4 מ"מ MgSO 4, 0.6 מ"מ Ca (NO 3) 2, 5.0 HEPES מ"מ, ה-pH 7.6) ואדום פנול 0.01% (VWR מדעי).
- לעבודה הזרקת morpholino פעל על פי פרוטוקול רוזן ואחרים. 31 ו יואן ואח'. 30. יש לשטוף את הכלים morpholino הזרקת מים ביצה חמה על 28 מעלות צלזיוס במשך 15 דקות. להסיר מים מנות הזרקה ו-line up 1-cבשלב טו עוברים לתוך החריצים של המנה בזריקה (להכינו סעיף 1) עם טפטפת העברה. כל צלחת תחזיק כ 250 ביצים. להזריק 1-2 בשלב עוברי תאים עם morpholino. ביצים יישאר בשלב 1 תאים במשך 15 דקות 27.
- יש לשטוף את הביצים הזריק עם מים ביצה עם סיום (מים deionized סטרילית עם מלחי 60 מ"ג / ל 'אושן מיידי) ומקום 60 מ"ל ביצה מים נוספות צלחות פטרי עמוקים. מנות morpholino הזרקת ניתן לעשות שימוש חוזר. לשטוף עם מים, ביצה, כאשר סיים ולאחסן הפוך ב 4 ° C.
- לאחסון של עוברים להוסיף 60 מ"ל מים ביצה צלחת. לספור את 110 עוברים עם טפטפת לתוך העברה נוספות מנות נפרדות פטרי עמוקים עם 60 מ"ל מים ביצה. הוסף מתילן 0.00003% כחול למנוע התפתחותם של חיידקים ו עוברים דגירה על 28 ° C.
- כדי להאיץ את ההתפתחות של עוברי לשמור מנות העובר על 33 מעלות צלזיוס למשך 24 שעות על הבמה על פי קימל ואח'. 27, המאפשר עוברים לפתח בראשתא המטען זווית של 75 מעלות (25 פרים שלב 27).
- לעבודה זיהום הזחל לשמור על העוברים על 28 מעלות צלזיוס לאחר הזרקת עם ג אלביקנס.
- כל יום להחליף מנות העובר עם 60 מ"ל מים ביצה טרייה.
הדמיה
משך הניסוי: ***** (1-5 שעות)
דרגת הקושי: ***
- להכין דגים נמוכה להמיס agarose (לפי סעיף 4.2) עם tricaine בתחום ההדמיה זכוכית הכלים התחתון (MatTek Corporation) כפי שתואר קודם לכן. מניחים את המנה על הבמה IX-81 (אולימפוס) מיקרוסקופ אולימפוס הפוכה. להביא את הדג אל המוקד תחת הגדלה פי 4 לעומת זאת תחת הפרעות של אור ההפרש (DIC). דמויות יכולות להיות שנתפסו על 4x, 20x, ו בהגדלה 40X ב DIC, TRITC (isothiocyanate rhodamine tetramethyl), ו FITC (isothiocyanate fluorescein) הגדרות המסנן.
- השתמש IX-81 Olympus מיקרוסקופ הפוכה עם FV-1000 סריקת לייזר במערכת confocal פי Ariga et al. 32. לקיים קורסים הזמן בהגדלה 40X ידי הגדרת Z-ערימות עם פרוסות 1-1.5 מיקרומטר כל שעה של זיהום.
- הדמיה כמובן זמן ארוך של 2 שעות או יותר, במקום שכבת נמוכה להמיס agarose על גבי הדג בצלחת הדמיה כל 2-3 שעות. הדבר מונע agarose מהתייבשות ומוחצת את הדג בזמן שהוא נמצא צילמו. לקורסים זמן ממושך עם מספר קטן של דגים, להשתמש במה מחוממת (Bioptechs Inc) כדי לשמור על 28 מעלות צלזיוס במהלך זיהומים.
6. נציג תוצאות
דוגמה למוח האחורי מוצלח החדר ג אלביקנס זיהום הזחל דג הזברה לאחר 5 שעות לאחר הפגיעה (HPI) ו 24 HPI מוצג (איור 1). מקרופאג דמויי תאים עם ג אפוף אלביקנס נראים החדר למוח האחורי של HPI 5. עד 24 HPI, C. albicans הוא בתוך התא מקרופאג כמושל ברקמות הזנב הגב מעיד על קנדידה מפושטת. תוצאה זו זיהום תלויה מאוד על זריקה מדויקת של 10-15 שמרים בצורת C. אלביקנס לתוך החדר למוח האחורי. הקרנה של דגים נגוע מיד לאחר ההזרקה אפשר להבטיח זאת.
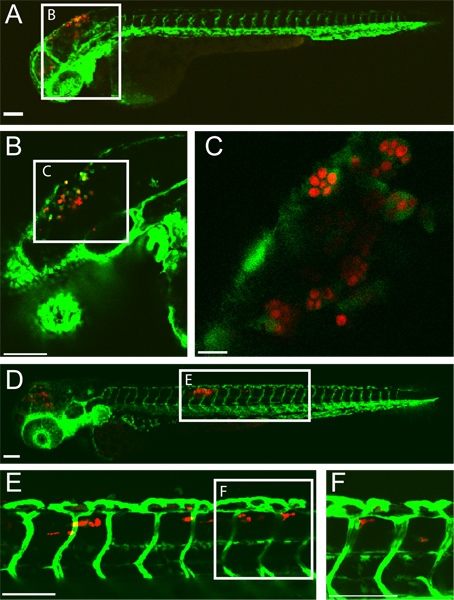
איור 1 מהונדס fli1:. EGFP 22, 33 הזחל נגוע CAF2-yCherry קנדידה אלביקנס וגם צילמו intravitally על ידי מיקרוסקופ confocal. (AC) 5 שעות לאחר הפגיעה () הזחל מאשרום עם EGFP-להביע מקרופאג דמויי תאים באתר של זיהום (למוח האחורי החדר) סרגל קנה מידה = 100 מיקרומטר. (B ו-C) הגדלה תמונות גבוהות יותר של דגים אותו, מראה ג אלביקנס בתוך phagocytes. קנה מידה בר = 100 מיקרומטר עבור B ו -10 מיקרומטר עבור C. (DF) 24 שעות לאחר הפגיעה (ד ') הזחל מאשרום עם קנדידה המופץ עם CAF2-yCherry ג אלביקנס בתוך EGFP Macrophage דמויי תאים ברקמה הזנב הגב. סרגל קנה מידה = 100 מיקרומטר. (E ו-F) תמונות הגדלה גבוהה של דגים אותו, מראה ג אלביקנס ברקמות הזנב. סרגל קנה מידה = 100 מיקרומטר.
Discussion
שיטת microinjection דג הזברה המוצג כאן שונה Gutzman et al. 34 ב שכאן אנחנו מדגימים הזרקת דרך שלפוחית otic לתוך החדר למוח האחורי של הזחלים hpf 36-48. השיטה מאפשרת לנו לתאר להזרקה קבועה של 10-15 שמרים לתוך החדר למוח האחורי עם נזק לרקמות מופחת. פרוטוקול זה מייצר זיהום מקומי בתחיל?...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
המחברים מבקשים להודות במעבדה של ד"ר קרול קים לאימונים microinjection, קלריסה הנרי עצה האצת פיתוח העובר ושימוש בציוד, ונתן לוסון לתרום fli1: דגים EGFP. אנו מודים לחברי המעבדה וילר קירות שון לקריאה ביקורתית של כתב היד. אנו רוצים גם להודות מארק Nilan לטיפול דגים עצות, ריאן Phennicie וקריסטין גאבור עבור ייעוץ טכני על הפרויקט הזה. עבודה זו מומנה על ידי אסיסטנט מחקר MAFES את האחים ק ', האץ' MAFES מענק E08913-08, וכן בפרס NCRR NIH P20RR016463 ר' וילר.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (לא חובה) |
| הרבייה טנקים | בתי גידול מימיים | 2L | |
| 1.7 מ"ל צינורות | Axygen | MCT-175-C | |
| מיידית האוקיינוס | פישר סיינטיפיק | S17957C | |
| מנות נוספות עמוקים פטרי | פישר סיינטיפיק | 08-757-11z | |
| סטנדרט פטרי מנות | VWR מדעי | 25384-302 | |
| העברת בטפי להחדרת נוזלים | פישר סיינטיפיק | 13-711-7M | |
| תמצית שמרים | VWR ScientiFIC | 90000-726 | |
| Peptone | VWR מדעי | 90000-264 | |
| דקסטרוז | פישר סיינטיפיק | D16-1 | |
| אגר | VWR מדעי | 90000-760 | |
| פנויה Hemocytometer | VWR מדעי | 82030-468 | |
| פוספט שנאגרו מלוחים | VWR מדעי | 12001-986 | |
| דומון Dumoxel מלקטת | VWR מדעי | 100501-806 | |
| עץ פינים | VWR מדעי | 10805-018 | |
| KimWipes | VWR מדעי | 300053-964 | |
| נמוכה ממיסיםAgarose | VWR מדעי | 12001-722 | |
| Agarose מנות הזרקה | VWR מדעי | 12002-102 | |
| בראון הלוהט micropipette פולר | סאטר מכשירים | P-97 | |
| מוטות זכוכית חלולים | סאטר מכשירים | BF120-69-10 | על מוטות זכוכית זכוכית חלקה על ידי חימום מעל בונזן מבער |
| פיפטה תיבת אחסון | סאטר מכשירים | BX10 | |
| MPPI-3 הזרקת מערכת | מכשור מדעי יישומי | MPPI-3 | |
| לחץ בגב היחידה | מכשור מדעי יישומי | BPU | |
| Micropipette ערכת מחזיק | Appliאד מכשור מדעי | MPIP | |
| רגל החלף | מכשור מדעי יישומי | FSW | |
| Micromanipulator | מכשור מדעי יישומי | MM33 | |
| בסיס מגנטי | מכשור מדעי יישומי | בסיס מגנטי | |
| Tricaine sulfonate מתאן | המערבי כימיים בע"מ | MS-222 | |
| לנתח את היקף | אולימפוס | SZ61 בסיס העליון SZX-ILLB2-100 | |
| Confocal מיקרוסקופ | אולימפוס | IX-81 עם מערכת FV-1000 סריקת לייזר confocal | |
| TC-7 תרבות רקמות רולר תוף עם גלגל 14 אינץ בדיקה צינור | ניו ברונסוויק מדעי | TC-7 | |
| הדמיה מנות | MatTek Corporation | P24G-1.0-10-F | |
| פיפטה טיפים טוען מחטים | Eppendorf | 930001007 | |
| צלחת רשתות יציקה | מסתגלת מדע כלים | TU-1 | |
| מחוממת שלב | Bioptechs בע"מ | דלתא T-5 | |
| שטוחה מרית | VWR מדעי | 82027-486 | |
| נפות פלסטיק | מרכולתם של Knutsford מחובר | 12 ס"מ | |
| Parafilm | VWR מדעי | 52858-000 | |
| מערבולת Genie | VWR מדעי | 14216-184 | |
| 150 x 16 מ"מ צינורות תרבות | VWR מדעי | 60825-435 | |
| Nanodrop | Thermo Scientific | ND 2000 | |
| פנול אדום | VWR מדעי | 97062-478 | |
| HCl | VWR מדעי | 87003-216 | |
| NaCl | VWR מדעי | BDH4534-500GP | |
| KCl | VWR מדעי | BDH4532-500GP | |
| MgSO 4 | VWR מדעי | BDH0246-500GP | |
| Ca (NO 3) 2 | VWR מדעי | BDH0226-500GP | |
| HEPES | VWR מדעי | BDH4520-500GP | |
| Morpholinos | GeneTools, LLC |
References
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved