Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Nicht-invasive Bildgebung von disseminierter Candidiasis in Zebrafischlarven
In diesem Artikel
Zusammenfassung
Die rasante Entwicklung, geringe Größe und Transparenz der Zebrafisch sind enorme Vorteile für das Studium der angeborenen Immunabwehr Kontrolle der Infektion 4.1. Hier zeigen wir Techniken zur Infektion mit dem Zebrafisch-Larven Pilzpathogen Candida albicans Durch Mikroinjektion, Methodik kürzlich verwendet, um Phagozyten NADPH-Oxidase-Aktivität in Kontrolle von Pilz-Dimorphismus implizieren 5.
Zusammenfassung
Multipel Candidiasis durch das Pathogen Candida albicans ist ein klinisch bedeutendes Problem in Krankenhauspatienten mit einer 30 bis 40% auf Mortalität 6 zugeordnet ist. Systemische Candidiasis wird normalerweise durch angeborene Immunität kontrolliert, und Individuen mit genetischen Defekten in angeborenen Immunsystems Zellbestandteile wie Phagozyten NADPH-Oxidase sind anfälliger für Candidämie 09.07. Sehr wenig ist über die Dynamik von C bekannt albicans Interaktion mit Zellen des angeborenen Immunsystems in vivo. In umfangreichen in-vitro-Studien haben ergeben, dass außerhalb des Wirtes C. albicans keimt innerhalb von Makrophagen, und wird schnell durch Neutrophile 10-14 zerstört. In-vitro-Studien, aber nützlich, kann nicht rekapitulieren die komplexe in vivo-Umgebung, die zeitabhängige Dynamik Cytokinspiegel, extrazelluläre Matrix-Anhänge, Kontakte und interzellulären 10 enthält, 15-18 Die Zebrafischlarve bietet eine einzigartige und vielseitige Wirbeltier-Wirt für das Studium der Infektion. In den ersten 30 Tagen der Entwicklung Zebrafischlarven haben nur angeborene Immunabwehr 2, 19-21, Vereinfachung der Untersuchung von Krankheiten wie der disseminierten Candidiasis, die in hohem Maße von der angeborenen Immunität sind. Die geringe Größe und Transparenz der Zebrafischlarven erlauben Abbildungen von Infektionen Dynamik auf zellulärer Ebene sowohl für Wirt und Pathogen. Transgene Larven mit fluoreszierenden Zellen des angeborenen Immunsystems können bestimmte Zelltypen in 22-24 Infektion beteiligt zu identifizieren. Geändert Antisense-Oligonukleotide (Morpholinos) kann verwendet werden, um knock down verschiedenen Immun-Komponenten wie Phagozyten NADPH-Oxidase und studieren die Veränderungen als Reaktion auf Funga werdenl 5-Infektion. Zusätzlich zu den ethischen und praktischen Vorteile der Verwendung einer kleinen unteren Wirbeltieren, bietet das Zebrafisch-Larven die einzigartige Möglichkeit, das Bild Feldschlacht zwischen Erreger und Wirt sowohl intravital und in Farbe.
Der Zebrafisch hat, um Modell-Infektion wurde für eine Reihe von humanpathogenen Bakterien verwendet, und war maßgeblich an der großen Fortschritte in unserem Verständnis der Mykobakterieninfektion 3, 25. Doch erst in jüngster Zeit viel größer Krankheitserregern wie Pilzen verwendet worden, um Larven infizieren 5, 23, 26, und bis heute hat es nicht eine detaillierte visuelle Beschreibung der Methodik Infektion. Hier präsentieren wir unsere Techniken für Hinterhirn Ventrikel Mikroinjektion von prim 25 Zebrafisch, darunter Modifikationen an unseren früheren Protokollen. Unsere Ergebnisse unter Verwendung der Zebrafisch-Larven-Modell für die Pilzinfektion aus in vitro Studien divergieren und verstärken die Notwendigkeit, die Wirt-Erreger-Intera untersuchenktion in der komplexen Umgebung des Wirtes statt des vereinfachten Systems der Petrischale 5.
Protokoll
Alle Zebrafisch Pflege-Protokolle und Experimente wurden unter Institutional Animal Care und Use Committee (IACUC) Protokoll A2009-11-01 durchgeführt.
1. Morpholino und Larven Injection Dishes
Experimentelle Dauer: * (10-15 Minuten)
Schwierigkeitsgrad: *
- Für Ei-Injektionen, bereiten Sie einen 2% igen Lösung in sterilem Wasser und Mikrowelle. Wenn die Lösung abgekühlt ist schütten einen Teil davon in eine extra tiefe Petrischale (Fisher Scientific), bis er halb voll ist. Cool auf Eis und sicherstellen, dass die Platte waagerecht steht.
- Sobald die Schale abgekühlt ist, gießen Sie einen 15-ml-Deckschicht aus 2% Agarose. Sprühen Sie ein Ei Injektion gerillten Kunststoff-Form (Adaptive Science Tools) mit sterilem Wasser aus einer Sprühflasche. Legen Sie das Werkzeug Nut Seite nach unten in die heiße Agarose. Wenn die Agarose abgekühlt ist, mit einem flachen Spatel aus Metall (VWR Scientific), die Form aus der AGA distanzierenstieg. Entfernen Sie langsam das Gitter aus der Agarose. Wrap Embryo Injektion Gerichte in Parafilm (VWR Scientific) und bei 4 ° C invertiert
- Für Fisch-Larven-Injektionen, bereiten Sie einen 2% igen Lösung, wie beschrieben. Füllen Sie die Lösung in eine Standard-Größe Petrischale (VWR Scientific) und beiseite stellen, bis sie erstarrt. Wrap Larven Injektion Gerichte in Parafilm und lagern bei 4 ° C invertiert
2. Pilzkultur Vorbereitung
Versuchsdauer: ** (30 Minuten)
Schwierigkeitsgrad: **
- Planen Hefeextrakt-Pepton-Dextrose (YPD)-Agarplatten: 10 g / l Hefeextrakt, 20 g / l Pepton, 20 g / l Dextrose und 20 g / l Agar in und Autoklaven. Für YPD-Flüssigkeit herzustellen 10 g / l Hefeextrakt, 20 g / l Pepton, 20 g / l Dextrose und Autoklav 20-30 Minuten bei 121 ° C
- Zwei Tage vor dem Fisch-Infektionen bereiten einen Streifen Platte aus gefrorenemAktien von Candida albicans Kulturen auf YPD-Agar, um einzelne Kolonien zu erhalten.
- Bei 37 ° C über Nacht.
- Setzen Sie 5 ml YPD-Brühe in 16 x 150 mm Kulturröhrchen (VWR Scientific).
- Am Tag vor der Fisch-Infektionen holen 1 kleine Kolonie an der YPD-Agar mit einem hölzernen Dübel (VWR Scientific). Setzen Sie den Stick in die Röhre Kultur und wirbeln um zu resuspendieren Kolonie in der YPD-Flüssigkeit.
- Wachsen bei 37 ° C über Nacht auf einem TC-7 Tissue Culture Bandage mit einem 14-Zoll-Rad Reagenzglas (New Brunswick Scientific) ausgestattet.
- Am nächsten Tag, der Spin-Down 1 ml Kultur bei 14000x g für 1 Minute in einem 1,7 ml Röhrchen (Axygen). Entfernen Sie den Überstand und das Pellet in Restflüssigkeit durch Vortexen (VWR Scientific).
- 1 mL 1x Phosphat-gepufferte Kochsalzlösung (VWR Scientific) und Spin wie zuvor beschrieben.
- Wiederholen Sie den PBS 3 x waschen.
- Verdünnung 1:100 Verdünnung in 1x PBS (10 ul gewaschene C. albicans in 990 ul 1x PBS).
- Rechnen Sie mit einer Zählkammer (VWR Scientific).
- Verdünnen auf 10 7 Zellen / ml.
3. Zebrafisch-Infektionen
Experimentelle Dauer: **** (1-3 Stunden)
Schwierigkeitsgrad: ****
- Sammle Embryonen gemäß § 5 und lagern in Ei-Wasser, 60 mg / L Instant Ocean Salze (Fisher Scientific) in sterilem, deionisiertem Wasser.
- Mit einem Binokular wie dem Olympus SZ61 (Olympus), dechorionate Embryonen auf Infektion Tag. Verwenden Sie Dumont Dumoxel Pinzette (VWR Scientific), um das Chorion 27 auseinander ziehen wie das Öffnen einer Tüte Chips oder sanft stoßen die Pinzette in der geschlossenen Position in die Chorion und dann langsam öffnen. Die Fische sollten Recht herausspringen des Chorion.
- Swirl das extra tiefe Petrischale mit dem Deckel auf, um Fische in der Mitte der Schale zu bewegen. Übertragen Fische mit dem Deckel der Schale. Entfernen Sie Ei-Wasser-undersetzen Sie sie durch frische Medien. Fisch hinzufügen, um Medien.
- Warme Gerichte Larven Injektion in einem Brutschrank bei 28 ° C. Bereiten Tricain Methansulfonat (Western Chemical Inc.) Verdünnung bei 200 ug / ml für Fische betäuben.
- Zählen Sie die gewünschte Anzahl von Larven für Infektionsforschung (20-50 Fische). Setzen Sie Fisch in Tricain Methansulfonat Lösung und warten Sie 1-2 Minuten, bis sie zum Stillstand kommen.
- Schalten Sie den MPPI-3 Einspritzeinheit (Applied Scientific Instruments). Sicherstellen, dass der Druckschalter ist auf "Impuls" und die "Pulsdauer" ist mit 3 bis 9 für die PSI-Gegendruck-Einheit eingestellt. Öffnen Sie das Ventil auf die Stickstoff-Tank, bis der Druck auf die Spritzeinheit 30 PSI liest.
- Legen Sie eine gezogen Mikropipette 28 mit 5 ul gevortexten Candida albicans bei einer Konzentration von 1x10 7 Zellen / ml. Legen Sie die Mikropipette in der Mikropipette Halter (Applied Scientific Instruments). Füllen Sie eine leere extra tiefe Petrischale mit Wasser. Bewegen Sie die Mikropipette, bis die Spitze is in Sichtweite nur die Berührung der Oberfläche des Wassers über Seziermikroskop und Nutzung Dumont Dumoxel Pinzette (VWR Scientific), um die Nadel etwa 3 mm von der Spitze der Pipette gezogen Clip.
- Drücken Sie den Fußschalter (Applied Scientific Instruments) zu überprüfen, die Nadel wurde abgeschnitten. Sie sollten sehen, die Flüssigkeit zu dispergieren, wenn Sie erfolgreich waren. Der Durchmesser des flüssigen Bolus sollte nicht größer als der Durchmesser der Pupille des Prims 25 Zebrafischlarve (0,21 mm, was eine Kugel von 4,9 nL in Volumen). Passen Sie den Druck entsprechend, wenn die Flüssigkeit Bolus zu groß oder zu klein ist.
- Betäuben die Fische in Tricain Methansulfonat (200 pg / ml). Sobald die Fische haben aufgehört sich zu bewegen, schwenken Sie die Schale mit dem Deckel auf, bis die Fische sind in der Mitte. Sammle 50 Fische mit einer Transferpipette (Fisher Scientific). Tippen Sie auf die Seite der Pipette, um die Fische gegen die Spitze zu begleichen. Vorsichtig pipettieren Fisch auf die Larven-Agarose Schüssel mit so wenig Flüssigkeit wie möglich.
- Line-up den Fisch mit einer glatten Glasstab (darauf achten, nicht zu zerdrücken!). Saugen Sie so viel Flüssigkeit wie möglich aus der Schale. Verwenden Sie einen Kimwipe Docht entfernt, um keine Feuchtigkeit.
- Positionieren Sie den Larven Agarose Gericht mit Fisch unter dem Mikroskop, bis Sie eine gute Sicht auf die Fische und die Nadel zur gleichen Zeit zu bekommen. Bewegen Sie das Glas Nadel gegen den Fisch. Vergrößern Sie sowohl den Fischen und Nadel, wie Sie die Nadel gegen die Fische zu positionieren. Bringen Sie den Glas-Nadel in das Ohr Vesikel 27, 29 (Ohr) des ersten Fisch. Du wirst wissen, wenn Sie die Nadel in die Fische sind umgezogen, weil, wenn Sie den Fußschalter (Applied Scientific Instruments) zu drücken, das Hinterhirn Ventrikel hebe leicht.
- Drücken Sie den Fußschalter (Applied Scientific Instruments) und beobachten Sie die Flüssigkeit im Inneren des Fisches Hinterhirn Ventrikel 27 zu verteilen. Ziehen Sie die Nadel aus der Fisch-und Umzug in den nächsten Fisch. Wiederholen Sie den Vorgang, bis Sie alle Fische auf dem Teller haben, injiziert. Entfernen Sie alle dEAD Fisch und injizieren Ersatz zu halten, die Zahl richtig (50 Fische). Für jede Gruppe von 50 Fischen injiziert eine neue Mikroinjektionsnadel vorbereitet werden müssen, oder die C albicans lässt sich in der Unterseite der Nadel und verstopft, oder wirft die Konzentration injiziert.
- Waschen Sie den Fisch aus der Schale, durch Verdrehen der Schale und Ei-Spritzen Wasser auf die Fische in ein sauberes extra tiefe Petrischale mit 60 ml Wasser-Ei. Es ist wichtig, nicht um die Fische auf dem Agarose länger als 15-20 Minuten zu verlassen, oder sie werden austrocknen und sterben.
- Wiederholen Sie die gesamte Einspritzvorgang bis zum Ende. Vergessen Sie nicht, PBS und nicht-pathogene injiziert Kontrollen.
- Wenn Sie fertig sind, halten die Fische bei 28 ° C
- Schließen Sie das Ventil Stickstofftank. Bewegen Sie die Spritzeinheit Schalter von "Puls" bis "stetig", um den Druck in der Tankleitung zu entlasten, sollte der Druck auf Null an dieser Stelle fallen zu lassen. Schalten Spritzeinheit zurück zu "Puls". Schalten Sie die Spritzeinheit und säubern Sie den Arbeitsbereich.
4. Vorbereiten der Fische für Imaging
Versuchsdauer: ** (30 Minuten)
Schwierigkeitsgrad: **
- Bereiten Tricain Methansulfonat Lösung wie vorher (200 pg / ml). Raus aus infizierten Fischen, und überführen sie in Tricain.
- Bereiten 47,9 ml 0,4% low-melt Agarose (VWR Scientific) in Ei-Wasser. Erhitzen Sie die Lösung durch die Mikrowelle. Abkühlen auf 37 ° C und Add Tricain Methansulfonat (200 pg / ml) zur Mischung
- Sobald Fische werden in Tricain Methansulfonat, Pipette einzelnen Fische in eine Petrischale (VWR Scientific) mit 0,4% niedrig schmelzende Agarose (VWR Scientific) immobilisiert.
- Anschließend bewegen Sie den Fisch aus niedrig schmelzenden Agarose in einzelne Vertiefungen einer Glasboden-Spiegel (MatTek Corporation) für die Bildgebung. Verwenden Sie so wenig niedrig schmelzende Agarose wie möglich, damit der Fisch liegt flach auf dem Boden der Schale. Verwenden Sie nur genug von der Tricain-Agarose zu füllen in derner Kreise der Glasboden Gericht.
5. Änderungen im Bereich der Protokolle Jupiter
Mikropipetten für die Mikroinjektion
Experimentelle Dauer: * (10-15 Minuten)
Schwierigkeitsgrad: *
- Ziehen hohlen Glasstäbe BF120-69-10 (Sutter Instruments) mit einem Flaming Brown Feinpipettenziehvorrichtung Modell P-97 (Sutter Instruments) nach Yuan et al. 30. Wählen Sie Programm Nr. 7 mit der folgenden Bedingungen Hitze = 470, Velocity = 120, Time = 200. Das resultierende Nadel 8 mm von der Spitze und dem Kegel, einmal in 3 mm über die Spitze hat einen Durchmesser von etwa 10 um abgeschnitten.
- Legen Sie eine Glasmikropipette in die Halterungen. Wählen Sie "Ziehen". Der Heizfaden die Nadel nach den Programm-Parameter und der Glasstab wird in zwei gezogen Mikropipetten trennen zu erwärmen. Shop Mikropipetten in einer Pipette Aufbewahrungsbox (SuttER Instrumente).
Embryo-Entnahme-, Morpholino-Injektion und Wartung
Experimentelle Dauer: *** (1-2 Stunden)
Schwierigkeitsgrad: ***
- Sammeln Embryonen gemäß den Verfahren von Rosen et al. 31. Verwenden Sie einen Kunststoff-Sieb (Wares von Knutsford), um Eier aus dem Laich-Tank (aquatische Habitate) zu sammeln. Halten Sie das Sieb auf den Kopf über eine extra tiefe Petrischale und spülen mit Wasser Tank, um Eier zu sammeln.
- Für Morpholino Vorbereitung, fügen Sie 300 ul sterilem Wasser auf 300 Nanomol Morpholino (GeneTools, LLC). Daraus ergibt sich eine Arbeitsgruppe Bestand von 1,0 mm.
- Überprüfen der Konzentration des Morpholino unter Verwendung eines Nanodrop (Thermo Scientific). Wählen Sie "Nukleinsäure und ändern Sie den Typ auf Probe" Anderen "und Wellenlänge auf 265. Geben Sie die Konstante durch Multiplikation des Molekulargewicht des Morpholino durch 1000 dividiert durch die absorptivity-Koeffizienten in der Morpholino-Oligo Karteikarte notiert.
- Blank die NanoDrop mit 2 ul 0,1 N HCl. Verdünnen Sie 5 ul der Morpholino-Lösung in 95 ul 0,1 N HCl (20x Verdünnung). Setzen Sie 2 ul der Verdünnung auf dem Podest, und klicken Sie NanoDrop Maßnahme. Multiplizieren Sie die Konzentration mit dem Verdünnungsfaktor (20). Man erhält eine Arbeitskonzentration von Morpholino ist. Um die millimolaren Konzentration zu berechnen unterteilen die Konzentration durch das Molekulargewicht der Morpholino erhalten.
- Bereiten Sie eine Bilanz der Arbeit in Danieau Morpholino-Puffer (58 mM NaCl, 0,7 mM KCl, 0,4 mM MgSO 4, 0,6 mM Ca (NO 3) 2, 5,0 mM HEPES, pH 7,6) und 0,01% Phenolrot (VWR Scientific).
- Für Morpholino Injektion Arbeiten folgen dem Protokoll nach Rosen et al. Und 31 Yuan et al. 30. Spülen Sie Morpholino Injektion Gerichte mit Ei-Wasser und warm bei 28 ° C für 15 Minuten. Entfernen von Wasser aus Injektion Gerichte und ein Line-Up-cell Embryonen in die Nuten der Injektion Schüssel (hergestellt aus Abschnitt 1) mit einer Pipette. Jede Platte wird ein Fassungsvermögen von ungefähr 250 Eier. Inject 1-2 Zell-Stadium Embryonen mit Morpholino. Eier werden in der Ein-Zellen-Stadium für 15 Minuten 27 verbleiben.
- Spülen Sie injizierten Eier mit Ei-Wasser, wenn Sie fertig (sterilem, deionisiertem Wasser mit 60 mg / L Instant Ocean Salze) werden in 60 ml Ei-Wasser in extra tiefe Petrischalen. Morpholino Injektion Speisen wiederverwendet werden kann. Spülen Sie mit Ei-Wasser, wenn Sie fertig und bei 4 ° C lagern invertiert
- Für die Lagerung von Embryonen mit 60 ml Wasser, um Ei-Schale. Zählen Sie 110 Embryonen mit einer Transferpipette in separaten extra tiefe Petrischalen mit 60 ml Wasser-Ei. In 0,00003% Methylenblau um das mikrobielle Wachstum und inkubieren Embryonen bei 28 ° C verhindern
- Zur Beschleunigung der Entwicklung von Embryonen zu halten Embryo Geschirr bei 33 ° C für 24 Stunden und Bühne nach Kimmel et al. 27, so dass Embryonen zu einem Kopf entwickelnStamm Winkel von 75 ° (25 Prim Stadium 27).
- Für Larven-Infektion Arbeit zu halten Embryonen bei 28 ° C nach der Injektion mit C. albicans.
- Jeder Tag ersetzen Embryo Gerichte mit 60 ml frisches Ei-Wasser.
Imaging
Experimentelle Dauer: ***** (1-5 Stunden)
Schwierigkeitsgrad: ***
- Bereiten Sie Fisch in niedrig schmelzende Agarose (gemäß Abschnitt 4.2) mit Tricain im Glasboden Imaging-Gerichte (MatTek Corporation) wie oben beschrieben. Anschließend wird die Schale auf einem Olympus IX-81 (Olympus) inverse Mikroskop Bühne. Bringen Sie den Fisch in den Fokus unter 4x Vergrößerung unter Differential Interferenz Kontrast (DIC) Licht. Bilder können mit 4x, 20x erfasst werden, und 40-facher Vergrößerung an der DIC, TRITC (Tetramethylrhodamin-Isothiocyanat) und FITC (Fluoresceinisothiocyanat) Filter-Einstellungen.
- Verwenden Sie eine Olympus IX-81 mit einem inversen Mikroskop FV-1000 Laser-Scanning-konfokalen System nach Ariga et al. 32. Führen Sie Zeit-Verläufe bei 40-facher Vergrößerung, indem Sie Z-Stapel mit 1 bis 1,5 mu m Scheiben jede Stunde der Infektion.
- Für lange Zeit natürlich Bildgebung von 2 Stunden oder mehr, legen Sie eine Schicht von niedrig schmelzenden Agarose auf der Oberseite des Fisches in der Imaging-Schüssel alle 2-3 Stunden. Dies verhindert die Agarose vor dem Austrocknen und Zerkleinern der Fisch während es abgebildet wird. Für längere Zeit Kurse mit einer kleinen Anzahl von Fischen, verwenden Sie ein beheiztes Stufe (Bioptechs Inc.) bis 28 ° C während der Infektionen zu halten.
6. Repräsentative Ergebnisse
Ein Beispiel für eine erfolgreiche Rautenhirn Ventrikels C albicans-Infektion in einem Zebrafischlarve bei 5 Stunden nach der Infektion (hpi) und 24 hpi ist in (1). Makrophagen-artigen Zellen, die mit C verschlungen albicans im Rautenhirn Ventrikel bei 5 hpi gesehen. Bis zum 24. HPI, C. albicans ist in Makrophagen-artigen Zelles in der dorsalen Schwanz Gewebe indikativen von disseminierten Candidiasis. Diese Infektion Ergebnis ist stark abhängig von einer genauen Injektion von 10-15 Hefe-Form C. albicans in das Hinterhirn Ventrikels. Screening der infizierten Fische sofort nach der Injektion kann dies sicherstellen.
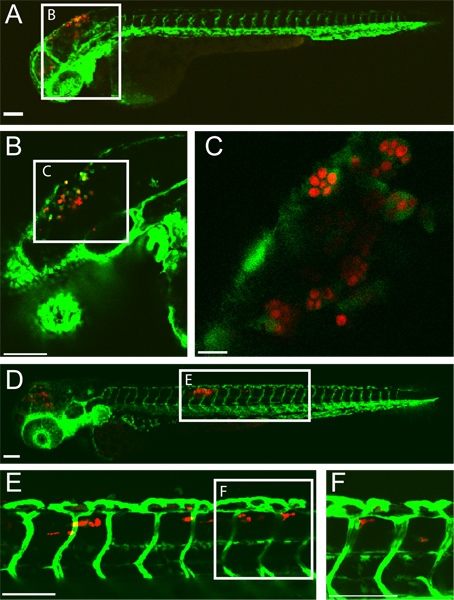
Abbildung 1 Transgene FLI1:. EGFP 22, 33 Larve mit CaF2-yCherry Candida albicans und abgebildet intravital durch konfokale Mikroskopie infiziert. (AC) 5 Stunden nach der Infektion (A) Infizierte Larve mit EGFP-exprimierenden Makrophagen-ähnlichen Zellen am Ort der Infektion (Hinterhirn Ventrikel) Maßstab = 100 um. (B und C) Stärker vergrößerte Bilder der gleiche Fisch, zeigt C. albicans innerhalb von Fresszellen. Maßstab = 100 mu m für B und 10 um für C (DF) 24 Stunden nach der Infektion (D) Infizierte Larve mit disseminierter Candidiasis mit CaF2-yCherry C. albicans innerhalb EGFP Macrophage-Zellen, die in der dorsalen Schwanz Gewebe. Maßstab = 100 um. (E und F) Stärker vergrößerte Bilder der gleiche Fisch, zeigt C. albicans im Gewebe Schwanz. Maßstab = 100 um.
Diskussion
Der Zebrafisch Mikroinjektion hier vorgestellte Verfahren unterscheidet sich von Gutzman et al. 34 in diesem Hier zeigen wir Injektion durch die Ohr-Vesikel in die Herzkammer Rautenhirn von 36 bis 48 hpf Larven. Die Methode, die wir beschreiben, erlaubt das gleichmäßige Injektion von 10-15 Hefe in die Ventrikel mit eingeschränkter Hinterhirn Gewebeschädigung. Dieses Protokoll erzeugt eine zunächst lokale Infektion, die im ganzen Körper ausbreitet um 24 hpi (Abbildung 1) und fü...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren möchten dem Labor von Dr. Carol Kim für die Mikroinjektion Ausbildung, Clarissa Henry um Rat danken über die Beschleunigung Embryo-Entwicklung und Nutzung von Geräten, und Nathan Lawson für den Beitrag FLI1: EGFP Fisch. Wir danken Mitglieder der Wheeler-Labor und Shawn Wände für die kritische Durchsicht des Manuskripts. Wir möchten auch Mark Nilan für Fische Betreuung und Beratung, und Ryan Phennicie und Kristin Gabor für technische Beratung bezüglich dieses Projektes bedanken. Diese Arbeit wurde von einem MAFES Forschung Assistenzzeit an K. Brothers, ein MAFES Hatch Zuschuss E08913-08, und ein NIH NCRR Auszeichnung P20RR016463 zu R. Wheeler finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Laichbehältern | Aquatischer Lebensräume | 2L | |
| 1,7 ml Röhrchen | Axygen | MCT-175-C | |
| Instant Ocean | Fisher Scientific | S17957C | |
| Extra tiefe Petrischalen | Fisher Scientific | 08 bis 757-11Z | |
| Standard-Petrischalen | VWR Scientific | 25384-302 | |
| Transferpipetten | Fisher Scientific | 13 bis 711-7M | |
| Hefeextrakt | VWR wissenschaftlichFIC | 90000-726 | |
| Pepton | VWR Scientific | 90000-264 | |
| Traubenzucker | Fisher Scientific | D16-1 | |
| Agar | VWR Scientific | 90000-760 | |
| Einweg Hämocytometer | VWR Scientific | 82030-468 | |
| Phosphate Buffered Saline | VWR Scientific | 12001-986 | |
| Dumont Pinzetten Dumoxel | VWR Scientific | 100501-806 | |
| Holzdübel | VWR Scientific | 10805-018 | |
| Kimwipes | VWR Scientific | 300053-964 | |
| Low MeltAgarose | VWR Scientific | 12001-722 | |
| Agarose zur Injektion Gerichte | VWR Scientific | 12002-102 | |
| Flaming Brown Feinpipettenziehvorrichtung | Sutter Instruments | P-97 | |
| Hohle Glasstäbe | Sutter Instruments | BF120-69-10 | Für Glasstäbe glatten Glas durch Erhitzen über Bunsenbrenner |
| Pipette Aufbewahrungsbox | Sutter Instruments | BX10 | |
| MPPI-3 Einspritzsystem | Applied Scientific Instrumentation | MPPI-3 | |
| Back-Pressure-Einheit | Applied Scientific Instrumentation | BPU | |
| Mikropipette Holder Kit | Applied Scientific Instrumentation | MPIP | |
| Foot Switch | Applied Scientific Instrumentation | FSW | |
| Mikromanipulator | Applied Scientific Instrumentation | MM33 | |
| Magnetfuß | Applied Scientific Instrumentation | Magnetfuß | |
| Tricaine Methansulfonat | Westlichen Chemical Inc. | MS-222 | |
| Binokular | Olymp | SZ61 oben SZX-ILLB2-100 Basis | |
| Konfokalmikroskop | Olymp | IX-81 mit FV-1000 Laser-Scanning-konfokalen System | |
| TC-7 Tissue Culture Roller Trommel mit 14-Zoll-Rad Reagenzglas | New Brunswick Scientific | TC-7 | |
| Imaging Dishes | MatTek GmbH | P24G-1.0-10-F | |
| Pipettenspitzen zum Be-Nadeln | Eppendorf | 930001007 | |
| Teller gießen Gitter | Adaptive Science Tools | TU-1 | |
| Heiztisch | Bioptechs Inc. | Delta-T-5 | |
| Flachen Spatel | VWR Scientific | 82027-486 | |
| Kunststoffsieben | Wares von Knutsford Online | 12 cm | |
| Parafilm | VWR Scientific | 52858-000 | |
| Vortex Genie | VWR Scientific | 14216-184 | |
| 16 x 150 mm Kulturröhrchen | VWR Scientific | 60825-435 | |
| NanoDrop | Thermo Scientific | ND 2000 | |
| Phenolrot | VWR Scientific | 97062-478 | |
| HCl | VWR Scientific | 87003-216 | |
| NaCl | VWR Scientific | BDH4534-500GP | |
| KCl | VWR Scientific | BDH4532-500GP | |
| MgSO 4 | VWR Scientific | BDH0246-500GP | |
| Ca (NO 3) 2 | VWR Scientific | BDH0226-500GP | |
| HEPES | VWR Scientific | BDH4520-500GP | |
| Morpholinos | GeneTools, LLC |
Referenzen
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten