Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Неинвазивная визуализация диссеминированный кандидоз в Личинки данио рерио
В этой статье
Резюме
Бурное развитие, малый размер и прозрачность данио огромные преимущества для изучения иммунной контроль инфекции 1-4. Здесь мы покажем методы заражения личинки данио использованием возбудителей грибковых Candida Albicans По микроинъекции, методология недавно использовали, чтобы обвинить фагоцитарную активность NADPH оксидазы в управлении грибковых диморфизм 5.
Аннотация
Disseminated candidiasis caused by the pathogen Candida albicans is a clinically important problem in hospitalized individuals and is associated with a 30 to 40% attributable mortality6. Systemic candidiasis is normally controlled by innate immunity, and individuals with genetic defects in innate immune cell components such as phagocyte NADPH oxidase are more susceptible to candidemia7-9. Very little is known about the dynamics of C. albicans interaction with innate immune cells in vivo. Extensive in vitro studies have established that outside of the host C. albicans germinates inside of macrophages, and is quickly destroyed by neutrophils10-14. In vitro studies, though useful, cannot recapitulate the complex in vivo environment, which includes time-dependent dynamics of cytokine levels, extracellular matrix attachments, and intercellular contacts10, 15-18. To probe the contribution of these factors in host-pathogen interaction, it is critical to find a model organism to visualize these aspects of infection non-invasively in a live intact host.
The zebrafish larva offers a unique and versatile vertebrate host for the study of infection. For the first 30 days of development zebrafish larvae have only innate immune defenses2, 19-21, simplifying the study of diseases such as disseminated candidiasis that are highly dependent on innate immunity. The small size and transparency of zebrafish larvae enable imaging of infection dynamics at the cellular level for both host and pathogen. Transgenic larvae with fluorescing innate immune cells can be used to identify specific cells types involved in infection22-24. Modified anti-sense oligonucleotides (Morpholinos) can be used to knock down various immune components such as phagocyte NADPH oxidase and study the changes in response to fungal infection5. In addition to the ethical and practical advantages of using a small lower vertebrate, the zebrafish larvae offers the unique possibility to image the pitched battle between pathogen and host both intravitally and in color.
The zebrafish has been used to model infection for a number of human pathogenic bacteria, and has been instrumental in major advances in our understanding of mycobacterial infection3, 25. However, only recently have much larger pathogens such as fungi been used to infect larva5, 23, 26, and to date there has not been a detailed visual description of the infection methodology. Here we present our techniques for hindbrain ventricle microinjection of prim25 zebrafish, including our modifications to previous protocols. Our findings using the larval zebrafish model for fungal infection diverge from in vitro studies and reinforce the need to examine the host-pathogen interaction in the complex environment of the host rather than the simplified system of the Petri dish5.
протокол
Все данио протоколы ухода и эксперименты проводились в условиях институционального ухода и использования животных комитета (IACUC) протокол A2009-11-01.
1. Морфолино и личинок посуды инъекций
Экспериментальные продолжительность: * (10-15 минут)
Степень сложности: *
- Для инъекций яйца, готовят 2% агарозном решение в стерильной водой и микроволновая печь. Когда раствор остынет налить его в дополнительные глубокие чашки Петри (Fisher Scientific), пока он наполовину полон. Прохладный на лед и убедитесь, что пластины уровне.
- Когда блюдо остынет, залить 15 мл верхнего слоя 2% агарозы. Спрей яйцо инъекции канавками для литья пластмасс (адаптивная науки Tools) стерильной водой из пульверизатора. Аккуратно положите форму паз вниз в горячую агарозы. Когда агарозном остынет, используйте плоский металлический шпатель (VWR Scientific) отделить форму от агарозу. Медленно снимите сетку из агарозы. Перенос эмбрионов инъекции блюда в парафильмом (VWR Scientific) и перевернутый магазин при 4 ° C.
- Для инъекций рыб личиночные, готовят 2% агарозном решение, как описано. Залейте раствор в стандартный размер чашки Петри (VWR Scientific) и отложите в сторону, пока он не затвердеет. Wrap личиночной блюда инъекций в парафильмом и хранить перевернутой при 4 ° C.
2. Грибковые Подготовка культуры
Экспериментальные продолжительность: ** (30 минут)
Степень сложности: **
- Подготовить дрожжевой экстракт, пептон-декстроза (YPD) агаром: 10 г / л дрожжевого экстракта, 20 г / л пептона, 20 г / л, глюкоза, 20 г / л агара и в автоклаве. Для подготовки YPD жидкости 10 г / л дрожжевого экстракта, 20 г / л пептона, 20 г / л, глюкоза и автоклава 20-30 минут при температуре 121 ° C.
- За два дня до рыбы инфекции подготовить серию пластин из замороженногозапасы Candida Albicans культур на YPD агар для получения отдельных колоний.
- Инкубировать при температуре 37 ° С в течение ночи.
- Положите 5 мл бульона YPD в 16 х 150 мм культуры труб (VWR Scientific).
- За день до рыбы инфекции выбрать 1 небольшой колонии на агаре с YPD деревянные дюбеля (VWR Scientific). Вставьте карту в трубку культуры и вертеться вокруг повторно приостанавливать колонии в YPD жидкости.
- Расти в течение ночи при 37 ° C на ТС-7 тканей барабан культуры роликовые оснащен 14-дюймовым пробирке колеса (New Brunswick Scientific).
- На следующий день, замедления вращения 1 мл культуры в г 14000x в течение 1 минуты в 1,7 мл трубки (Axygen). Удалить супернатант и осадок ресуспендируют в остаточной жидкости встряхивая (VWR Scientific).
- Добавить 1 мл 1x фосфатного буфера (VWR Scientific) и спина, как описано выше.
- Повторите мытье PBS 3 раза.
- Развести в разведении 1:100 1x PBS (10 мкл промытый C. Albicans в 990 мкл 1x PБС).
- Рассчитывать на гемоцитометра (VWR Scientific).
- Развести в 10 7 клеток / мл.
3. Данио рерио инфекции
Экспериментальные продолжительность: **** (1-3 часов)
Степень сложности: ****
- Сбор эмбрионов в соответствии с разделом 5 и магазин в яйцо воды, 60 мг / л солей мгновение океан (Fisher Scientific) в стерильной дистиллированной водой.
- Используя микроскоп рассечения, таких как Olympus SZ61 (Olympus), dechorionate эмбрионов на инфекцию день. Используйте пинцет Dumoxel Дюмон (VWR Scientific) тянуть хориона 27, кроме как открыть пакетик чипсов или слегка ткнуть пинцетом в закрытом положении в хориона, а затем медленно откройте их. Рыба должна появиться прямо из хориона.
- Swirl дополнительные глубокие чашки Петри с крышкой, чтобы переместить рыбу в центр блюда. Передача рыб крышку блюдо. Удалите яйца и водызаменить свежей информации. Добавить рыбу СМИ.
- Теплые блюда личиночной инъекции в термостате при 28 ° C. Подготовить tricaine метан сульфонат (Западная Химическая Inc) в разведении 200 мкг / мл для обезболивающего рыбу.
- Отсчитывать нужное количество личинок-инфекции (20-50 рыб). Положите рыбу в tricaine решение сульфонат метана и подождать 1-2 минуты, пока они не перестают двигаться.
- Включите ИПМТ-3 узла впрыска (прикладных научных приборов). Убедитесь, что реле давления на "импульс" и "длительность" установлен до 9 с 3 PSI для противодавление устройства. Откройте клапан бака азота до давления впрыска читает 30 PSI.
- Загрузка вытащил микропипетки 28 с 5 мкл встряхивали Candida Albicans в концентрации 1х10 7 клеток / мл. Поместите микропипетки в держатель пипетки (прикладных научных приборов). Заполнить пустые дополнительные глубокие чашки Петри с водой. Перемещение микропипетки до кончика яс в поле зрения лишь касаясь поверхности воды с помощью рассечения микроскоп и использование Дюмон Dumoxel пинцет (VWR Scientific), чтобы обрезать иглы около 3 мм от кончика пипетки вытащил.
- Нажмите на педаль (прикладных научных инструментов), чтобы убедиться иглы был обрезан. Вы должны увидеть жидкой дисперсной если бы вы были успешными. Диаметр жидкости болюсно должна быть не больше, чем диаметр зрачка чопорной 25 данио личинка (0,21 мм, что дает сфера 4,9 нл по объему). Отрегулируйте давление соответственно, если жидкости болюсно является слишком большим или слишком маленьким.
- Обезболить рыбу в сульфонат метана tricaine (200 мкг / мл). Как только рыба остановилась, вихревые блюдо с крышкой, пока рыба в центре. Соберите 50 рыб с помощью передачи пипетки (Fisher Scientific). Нажмите на стороне пипеткой по урегулированию рыбы к концу. Осторожно пипетировать рыбу на блюдо личиночной агарозы, используя в качестве немного жидкости, как это возможно.
- Линия рыбу с гладкой стеклянной палочкой (будьте осторожны, чтобы не раздавить их!). Аспирируйте столько жидкости, возможно от этого блюда. Используйте KimWipe на фитиль от влаги.
- Установите личиночной блюдо с рыбой агарозном под микроскопом, пока не получите хороший вид рыбы и иглы в то же время. Перемещение стекла иглы к рыбе. Увеличить как на рыбу и иглы, как вы установите иглу к рыбе. Тщательно перемещать иглу в стекло слухового пузырька 27, 29 (ухо) первой рыбы. Вы будете знать только вы переехали иглу в рыбе, потому что когда вы нажимаете на педаль (прикладных научных приборов), задний мозг желудочка поднимет немного.
- Нажмите на педаль (прикладных научных приборов) и смотреть жидкой дисперсной внутри задний мозг рыбы желудочка 27. Уберите иглу из рыбы и перейти к следующей рыбы. Повторяйте процедуру, пока не вводится вся рыба на тарелке. Удалите гРыба EAD и ввести замену, чтобы число правильных (50 рыб). Для каждой группы из 50 рыб вводят новую иглу микроинъекции должны быть готовы, или C. Albicans располагается в нижней части иглы и забивает он, или сбрасывает концентрации инъекции.
- Промыть рыбу от этого блюда на рыбалку блюдо и опрыскивания яиц воды на рыбу в чистой дополнительные глубокие чашки Петри, содержащие 60 мл яйцо воды. Важно не оставлять рыбу на агарозном более чем на 15-20 минут, иначе они высыхают и умирают.
- Повторите весь процесс инъекции пока не закончено. Не забывайте, PBS и непатогенных вводят контроль.
- Когда закончите, держать рыбу на 28 ° C.
- Закройте клапан азота танка. Переместите переключатель впрыска с "импульс" на "непрерывный", чтобы уменьшить давление в баке линии, давление должно снизиться до нуля в этой точке. Включите впрыска к «Пульс». Выключите впрыска и очистки рабочей зоны.
- Подготовить tricaine метан сульфонат решение как и раньше (200 мкг / мл). Убирайся зараженную рыбу, и передавать их в tricaine.
- Подготовить 47,9 мл 0,4% легкоплавкой агарозы (VWR научных) в яйце воды. Нагрейте раствор микроволновой печи. Остудить до 37 ° С и добавить tricaine метан сульфонат (200 мкг / мл) в смеси
- Как только рыба закреплены tricaine метан сульфонат, пипетки особи в чашку Петри (VWR научные), содержащий 0,4% низкой температурой плавления агарозы (VWR Scientific).
- Затем переместить рыбу из низкой температурой плавления агарозы в отдельных скважинах блюдо со стеклянным дном (Маттек Corporation) для работы с изображениями. Используйте как можно меньше низкой температурой плавления агарозы как возможно, чтобы рыба лежит плоско на дне тарелки. Используйте только достаточно tricaine-агарозы, чтобы заполнить впартнера кругах блюдо со стеклянным дном.
- Потяните полые стержни стекло BF120-69-10 (Sutter Instruments) с помощью пипетки Горячие Браун Puller Модель P-97 (Sutter Instruments) в соответствии с Юань и соавт. 30. Выберите программу № 7 со следующими условиями тепло = 470, скорость = 120, Время = 200. В результате иглы 8 мм с коническими к кончику и, когда обрезается на 3 мм выше кончика он имеет диаметр около 10 мкм.
- Загрузка стекла микропипетки в скобках. Выберите "Pull". Отопления нить будет нагреваться иглу в соответствии с программой параметров и стеклянной палочкой будет разделиться на две вытащил микропипетки. Магазин микропипетки в окне пипетки хранения (Suttэ инструментов).
- Сбор эмбрионов в соответствии с методами Розен и др.. 31. Использование пластиковых сито (Изделия Knutsford) собирать яйца из нерестовых бак (водной среды). Держа решето с ног на голову в течение дополнительных глубоких чашках Петри и промыть бак воды для сбора яиц.
- Для приготовления морфолино, добавьте 300 мкл стерильной воды до 300 нмоль из морфолино (GeneTools, LLC). Это дает рабочие запасы 1,0 мм.
- Проверьте концентрацию морфолино с помощью Nanodrop (Thermo Scientific). Выберите "нуклеиновой кислоты и изменить образец типа« другие »и длина волны до 265. Введите постоянного умножения молекулярный вес морфолино в 1000 разделен на absorptivitкоэффициент у, перечисленные в окне свойств морфолино олиго.
- Пустые nanodrop с 2 мкл 0,1 N HCl. Развести 5 мкл раствора морфолино на 95 мкл 0,1 N HCl (20x разведения). Поместите 2 мкл разведения на nanodrop пьедестал и нажмите меры. Умножьте концентрации на коэффициент разведения (20). Это дает рабочие концентрации морфолино. Для расчета концентрации миллимолярных делить концентрацию получить молекулярный вес морфолино.
- Подготовка рабочего запаса морфолино в Danieau буфера (58 мМ NaCl, 0,7 мМ KCl, 0,4 мМ MgSO 4, 0,6 мМ Ca (NO 3) 2, 5,0 мМ HEPES, рН 7,6) и 0,01% фенола красного (VWR Scientific).
- Для работы инъекции морфолино следовать протоколу в соответствии с Розен и др. 31. И Юань и соавт. 30. Промыть блюда морфолино инъекции яйца водой и теплом при 28 ° С в течение 15 минут. Удаление воды из инъекция блюда и состав одного слокоть стадии эмбриона в пазы инъекции блюдо (готовится из раздела 1) с передачей пипетки. Каждая пластинка будет содержать около 250 яиц. Вводите 1-2 эмбрионов клетки сцене с морфолино. Яйца остаются в одном-клеточной стадии в течение 15 минут 27.
- Промыть вводят яйца с яйцами воды после завершения (стерильный деионизированной воды 60 мг / л солей мгновенных океан) и место в 60 мл воды яйцо в дополнительных глубоких чашках Петри. Блюда морфолино инъекции могут быть использованы повторно. Промойте яйца водой, когда закончил и сохраняет инвертируется при 4 ° C.
- Для хранения эмбрионов добавить 60 мл воды яйца на блюдо. Граф из 110 эмбрионов с передачей пипеткой в отдельные дополнительные глубокие чашки Петри с 60 мл яйцо воды. Добавить 0,00003% метиленовым синим, чтобы предотвратить рост микроорганизмов и инкубировать эмбрионов при 28 ° C.
- Чтобы ускорить развитие эмбриона сохранить эмбрион блюд на 33 ° С в течение 24 часов и в зависимости от стадии Kimmel и соавт. 27, позволяющий эмбрионы развиваются в головуствол углом 75 ° (Прим 25 этап 27).
- В личиночной работы инфекции держать эмбрионов при 28 ° С после инъекции C. Albicans.
- Каждый день заменить эмбрион блюда с 60 мл свежего яйца водой.
- Подготовить рыбу в низкой температурой плавления агарозы (в соответствии с разделом 4.2) с tricaine в стеклянным дном изображения блюд (Маттек Corporation), как описано выше. Поместите блюдо на Olympus IX-81 (Olympus), перевернутый столик микроскопа. Принесите рыбу в центр внимания при 4x увеличение относительно дифференциальных интерференционного контраста (DIC) света. Изображения могут быть записаны на скорости 4х, 20х и 40х увеличением в ОПК, TRITC (тетраметил изотиоцианат родамин) и FITC (флуоресцеин изотиоцианат) настройки фильтра.
- Используйте Olympus IX-81 инвертированный микроскоп с FV-1000 лазерной сканирующей конфокальной системы в соответствии с Ariga соавт. 32. Проводить время на курсах 40-кратном увеличении, установив Z-стеки с 1-1,5 мкм ломтиками каждый час инфекции.
- Долгое время изображение курс 2 часа или больше, поместите слой низкой температурой плавления агарозы в верхней части рыбы в блюде изображения каждые 2-3 часа. Это предотвращает агарозном от высыхания и измельчения рыбы во время ее образ. Для длительных курсах время с небольшим количеством рыбы, использование нагретого этапе (Bioptechs Inc) для поддержания 28 ° C в течение инфекции.
4. Подготовка рыбы для работы с изображениями
Экспериментальные продолжительность: ** (30 минут)
Степень сложности: **
5. Изменения, относящиеся к Юпитеру протоколы
Микропипетки для Микроинъекция
Экспериментальные продолжительность: * (10-15 минут)
Степень сложности: *
Эмбрион сбор, морфолино инъекций и обслуживание
Экспериментальные продолжительность: *** (1-2 часа)
Степень сложности: ***
Изображений
Экспериментальные Продолжительность: ***** (1-5 часов)
Степень сложности: ***
6. Представитель Результаты
Примером успешного задний мозг желудочка C. Albicans инфекции у данио личинка в 5 часов после заражения (ИНН) и 24 HPI показано на (рис. 1). Макрофаги, как клетки охватили C. Albicans видны в задний мозг желудочка на 5 HPI. К 24 HPI, C. Albicans внутри макрофагов, как сотовыес в спинной ткани хвоста указывает на диссеминированный кандидоз. Эта инфекция результат во многом зависит от точного введения 10-15 дрожжи форме C. Albicans в задний мозг желудочка. Скрининг зараженную рыбу сразу же после инъекции можете убедиться в этом.
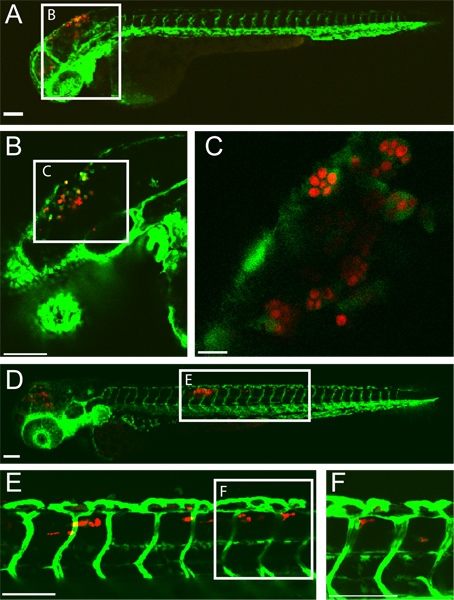
Рисунок 1 Трансгенные fli1. EGFP 22, 33 личинок, инфицированных CAF2-yCherry Candida Albicans и отображаемого intravitally с помощью конфокальной микроскопии. (AC) 5 часов после заражения (А) Инфицированные личинки с экспрессией EGFP макрофаг-подобных клеток в месте инфекции (задний мозг желудочка) Шкала бар = 100 мкм. (B и C) Высшее увеличения изображения одного и того же рыба, показывая C. Albicans в фагоцитов. Шкала бар = 100 мкм для B и 10 мкм для С. (DF) 24 часа после заражения (D) Инфицированные личинки с диссеминированный кандидоз с CaF2-yCherry C. Albicans в EGFP Macrophage-подобных клеток в спинной ткани хвоста. Шкала бар = 100 мкм. (E и F) Высшее увеличения изображения одного и того же рыба, показывая C. Albicans в хвост ткани. Шкала бар = 100 мкм.
Обсуждение
Данио методом микроинъекции, представленные здесь отличается от Gutzman и др. 34. В том, что здесь мы демонстрируем инъекции через слуховым пузырьком в задний мозг желудочка 36 до 48 личинок HPF. Метод описан позволяет последовательное введение 10-15 дрожжи в задний мозг желудочка с ум?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить лабораторию доктора Кэрол Ким микроинъекции для обучения, Кларисса Генри совет по ускорению развития эмбриона и использования оборудования, и Натан Лоусон за вклад fli1: EGFP рыбы. Мы благодарим членов Уилер лаборатории и Шон стены на критическое чтение рукописи. Мы также хотели бы поблагодарить Марка Nilan для ухода рыбы и советами, и Райан Phennicie и Кристин Габора для технических консультаций по этому проекту. Эта работа финансировалась ассистентом MAFES исследования К. Brothers, MAFES Hatch грант E08913-08, и награда NIH NCRR P20RR016463 Р. Уилер.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (опционально) |
| Нерест танков | Водной среды обитания | 2L | |
| 1,7 мл труб | Axygen | MCT-175-C | |
| Мгновенный океана | Fisher Scientific | S17957C | |
| Дополнительные глубокие чашки Петри | Fisher Scientific | 08-757-11Z | |
| Стандартные чашки Петри | VWR Научные | 25384-302 | |
| Передача пипетки | Fisher Scientific | 13-711-7М | |
| Дрожжевой экстракт | VWR ScientiFIC | 90000-726 | |
| Пептон | VWR Научные | 90000-264 | |
| Декстроза | Fisher Scientific | D16-1 | |
| Агар | VWR Научные | 90000-760 | |
| Одноразовые гемоцитометра | VWR Научные | 82030-468 | |
| Фосфатного буфера | VWR Научные | 12001-986 | |
| Дюмон Dumoxel пинцет | VWR Научные | 100501-806 | |
| Деревянные дюбели | VWR Научные | 10805-018 | |
| KimWipes | VWR Научные | 300053-964 | |
| Низкой температурой плавленияАгароза | VWR Научные | 12001-722 | |
| Агарозы для инъекций блюда | VWR Научные | 12002-102 | |
| Горячие Браун микропипетки Puller | Саттер инструменты | P-97 | |
| Полые стержни стекло | Саттер инструменты | BF120-69-10 | Для стеклянных стержней гладкого стекла при нагревании свыше Горелка Бунзена |
| Внесите Коробка для хранения | Саттер инструменты | BX10 | |
| ИПМТ-3 Система впрыска | Прикладные научного приборостроения | ИПМТ-3 | |
| Вернуться удельное давление | Прикладные научного приборостроения | ГПП | |
| Микропипетки держатель комплект | Appliиздание научного приборостроения | MPIP | |
| Foot Switch | Прикладные научного приборостроения | FSW | |
| Микроманипулятор | Прикладные научного приборостроения | MM33 | |
| Магнитная база | Прикладные научного приборостроения | Магнитная база | |
| Tricaine метан сульфонат | Западные химических Инк | MS-222 | |
| Анатомический Область | Олимп | SZ61 верхней SZX-ILLB2-100 база | |
| Конфокальной микроскопии | Олимп | IX-81 с FV-1000 конфокальной лазерной сканирующей системы | |
| ТС-7 тканевой культуры каток с 14-дюймовыми колесными пробирки | New Brunswick Scientific | ТС-7 | |
| Изображениями посуды | Маттек корпорации | P24G-1.0-10-F | |
| Наконечники для загрузки иглы | Эппендорф | 930001007 | |
| Пластина заливки сетки | Адаптивная науки Инструменты | Ту-1 | |
| Подогрев этап | Bioptechs Инк | Delta T-5 | |
| Плоский шпатель | VWR Научные | 82027-486 | |
| Пластиковые Сита | Изделия Knutsford Интернет | 12 см | |
| Парафильмом | VWR Научные | 52858-000 | |
| Vortex Genie | VWR Научные | 14216-184 | |
| 16 х 150 мм трубы культуры | VWR Научные | 60825-435 | |
| Nanodrop | Thermo Scientific | ND 2000 | |
| Фенол красный | VWR Научные | 97062-478 | |
| HCl | VWR Научные | 87003-216 | |
| NaCl | VWR Научные | BDH4534-500gP | |
| KCl | VWR Научные | BDH4532-500gP | |
| MgSO 4 | VWR Научные | BDH0246-500gP | |
| Ca (NO 3) 2 | VWR Научные | BDH0226-500gP | |
| HEPES | VWR Научные | BDH4520-500gP | |
| Morpholinos | GeneTools, ООО |
Ссылки
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены