Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'imagerie non invasive de la candidose disséminée chez les larves poisson zèbre
Dans cet article
Résumé
Le développement rapide, de petite taille et la transparence du poisson zèbre sont des atouts considérables pour l'étude du contrôle immunitaire innée de l'infection 1-4. Nous démontrons ici les techniques de larves infectantes poisson-zèbre à l'aide de l'agent pathogène fongique Candida albicans Par microinjection, la méthodologie utilisée récemment pour impliquer phagocyte l'activité de la NADPH oxydase dans le contrôle du dimorphisme fongique 5.
Résumé
Candidose disséminée provoquée par l'agent pathogène albicans Candida est un problème cliniquement important dans les individus hospitalisés et est associée à un taux de mortalité 30 à 40% attribuables 6. La candidose systémique est normalement contrôlée par l'immunité innée, et les individus présentant des anomalies génétiques dans des cellules immunitaires innées composants tels que la NADPH oxydase phagocytaire sont plus sensibles à la candidémie 7-9. On sait très peu sur la dynamique de C. l'interaction avec albicans cellules immunitaires innées in vivo. Vaste études in vitro ont établi que, en dehors de l'hôte C. albicans germe à l'intérieur des macrophages, et est rapidement détruite par les neutrophiles 10-14. Des études in vitro, bien qu'utile, ne peut pas résumer le complexe dans un environnement in vivo, qui comprend en fonction du temps la dynamique des niveaux de cytokines, les pièces jointes de la matrice extracellulaire et les contacts intercellulaires 10, 15-18 La larve du poisson zèbre offre un hôte vertébré unique et polyvalent pour l'étude de l'infection. Pour les 30 premiers jours de développement du poisson zèbre larves n'ont que les défenses immunitaires innées 2, 19-21, simplifier l'étude des maladies telles que la candidose disséminée qui sont fortement tributaires de l'immunité innée. La petite taille et la transparence des larves du poisson zèbre permettre l'imagerie de la dynamique de l'infection au niveau cellulaire à la fois pour l'hôte et le pathogène. Larves transgénique fluorescent avec les cellules immunitaires innées peuvent être utilisés pour identifier les types spécifiques de cellules impliquées dans l'infection 22-24. Modifiés oligonucléotides antisens (morpholinos) peut être utilisé pour abattre diverses composantes immunitaires telles que la NADPH oxydase phagocytaire et d'étudier les changements en réponse à fungal'infection de 5 litres. En plus des avantages éthiques et pratiques de l'aide d'un petit vertébré inférieur, le poisson-zèbre larves offre la possibilité unique de l'image de la bataille rangée entre agents pathogènes et l'hôte à la fois intravitally et en couleur.
Le poisson zèbre a été utilisé à l'infection de modèle pour un certain nombre de bactéries pathogènes pour l'homme, et a joué un rôle dans de grandes avancées dans notre compréhension de l'infection mycobactérienne 3, 25. Toutefois, c'est seulement récemment que les agents pathogènes beaucoup plus grandes, comme des champignons été utilisés pour infecter une larve 5, 23, 26, et à ce jour, il n'a pas été une description visuelle détaillée de la méthodologie d'infection. Ici, nous présentons nos techniques de microinjection ventricule rhombencéphale de prim 25 poisson-zèbre, y compris nos modifications à apporter aux protocoles précédents. Nos résultats en utilisant le modèle de poisson zèbre larves pour l'infection fongique divergent d'études in vitro et de renforcer la nécessité d'examiner l'intera hôte-pathogènection dans l'environnement complexe de l'hôte plutôt que le système simplifié de la boîte de Pétri 5.
Protocole
Tous les protocoles de soins de poisson zèbre et des expériences ont été réalisées sous protection des animaux et le Comité institutionnel d'utilisation (IACUC) protocole A2009-11-01.
1. Morpholino et plats injection larvaires
Durée expérimentale: * (10-15 minutes)
Degré de difficulté: *
- Pour les injections d'œufs, de préparer une solution à 2% d'agarose dans de l'eau stérile et micro-ondes. Lorsque la solution est refroidie versez un peu de celui-ci dans une boîte de Pétri extra-profond (Fisher Scientific) jusqu'à ce qu'il soit à moitié plein. Laisser refroidir sur glace et assurez-vous que la plaque est de niveau.
- Une fois le plat a refroidi, versez une couche de 15 ml haut de 2% d'agarose. Vaporisez une injection oeuf moule en plastique rainuré (Adaptive Science Tools) avec de l'eau stérile à partir d'un flacon pulvérisateur. Placez délicatement le côté à rainure vers le bas dans le moule chaude d'agarose. Lorsque la gélose a refroidi, utilisez une spatule en métal plat (VWR Scientific) pour dissocier le moule de l'agaaugmenté. Lentement enlever la grille de l'agarose. Plats Wrap embryon d'injection dans Parafilm (VWR Scientific) et des magasins inversé à 4 ° C.
- Pour les injections larves de poissons, de préparer une solution à 2% d'agarose comme décrit. Versez la solution dans une boîte de Pétri de taille standard (VWR Scientific) et mettre de côté jusqu'à ce qu'il se solidifie. Plats Wrap injection larvaires dans Parafilm et magasin inversé à 4 ° C.
2. Préparation de la culture des champignons
Durée expérimentale: ** (30 minutes)
Degré de difficulté: **
- Préparer l'extrait de levure-peptone-glucose (YPD) des plaques d'agar: 10 g / litre d'extrait de levure, 20 g / litre de peptone, 20 g / litre de dextrose, et 20 g / litre de gélose dans et autoclave. Pour liquide YPD préparer 10 g / litre d'extrait de levure, 20 g / litre de peptone, 20 g / litre de dextrose et autoclaves 20-30 minutes à 121 ° C.
- Deux jours avant les infections de poissons préparer une plaque strie à l'état congelédes stocks de cultures de Candida albicans sur une gélose YPD pour obtenir des colonies isolées.
- Incuber à 37 ° C pendant la nuit.
- Mettre 5 ml de bouillon YPD en 16 x 150 mm (tubes de culture VWR Scientific).
- La veille, les infections de poissons vous pouvez choisir 1 petite colonie sur la gélose YPD avec une cheville en bois (VWR Scientific). Placez le bâton dans le tube de culture et de tourbillonner autour de remettre en suspension dans le liquide colonie YPD.
- Cultiver une nuit à 37 ° C sur un tambour à rouleaux Culture TC-7 tissus équipé d'une roue de 14 pouces tube à essai (New Brunswick Scientific).
- Le lendemain, le ralentissement de 1 mL de la culture à g 14000x pendant 1 minute dans un tube de 1,7 mL (Axygen). Eliminer le surnageant et remettre en suspension le culot dans le liquide résiduel au vortex (VWR Scientific).
- Ajouter 1 ml 1x tampon phosphate salin (VWR Scientific) et de spin, comme décrit précédemment.
- Répéter le lavage PBS 3 fois.
- Diluer dilution 1:100 dans du PBS 1X (10 uL de C. albicans lavé dans 990 ul P 1xBS).
- Comptez sur un hémocytomètre (VWR Scientific).
- Diluer à 10 7 cellules / ml.
3. Infections de poisson-zèbre
Durée expérimentale: **** (1-3 heures)
Degré de difficulté: ****
- Recueillir des embryons en fonction de l'article 5 et le ranger dans l'œuf l'eau, 60 mg / L sels Instant Ocean (Fisher Scientific) dans de l'eau déminéralisée stérile.
- En utilisant un microscope à dissection tels que le SZ61 Olympus (Olympus), les embryons dechorionate le jour l'infection. Utilisez Dumont Dumoxel pincettes (VWR Scientific) pour tirer le chorion 27 en dehors, comme l'ouverture d'un sac de chips, ou légèrement piquer la pince à épiler dans la position fermée dans le chorion et puis, lentement, les ouvrir. Le poisson devrait apparaître dès la sortie du chorion.
- Swirl la boîte de Pétri extra profonde avec le couvercle de déplacer le poisson dans le centre de l'assiette. Transférer le poisson sur le couvercle de la boîte. Retirez l'œuf-eau etremplacer par du milieu frais. Ajouter le poisson aux médias.
- Chauds plats d'injection larvaires dans un incubateur à 28 ° C. Préparer le méthane sulfonate de tricaïne (Western Chemical Inc) de dilution à 200 pg / mL pour anesthésier les poissons.
- Compter le nombre souhaité de larves de l'infection (20-50 poissons). Mettre le poisson dans une solution de tricaïne méthane sulfonate et attendez quelques minutes jusqu'à ce qu'elles cessent 1-2 en mouvement.
- Allumez l'unité MPPI-3 d'injection (Applied Scientific Instruments). Assurez-vous que le commutateur de pression est sur "impulsion" et la "durée d'impulsion" est réglé à 9 avec 3 PSI pour l'unité de contre-pression. Ouvrir la vanne à la cuve d'azote jusqu'à ce que la pression sur l'unité d'injection lit 30 PSI.
- Chargez une micropipette tiré 28 avec 5 pi de vortex Candida albicans à une concentration de 1x10 7 cellules / ml. Placez la micropipette dans le porte-micropipette (Applied Scientific Instruments). Remplir un vide plat supplémentaire Petri profonde avec de l'eau. Déplacez la micropipette jusqu'à la pointe is au sein de vue juste de toucher la surface de l'eau par l'intermédiaire microscope à dissection et l'utilisation Dumont Dumoxel pincettes (VWR Scientific) pour couper l'aiguille d'environ 3 mm de la pointe de la pipette tiré.
- Appuyez sur l'interrupteur au pied (Applied Scientific Instruments) afin de vérifier que l'aiguille a été coupé. Vous devriez voir le liquide se disperser si vous avez réussi. Le diamètre du bol de liquide ne devrait pas être plus grand que le diamètre de la pupille de la prim 25 larves du poisson zèbre (0,21 mm, ce qui donne une sphère de 4,9 nL en volume). Régler la pression en conséquence si le bolus de liquide est trop grand ou trop petit.
- Anesthésier le poisson dans le sulfonate de méthane tricaïne (200 pg / mL). Une fois le poisson ont cessé de bouger, remuer le plat avec le couvercle jusqu'à ce que le poisson se trouve dans le centre. Recueillir 50 poissons à l'aide d'une pipette de transfert (Fisher Scientific). Appuyez sur le côté de la pipette pour régler les poissons vers la pointe. Doucement pipeter poisson sur le plat de larves d'agarose en utilisant le moins de liquide que possible.
- Ligne du poisson avec une tige de verre lisse (attention à ne pas les écraser!). Aspirer autant de liquide que possible hors de la boîte. Utilisez un Kimwipe pour évacuer toute trace d'humidité.
- Placez le plat des larves de poissons d'agarose sous le microscope jusqu'à ce que vous obtenez une bonne vue sur le poisson et l'aiguille dans le même temps. Déplacer l'aiguille de verre vers le poisson. Zoom sur le poisson à la fois et l'aiguille comme vous positionner l'aiguille vers le poisson. Soigneusement déplacer l'aiguille de verre dans la vésicule otique 27, 29 (l'oreille) du premier poisson. Vous saurez une fois que vous avez déplacé l'aiguille dans le poisson, car lorsque vous appuyez sur l'interrupteur au pied (Applied Scientific Instruments), le ventricule rhombencéphale se soulever légèrement.
- Appuyez sur l'interrupteur au pied (Applied Scientific Instruments) et regarder le liquide à l'intérieur de disperser rhombencéphale du poisson ventricule 27. Retrait de l'aiguille de la pêche et de passage à la prochaine poissons. Répétez la procédure jusqu'à ce que vous avez injecté la totalité du poisson sur la plaque. Retirez tout dpoissons EAD et injecter remplacements pour maintenir le nombre correct (50 poissons). Pour chaque groupe de 50 poissons injecté une aiguille microinjection nouvelle doit être préparé, ou le C. albicans s'installe dans le bas de l'aiguille et il obstrue, ou jette la concentration injectée.
- Lavez le poisson hors de l'assiette en inclinant le plat et la pulvérisation d'oeuf de l'eau sur le poisson dans un récipient propre boîte de Pétri extra-profond contenant 60 ml d'oeuf de l'eau. Il est important de ne pas laisser le poisson sur le agarose pendant plus de 15-20 minutes ou ils se dessèchent et meurent.
- Répétez le processus d'injection ensemble jusqu'à la fin. N'oubliez pas de PBS et non-pathogènes contrôles injectés.
- Lorsque vous avez terminé, garder le poisson à 28 ° C.
- Fermez le robinet de la bouteille d'azote. Déplacer le commutateur unité d'injection de «impulsion» à «en continu» pour soulager la pression dans la conduite du réservoir, la pression devrait tomber à zéro à ce point. Mettez l'unité d'injection de retour à "impulsion". Eteignez l'appareil d'injection et nettoyer la zone de travail.
4. Préparation du poisson pour l'imagerie
Durée expérimentale: ** (30 minutes)
Degré de difficulté: **
- Préparer la solution de tricaïne méthane sulfonate comme avant (200 pg / mL). Sortez le poisson infecté, et les transférer dans tricaïne.
- Préparer 47,9 mL de 0,4% d'agarose bas point de fusion (VWR scientifique) dans l'œuf-eau. Chauffer la solution par micro-ondes. Laisser refroidir à 37 ° C et le sulfonate de méthane add tricaïne (200 pg / mL) au mélange
- Une fois les poissons sont immobilisées dans le sulfonate de méthane tricaïne, pipette chaque poisson dans une boîte de Pétri (VWR scientifique) contenant 0,4% d'agarose bas point de fusion (VWR Scientific).
- Ensuite, déplacez le poisson de bas point de fusion d'agarose dans des puits individuels d'un plat à fond de verre (MatTek Corporation) pour l'imagerie. Utilisation telle que peu d'agarose à bas que possible à l'état fondu de sorte que le poisson est à plat sur le fond de la cuvette. N'utilisez assez de la tricaïne-agarose pour combler le danscercles TNS de l'assiette à fond de verre.
5. Modifications liées à Jupiter Protocoles
Micropipettes permettant de microinjection
Durée expérimentale: * (10-15 minutes)
Degré de difficulté: *
- Tirez tiges de verre creux BF120-69-10 (Instruments Sutter) en utilisant un Flaming Brown Micropipette Extracteur modèle P-97 (Sutter Instruments) selon Yuan et al. 30. Choisir le programme n ° 7 avec la chaleur les conditions suivantes = 470, vitesse = 120, temps = 200. L'aiguille résultant est de 8 mm à partir de biseau à bout et, une fois encliqueté à 3 mm au-dessus de la pointe elle a un diamètre d'environ 10 um.
- Chargez une micropipette de verre dans les supports. Sélectionnez «Tirez». Le filament de chauffage chauffe l'aiguille en fonction des paramètres de programme et la tige de verre se sépare en deux micropipettes tirés. Micropipettes ranger dans une boîte de stockage de pipette (Suttinstruments er).
Collecte d'embryons, d'injection et d'entretien morpholino
Durée expérimentale: *** (1-2 heures)
Degré de difficulté: ***
- Recueillir des embryons selon les méthodes de Rosen et al. 31. Utilisez un tamis en plastique (Wares de Knutsford) à collecter des oeufs à partir du réservoir de frai (habitats aquatiques). Tenez le tamis à l'envers sur une boîte de Pétri en profondeur supplémentaire et rincer à l'eau du réservoir pour recueillir les oeufs.
- Pour la préparation morpholino, ajouter 300 pi d'eau stérile pour 300 nanomoles de morpholino (GeneTools, LLC). Cela donne un stock de travail de 1,0 mM.
- Vérifier la concentration du morpholino en utilisant un Nanodrop (Thermo). Sélectionnez "acide nucléique et de changer le type d'échantillon à« l'autre »et longueur d'onde à 265. Entrez la constante en multipliant le poids moléculaire du morpholino par 1000 divisé par le absorptivitcoefficient y figurer sur la fiche morpholino oligo la propriété.
- Blank NanoDrop avec 2 pl de HCl 0,1 N. Diluer 5 pi de la solution dans 95 uL morpholino de 0,1 N HCl (20x dilution). Placez 2 ul de la dilution sur le piédestal NanoDrop et mesure clic. Multiplier la concentration par le facteur de dilution (20). Cela donne une concentration de travail de morpholino. Pour calculer la concentration millimolaire diviser la concentration obtenue par le poids moléculaire du morpholino.
- Préparer un stock de travail de morpholino dans Danieau tampon (58 mM de NaCl, 0,7 mM de KCl, 0,4 mM MgSO 4, 0,6 mM de Ca (NO 3) 2, 5.0 mM d'HEPES, pH 7,6) et 0,01% de phénol rouge (VWR Scientific).
- Pour les travaux d'injection morpholino suivre le protocole en fonction de Rosen et al. 31 et Yuan et al. 30. Rincez la vaisselle d'injection morpholino avec l'oeuf d'eau chaude et à 28 ° C pendant 15 minutes. Enlever l'eau de la vaisselle d'injection et line-up d'un cembryons au stade aune dans les rainures de la capsule d'injection (préparée à partir section 1) avec une pipette de transfert. Chaque plaque contient environ 250 oeufs. Injecter 1-2 embryons au stade de cellules avec des morpholino. Oeufs restera au stade d'une cellule pendant 15 minutes 27.
- Rincer les oeufs injectés avec de l'eau d'œuf lorsque vous avez terminé (eau stérile déionisée avec 60 mg / L sels Instant Ocean) et placer dans 60 ml d'oeuf de l'eau dans les boîtes de Pétri supplémentaires profondes. Plats injection Morpholino peuvent être réutilisés. Rincer avec de l'eau d'œuf lorsque vous avez terminé et stocker inversé à 4 ° C.
- Pour le stockage d'embryons ajouter 60 ml d'eau d'œuf à plat. Comptez 110 embryons avec une pipette de transfert dans des boîtes de Pétri séparées supplémentaires de profondeur avec 60 ml d'oeuf de l'eau. Ajouter méthylène 0,00003% bleu pour prévenir la croissance microbienne et d'embryons incuber à 28 ° C.
- Pour accélérer le développement des embryons garder les plats d'embryons à 33 ° C pendant 24 heures et le stade selon Kimmel et al. 27, qui autorise les embryons de se développer à une têtel'angle du tronc de 75 ° (25 prims étape 27).
- Pour les travaux de l'infection des larves conserver des embryons à 28 ° C après l'injection avec C. albicans.
- Chaque jour remplacer les plats d'embryons avec 60 ml d'oeuf d'eau douce.
Imagerie
Durée expérimentale: ***** (1-5 heures)
Degré de difficulté: ***
- Préparez le poisson en bas point de fusion d'agarose (conformément à l'article 4.2) avec tricaïne dans les plats en verre d'imagerie de fond (MatTek Corporation) comme décrit précédemment. Placer le plat sur un Olympus IX-81 (Olympus) stade microscope inversé. Apportez le poisson en vertu de foyer grossissement 4x en vertu de contraste d'interférence différentiel (DIC) de la lumière. Les images peuvent être capturées à 4x, 20x, 40x et en DIC, TRITC (tétraméthyl rhodamine isothiocyanate), et FITC (isothiocyanate de fluorescéine) les paramètres de filtrage.
- Utilisez un Olympus IX-81 microscope inversé avec une FV-1000 système de balayage à laser selon l'une confocale Ariga et al. 32. Organiser des cours de temps à un grossissement de 40x par la mise en Z-piles avec 1-1,5 um tranches à chaque heure de l'infection.
- Pour l'imagerie en temps long cours de 2 heures ou plus, placer une couche de bas point de fusion d'agarose sur le dessus du poisson dans le plat d'imagerie toutes les 2-3 heures. Cela empêche l'agarose de se dessécher et à l'écrasement du poisson pendant qu'il est imagé. Pour les cours en temps longs avec un petit nombre de poissons, utilisez une platine chauffante (Bioptechs Inc) pour maintenir 28 ° C au cours des infections.
6. Les résultats représentatifs
Un exemple de succès rhombencéphale ventricule C. l'infection albicans chez une larve poisson-zèbre à 5 heures post-infection (hpi) et 24 hpi est montré dans (Figure 1). Cellules de type macrophage avec englouti C. albicans sont vu dans le ventricule du cerveau postérieur à 5 hpi. Le 24 hpi, C. albicans est à l'intérieur des macrophages-cellules analoguess dans le tissu queue dorsale indicative de candidose disséminée. Ce résultat l'infection est fortement tributaire d'une injection précise de 10-15 levure sous forme C. albicans dans le ventricule du cerveau postérieur. Le dépistage des poissons infectés immédiatement après l'injection peut garantir cela.
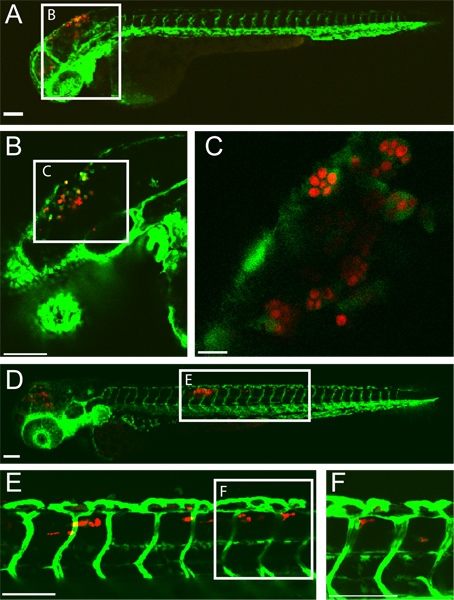
Figure 1 transgénique FLI1:. EGFP 22, 33 larves infectées par le CaF2-yCherry Candida albicans et imagée intravitally par microscopie confocale. (AC) 5 heures post-infection (A) la larve infectée avec EGFP-exprimant cellules de type macrophage sur le site de l'infection (rhombencéphale ventricule) La barre d'échelle = 100 um. (B et C) des images de grossissement supérieur de même poisson, montrant C. albicans dans les phagocytes. La barre d'échelle = 100 um pour B et 10 um pour C. (DF) 24 heures post-infection (D) la larve infectée avec une candidose disséminée avec CaF2-yCherry C. albicans à l'intérieur EGFP macrophage-comme les cellules dans le tissu queue dorsale. Échelle = 100 um. (E et F) images agrandies plus élevés de même poisson, montrant C. albicans dans les tissus queue. Échelle = 100 um.
Discussion
La technique de microinjection poisson zèbre présenté ici diffère de Gutzman et al. 34 en ce que nous démontrons ici l'injection à travers la vésicule otique dans le ventricule du cerveau postérieur de 36 à 48 larves HPF. La méthode que nous décrivons permet pour l'injection constante de 10-15 levure dans le ventricule du cerveau postérieur à une lésion tissulaire réduite. Ce protocole provoque une infection qui se propage d'abord locale dans tout le corps de 24 hpi
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier le laboratoire du Dr Carol Kim pour la formation de micro-injection, Clarissa Henry pour obtenir des conseils sur l'accélération de développement de l'embryon et l'utilisation de l'équipement, et Nathan Lawson pour contribuer FLI1: poissons EGFP. Nous remercions les membres du laboratoire Wheeler et murs Shawn pour la lecture critique du manuscrit. Nous tenons également à remercier Mark Nilan pour les soins de poissons et de conseils, et Ryan Phennicie et Kristin Gabor pour des conseils techniques sur ce projet. Ce travail a été financé par un assistanat de recherche MAFES Brothers K., un MAFES Hatch subvention E08913-08, et un prix NIH NCRR P20RR016463 à R. Wheeler.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Le numéro de catalogue | Commentaires (optionnel) |
| Bassins de ponte | Les habitats aquatiques | 2L | |
| 1,7 mL tubes | Axygen | MCT-175-C | |
| Instantanée océan | Fisher Scientific | S17957C | |
| Supplémentaires profondes boîtes de Pétri | Fisher Scientific | 08-757-11Z | |
| Standard des boîtes de Pétri | VWR Scientific | 25384-302 | |
| Les pipettes de transfert | Fisher Scientific | 13-711-7M | |
| Extrait de levure | VWR scientific | 90000-726 | |
| Peptone | VWR Scientific | 90000-264 | |
| Dextrose | Fisher Scientific | D16-1 | |
| Gélose | VWR Scientific | 90000-760 | |
| Hémocytomètre jetable | VWR Scientific | 82030-468 | |
| Phosphate Buffered Saline | VWR Scientific | 12001-986 | |
| Dumont Dumoxel Brucelles | VWR Scientific | 100501-806 | |
| Chevilles de bois | VWR Scientific | 10805-018 | |
| Kimwipes | VWR Scientific | 300053-964 | |
| Bas point de fusionAgarose | VWR Scientific | 12001-722 | |
| Agarose pour les plats d'injection | VWR Scientific | 12002-102 | |
| Flaming Brown Micropipette Puller | Sutter Instruments | P-97 | |
| Tiges de verre creux | Sutter Instruments | BF120-69-10 | Pour tiges de verre en verre lisse par chauffage au cours bec Bunsen |
| Boîte de rangement pipette | Sutter Instruments | BX10 | |
| MPPI-3 Système d'injection | Appliqué Instrumentation scientifique | MPPI-3 | |
| Unité de pression Retour | Appliqué Instrumentation scientifique | BPU | |
| Kit Holder Micropipette | Applied Scientific Instrumentation | PMIV | |
| Foot Switch | Appliqué Instrumentation scientifique | FSW | |
| Micromanipulateur | Appliqué Instrumentation scientifique | MM33 | |
| Base magnétique | Appliqué Instrumentation scientifique | Base magnétique | |
| Méthanesulfonate tricaïne | Western Chemical Inc | MS-222 | |
| Dissection Portée | Olympe | SZ61 haut SZX-ILLB2-100 de base | |
| Microscope confocal | Olympe | IX-81 avec FV-1000 confocale à balayage laser du système | |
| TC-7 tambour rouleau culture de tissus avec 14 roue d'essai tube pouce | New Brunswick Scientific | TC-7 | |
| Plats d'imagerie | MatTek Corporation | P24G-1.0-10-F | |
| Les pointes de pipette pour le chargement des aiguilles | Eppendorf | 930001007 | |
| Grilles plaque de coulée | Adaptive Science Tools | TU-1 | |
| Stade chauffée | Bioptechs Inc | Delta T-5 | |
| Spatule plate | VWR Scientific | 82027-486 | |
| Tamis en plastique | Liaison avec les marchandises de Knutsford en ligne | 12 cm | |
| Parafilm | VWR Scientific | 52858-000 | |
| Vortex Genie | VWR Scientific | 14216-184 | |
| 16 x 150 mm Les tubes de culture | VWR Scientific | 60825-435 | |
| Nanodrop | Thermo Scientific | ND 2000 | |
| Rouge de phénol | VWR Scientific | 97062-478 | |
| HCl | VWR Scientific | 87003-216 | |
| NaCl | VWR Scientific | BDH4534-500GP | |
| KCl | VWR Scientific | BDH4532-500GP | |
| MgSO 4 | VWR Scientific | BDH0246-500GP | |
| Ca (NO 3) 2 | VWR Scientific | BDH0226-500GP | |
| HEPES | VWR Scientific | BDH4520-500GP | |
| Morpholinos | GeneTools, LLC |
Références
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon