É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Não-invasivos de imagem de candidíase disseminada em larvas do peixe
Neste Artigo
Resumo
O desenvolvimento rápido, tamanho pequeno e transparência de peixes-zebra são enormes vantagens para o estudo do controle imunológico inato de infecção 1-4. Aqui demonstramos técnicas para infectar larvas do peixe utilizando o agente patogénico fúngica Candida albicans Por microinjeção, a metodologia usada recentemente para implicar atividade oxidase NADPH de fagócitos no controle de dimorfismo fúngico 5.
Resumo
Candidíase disseminada causada pelo patógeno Cândida albicans é um problema clínico importante em indivíduos hospitalizados e está associada com uma mortalidade de 30 a 40% atribuível 6. A candidíase sistêmica é normalmente controlada pela imunidade inata, e indivíduos com defeitos genéticos em células imunes inatas componentes, tais como NADPH oxidase de fagócitos são mais suscetíveis à candidemia 7-9. Muito pouco é conhecido sobre a dinâmica de C. albicans interacção com as células imunes inatas in vivo. extensa em estudos in vitro demonstraram que fora do hospedeiro C. albicans germina dentro de macrófagos, e é rapidamente destruída por neutrófilos 10-14. Os estudos in vitro, embora úteis, não pode recapitular o complexo in vivo ambiente, que inclui dependentes do tempo dinâmica dos níveis de citocinas, anexos da matriz extracelular, e os contactos intercelulares 10, 15-18 A larva do peixe-zebra oferece um hospedeiro vertebrado único e versátil para o estudo da infecção. Durante os primeiros 30 dias de desenvolvimento larvas do peixe têm apenas inatas defesas imunitárias 2, 19-21, simplificando o estudo de doenças como a candidíase disseminada que são altamente dependentes da imunidade inata. O tamanho pequeno e transparência das larvas do peixe permitir imagem de dinâmica da infecção a nível celular, tanto para hospedeiro e do patógeno. Larvas transgénico com fluorescentes inatos células do sistema imunológico pode ser usado para identificar os tipos específicos de células envolvidas na infecção 22-24. Modificados oligonucleótidos anti-sentido (Morpholinos) pode ser usado para derrubar vários componentes imunológicos, tais como NADPH oxidase de fagócitos e estudar as alterações em resposta a fungal infecção 5. Além das vantagens éticas e práticas da utilização de um vertebrado pequeno inferior, as larvas do peixe-zebra oferece a possibilidade única para a imagem da batalha lançada entre patógeno e tanto intravitally e na cor.
O peixe-zebra tem sido utilizada para a infecção modelo para um número de bactérias patogénicas humanas, e tem sido instrumental em grandes avanços na compreensão da infecção micobacteriana 3, 25. No entanto, só recentemente patógenos muito maiores, tais como fungos foram utilizados para infectar larvas 5, 23, 26, e até à data não tem havido uma descrição detalhada visual da metodologia infecção. Aqui apresentamos as nossas técnicas de microinjeção rombencéfalo ventrículo de zebrafish 25 prim, incluindo os nossos alterações aos protocolos anteriores. Nossos resultados utilizando o modelo de zebrafish larval para infecção fúngica divergem dos estudos in vitro e reforçam a necessidade de examinar a Intera patógeno-hospedeiroction no complexo ambiente do hospedeiro em vez do sistema simplificado da placa de Petri 5.
Protocolo
Todos os protocolos de atendimento zebrafish e experimentos foram realizados sob Animal Care Institucional e Comitê de Uso (IACUC) protocolo A2009-11-01.
1. Morfolino e Pratos de injeção larval
Duração Experimental: * (10-15 minutos)
Grau de dificuldade: *
- Para injecções de ovo, preparar uma solução a 2% de agarose em água estéril e microondas. Quando a solução tiver arrefecido colocar um pouco dele em uma placa de Petri extra profundo (Fisher Scientific) até que ele está meio cheio. Esfriar em gelo e verifique se a placa está nivelado.
- Uma vez que o prato ter arrefecido, verter uma camada de topo 15 mL de agarose a 2%. Borrife uma injeção ovo sulcado de moldes de plástico (Ferramentas Adaptive Ciência) com água estéril de um frasco de spray. Com cuidado, coloque o lado da ranhura do molde para baixo na agarose quente. Quando a agarose foi arrefecida, utilizar uma espátula de metal plana (VWR Scientific) para dissociar o molde da agalevantou-se. Lentamente remover a grade a partir da agarose. Pratos envoltório de embriões de injecção em Parafilm (VWR Scientific) e armazenar invertido a 4 ° C.
- Para injecções de larvas de peixe, preparar uma solução a 2% de agarose como descrito. Despeje a solução no prato um padrão de tamanho Petri (VWR Scientific) e reserve até que ela se solidifica. Quebrar pratos de injeção de larvas em Parafilm e loja invertido a 4 ° C.
2. Preparação Cultura fúngica
Duração Experimental: ** (30 minutos)
Grau de dificuldade: **
- Preparar extracto de levedura-peptona-dextrose (YPD) placas de ágar: 10 g / litro de extracto de levedura, 20 g / litro de peptona, 20 g de dextrose / litro, e 20 g de agar / litro para dentro e para autoclave. Para preparar o líquido YPD 10 g / litro de extracto de levedura, 20 g / litro de peptona, 20 g de dextrose / litro e de autoclave de 20-30 minutos a 121 ° C.
- Dois dias antes de infecções preparar um prato de peixe raia de congeladosexistências de culturas de Candida albicans em agar YPD para obter colónias individuais.
- Incubar a 37 ° C durante a noite.
- Coloque 5 mL de caldo YPD em 16 x 150 mm tubos de cultura (VWR Scientific).
- Um dia antes de as infecções de peixe pegar um pequena colônia no ágar YPD com um passador de madeira (VWR Scientific). Coloque o pau no tubo de cultura e giram em volta para re-suspender colônia no líquido YPD.
- Crescer durante a noite a 37 ° C em um tambor TC-7 Tissue Culture rolo equipado com uma roda de tubo de 14 polegadas de teste (New Brunswick Scientific).
- No dia seguinte, girar para baixo 1 mL de cultura no g 14000x durante 1 minuto num tubo mL 1,7 (Axygen). Remover o sobrenadante e ressuspender o pellet em líquido residual por vórtice (VWR Scientific).
- Adicionar 1 mL 1x tampão fosfato salino (VWR Scientific) e girar como descrito anteriormente.
- Repita a lavagem PBS 3 vezes.
- Diluir diluição 1:100 em PBS 1x (10 uL de lavado C. albicans em 990 uL 1x PBS).
- Conte com um hemocitômetro (VWR Scientific).
- Diluir a 10 7 células / mL.
3. Infecções zebrafish
Duração Experimental: **** (1-3 horas)
Grau de dificuldade: ****
- Recolher embriões de acordo com a seção 5 e loja no ovo de água, 60 mg / l sal dos oceanos instantâneas (Fisher Scientific) em água deionizada estéril.
- Usando um microscópio de dissecação, tais como o SZ61 Olympus (Olympus), embriões dechorionate no dia da infecção. Use Dumont Dumoxel pinças (VWR Scientific) para puxar o córion 27 pedaços como abrir um saco de batatas fritas, ou picar delicadamente a pinça na posição fechada dentro do córion e então lentamente abri-los. O peixe deve aparecer para a direita fora do córion.
- Agitar o prato de Petri extra profundo com a tampa sobre a mover peixe para o centro do prato. Transfira o peixe para a tampa do prato. Remover ovo de água esubstituir por meio fresco. Adicione o peixe para a mídia.
- Quentes larvas pratos de injeção em uma incubadora a 28 ° C. Preparar metano sulfonato tricaina (Western Chemical Inc.) de diluição a 200 ug / mL para anestesiar peixe.
- Contar o número desejado de larvas para a infecção (20-50 de peixe). Coloque o peixe em tricaina solução metano sulfonato e esperar 1-2 minutos até que eles param de se mover.
- Ligue a unidade MPPI-3 de injeção (Applied Scientific Instruments). Verifique se o interruptor de pressão está no "pulso" e "duração de impulso" é definido como 9 com 3 PSI para a unidade de contrapressão. Abrir a válvula para o tanque de azoto até que a pressão sobre a unidade de injecção lê 30 PSI.
- Carregar uma micropipeta puxado 28 com 5 uL de vórtex Cândida albicans a uma concentração de 1x10 7 células / mL. Coloque a micropipeta no suporte micropipeta (Applied Scientific Instruments). Encha uma placa de Petri vazia extra profundo com água. Mova o micropipeta até a ponta is dentro de vista apenas tocar a superfície da água através de microscópio de dissecção e utilização Dumont Dumoxel pinça (VWR Scientific) para cortar a agulha cerca de 3 mm a partir da ponta da pipeta puxado.
- Pressione o pedal (Applied Scientific Instruments) para verificar a agulha foi cortada. Você deverá ver o líquido disperso se você fosse bem sucedido. O diâmetro do bolo líquido não deve ser maior do que o diâmetro da pupila do peixe-zebra larva prim 25 (0,21 mm, produzindo uma esfera de 4,9 nL em volume). Ajuste a pressão de acordo, se o bolo líquido é demasiado grande ou demasiado pequeno.
- Anestesiar os peixes no tricaina sulfonato de metano (200 ug / mL). Uma vez que o peixe ter parado de se mover redemoinho, a cápsula com a tampa na até que o peixe estão no centro. Recolha 50 peixes com uma pipeta de transferência (Fisher Scientific). Toque no lado da pipeta para resolver os peixes para a ponta. Suavemente pipetar peixe para o prato de agarose larval utilizando como líquido pouco quanto possível.
- Linha do peixe com uma vareta de vidro liso (ter cuidado para não esmagá-los!). Aspirar a forma de líquido tanto quanto possível fora do prato. Use um Kimwipe para afastar qualquer umidade.
- Coloque o prato de agarose larval de peixes sob o microscópio, até obter uma boa visão do peixe e da agulha, ao mesmo tempo. Mova a agulha de vidro para o peixe. Zoom sobre os peixes eo agulha como você posicionar a agulha para o peixe. Cuidadosamente, mover a agulha de vidro na vesícula ótica 27, 29 (orelha) do primeiro peixe. Você saberá uma vez que você mudou a agulha para o peixe, porque quando você aperta o pedal (Instrumentos Científica Aplicada), o ventrículo rombencéfalo vai levantar um pouco.
- Pressione o pedal (Applied Scientific Instruments) e assistir o líquido disperso dentro rombencéfalo do peixe ventrículo 27. Retrair a agulha do peixe e passar para o peixe que vem. Repita o procedimento até que você tenha injetado todo o peixe no prato. Remova qualquer dpeixe ead e injetar substituições para manter o número correto (50 peixes). Para cada grupo de 50 peixes injetado uma agulha microinjeção novo deve estar preparado, ou o C. albicans se deposita no fundo da agulha e entope-lo, ou lança a concentração injectado.
- Lave o peixe fora do prato por prato e dobrar a pulverização de ovo de água para o peixe em uma placa de Petri limpa extra profundo contendo 60 mL de ovo e água. É importante não deixar o peixe na agarose por mais 15-20 minutos, ou eles irão secar e morrer.
- Repita o processo até terminar toda a injeção. Não se esqueça PBS e não-patogênicas controles injetados.
- Quando terminar, manter o peixe a 28 ° C.
- Feche a válvula do tanque de nitrogênio. Mova o interruptor unidade de injeção de "pulso" para "contínuo" para aliviar a pressão na linha do tanque, a pressão deve cair a zero neste ponto. Mudar unidade de injeção de volta para "pulso". Desligue a unidade de injeção e limpar a área de trabalho.
4. Preparando o Peixe for Imaging
Duração Experimental: ** (30 minutos)
Grau de dificuldade: **
- Preparar solução tricaina sulfonato de metano como antes (200 ug / mL). Saia peixes infectados, e transferi-los para tricaina.
- Preparar 47,9 mL de 0,4% de agarose de baixa fusão (VWR Scientific) em ovo-água. Aquecer a solução por microondas. Arrefecer até 37 ° C e adicionar sulfonato de metano tricaina (200 ug / mL) à mistura
- Uma vez que os peixes são imobilizadas em tricaina sulfonato de metano, pipeta peixe indivíduo em uma placa de Petri (VWR Scientific) contendo 0,4% de agarose de baixo de fusão (VWR Scientific).
- Em seguida, mova o peixe de baixa fusão agarose em poços individuais de um prato fundo de vidro (MatTek Corporation) para a imagem latente. Use tão pouco baixo de fusão de agarose quanto possível de modo que o peixe fica encostado ao fundo do prato. Apenas usar o suficiente do tricaina-agarose para encher o emcírculos parceiras do prato fundo de vidro.
5. Modificações relacionadas a Jove Protocolos
Micropipetas de microinjeção
Duração Experimental: * (10-15 minutos)
Grau de dificuldade: *
- Puxar hastes de vidro ocas BF120-69-10 (Sutter Instruments) utilizando um flamejante Brown Micropipeta Puller Modelo P-97 (Sutter Instruments) de acordo com Yuan et ai. 30. Escolha o programa # 7 com o Heat condições seguinte = 470 Velocidade, Tempo = 120 = 200. A agulha resultante é de 8 mm a partir de bisel à ponta e, uma vez cortada a 3 mm acima da ponta tem um diâmetro de cerca de 10 uM.
- Carregar uma micropipeta de vidro nos suportes. Selecione "Puxar". O filamento de aquecimento irá aquecer a agulha de acordo com os parâmetros do programa, a vareta de vidro vai separar em duas micropipetas puxadas. Micropipetas Loja em uma caixa de armazenamento pipeta (Suttinstrumentos de ER).
Colheita de embriões, Injeção Morfolino e Manutenção
Experimental: *** duração (1-2 horas)
Grau de dificuldade: ***
- Recolher embriões de acordo com os métodos de Rosen et al. 31. Use uma peneira plástica (Wares de Knutsford) para coletar os ovos a partir do tanque de desova (Habitats Aquáticos). Segure a peneira de cabeça para baixo sobre uma placa de Petri extra profundo e enxágüe com água do tanque para coleta de ovos.
- Para a preparação morfolino, adicionam-se 300 uL de água estéril para 300 nanomoles de morfolino (GeneTools, LLC). Isto dá um estoque de trabalho de 1,0 mM.
- Verificar a concentração do morfolino usando um Nanodrop (Thermo Scientific). Seleccione "ácido nucleico e alterar o tipo de amostra a" outro "comprimento de onda e 265. Introduza a constante através da multiplicação do peso molecular do morfolino por 1000 dividido pelo absorptivitcoeficiente de y listados na folha de propriedades morfolino oligo.
- Nanodrop o ensaio em branco com 2 uL 0,1 N de HCl. Diluir 5 uL da solução de morfolino em 95 uL de 0,1 N HCl (20x de diluição). Coloque 2 uL da diluição sobre o pedestal e nanodrop medida clique. Multiplicar a concentração pelo fator de diluição (20). Isto dá uma concentração de trabalho de morfolino. Para calcular a concentração milimolar dividir a concentração obtida pelo peso molecular do morfolino.
- Preparar um estoque de trabalho de morfolino em Danieau tampão (58 mM de NaCl, 0,7 mM de KCl, 0,4 mM MgSO4, 0,6 mM de Ca (NO3) 2, 5,0 mM de HEPES, pH 7,6) e 0,01% de vermelho de fenol (VWR Scientific).
- Para morfolino trabalho injecção seguir o protocolo de acordo com Rosen et al. 31 e et Yuan ai. 30. Lavar os pratos de injecção morfolino com ovo em água e aquecido a 28 ° C durante 15 minutos. Retire a água dos pratos de injeção e line-up de um cell embriões em fase para dentro das ranhuras do prato de injecção (preparado a partir de secção 1) com uma pipeta de transferência. Cada placa irá realizar cerca de 250 ovos. Injectar 1-2 embriões em fase de células com morfolino. Ovos irá permanecer na fase de uma célula-por 15 minutos 27.
- Lavar os ovos injectados com ovo em água quando acabados (água desionizada estéril com 60 mg / l sais Instant Ocean) e colocar em 60 mL de ovo de água-em placas de Petri extras profundas. Pratos de injeção morfolino pode ser reutilizado. Enxágüe com água-ovo quando terminar e armazenar invertido a 4 ° C.
- Para o armazenamento de embriões adicionar 60 mL de água-ovo de prato. Contar 110 embriões com uma pipeta de transferência em separadas adicionais placas de Petri de profundidade com 60 mL de ovo-água. Adicionar metileno 0,00003% de azul para impedir o crescimento microbiano e embriões incubar a 28 ° C.
- Para acelerar o desenvolvimento de embriões manter pratos de embriões a 33 ° C durante 24 horas e fase de acordo com Kimmel et ai. 27, permitindo que os embriões para desenvolver a uma cabeçaângulo de tronco de 75 ° (fase Prim 25 27).
- Para o trabalho infecção de larvas manter embriões a 28 ° C após injecção com C. albicans.
- Cada dia substituir pratos embrião com 60 mL de água doce de ovos.
Imagem
Duração Experimental: ***** (1-5 horas)
Grau de dificuldade: ***
- Prepare peixe em baixa fusão agarose (de acordo com a secção 4.2) com tricaina em pratos de vidro de fundo de imagem (MatTek Corporation) como descrito anteriormente. Coloque o prato em um IX-81 Olympus platina do microscópio (Olympus) invertido. Trazer o peixe para o foco no aumento de 4x em contraste de interferência diferencial (DIC) de luz. As imagens podem ser capturadas em 4x, 20x e 40x no DIC, TRITC (isotiocianato de rodamina tetrametil), e FITC (isotiocianato de fluoresceína) configurações do filtro.
- Use uma Olympus IX-81 microscópio invertido com uma FV-1000 a laser confocal sistema de digitalização de acordo com a Ariga et al. 32. Realizar cursos de tempo em 40x definindo Z-pilhas com 1-1,5 mM fatias a cada hora de infecção.
- Para imagem muito tempo com decurso de 2 horas ou mais, colocar uma camada de baixa massa fundida de agarose na parte superior do peixe no prato de imagem a cada 2-3 horas. Isto evita que a agarose de secar e esmagamento do peixe enquanto está a ser trabalhada. Para os cursos de tempo prolongados com um pequeno número de peixe, utilizar uma fase aquecida (Bioptechs Inc.) para manter a 28 ° C durante as infecções.
6. Os resultados representativos
Um exemplo de sucesso rombencéfalo ventrículo C. albicans infecção em uma larva do peixe-zebra, 5 horas pós-infecção (HPI) e 24 hpi é mostrado na (Figura 1). Macrófagos como células com C. engolfou albicans são vistas no ventrículo rombencéfalo a 5 hpi. Em 24 hpi, C. albicans está dentro de macrófagos como células no tecido da cauda dorsal indicativa de candidíase disseminada. Este resultado infecção é altamente dependente de uma injecção precisa de 10-15 levedura forma C. albicans no ventrículo rombencéfalo. Triagem de peixes infectados imediatamente após a injecção pode garantir isso.
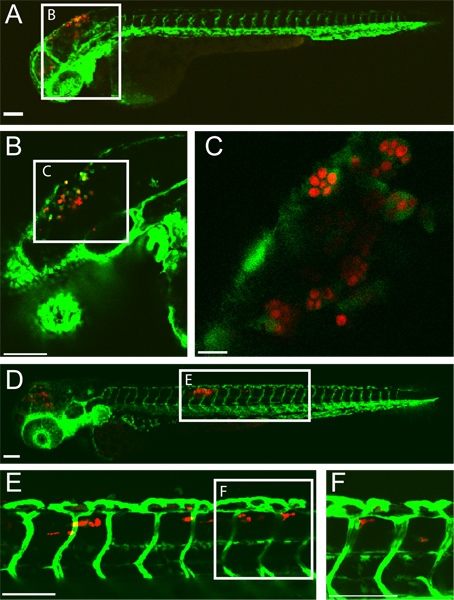
Figura 1 transgênica fli1:. EGFP 22, 33 larva infectados com Candida albicans CaF2-yCherry e fotografada intravitally por microscopia confocal. (AC) de 5 horas pós-infecção (A) larva infectada com EGFP-expressando macrófagos, como as células no local da infecção (rombencéfalo ventrículo) Barra de escala = 100 uM. (B e C) mais elevadas imagens de ampliação de peixe mesmo, mostrando C. albicans dentro fagócitos. Barra de escala = 100 mm para B e 10 M para C. (DF) 24 horas após a infecção larva (D) infectados com candidíase disseminada com CaF2-yCherry C. albicans dentro EGFP macrophage-like células no tecido de cauda dorsal. Barra de escala = 100 mm. (E e F) Superior imagens de ampliação do mesmo peixe, mostrando C. albicans no tecido de cauda. Barra de escala = 100 mm.
Discussão
O método de microinjecção peixe-zebra aqui apresentado difere da Gutzman et al. 34 em que aqui se demonstrar a injecção através da vesícula ótica para o ventrículo rombencéfalo de 36-48 larvas hpf. O método permite que descrevemos injectável consistente de 10-15 levedura para o ventrículo rombencéfalo com danos nos tecidos reduzida. Este protocolo produz uma infecção local que inicialmente se espalha em todo o corpo por 24 hpi (Figura 1) e resulta em letalidade signif...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer ao laboratório do Dr. Carol Kim para a formação microinjeção, Clarissa Henry para o conselho, que visa acelerar o desenvolvimento do embrião e utilização de equipamentos, e Nathan Lawson para contribuir fli1: peixe EGFP. Agradecemos os membros do laboratório Wheeler e Shawn Paredes para a leitura crítica do manuscrito. Gostaríamos também de agradecer a Mark Nilan para cuidado dos peixes e conselhos, e Ryan Phennicie e Kristin Gabor para consultoria técnica sobre este projeto. Este trabalho foi financiado por um estágio de pesquisa para MAFES K. Brothers, um MAFES escotilha concessão E08913-08, e um prêmio NIH NCRR P20RR016463 a R. Wheeler.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentários (opcional) |
| Tanques de desova | Habitats aquáticos | 2L | |
| 1,7 ml tubos | Axygen | MCT-175-C | |
| Instant Ocean | Fisher Scientific | S17957C | |
| Extra profundo placas de Petri | Fisher Scientific | 08-757-11Z | |
| Padrão placas de Petri | VWR Scientific | 25384-302 | |
| Pipetas de transferência | Fisher Scientific | 13-711-7M | |
| Extracto de levedura | VWR científic | 90000-726 | |
| Peptona | VWR Scientific | 90000-264 | |
| Dextrose | Fisher Scientific | D16-1 | |
| Agar | VWR Scientific | 90000-760 | |
| Hemocitômetro descartável | VWR Scientific | 82030-468 | |
| Tampão fosfato salino | VWR Scientific | 12001-986 | |
| Dumont Dumoxel Pinças | VWR Scientific | 100501-806 | |
| Cavilhas de madeira | VWR Scientific | 10805-018 | |
| KimWipes | VWR Scientific | 300053-964 | |
| Low MeltAgarose | VWR Scientific | 12001-722 | |
| Agarose para pratos de injeção | VWR Scientific | 12002-102 | |
| Flaming Brown Micropipeta Puller | Sutter Instruments | P-97 | |
| Ocos bastões de vidro | Sutter Instruments | BF120-69-10 | Para bastões de vidro vidro liso por aquecimento sobre Bico de Bunsen |
| Pipetar Caixa de armazenamento | Sutter Instruments | BX10 | |
| MPPI-3 Sistema de injecção | Aplicada Instrumentação Científica | MPPI-3 | |
| Unidade de pressão Voltar | Aplicada Instrumentação Científica | BPU | |
| Micropipeta kit Titular | Aplicaçãoed Instrumentação Científica | MPIP | |
| Foot Switch | Aplicada Instrumentação Científica | FSW | |
| Micromanipulador | Aplicada Instrumentação Científica | MM33 | |
| Base Magnética | Aplicada Instrumentação Científica | Base Magnética | |
| Tricaina sulfonato de metano | Ocidental Chemical Inc. | MS-222 | |
| Dissecando Âmbito | Olimpo | SZ61 base de SZX-ILLB2 top-100 | |
| Microscópio confocal | Olimpo | IX-81 com FV-1000 sistema de varredura a laser confocal | |
| TC-7 Tissue monocilíndrico Cultura com 14 polegadas roda tubo de ensaio | New Brunswick Scientific | TC-7 | |
| Pratos de imagem | MatTek Corporação | P24G-1.0-10-F | |
| Ponteira para colocar as agulhas | Eppendorf | 930001007 | |
| Grades Placa vazamento | Ferramentas adaptativas Ciência | TU-1 | |
| Estágio aquecida | Bioptechs Inc. | Delta T-5 | |
| Espátula Plana | VWR Scientific | 82027-486 | |
| Peneiras de plástico | Wares de Knutsford online | 12 centímetros | |
| Parafilm | VWR Scientific | 52858-000 | |
| Vortex Genie | VWR Scientific | 14216-184 | |
| 16 x 150 mm tubos de cultura | VWR Scientific | 60825-435 | |
| Nanodrop | Thermo Scientific | ND 2000 | |
| Vermelho de Fenol | VWR Scientific | 97062-478 | |
| HCl | VWR Scientific | 87003-216 | |
| NaCl | VWR Scientific | BDH4534-500gP | |
| KCl | VWR Scientific | BDH4532-500gP | |
| MgSO4 | VWR Scientific | BDH0246-500gP | |
| Ca (NO3) 2 | VWR Scientific | BDH0226-500gP | |
| HEPES | VWR Scientific | BDH4520-500gP | |
| Morpholinos | GeneTools, LLC |
Referências
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados