A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח מדויק, תפוקה גבוהה של התפתחות חיידקים
In This Article
Summary
הערכה כמותית של התפתחות חיידקים חיוני להבנת הפיזיולוגיה מיקרוביאלי כתופעה מערכות ברמת. פרוטוקול עבור גישה אנליטית מניפולציה ניסויית הם הציגו, המאפשר ניתוח מדויק, תפוקה גבוהה של התפתחות חיידקים, אשר הוא נושא מפתח עניין במערכות ביולוגיות.
Abstract
התפתחות חיידקים הוא מושג מרכזי בהתפתחות של פיזיולוגיה מיקרוביאלי מודרניים, כמו גם בחקירה של דינמיקה סלולר ברמת מערכות. מחקרים שנעשו לאחרונה דיווחו על מתאמים בין התפתחות חיידקים ואירועים הגנום כולו, כגון ארגון מחדש, הפחתת ו- transcriptome, הגנום. כראוי ניתוח התפתחות חיידקים חיוני להבנת התיאום תלויי-צמיחה של ג'ין פונקציות ורכיבים הסלולר. בהתאם לכך, הערכה כמותית מדויקת של התפתחות חיידקים באופן תפוקה גבוהה נדרש. התפתחויות טכנולוגיות המתעוררים מציעים כלים חדשים ניסיוני לאפשר עדכוני שיטות לימוד התפתחות חיידקים. פרוטוקול הציג כאן מעסיקה קורא microplate עם הליך ניסיוני מאוד וממליצה על הערכה מדויקת הדירים של התפתחות חיידקים. פרוטוקול זה שימש להערכת הצמיחה של מספר זנים Escherichia coli שתואר קודם לכן. השלבים העיקריים של הפרוטוקול הם כדלקמן: הכנת כמות גדולה של מניות תא בקבוקונים קטנים לבדיקות חוזרות ונשנות עם תוצאות לשחזור, השימוש של 96-ובכן צלחות להערכת גידול בתפוקה גבוהה בחישוב ידני של מייג'ור שני פרמטרים (קרי, צפיפות האוכלוסין וקצב הצמיחה המקסימלי) המייצג את הדינמיקה צמיחה. בהשוואה המסורתית המושבה יוצרי יחידה (CFU) וזמינותו, מה. שמסביר את התאים מתורבתים צינורות זכוכית לאורך זמן על פלטות אגר, השיטה הנוכחית יעיל יותר, מספק מפורט יותר רשומות הטמפורלי של צמיחה שינויים, אבל יש על ההחמרה מגבלת זיהוי-צפיפות אוכלוסין נמוכה. לסיכום, השיטה המתוארת היא יתרון לניתוח לשחזור ומדויק תפוקה גבוהה של התפתחות חיידקים, אשר יכול לשמש להסיק מסקנות רעיונית או כדי לבצע תצפיות תיאורטי.
Introduction
מחקרים מיקרוביולוגית בדרך כלל מתחילים עם התרבות של תאים חיידקיים, את ההערכה של עקומות התפתחות חיידקים, אשר מייצגים תופעה הבסיסית של פיזיולוגיה בקטריאליות1,2,3. עקרונות תרבות בסיסיים זמינים באופן נרחב ספרות המחקר שפורסם ואת ספרי הלימוד כי התרבות חיידקי היא מתודולוגיה היסוד. ברמת ספסל, תשומת לב רבה התמקדה באופן מסורתי על אופטימיזציה של צמיחה מדיה ו culturing תנאים, אך שליטה הצמיחה, אשר סביר לספק הבנה אפילו טובה יותר של חיידקים פיזיולוגיה, לא היה למדה בהרחבה4. עבור שמתקדמות חיידקים, פרמטר מפתח של המדינה הסלולר הוא שיעור צמיחה, אשר דווחה בתיאום עם הגנום, transcriptome, פרוטאום5,6,7,8 . לפיכך, הערכה כמותית של התפתחות חיידקים חיוני להבנת הפיזיולוגיה מיקרוביאלי.
כדי להעריך את התפתחות חיידקים, השיטות ניסיוני המשמש להערכת ביומסה וותיקה9,10 הינם מבוססים על הגילוי של פרמטרים ביוכימיים, פיזי או ביולוגיים, כגון עכירות אופטי. בנוסף, שיטות אנליטיות להשתמש כדי ללכוד את מאפייני צמיחה שינויים דינמיים בדרך כלל מבוססים על ויצר מודלים ליניאריים11,12,13, לדוגמה, לוגיסטיים משוואות. דינמיקה הגדילה נרכשים בדרך כלל על ידי דגימה מתוזמן של צמיחת תאים בתרבות באמצעות מדידת עכירות אופטי או ביצוע מבחני יחידה (CFU) המושבה יוצרי. המגבלה של שיטות אלה culturing וזיהוי היא נקודות הנתונים אינם השתקפות אמיתית של המלאכותיות כי מרווחי המדידה הם לעיתים קרובות בשעות וכי התנאי תרבות (למשל, שינויים בטמפרטורה, לערבב) מופר בזמנו של הדגימה. תרבות טכניקות ניתוח יש לעדכן באמצעות התפתחויות הטכנולוגיה והבנה. התפתחויות אחרונות microplate הקוראים לאפשר התצפית בזמן אמת של התפתחות חיידקים, להקטין באופן משמעותי את עלויות העבודה. באמצעות אלה מכשירים מתקדמים, המחקרים העדכניים ביותר על התפתחות חיידקים דיווחו על שיטות אנליטיות על תפוקה גבוהה מידות14,15.
המטרה של פרוטוקול זה היא להעריך את הדינמיקה צמיחה מדויק באופן תפוקה גבוהה, אשר יהיה יקר עבור מחקרים כמותיים המטפלות בסופו של דבר את השאלות כיצד נקבע קצב הגידול, אילו גורמים משפיעים על הצמיחה. הפרוטוקול מענה כל הגורמים אשר צריכים להילקח בחשבון עבור כימות הדיר ומדויק של התפתחות חיידקים. השיטה הניסיונית וניתוח מתוארים בפירוט רב הטקסט העיקרי. שיטה זו מאפשרת ניתוח לשחזור ומדויק של התפתחות חיידקים באופן תפוקה גבוהה. מיקרוביולוגים ניתן להשתמש בפרוטוקול זה להפיק תוצאות כמותיות נוספות מהראיות ניסיוני שלהם. פרוטוקול זה יכול לשמש גם ללימודי במערכות ביולוגיות שמנסות להסיק מסקנות רעיונית או להשיג סקירה תיאורטית של צמיחה.
Access restricted. Please log in or start a trial to view this content.
Protocol
1-הכנת מדיום הגידול
הערה: ההרכב הכימי של M63 בינונית מזערי הוא כדלקמן: 62 מ מ K-2-HPO-4, 39 מ מ ח' 2 PO 4, 15 מ מ (NH 4) 2 אז 4, 1.8 מיקרומטר מכל 4, 15 מיקרומטר תיאמין-HCl, MgSO 0.2 מ מ 4 ו- 22 מ"מ גלוקוז. M63 נעשית על ידי ערבוב שלושה פתרונות מניות: פתרון X חמש, גלוקוז 20% ו- MgSO 4 תיאמין פתרון. לאחסן את כל הפתרונות ב-4 מעלות צלזיוס
- הכנת הפתרון X חמש
- להכין מכל 4 פתרון, השתמש פיפטה של חשמל, על פיפטה סרולוגית חד פעמיות כדי להוסיף ddH 2 O שפופרת צנטרפוגה 50-mL. שימוש P-200 כדי להוסיף 0.06 מ ב- HCl כדי להשיג 0.01 M HCl. מוסיפים 36 מ"ג מכל 4-7 H 2 O ומערבבים היטב.
- למדוד 160 מ"ל ddH 2 O ב גליל מדידה ולהוסיף אותו גביע 500-mL. להוסיף את הפעולות הבאות לפי הסדר: 10.72 g K-2-HPO-4, 5.24 g ח' 2 PO 4, 2.0 g (NH 4) 2 אז 4 ו- 0.5 מ"ל מכל 4 פתרון (להכין בשלב 1.1.1).
- באמצעות מד pH דיוק, להתאים את רמת ה-pH אל 7.0 על-ידי הוספת 2 מ' KOH. יוצקים את הפתרון ב גליל מדידה ולהוסיף ddH 2 O הנפח הכולל של 200 מ. לעקר את הפתרון באמצעות יחידת סינון 250-mL (PVDF, 0.22 מיקרומטר).
- מכין את תמיסת גלוקוז 20%
- למדוד 200 מ ל ddH 2 O ב גליל מדידה ויוצקים אותו כדי גביע 500-mL. תוך כדי ערבוב בעזרת של פגים, להוסיף 50 גר' גלוקוז. לדלל את הפתרון ב גליל מדידה כדי הנפח הכולל של 250 מ. לחטא את הפתרון כפי שמתואר בשלב 1.1.3.
- הכנת הפתרון תיאמין MgSO 4
- להוסיף 150 מ ddH 2 O גביע 500-mL. תוך כדי ערבוב עם פגים, להוסיף 1.0 g של תיאמין-HCl ו- 10 גרם של MgSO 4-7 H 2 O. Dilute הפתרון ב גליל למדידת הנפח הכולל של 200 מ. לחטא את הפתרון כפי שמתואר בשלב 1.1.3.
- הכנת M63 בינונית מזערי
- מקום הפתרון X חמש, הפתרון גלוקוז 20%, הפתרון תיאמין MgSO 4, על פיפטה אלקטרונית, על פיפטה P-200 ועצות 200-µL פיפטה על ספסל נקי.
- למדוד 155.8 mL ddH 2 O ב גליל מדידה ויוצקים אותו לתוך גביע 500-mL-
- באמצעות פיפטה אלקטרונית פיפטה סרולוגית חד פעמית, להוסיף 40 מ של פתרון X 5 ו- 4 מ ל תמיסת גלוקוז 20% ddH נמדד 2 O. לאחר מכן, הוסף 0.2 מ"ל MgSO 4 תיאמין פתרון עם P-200. לחטא את הפתרון כפי שמתואר בשלב 1.1.3.
2. הכנת המניה גליצרול
תרבות- תא
הערה: זני חיידקים (למשל, W3110, שלה הגנום מופחתת) זמינים מארגונים הבנק זן. הזנים מתקבלים בדרך כלל בצורה של מושבות על פלטות אגר.- מקום חמישה צינורות זכוכית מעוקר עם stoppers גומי סיליקון, על פיפטה אלקטרוניים, P-1,000, טיפים פיפטה 1,000-µL, P-200, 200-µL פיפטה טיפים זנים היעד (מושבות על צלחות) על ספסל נקי.
- לחשוף את הפה של צינור זכוכית כדי מבער בונזן לפני פתיחת את פקק הגומי סיליקון. לחשוף את פקק הגומי סיליקון ללהבה לאחר הצינור נפתח, ולאחר מכן מקם בקלילות את הכובע בחזרה על המרקע זכוכית-
- השתמש פיפטה אלקטרונית פיפטה סרולוגית חד פעמיים כדי להוסיף אחד של צינורות זכוכית, 4.5 מ"ל M63 עד ארבעה צינורות אחרים מ ל M63.
- שימוש בקצה P-200 כדי לאסוף מושבה ואת לחסן אותו בצינור זכוכית המכיל 5 מ ל M63.
- מערבולת הצינור כדי להפוך השעיה. לאחר מכן, לדלל את הפתרון 10-fold על ידי העברת 0.5 מ"ל של פתרון זה לאחד ארבעה הצינורות המכילים 4.5 מ ל M63.
- חזור על התהליך שמתואר בשלב 2.1.5 עד שהשפופרות הנותרים. סדרה דילול עם ריכוזים שונים חמש (דילולים של 1, 10, 100, 1000, ו 10,000) מוכן כעת.
- לחטא את הפיות של צינורות זכוכית, stoppers גומי סיליקון כפי שמתואר בשלב 2.1.2. קאפ הצינורות עם פקקים. למנוע זיהום על-ידי לא קימוטי את stoppers גומי סיליקון.
- למקם את הצינורות חמש חממה חזק ומחוממת מראש ב 37 מעלות צלזיוס ומנערים במהירות של 200 סל ד. דגירה התרבות בין לילה או עבור ה 10-30
- הבחירה של התרבות המניות גליצרול
- במקום המדיום בטמפרטורת החדר מראש ומחוממת M63, P-1,000, טיפים פיפטה 1,000-µL ו- cuvette חד פעמיות על ספסל נקי.
- להוסיף 1000 µL M63 אל cuvette חד פעמיות עם P-1, 000. במקום את cuvette חד פעמיות בספקטרופוטומטר, להפעיל את התוכנית-גל קבוע של 600 nm, ולמדוד התותב.
- להעביר את צינורות זכוכית חמש החממה חזק הספסל נקי.
- M63 למחוק מן cuvette חד פעמיות ולהוסיף 1,000 תרבות µL cuvette חד פעמיות אותו עם P-1, 000. למדוד את עכירות אופטי של התרבות תאים (OD 600) כפי שמתואר בשלב 2.2.2.
הערה: כדי למנוע כל זיהום וכדי להשיג מידה מדויקת, לחשוף את צינורות זכוכית, פקקים של להבה כמתואר, מערבולת התרבות לפני דגימה. כדי להבטיח תוצאות אמינות, מדידות חוזרות מומלץ, במיוחד כאשר צפיפות התאים נמוך. - של חמשת תא תרבויות, לבחור אחת שהיא בשלב הגידול האקספוננציאלי מוקדם (OD 600 = 0.01 - 0.05) המניות גליצרול.
הערה: אם תרבויות רבות יש צפיפות בתוך הטווח האופטימלי, שקרוב ל 0.05 נפוץ נבחרה.
- להפוך את המניות גליצרול לבדיקות חוזרות ונשנות-
הערה: זה מתואר להכנת 10 מניות. סכומים גדולים יותר או קטנים יותר יכולים להתבצע בהתאם לדרישות ניסיוני.- מקום הפתרון גליצרול 60% מעוקר, 10 מחוטא מ 1.5-ל microtubes, P-1,000, P-200, טיפים פיפטה 1,000 - ו 200-µL ו- microtube לעמוד על ספסל נקי.
- µL 250 להוסיף מחוטא פתרון גליצרול 60% ו- 750 µL של התרבות התא שנבחר microtube 1.5-mL ומיקס ע י pipetting.
הערה: מניות נפח משתנה, אך תמיד לשמור על יחס של 1:3 של 60% גליצרול לתרבות תא; התוצאה הסופית ריכוז גליצרול 15%- - למקם את microtubes תשעה הנותרים ביציע microtube, לוותר על µL 100 של תערובת מוכנה בשלב 2.3.2 כדי כל שפופרת. יש עכשיו עשר מניות גליצרול זהה לשימוש עתידי.
- לאחסן את המניות במקפיא עמוק ב-80 מעלות צלזיוס
3. רכישת. את עקומות הגדילה
- הגדרת לקורא microplate.
הערה: התנאים שמוצג בהצגה מרכאות הנוסח ספציפי בשימוש בקורא צלחת המשמש כאן (ראה טבלה של החומרים).- פתח התוכנה. פתוח " פרוטוקולים " ב " ' מנהל המשימות ' " ובחר " צור חדש ". בחר " פרוטוקול סטנדרטי ".
- פתח " הליך ", והתאם את ההגדרות. פתוח " להגדיר טמפרטורה ", ובחר " חממה על ". הגדר " טמפרטורה " עד 37 ° C, " הדרגתיות " ל- 0 ° ג הסימון " Preheat " לפני שתמשיך לשלב הבא. פתוח " להתחיל קינטי ", קבע " בזמן ריצה " 24:00:00 או 48:00:00, ו " מרווח " 00:30:00 או 01:00:00-
הערה: זה לוקח כ 1 דקות לקריאה 96 כולו טוב צלחת- - פתח " לנער " ולהגדיר " מצב לנער " כמו " לינארית ". בדוק " Constitution לנער " ולהגדיר " תדר "-567 cpm. פתוח " לקריאה ", לבדוק " ספיגת ", " קצה/קינטית ", ו " Monochromators. " להגדיר " אורך גל " ל 600.
- לחץ " אמת " כדי לאשר כי הנוהל אינו נכון. לחץ על " להציל " לשמור אותה תוכנית חדשה לשימוש עתידי.
- בזמן אמת הקלטה של צמיחה
- לצייר של pictogram 96-ובכן צלחת (8 × 12 טבלה) כדי לציין את המיקום של הדגימות תרבות חוסנו בצלחת 96-ובכן. להדפיס את טבלת ולהשתמש בה כנקודת התייחסות לניסוי.
הערה: בארות ממוקם בשולי microplate צריך להכיל רק מדיום ריק בשל התאיידות. - המקום פנצ'ר 96-ובכן סטיריליים microplate התחתון עם מכסה, P-1000, טיפים פיפטה 1000-µL, P-200, 200-µL פיפטה טיפים, microtubes 1.5-מ"ל במספר, פיפטה של 8-רב-ערוצי, מאגר ריאגנט מעוקר, בטמפרטורת החדר M63 של גליצרול מניות (להכין בשלב 2.3) על ספסל נקי.
- להוסיף כ- 25 מ ל M63 המאגר מגיב. השתמש מלאי מאגר זה על כל השלבים הבאים-
- הוסף 900 µL M63 microtubes לקראת ביצוע דילולים טורי.
- להפשיר את המניה גליצרול בטמפרטורת החדר. הוסף 900 µL M63 גליצרול המופשרים המניות ו מערבולת. התוצאה היא לדילול המניות גליצרול המקורי 10-fold.
- µL 100 העברה של דילול 10-fold כדי microtube אחר המכיל 900 µL של M63 ו מערבולת. התוצאה היא לדילול 100-fold.
- חזור על שלב 3.2.6 עד המספר הרצוי של דילולים משימותיה.
- למלא את הבארות בקצה microplate עם M63 µL 200 באמצעות פיפטה ערוץ 8 (P-200).
הערה: הבארות הללו יכול לשמש הריק. - טען 200 µL של כל אחד מדולל מדגם שהוכנו בשלבים 3.2.4 - 3.2.7 לבארות microplate על פי הטבלה הפניה (שלב 3.2.1). מערבולת המנזר דגימות מדולל הטעינה, טען אותו לטעום בבארות מרובים-מגוון מיקומים על הצלחת.
- למקם את microplate 96-ובכן על הקורא צלחת-
- פתח " לקריאה עכשיו " ב " ' מנהל המשימות ' " ובחרו את התוכנית (סעיף 3.1). לחץ על " אישור " להתחיל מדידה. להציל את ההקלטה כקובץ ניסיוני חדש לניתוח נתונים (סעיף 4).
- לצייר של pictogram 96-ובכן צלחת (8 × 12 טבלה) כדי לציין את המיקום של הדגימות תרבות חוסנו בצלחת 96-ובכן. להדפיס את טבלת ולהשתמש בה כנקודת התייחסות לניסוי.
4. ניתוח נתונים
- לייצא התוצאות של נתונים בזמן אמת-שיעור הצמיחה (סעיף 3.2) אל זיכרון USB מקל כקובץ טקסט.
הערה: תוצאות מעוצב 96-ובכן (עקומות) יוצגו על הקורא צלחת בזמן אמת. ניתן לייצא את הרשומות לפי שעה (OD ערכים) כטבלה; השורות והעמודות לייצג את המספרים היטב (למשל, A1, B1) ואת הזמן מדידה (לדוגמה, 00:00:59), בהתאמה. - פתח את קובץ הטקסט באמצעות תוכנת גיליון אלקטרוני-
- להעתיק את קריאות מדי שעה 600 OD של microplate 96-ובכן גליון עבודה חדש לניתוח נוסף.
- הפחת הרקע רוברטס. זמן אפס מ קריאות מדי שעה של כל מדגם טוב.
הערה: לנוחיותכם, הערך הממוצע של הריק בארות M63 המכיל (שלב 3.2.8) יכול לשמש רקע הערך. - לחשב את ממוצעם הקריאות חמש רצופות OD 600 כדי להעריך את צפיפות האוכלוסייה מקסימלי.
הערה: הערך הממוצע הגדול ביותר של חמש רצופות OD 600 הקריאות מוגדר ה OD מקסימלי 600 של עקומת גדילה המתאים. - לחשב את קצב הצמיחה, ממוצע (h -1), על-ידי החלת את המשוואה הבאה עבור כל זוגות ערכים רציפים של יתר 600:
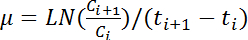
הערה: במשוואה, C אני ו C אני + 1 מייצג את הערכים 600 OD של כל נקודות רצופות זמן שני (t אני ו- t אני + 1, בהתאמה). LN מציין הלוגריתם הטבעי. - חישוב שינויי קצב הצמיחה לאורך זמן על סמך מדי שעה יתר 600 קורא לפי שלב 4.6. חישוב הממוצע, סטיית התקן של חמישה שיעורי צמיחה רצופים כדי להעריך את קצב הצמיחה המקסימלי.
הערה: הממוצע הגדול ביותר עם סטיית התקן הקטן מוגדר הצמיחה המקסימלי של עקומת גדילה המתאים.
5. המאשר הטיה הכללית הקריאות 96-ובכן (אופציונלי)
הערה: הן את הצלחת קורא את הצלחת 96-ובכן מתכלים יכול לגרום מדידות משוחד. כדי להשיג תוצאות כמותיות לשחזור ומדויק מאוד, המאשר הטיה הכללית של צלחת 96-ובכן מומלץ בחום.
- להכין את הצלחת 96-ובכן, הקורא צלחת עבור הבדיקה הסטייה כמתואר בסעיף 3.2.2.
- להוסיף 20 מ"ל M63 עד שפופרת צנטרפוגה 50-mL מעוקר. הוסף את המניה גליצרול באותו צינור צנטריפוגה, מערבולת. להעביר את הפתרון מושעה מאגר ריאגנט מעוקר.
- להשתמש פיפטה של ערוץ 8 כדי להעביר µL 200 של הפתרון מושעה לצלחת 96-ובכן.
- למקם את הצלחת 96-ובכן על הקורא צלחת, להתחיל את המדידה.
- שיא מדי שעה OD 600 קורא ולנתח כמתואר בסעיף 4. להשוות בין צמיחה מקסימאלית מחושב שיעור והאוכלוסיה הצפיפות של כל טוב כדי לקבוע הטיה locational הקריאות 96-ובכן.
Access restricted. Please log in or start a trial to view this content.
תוצאות
השיטה המתוארת מספק אמצעים כדי ללכוד את התפתחות חיידקים דינמי בצורה רציפה, תפוקה גבוהה על ידי ניצול קורא פורמט 96-ובכן זה לוקח מספר מדידות צפיפות אופטית במרווחי זמן שונים (מתוך דקות שעות עד ימים). עקומות גדילה של מגוון של זנים e. coli לבטא הגנום שונים ניתן לרכוש דווקא בניס?...
Access restricted. Please log in or start a trial to view this content.
Discussion
שלבים קריטיים בפרוטוקול כוללות הכנת מלאי משותף של שמתקדמות תאים, השכפול של הדגימות באותו בבארות מרובים-עמדות שונות על microplate. בעבר, מיקרוביולוגים החלה התרבות מתרבות מראש בין לילה. בעוד ששיטה זו עשויה להפחית את זמן ההשהיה של התפתחות חיידקים, קשה להשיג. את עקומות גדילה לשחזור. כפי שמוצג
Access restricted. Please log in or start a trial to view this content.
Disclosures
אנו מודים Kohei טסוצ'יה למתן הדוגמה assay CFU. עבודה זו חלקית מבחינה כלכלית נתמך על ידי מענק הסיוע עבור מחקר מדעי (ג) מס 26506003 (ל BWY) של משרד החינוך, תרבות, ספורט, מדע, טכנולוגיה, יפן.
Acknowledgements
המחברים אין לחשוף.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| K2HPO4 | Wako | 164-04295 | |
| KH2PO4 | Wako | 166-04255 | |
| (NH4)2SO4 | Wako | 019-03435 | |
| MgSO4-7H2O | Wako | 138-00415 | |
| Thiamine-HCl | Wako | 201-00852 | |
| glucose | Wako | 049-31165 | |
| HCl | Wako | 080-01066 | |
| Iron (II) sulfate heptahydrate (FeSO4-7H2O) | Wako | 094-01082 | |
| KOH | Wako | 168-21815 | |
| Glycerol | Wako | 075-00611 | |
| Centrifuge tube (50 mL, sterilized) | WATSON | 1342-050S | |
| Pipette Tips, 200 µL | WATSON | 110-705Y | |
| Pipette Tips, 1,000 µL | WATSON | 110-8040 | |
| Microtube (1.5 mL) | WATSON | 131-715C | |
| 8 multichannel-pipette | WATSON | NT-8200 | |
| PASORINA STIRRER | AS ONE | 2-4990-02 | |
| Glass cylinder (200 mL) | AS ONE | 1-8562-07 | |
| Precision pH mater | AS ONE | AS800 / 1-054-01 | |
| Pipetman P-200 | GILSON | 1-6855-05 | |
| Pipetman P-1000 | GILSON | 1-6855-06 | |
| Disposable Serolocical Pipettes (10 mL) | SANPLATEC | SAN27014 | |
| Disposable Serolocical Pipettes (25 mL) | SANPLATEC | SAN27015 | |
| Microtube stand | BM Bio | 801-02Y | |
| Vortex | BM Bio | BM-V1 | |
| Corning Costar 96-well microplate with lid (Flat bottom, Clear) | Sigma-Aldrich | Corning, 3370 | |
| Corning Costar reagent reservoir (50 mL) | Sigma-Aldrich | Corning, 4870 | |
| Stericup GV PVDF (250 mL, 0.22 µM) | Merck Millipore | SCGVU02RE | |
| Pipet-Aid XP | DRUMMOND | 4-000-101 | |
| Bioshaker (BR-23UM MR) | TAITEC | 0053778-000 | |
| Disposal cell (1.5 mL) | Kartell | 1938 / 2-478-02 | |
| DU 730 Life Science UV/Vis Spectrophotometer | Beckman Coulter | A23616 | |
| EPOCH2 | BioTek | 2014-EP2-002 / EPOCH2T | |
| Beaker (500 mL) | IWAKI | 82-0008 | |
| BIO clean bench | Panasonic | MCV-B131F | |
| Glass tubes | NICHIDEN RIKA GLASS | P-10M~P-30 /101019 | |
| Silicone rubber stoppers | ShinEtsu Polymer | T-19 | |
| Bacterial strains | Strain bank organization; National Bio Resource Project (NBRP) in Japan |
References
- Kovarova-Kovar, K., Egli, T. Growth kinetics of suspended microbial cells: from single-substrate-controlled growth to mixed-substrate kinetics. Microbiol Mol Biol Rev. 62 (3), 646-666 (1998).
- Soupene, E., et al. Physiological studies of Escherichia coli strain MG1655: growth defects and apparent cross-regulation of gene expression. J Bacteriol. 185 (18), 5611-5626 (2003).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Egli, T. Microbial growth and physiology: a call for better craftsmanship. Front Microbiol. 6, 287(2015).
- Kurokawa, M., Seno, S., Matsuda, H., Ying, B. W. Correlation between genome reduction and bacterial growth. DNA Res. 23 (6), 517-525 (2016).
- Matsumoto, Y., Murakami, Y., Tsuru, S., Ying, B. W., Yomo, T. Growth rate-coordinated transcriptome reorganization in bacteria. BMC Genomics. 14, 808(2013).
- Nahku, R., et al. Specific growth rate dependent transcriptome profiling of Escherichia coli K12 MG1655 in accelerostat cultures. J Biotechnol. 145 (1), 60-65 (2010).
- Dai, X., et al. Reduction of translating ribosomes enables Escherichia coli to maintain elongation rates during slow growth. Nat Microbiol. 2, 16231(2016).
- Madrid, R. E., Felice, C. J. Microbial biomass estimation. Crit Rev Biotechnol. 25 (3), 97-112 (2005).
- Harris, C. M., Kell, D. B. The estimation of microbial biomass. Biosensors. 1 (1), 17-84 (1985).
- Yates, G. T., Smotzer, T. On the lag phase and initial decline of microbial growth curves. J Theor Biol. 244 (3), 511-517 (2007).
- Kargi, F. Re-interpretation of the logistic equation for batch microbial growth in relation to Monod kinetics. Lett Appl Microbiol. 48 (4), 398-401 (2009).
- Peleg, M., Corradini, M. G. Microbial growth curves: what the models tell us and what they cannot. Crit Rev Food Sci Nutr. 51 (10), 917-945 (2011).
- Sprouffske, K., Wagner, A. Growthcurver: an R package for obtaining interpretable metrics from microbial growth curves. BMC Bioinformatics. 17, 172(2016).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Mol Biol Evol. 31 (1), 232-238 (2014).
- Hermsen, R., Okano, H., You, C., Werner, N., Hwa, T. A growth-rate composition formula for the growth of E.coli on co-utilized carbon substrates. Mol Syst Biol. 11 (4), 801(2015).
- Engen, S., Saether, B. E. r- and K-selection in fluctuating populations is determined by the evolutionary trade-off between two fitness measures: Growth rate and lifetime reproductive success. Evolution. 71 (1), 167-173 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved