É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preciso, elevado-throughput análise do crescimento bacteriano
Neste Artigo
Resumo
Avaliação quantitativa do crescimento bacteriano é essencial para a fisiologia microbiana como um fenômeno de sistemas-nível de compreensão. Um protocolo para uma abordagem analítica e manipulação experimental são introduzidos, permitindo a análise precisa, elevado-throughput de crescimento bacteriano, que é um tema chave de interesse em biologia de sistemas.
Resumo
Crescimento bacteriano é um conceito central no desenvolvimento da moderna fisiologia microbiana, bem como na investigação da dinâmica celular a nível de sistemas. Estudos recentes têm relatado correlações entre o crescimento bacteriano e eventos de todo o genoma, tais como reorganização de redução e transcriptoma do genoma. Analisar corretamente o crescimento bacteriano é crucial para a compreensão da coordenação de crescimento dependente de gene funções e componentes celulares. Nesse sentido, a avaliação quantitativa precisa de crescimento bacteriano em forma de alto rendimento é necessária. Desenvolvimentos tecnológicos emergentes oferecem novas ferramentas experimentais que permitem atualizações dos métodos utilizados para estudar o crescimento bacteriano. O protocolo introduzido aqui emprega um leitor de microplacas com um procedimento experimental altamente otimizado para a avaliação do crescimento bacteriano preciso e reprodutível. Este protocolo foi utilizado para avaliar o crescimento de vários descrito anteriormente estirpes de Escherichia coli . As principais etapas do protocolo são os seguintes: a preparação de um grande número de ações de célula em pequenos frascos para testes repetidos com resultados reprodutíveis, o uso de placas de 96 poços para avaliação de crescimento elevado-throughput e o cálculo manual de duas principais parâmetros (ou seja, densidade de população e taxa de crescimento máxima) que representa a dinâmica de crescimento. Em comparação com o tradicionais formadoras unidade (CFU) do ensaio, que conta as células que são cultivadas em tubos de vidro ao longo do tempo em placas de ágar, o presente método é mais eficiente e fornece registros temporais mais detalhados das alterações de crescimento, mas tem um mais rigorosas limite de deteção em densidades de população baixas. Em resumo, o método descrito é vantajoso para a análise da elevado-produção precisa e reprodutível de crescimento bacteriano, que pode ser usado para tirar conclusões conceituais ou fazer observações teóricas.
Introdução
Estudos microbiológicos muitas vezes começam com a cultura de células bacterianas e a avaliação das curvas de crescimento bacteriano, que representam um fenômeno fundamental da fisiologia bacteriana1,2,3. Princípios básicos de cultura estão amplamente disponíveis na literatura de pesquisa publicados e livros didáticos, porque a cultura bacteriana é uma metodologia fundamental. No nível do banco, substancial atenção tradicionalmente tem sido focada na otimização de meios de crescimento e condições de cultivo, mas controlando a taxa de crescimento, que provavelmente proporcionará maior compreensão da fisiologia microbiana, não foi extensivamente estudados4. Para bactérias de crescimento exponencial, um parâmetro chave do estado celular é a taxa de crescimento, o que foi relatada para ser coordenado com o genoma, transcriptoma e proteoma5,6,7,8 . Assim, a avaliação quantitativa do crescimento bacteriano é crucial para a compreensão fisiologia microbiana.
Para avaliar o crescimento bacteriano, os métodos experimentais utilizados para estimar a biomassa são bem estabelecida9,10 e baseiam-se na detecção de parâmetros bioquímicos, físicos ou biológicos, tais como turbidez óptica. Além disso, os métodos analíticos utilizados para capturar as propriedades dinâmicas de mudanças de crescimento comumente são baseados em modelos não-lineares estabelecida11,12,13, por exemplo, as equações logísticas. Dinâmica de crescimento geralmente é adquirida por amostragem cronometrada do crescimento celular em cultura por medição óptica turbidez ou realizando ensaios de unidade (CFU) formadoras. A limitação destes métodos de cultivo e deteção é que os pontos de dados não são um verdadeiro reflexo da dinâmica populacional, porque os intervalos de medição são muitas vezes em horas e a condição da cultura (por exemplo, mudanças na temperatura e aeração) é perturbada no momento da amostragem. Técnicas de cultura e análise devem ser atualizadas usando o desenvolvimentos recentes na tecnologia e na compreensão. Avanços recentes em leitores de microplacas permitem a observação em tempo real de crescimento bacteriano e diminuem significativamente os custos trabalhistas. Usando estes dispositivos avançados, os últimos estudos sobre crescimento bacteriano relataram métodos analíticos para medições de alta produtividade14,15.
O propósito do presente protocolo é avaliar a dinâmica de crescimento precisa de uma forma de alto rendimento, que será valiosa para estudos quantitativos que, finalmente, abordar as questões de como a taxa de crescimento é determinada e que fatores afetam a taxa de crescimento. O protocolo aborda todos os fatores que devem ser tomados em consideração para a quantificação precisa e repetível de crescimento bacteriano. O método experimental e a análise são descritas em detalhes no texto principal. Este método permite a análise precisa e reprodutível de crescimento bacteriano de uma forma de alta produtividade. Microbiologistas podem usar este protocolo para derivar resultados quantitativos adicionais de suas evidências experimentais. Este protocolo também pode ser usado para estudos em biologia de sistemas que tentam tirar conclusões conceituais ou para alcançar uma visão teórica de crescimento.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. preparar o meio de crescimento
Nota: A composição química do mínimo M63 médio é a seguinte: 62 mM K 2 HPO 4, 39 milímetros KH 2 PO 4, 15mm (NH 4) 2 SO 4, 1,8 µM Filipa 4, 15 µM tiamina-HCl, 0,2 mM de MgSO 4 e glicose de 22 mM. M63 é feita pela mistura de três soluções estoque: solução X cinco, 20% de glicose e MgSO 4 solução de tiamina. Armazene todas as soluções a 4 ° C.
- Preparar a solução de 5 X
- para preparar a solução de 4 Filipa, use uma pipeta elétrica e uma pipeta sorológica descartável para adicionar ddH 2 O tubo de centrífuga de 50 mL. Use um P-200 para adicionar 0,06 mL HCl para obter 0,01 M HCl. Adicione 36 mg Filipa Ferreira 4-7 H 2 O e misturar bem.
- Medir 160 mL ddH 2 O em uma proveta graduada e adicioná-lo para um copo de 500 mL. Adicione o seguinte nesta ordem: 10,72 g K 2 HPO 4, g 5,24 KH 2 PO 4, 2,0 g (NH 4) 2 SO 4 e 0,5 mL de solução de 4 de Filipa (preparada na etapa 1.1.1).
- Usando um medidor de pH de precisão, ajustar o pH a 7,0 adicionando 2 M KOH. Despeje a solução em uma proveta graduada e adicionar O ddH 2 para um volume total de 200 mL. Esterilizar a solução usando uma unidade de filtração de 250 mL (PVDF, 0,22 µM).
- Preparar a solução de glicose 20%
- medir 200ml ddH 2 O em uma proveta graduada e derramá-lo para um copo de 500 mL. Enquanto mistura utilizando um agitador magnético, adicione 50 g de glicose. Dilua a solução em uma proveta graduada para um volume total de 250 mL. Esterilizar a solução, conforme descrito na etapa 1.1.3.
- Preparar a solução de tiamina MgSO 4
- Adicionar 150 mL ddH 2 O para um copo de 500 mL. Enquanto mistura com um agitador magnético, adicione 1,0 g de tiamina-HCl e 10 g de MgSO 4-7 H 2 O. Dilua a solução em uma proveta graduada para um volume total de 200 mL. Esterilizar a solução, conforme descrito na etapa 1.1.3.
- M63 médio mínimo de preparação
- Coloque a solução de 5 X, a solução de glicose de 20%, a solução de tiamina MgSO 4, uma pipeta eletrônica, uma pipeta P-200 e pontas de pipetas de 200 µ l sobre uma bancada limpa.
- Medir 155,8 mL ddH 2 O em uma proveta graduada e despeje em um copo de 500 mL.
- Usando a pipeta eletrônica e pipeta sorológica descartável, adicionar 40 mL de solução X 5 e 4 mL de solução de glicose 20% para o ddH medido 2 O. Em seguida, adicione 0,2 mL de solução de tiamina MgSO 4 com o P-200. Esterilizar a solução, conforme descrito na etapa 1.1.3.
2. Preparando o estoque de glicerol
cultura- celular
Nota: as cepas bacterianas (por exemplo, W3110 e seus genomas reduzidas) estão disponíveis a partir de organizações bancárias de estirpe. As cepas são geralmente obtidas sob a forma de colônias em placas de ágar.- Coloque cinco tubos de vidro esterilizado com rolhas de borracha de silicone, uma pipeta eletrônica, P-1,000, pontas de pipetas de 1.000 µ l, P-200, pontas de pipetas de 200 µ l e as estirpes alvo (colônias em placas) sobre uma bancada limpa.
- Expor a boca do tubo de vidro para um bico de Bunsen antes de abrir a tampa de borracha do silicone. Expor a rolha de borracha do silicone da chama depois que o tubo é aberto e em seguida levemente Coloque a tampa de volta no tubo de vidro.
- Usar o eletrônica pipeta e pipeta sorológica descartável para adicionar 5ml M63 para um dos tubos de vidro e 4,5 mL M63 aos outros quatro tubos.
- Use a ponta de P-200 para escolher uma colônia e inoculá-lo no tubo de vidro contendo 5ml M63.
- o tubo de vórtice tornar-se uma suspensão. Em seguida, diluir a solução 10-fold ao transferir 0,5 mL desta solução para um dos quatro tubos contendo 4,5 mL M63.
- Repetir o processo descrito na etapa 2.1.5 para os tubos restantes. Uma série de diluição com cinco diferentes concentrações (diluições de 1, 10, 100, 1000 e 10.000) está agora pronto.
- Esterilizar as bocas dos tubos de vidro e as rolhas de borracha do silicone, conforme descrito na etapa 2.1.2. Tampa os tubos com as rolhas. Evitar a contaminação por não enrugar-se as rolhas de borracha de silicone.
- Coloque os cinco tubos numa incubadora de agitação previamente aquecido a 37 ° C e agitar a 200 rpm. Incubar a cultura durante a noite ou para 10 a 30 h.
- Seleção da cultura para o estoque de glicerol
- Coloque o médio pré-aquecido temperatura M63, P-1,000, pontas de pipetas de 1.000 µ l e uma cubeta descartável sobre uma bancada limpa.
- Adicionar 1000 µ l M63 para uma cubeta descartável com uma P-1, 000. Coloque a cubeta descartável em um espectrofotômetro, iniciar o programa em um comprimento de onda fixo de 600 nm e medir o espaço em branco.
- Mover os tubos de vidro de cinco de incubadora tremendo para o banco limpo.
- M63 descartar da cubeta descartável e adicionar 1.000 cultura µ l para a mesma cubeta descartável com uma P-1, 000. Medir a turbidez óptica da cultura de pilha (OD 600), conforme descrito na etapa 2.2.2.
Nota: Para evitar qualquer contaminação e para conseguir uma medição precisa, expor os tubos de vidro e as rolhas à chama conforme descrito e vórtice a cultura antes da amostragem. Para garantir resultados confiáveis, medidas repetidas são recomendadas, particularmente quando a densidade celular é baixa. - Dos cinco culturas de células, escolha um que está em fase inicial de crescimento exponencial (OD 600 = 0,01 - 0,05) para o estoque de glicerol.
Nota: Se múltiplas culturas têm densidade dentro da faixa ideal, o mais próximo de 0,05 é comumente selecionado.
- As existências de glicerol para testes repetidos.
Nota: Isto é descrito para a preparação de dez ações. Quantidades maiores ou menores podem ser feitas de acordo com as condições experimentais.- Coloque a solução de glicerol 60% esterilizada, dez esterilizados microtubos de 1,5 mL, P-1,000 e P-200, pontas de pipetas de 1.000 e 200 µ l e um microtubo pisar um banco limpo.
- Adicionar 250 µ l esterilizado 60% solução de glicerol e 750 µ l a cultura de célula selecionada para o microtubo de 1,5 mL e misture pipetando.
Nota: O volume de ações é variável, mas sempre manter uma relação de 1:3 de 60% de glicerol para cultura de células; Isso resulta em uma concentração final de 15% de glicerol. - Coloque os restantes nove microtubos no stand microtubo e dispensar 100 µ l da mistura preparada na etapa 2.3.2 a cada tubo. Agora, existem dez unidades populacionais de glicerol idênticos para uso futuro.
- Armazenar os estoques em um congelador a -80 ° C.
3. Adquirindo as curvas de crescimento
- configurar o leitor de microplacas.
Nota: Os termos mostrados em aspas mostrar o fraseado específico usado na leitora de placa usado aqui (veja a tabela de materiais).- Abrir o software. Aberto " protocolos de " em " Gerenciador de tarefas " e escolha " criar nova ". Escolha " protocolo padrão ".
- Open " procedimento " e ajustar as configurações. Aberto " temperatura definida " e selecione " incubadora na ". Conjunto " temperatura " a 37 ° C e " gradiente " para 0 ° C. Check " Preaqueça " antes de continuar com a próxima etapa. Aberto " começar a cinética ", conjunto " tempo de execução " para 24:00:00 ou 48:00:00, e " intervalo de " para 00:30:00 ou 01:00.
Nota: Demora cerca de 1 min para ler um inteiro 96 placa bem. - Open " Shake " e defina " Shake modo " como " Linear ". Verificar " Cosalvaguardar o Shake " e defina " frequência " em 567 cpm. Aberto " leitura ", verificar " absorvância ", " Endpoint/cinética ", e " Monochromators. " conjunto " comprimento de onda " a 600.
- Clique " Validate " para confirmar que o procedimento está correto. Clique em " salvar " para salvá-lo como um novo programa para uso futuro.
- Em tempo real, gravação de crescimento
- desenhar um pictograma placa de 96 poços (8 × 12 tabela) para indicar as posições das amostras de cultura inoculado na placa de 96 poços. Imprima a tabela e usá-lo como uma referência para o experimento.
Nota: Os poços localizados nas bordas do microplate devem conter apenas médio em branco por causa da evaporação.
Microplacas de fundo - lugar um apartamento 96 poços esterilizado com tampa, P-1000, pontas de pipetas de 1000 µ l, P-200, pontas de pipetas de 200 µ l, vários microtubos de 1,5 mL, uma pipeta multicanal-8, um reservatório de reagente esterilizado, temperatura M63 e o glicerol estoques (preparados no passo 2.3) sobre uma bancada limpa.
- Adicionar cerca de 25 mL M63 para o reservatório de reagente. Use este estoque de reservatório para todas as etapas a seguir.
- µ L adicionar 900 M63 para os microtubos em preparação para fazer diluições em série.
- Descongelar o estoque de glicerol em temperatura ambiente. Adicionar 900 µ l M63 para o estoque de glicerol descongeladas e vortex. Isso resulta em uma diluição de 10 vezes da unidade populacional de glicerol original.
- Transferir 100 µ l da diluição 10 vezes para outro microtubo contendo 900 µ l de M63 e vortex. Isso resulta em uma diluição de 100 vezes.
- Repita o passo 3.2.6 até o número desejado de diluições é alcançado.
- Encher os poços na borda do microplate com 200 µ l M63 usando uma pipeta de 8 canais (P-200).
Nota: Estes poços podem ser usados como o espaço em branco. - Carga 200 µ l de cada diluído amostra preparada em etapas 3.2.4 - 3.2.7 para os poços da microplaca de acordo com a tabela de referência (passo 3.2.1). Vórtice a prévia de amostras diluídas para carga e carga a mesma amostra em vários poços em variados locais na placa.
- Coloque o leitor de microplacas de 96 poços.
- Open " Leia agora " em " Gerenciador de tarefas " e escolha o programa (seção 3.1). Clique " Okey " para iniciar a medição. Salve a gravação como um novo arquivo experimental para análise de dados (seção 4).
- desenhar um pictograma placa de 96 poços (8 × 12 tabela) para indicar as posições das amostras de cultura inoculado na placa de 96 poços. Imprima a tabela e usá-lo como uma referência para o experimento.
4. Análise de dados
- exportação dos resultados dos dados em tempo real de taxa de crescimento (seção 3.2) para uma memória USB vara como um arquivo de texto.
Nota: Um resultado formatado 96 poços (curvas) irá exibir na leitora de placa em tempo real. Os registros de hora em hora (valores de OD) podem ser exportados como uma tabela; as linhas e colunas representam os números bem (por exemplo, A1, B1) e o tempo de medição (por exemplo, 00:00:59), respectivamente. - Abrir o arquivo de texto com um software de planilha eletrônica.
- Copie o lê de 600 OD horário de microplacas de 96 poços para uma nova planilha para uma análise mais aprofundada.
- Subtrair o fundo lê no tempo zero das leituras horárias de cada amostra bem.
Nota: Para sua conveniência, o valor médio do branco poços contendo M63 (etapa 3.2.8) pode ser usada como o valor de background. - Calcular a média de cinco consecutivos OD 600 leituras para estimar a densidade populacional máxima.
Nota: O maior valor médio das cinco leituras consecutivas de 600 OD é definido como o máximo de OD 600 da curva de crescimento correspondente. - Calcular a taxa de crescimento, μ (h -1), aplicando-se a seguinte equação para todos os pares de valores consecutivos de OD 600:
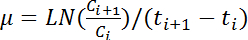
Nota: nesta equação, C eu e C i + 1 representam os valores de 600 de OD de quaisquer dois pontos de tempo consecutivos (t eu e t i + 1, respectivamente). LN indica o logaritmo natural. - Calcular as alterações na taxa de crescimento ao longo do tempo com base na cada hora OD 600 lê conforme item 4.6. Calcular a média e o desvio padrão das taxas de crescimento consecutivo cinco para estimar a taxa de crescimento máxima.
Nota: A maior média com o menor desvio padrão é definida como a taxa de crescimento máxima da curva de crescimento correspondente.
5. Confirmando o viés Global das leituras de 96 poços (opcional)
Nota: tanto a placa leitor e a placa de 96 poços consumível podem causar medições tendenciosas. Para conseguir resultados quantitativos altamente precisos e reprodutíveis, confirmando a tendência global da placa de 96 poços é altamente recomendado.
- Preparar a placa de 96 poços e o leitor para o teste de bias, conforme descrito na seção 3.2.2.
- Adicionar 20 mL M63 para um tubo de centrífuga de 50 mL esterilizado. Adicione o caldo de glicerol para o mesmo tubo de centrífuga e vortex. Transferir a solução de suspensa para um reservatório de reagente esterilizado.
- Utilizar uma pipeta de 8 canais para transferir 200 µ l da solução de suspensão para a placa de 96 poços.
- Colocar a placa de 96 poços na leitora de placa e iniciar a medição.
- Registro de hora em hora OD 600 lê e analisar como descrito na seção 4. Comparar a densidade de população e taxa de crescimento máximo calculado de cada poço para determinar a localização viés das leituras de 96 poços.
Access restricted. Please log in or start a trial to view this content.
Resultados
O método descrito fornece um meio de capturar dinâmico crescimento bacteriano de forma contínua, alta produtividade, utilizando um leitor de formato de 96 poços que leva várias medições de densidade óptica em vários intervalos de tempo (de minutos a horas e dias). As curvas de crescimento de uma variedade de cepas de Escherichia coli expressando vários genomas podem ser adquiridas precisamente em uma única experiência (figura 1A). Em comp...
Access restricted. Please log in or start a trial to view this content.
Discussão
Passos críticos no protocolo incluem a preparação de um estoque comum de células e a replicação das mesmas amostras em vários poços em várias posições na microplate exponencialmente crescentes. Anteriormente, microbiólogos começaram a cultura de uma pre-cultura durante a noite. Enquanto este método pode reduzir o tempo de retardo de crescimento bacteriano, é difícil conseguir-se curvas de crescimento podem ser reproduzidos. Como mostrado na Figura 2, as medições independent...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecemos Kohei Tsuchiya fornecendo o exemplo de ensaio de UFC. Este trabalho foi parcialmente financeiramente apoiado por um subsídio para investigação científica (C) no. 26506003 (para BWY) do Ministério da educação, cultura, esportes, ciência e tecnologia, Japão.
Agradecimentos
Os autores não têm nada para divulgar.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| K2HPO4 | Wako | 164-04295 | |
| KH2PO4 | Wako | 166-04255 | |
| (NH4)2SO4 | Wako | 019-03435 | |
| MgSO4-7H2O | Wako | 138-00415 | |
| Thiamine-HCl | Wako | 201-00852 | |
| glucose | Wako | 049-31165 | |
| HCl | Wako | 080-01066 | |
| Iron (II) sulfate heptahydrate (FeSO4-7H2O) | Wako | 094-01082 | |
| KOH | Wako | 168-21815 | |
| Glycerol | Wako | 075-00611 | |
| Centrifuge tube (50 mL, sterilized) | WATSON | 1342-050S | |
| Pipette Tips, 200 µL | WATSON | 110-705Y | |
| Pipette Tips, 1,000 µL | WATSON | 110-8040 | |
| Microtube (1.5 mL) | WATSON | 131-715C | |
| 8 multichannel-pipette | WATSON | NT-8200 | |
| PASORINA STIRRER | AS ONE | 2-4990-02 | |
| Glass cylinder (200 mL) | AS ONE | 1-8562-07 | |
| Precision pH mater | AS ONE | AS800 / 1-054-01 | |
| Pipetman P-200 | GILSON | 1-6855-05 | |
| Pipetman P-1000 | GILSON | 1-6855-06 | |
| Disposable Serolocical Pipettes (10 mL) | SANPLATEC | SAN27014 | |
| Disposable Serolocical Pipettes (25 mL) | SANPLATEC | SAN27015 | |
| Microtube stand | BM Bio | 801-02Y | |
| Vortex | BM Bio | BM-V1 | |
| Corning Costar 96-well microplate with lid (Flat bottom, Clear) | Sigma-Aldrich | Corning, 3370 | |
| Corning Costar reagent reservoir (50 mL) | Sigma-Aldrich | Corning, 4870 | |
| Stericup GV PVDF (250 mL, 0.22 µM) | Merck Millipore | SCGVU02RE | |
| Pipet-Aid XP | DRUMMOND | 4-000-101 | |
| Bioshaker (BR-23UM MR) | TAITEC | 0053778-000 | |
| Disposal cell (1.5 mL) | Kartell | 1938 / 2-478-02 | |
| DU 730 Life Science UV/Vis Spectrophotometer | Beckman Coulter | A23616 | |
| EPOCH2 | BioTek | 2014-EP2-002 / EPOCH2T | |
| Beaker (500 mL) | IWAKI | 82-0008 | |
| BIO clean bench | Panasonic | MCV-B131F | |
| Glass tubes | NICHIDEN RIKA GLASS | P-10M~P-30 /101019 | |
| Silicone rubber stoppers | ShinEtsu Polymer | T-19 | |
| Bacterial strains | Strain bank organization; National Bio Resource Project (NBRP) in Japan |
Referências
- Kovarova-Kovar, K., Egli, T. Growth kinetics of suspended microbial cells: from single-substrate-controlled growth to mixed-substrate kinetics. Microbiol Mol Biol Rev. 62 (3), 646-666 (1998).
- Soupene, E., et al. Physiological studies of Escherichia coli strain MG1655: growth defects and apparent cross-regulation of gene expression. J Bacteriol. 185 (18), 5611-5626 (2003).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Egli, T. Microbial growth and physiology: a call for better craftsmanship. Front Microbiol. 6, 287(2015).
- Kurokawa, M., Seno, S., Matsuda, H., Ying, B. W. Correlation between genome reduction and bacterial growth. DNA Res. 23 (6), 517-525 (2016).
- Matsumoto, Y., Murakami, Y., Tsuru, S., Ying, B. W., Yomo, T. Growth rate-coordinated transcriptome reorganization in bacteria. BMC Genomics. 14, 808(2013).
- Nahku, R., et al. Specific growth rate dependent transcriptome profiling of Escherichia coli K12 MG1655 in accelerostat cultures. J Biotechnol. 145 (1), 60-65 (2010).
- Dai, X., et al. Reduction of translating ribosomes enables Escherichia coli to maintain elongation rates during slow growth. Nat Microbiol. 2, 16231(2016).
- Madrid, R. E., Felice, C. J. Microbial biomass estimation. Crit Rev Biotechnol. 25 (3), 97-112 (2005).
- Harris, C. M., Kell, D. B. The estimation of microbial biomass. Biosensors. 1 (1), 17-84 (1985).
- Yates, G. T., Smotzer, T. On the lag phase and initial decline of microbial growth curves. J Theor Biol. 244 (3), 511-517 (2007).
- Kargi, F. Re-interpretation of the logistic equation for batch microbial growth in relation to Monod kinetics. Lett Appl Microbiol. 48 (4), 398-401 (2009).
- Peleg, M., Corradini, M. G. Microbial growth curves: what the models tell us and what they cannot. Crit Rev Food Sci Nutr. 51 (10), 917-945 (2011).
- Sprouffske, K., Wagner, A. Growthcurver: an R package for obtaining interpretable metrics from microbial growth curves. BMC Bioinformatics. 17, 172(2016).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Mol Biol Evol. 31 (1), 232-238 (2014).
- Hermsen, R., Okano, H., You, C., Werner, N., Hwa, T. A growth-rate composition formula for the growth of E.coli on co-utilized carbon substrates. Mol Syst Biol. 11 (4), 801(2015).
- Engen, S., Saether, B. E. r- and K-selection in fluctuating populations is determined by the evolutionary trade-off between two fitness measures: Growth rate and lifetime reproductive success. Evolution. 71 (1), 167-173 (2017).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados