Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyse précise, haut débit de la croissance bactérienne
Dans cet article
Résumé
Une évaluation quantitative de la croissance bactérienne est essentielle pour comprendre la physiologie microbienne comme un phénomène de niveau système. Un protocole pour la manipulation expérimentale et une approche analytique sont introduites, permettant une analyse précise et à haut débit de la croissance bactérienne, qui est un sujet clé d’intérêt en biologie des systèmes.
Résumé
La croissance bactérienne est un concept central dans le développement de la physiologie microbienne moderne, ainsi que dans l’investigation de la dynamique cellulaire au niveau des systèmes. Des études récentes ont rapporté des corrélations entre la croissance bactérienne et les événements de génome, comme la réorganisation de la réduction et le transcriptome du génome. Analyser correctement la croissance bactérienne est cruciale pour comprendre la coordination axées sur la croissance des fonctions des gènes et des composants cellulaires. Par conséquent, l’évaluation quantitative précise de la croissance bactérienne de manière haut débit est requise. Nouveaux développements technologiques offrent de nouveaux outils expérimentaux qui permettent des mises à jour des méthodes utilisées pour l’étude de la croissance bactérienne. Le protocole présenté ici utilise un lecteur de microplaques avec une procédure expérimentale hautement optimisé pour l’évaluation précise et reproductible de la croissance bactérienne. Ce protocole a été utilisé pour évaluer la croissance de plusieurs précédemment décrit des souches d’Escherichia coli . Les principales étapes du protocole sont les suivants : la préparation d’un grand nombre de stocks de cellules de petites fioles pour essais répétés avec des résultats reproductibles, l’utilisation des plaques à 96 puits, pour l’évaluation de la croissance du haut débit et le calcul manuel de deux grandes paramètres (p. ex., densité de population et taux de croissance maximal) qui représente la dynamique de croissance. En comparaison avec le test d’unité (CFU) formatrices traditionnels, qui compte les cellules qui sont cultivées dans des tubes de verre au fil du temps sur milieu gélosé, la présente méthode est plus efficace et fournit des notices plus détaillées temporelles des variations de croissance, mais a une plus stricte limite de détection à faible densité de population. En résumé, la méthode décrite est avantageuse pour l’analyse précise et reproductible de haut débit de la croissance bactérienne, qui peut être utilisée pour tirer des conclusions conceptuelles ou de présenter des observations théoriques.
Introduction
Des études microbiologiques commencent souvent avec la culture de cellules bactériennes et l’évaluation des courbes de croissance bactérienne, qui représentent un phénomène fondamental de la physiologie bactérienne1,2,3. Principes de base de la culture sont largement disponibles dans la littérature de recherche publiés et les manuels scolaires parce que la culture bactérienne est une méthodologie fondamentale. À l’échelle de banc, une attention particulière a traditionnellement été axée sur l’optimisation des milieux et des conditions de culture, mais contrôle le taux de croissance, qui permettrait sans doute une plus grande compréhension de la physiologie microbienne, n’a pas été étudiés4. Pour les bactéries en croissance exponentielle, un paramètre-clé de l’État cellulaire est le taux de croissance, qui a été rapporté pour être coordonné avec le génome, transcriptome et du protéome5,6,7,8 . Ainsi, une évaluation quantitative de la croissance bactérienne est cruciale pour comprendre la physiologie microbienne.
Pour évaluer la croissance bactérienne, les méthodes expérimentales utilisées pour estimer la biomasse sont bien établis9,10 et sont basées sur la détection des paramètres biochimiques, physiques ou biologiques, telles que la turbidité optique. En outre, les méthodes analytiques utilisées pour capturer les propriétés dynamiques des changements de croissance couramment reposent sur des modèles non linéaires établi11,12,13, par exemple, les équations logistiques. Dynamique de croissance est généralement acquises par échantillonnage chronométré de la croissance des cellules en culture par mesure de turbidité optique ou effectuant des tests d’unité (CFU) formatrices. La limitation de ces méthodes de détection et de mise en culture, c’est que les points de données ne sont pas un reflet fidèle de la dynamique des populations, parce que les intervalles de mesure sont souvent en heures et que la condition de la culture (p. ex., changements de température et aération) est perturbée au moment de l’échantillonnage. Techniques de culture et d’analyse doivent être actualisés à l’aide des développements récents dans la technologie et la compréhension. Les progrès récents dans des lecteurs de microplaque permettent l’observation en temps réel de la croissance bactérienne et diminuent considérablement les coûts de main-d'œuvre. En utilisant ces dispositifs avancés, les dernières études sur la croissance bactérienne ont signalé des méthodes analytiques pour les mesures haut débit14,15.
Le but du présent protocole est d’évaluer la dynamique de croissance précis d’une manière de haut débit, qui est très utile pour les études quantitatives qui finalement répondre aux questions de la façon dont le taux de croissance est déterminé et quels facteurs influent sur le taux de croissance. Le protocole porte sur tous les facteurs qui doivent être pris en compte pour la quantification précise et reproductible de la croissance bactérienne. La méthode expérimentale et l’analyse sont décrites en détail dans le texte principal. Cette méthode permet l’analyse précise et reproductible de la croissance bactérienne dans une manière de haut débit. Microbiologistes peuvent utiliser ce protocole, de déduire des résultats quantitatifs supplémentaires leurs preuves expérimentales. Ce protocole peut également servir pour les études en biologie des systèmes qui tentent de tirer des conclusions conceptuelles ou pour obtenir un aperçu théorique de la croissance.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. préparer le milieu de culture
Remarque : la composition chimique des M63 moyenne minimale est la suivante : 62 mM K 2 HPO 4, 39 mM KH 2 PO 4, 15 mM (NH 4) 2 SO 4 1,8 µM FeSO 4, 15 µM thiamine-HCl, 0,2 mM MgSO 4 et 22 mM de glucose. M63 est fabriqué en mélangeant trois solutions mères : solution X cinq, 20 % de glucose et MgSO 4 solution de thiamine. Conserver toutes les solutions à 4 ° C.
- Préparation de la solution X cinq
- préparation FeSO 4 solution, utilisez une pipette électrique et une pipette jetable sérologique pour ajouter ddH 2 O dans un tube à centrifuger de 50 mL. Utiliser un P-200 pour ajouter 0,06 mL HCl pour obtenir 0,01 M HCl. Ajouter 36 mg FeSO 4-7 H 2 O et mélanger bien.
- Mesure 160 mL FD 2 O dans une éprouvette graduée et ajoutez-le dans un bécher de 500 mL. Ajoutez le code suivant dans l’ordre suivant : 10,72 g K 2 HPO 4, 5,24 g KH 2 PO 4, 2,0 g (NH 4) 2 SO 4 et 0,5 mL de solution de 4 FeSO (préparée à l’étape 1.1.1).
- à l’aide d’un pH-mètre précision, ajuster le pH à 7.0 en ajoutant 2 M KOH. Verser la solution dans une éprouvette graduée et ajouter des ddH 2 O pour un volume total de 200 mL. Stériliser la solution à l’aide d’une unité de filtration de 250 mL (PVDF, 0,22 µM).
- Préparation de la solution de 20 % de glucose
- mesurer 200 mL FD 2 O dans une éprouvette graduée et le verser dans un bécher de 500 mL. Tout en mélangeant à l’aide d’un agitateur magnétique, ajouter 50 g de glucose. Diluer la solution dans une éprouvette graduée pour un volume total de 250 mL. Stériliser la solution comme indiqué au point 1.1.3.
- Préparation de la solution de thiamine MgSO 4
- Ajouter 150 mL FD 2 O dans un bécher de 500 mL. Tout en mélangeant avec un agitateur magnétique, ajouter 1,0 g de thiamine-HCl et 10 g de MgSO 4-7 H 2 O. diluer la solution dans une éprouvette graduée pour un volume total de 200 mL. Stériliser la solution comme indiqué au point 1.1.3.
- Préparation minimale moyenne M63
- Placer la solution X 5, la solution de glucose à 20 %, la solution de thiamine MgSO 4, une pipette Electronique, une pipette P-200 et pointes de pipette de 200 µL sur un banc propre.
- Mesure mL 155,8 ddH 2 O dans une éprouvette graduée et verser dans un bécher de 500 mL.
- à l’aide de la pipette Electronique et pipette sérologique jetable, ajouter 40 mL de la solution X 5 et 4 mL de solution de glucose 20 % à la ddH mesurée 2 O. Puis, ajouter 0,2 mL de solution de thiamine MgSO 4 avec le P-200. Stériliser la solution comme indiqué au point 1.1.3.
2. Préparer le Stock de glycérol
- Cell culture
Remarque : les souches bactériennes (p. ex., W3110 et génomes réduits) sont disponibles auprès des organismes bancaires de souche. Les souches sont generalement sous forme de colonies sur milieu gélosé.- Placer cinq tubes de verre stérilisé avec bouchons en caoutchouc silicone, une pipette Electronique, P-1,000, pointes de pipette 1 000 µL, P-200, pointes de pipette de 200 µL et les souches de la cible (colonies sur des plaques) sur un banc propre.
- Exposer l’embouchure du tube de verre pour un bec Bunsen avant d’ouvrir le bouchon de caoutchouc de silicone. Exposer le bouchon en caoutchouc de silicone à la flamme après que le tube est ouvert et puis légèrement Replacez le bouchon sur le tube en verre.
- Utiliser la pipette électronique et sérologique pipette à usage unique à ajouter à un des tubes de verre et 4,5 mL M63 aux quatre autres tubes 5 mL M63.
- Utiliser la pointe de P-200 à prélever une colonie et elle inoculer dans le tube de verre contenant 5 mL M63.
- Vortex le tube pour faire une suspension. Ensuite, diluer la solution 10 fois en transférant 0,5 mL de cette solution à l’un des quatre tubes contenant 4,5 mL M63.
- Répéter le processus décrit à l’étape 2.1.5 pour les tubes restants. Une série de dilutions avec cinq concentrations différentes (dilutions de 1, 10, 100, 1000 et 10 000) est maintenant prêt.
- Stériliser la bouche des tubes de verre et les bouchons de caoutchouc de silicone comme indiqué au point 2.1.2. Cap des tubes avec les bouchons. Éviter la contamination par le froissement ne pas les bouchons de caoutchouc silicone.
- Placer les cinq tubes dans un incubateur à agitation pré chauffé à 37 ° C et la secouer à 200 tr/min. Incuber la culture pendant la nuit ou pendant 10 à 30 h.
- Sélection de la culture pour le stock de glycérol
- Placer le milieu de la température de la pièce pré chauffé M63, P-1,000, pointes de pipette 1 000 µL et une cuvette jetable sur un banc propre.
- Ajouter 1000 µL M63 à une cuvette jetable avec un P-1, 000. Placez la cuvette jetable dans un spectrophotomètre, démarrer le programme à une longueur d’onde fixe de 600 nm et mesure le blank.
- Déplacer les tubes de cinq verre de l’incubateur à agitation au banc propre.
- M63 jeter de la cuvette jetable et ajouter 1 000 culture µL à la même cuvette jetable avec un P-1, 000. Mesurer la turbidité optique de la culture cellulaire (OD 600) comme indiqué au point 2.2.2.
Remarque : Pour éviter toute contamination et de réaliser une mesure précise, exposer les tubes de verre et les bouchons à la flamme comme décrit et vortex la culture avant l’échantillonnage. Pour garantir des résultats fiables, mesures répétées sont recommandés, particulièrement lorsque la densité cellulaire est faible. - Des cinq cultures cellulaires, choisir celui qui est dans la première phase de croissance exponentielle (OD 600 = 0,01 - 0,05) pour le stock de glycérol.
Remarque : Si plusieurs cultures ont des densités dans la plage optimale, le plus près à 0,05 communément estsélectionné.
- Faire les stocks de glycérol pour essais répétés.
NOTE : Ce qui est décrit pour la préparation des stocks de dix. Quantités plus grandes ou plus petites peuvent être faites selon les conditions expérimentales.- Place de la solution de glycérol 60 % stérilisé, dix stérilisé microtubes de 1,5 mL, P-1,000 et P-200, 1 000 et 200 µL-pointes de pipette et un microtube de se tenir debout sur un banc propre.
- Ajouter 250 µL stérilisé 60 % solution de glycérol et 750 µL de la culture de cellule sélectionnée au microtubes de 1,5 mL et mélanger par pipetage.
Remarque : Le volume de stock est variable, mais toujours maintenir un ratio de 1:3 de 60 % de glycérol pour culture cellulaire ; Il en résulte une concentration finale de 15 % de glycérol. - Placer les neuf microtubes restants dans le socle de microtube et déposer 100 µL du mélange préparé à l’étape 2.3.2 dans chaque tube. Il y a maintenant dix actions de glycérol identique pour une utilisation future.
- Conserver les stocks dans un congélateur à -80 ° C.
3. Acquérir les courbes de croissance
- mise en place le lecteur de microplaque.
Remarque : Les termes montrés en spectacle de guillemets le phrasé spécifique utilisé sur le lecteur utilisé ici (voir la Table des matières).- Ouvrir le logiciel. Ouvert " protocoles " dans " Gestionnaire des tâches " et choisissez " créer nouveau ". Choisissez " protocole Standard ".
- Open " procédure " et d’ajuster les paramètres. Ouvert " Réglez la température ", puis sélectionnez " incubateur sur ". La valeur " température " à 37 ° C et " Gradient " à 0 ° C. Vérifiez " préchauffage " avant de continuer avec l’étape suivante. Ouvert " cinétique commencer ", ensemble " moment de l’exécution " à 24:00:00 ou 48:00:00, et " intervalle " de 00:30:00 ou 01:00.
Remarque : Il faut environ 1 min à lire un entier 96 plaque bien. - Open " Shake " et " Mode Shake " comme " linéaire ". Vérifier " Coprotection Shake " et définissez " fréquence " à 567 cpm. Ouvert " lire ", vérifier " Absorbance ", " point de terminaison/cinétique ", et " monochromateurs. " Set " longueur d’onde " à 600.
- Click " Validate " pour confirmer que la procédure est correcte. Cliquez sur " enregistrer " de l’enregistrer dans un nouveau programme pour une utilisation future.
- En temps réel, enregistrement de croissance
- dessiner un pictogramme de la plaque à 96 puits (8 × 12 table) pour indiquer les positions des échantillons inoculés la culture sur la plaque à 96 puits. Imprimer le tableau et l’utiliser comme une référence pour l’expérience.
Remarque : Les puits situés sur les bords de la microplaque ne doivent contenir que vide moyen dû à l’évaporation. - Place un plat de 96 puits stérilisé bas microplaque avec couvercle, P-1000, pointes de pipette 1000 µL, P-200, pointes de pipette de 200 µL, plusieurs microtubes de 1,5 mL, une pipette à 8-multicanal, un réservoir de réactif stérilisé, température ambiante M63 et le glycérol stocks (préparés à l’étape 2.3) sur un banc propre.
- Ajouter environ 25 mL M63 dans le réservoir de réactif. Utiliser ce stock de réservoir pour toutes les étapes suivants.
- Ajouter 900 µL M63 aux microtubes en préparation pour faire des dilutions sériées.
- Décongeler le stock de glycérol à température ambiante. Ajouter 900 µL M63 au stock de glycérol décongelés et vortex. Cela se traduit par une dilution de 10 fois le stock de glycérol original.
- Transférer 100 µL de la dilution 10 fois à un autre microtube contenant 900 µL de M63 et vortex. Cela se traduit par une dilution de 100 fois.
- Répéter l’étape 3.2.6 jusqu'à ce que le nombre désiré de dilutions est atteints.
- Remplir les puits au bord de la microplaque avec 200 µL M63 en utilisant une pipette à 8 canaux (P-200).
Remarque : Ces puits peuvent être utilisés comme le blanc. - Charge 200 µL de chaque échantillon préparé en étapes 3.2.4 - 3.2.7 de la microplaque selon la table de référence (étape 3.2.1) dilué. Vortex le prieur échantillons dilués à charge et charge le même échantillon dans plusieurs puits à varié emplacements sur la plaque.
- Placer la Microplaque 96 puits sur le lecteur de plaque.
- Open " lire maintenant " dans " Gestionnaire des tâches " et choisir le programme (section 3.1). Cliquez sur " OK " pour commencer à mesurer. Sauvegarder l’enregistrement dans un nouveau fichier expérimental pour l’analyse des données (article 4).
- dessiner un pictogramme de la plaque à 96 puits (8 × 12 table) pour indiquer les positions des échantillons inoculés la culture sur la plaque à 96 puits. Imprimer le tableau et l’utiliser comme une référence pour l’expérience.
4. Analyse des données
- exportation les résultats des données en temps réel des taux de croissance (section 3.2) à une mémoire USB stick dans un fichier texte.
Remarque : Un résultat au format 96 puits (courbes) s’affiche sur le lecteur de plaque en temps réel. Les enregistrements horaires (valeurs do) peuvent être exportés sous forme de tableau ; les lignes et les colonnes représentent les nombres bien (p. ex., A1, B1) et le temps de mesure (par exemple, 00:00:59), respectivement. - Ouvrir le fichier texte avec un logiciel tableur.
- Copiez les lectures de 600 OD horaires de la Microplaque 96 puits dans une nouvelle feuille de calcul pour une analyse plus approfondie.
- Soustraire l’arrière-plan se lit au temps zéro des lectures horaires de chaque échantillon bien.
Remarque : Pour plus de commodité, la valeur moyenne de l’essai à blanc puits contenant M63 (étape 3.2.8) peut être utilisé comme la valeur background. - Calculer la moyenne des cinq lectures consécutives de 600 OD pour estimer la densité de population maximale.
NOTE : La plus grande valeur moyenne des cinq consécutifs OD 600 lectures est définie comme la maximale de l’OD 600 de la courbe de croissance correspondante. - Calculer le taux de croissance, µ (h -1), en appliquant l’équation suivante pour toutes les paires de valeurs consécutives de OD 600 :
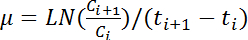
Remarque : dans cette équation, C i et C i + 1 représentent les valeurs de 600 OD deux points consécutifs de temps (t i et t i + 1, respectivement). Indique de LN logarithme népérien. - Calculer les changements dans le taux de croissance au fil du temps basées sur l’horaire OD 600 lit selon étape 4.6. Calculer la moyenne et l’écart-type des cinq taux de croissance consécutive pour estimer le taux de croissance maximal.
Remarque : La moyenne plus grande avec le plus petit écart est définie comme le taux de croissance maximal de la courbe de croissance correspondante.
5. Confirmant le biais Global de la dispose de 96 puits (facultatif)
Remarque : les deux la plaque lecteur et la plaque à 96 puits consommable peuvent provoquer des mesures biaisées. Pour obtenir des résultats quantitatifs très précis et reproductibles, confirmant le biais global de la plaque à 96 puits est hautement recommandé.
- Préparer la plaque 96 puits et le lecteur de plaque pour la partialité, comme décrit à la section 3.2.2.
- Ajouter 20 mL M63 dans un tube à centrifuger de 50 mL stérilisés. Ajouter le stock de glycérol dans le même tube à centrifuger et vortex. Transférer la solution suspendue dans un réservoir de réactif stérilisé.
- Utiliser une pipette à 8 canaux pour transférer 200 µL de la solution suspendue à la plaque à 96 puits.
- Placer la plaque à 96 puits sur le lecteur et lancer la mesure.
- Enregistrement horaire OD 600 lit et analyse tel que décrit à l’article 4. Comparer la densité de population et taux de croissance maximale calculée de chaque puits pour déterminer la localisation partialité les lectures de 96 puits.
Access restricted. Please log in or start a trial to view this content.
Résultats
La méthode décrite fournit un moyen de capturer la croissance bactérienne dynamique de façon continue et à haut débit en utilisant un lecteur de format 96 puits qui prend plusieurs mesures de la densité optique à divers intervalles de temps (à partir de minutes, heures ou jours). Les courbes de croissance d’un assortiment de souches d’Escherichia coli exprimant différents génomes peuvent être précisément acquises dans une expérience simple (
Access restricted. Please log in or start a trial to view this content.
Discussion
Les étapes critiques du protocole comprennent la préparation d’un stock commun en croissance exponentielle des cellules et la réplication des mêmes échantillons dans plusieurs puits à différentes positions sur la microplaque. Auparavant, microbiologistes ont commencé la culture d’une culture avant une nuit ou plus. Alors que cette méthode peut réduire le temps de latence de la croissance bactérienne, il est difficile d’obtenir des courbes de croissance reproductibles. Comme illustré à la
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous remercions Kohei Tsuchiya pour fournir l’exemple de test d’UFC. Ce travail a été partiellement financé par une subvention pour la recherche scientifique (C) no 26506003 (à BWY) depuis le ministère de l’éducation, Culture, Sports, Science et technologie, Japon.
Remerciements
Les auteurs n’ont rien à divulguer.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| K2HPO4 | Wako | 164-04295 | |
| KH2PO4 | Wako | 166-04255 | |
| (NH4)2SO4 | Wako | 019-03435 | |
| MgSO4-7H2O | Wako | 138-00415 | |
| Thiamine-HCl | Wako | 201-00852 | |
| glucose | Wako | 049-31165 | |
| HCl | Wako | 080-01066 | |
| Iron (II) sulfate heptahydrate (FeSO4-7H2O) | Wako | 094-01082 | |
| KOH | Wako | 168-21815 | |
| Glycerol | Wako | 075-00611 | |
| Centrifuge tube (50 mL, sterilized) | WATSON | 1342-050S | |
| Pipette Tips, 200 µL | WATSON | 110-705Y | |
| Pipette Tips, 1,000 µL | WATSON | 110-8040 | |
| Microtube (1.5 mL) | WATSON | 131-715C | |
| 8 multichannel-pipette | WATSON | NT-8200 | |
| PASORINA STIRRER | AS ONE | 2-4990-02 | |
| Glass cylinder (200 mL) | AS ONE | 1-8562-07 | |
| Precision pH mater | AS ONE | AS800 / 1-054-01 | |
| Pipetman P-200 | GILSON | 1-6855-05 | |
| Pipetman P-1000 | GILSON | 1-6855-06 | |
| Disposable Serolocical Pipettes (10 mL) | SANPLATEC | SAN27014 | |
| Disposable Serolocical Pipettes (25 mL) | SANPLATEC | SAN27015 | |
| Microtube stand | BM Bio | 801-02Y | |
| Vortex | BM Bio | BM-V1 | |
| Corning Costar 96-well microplate with lid (Flat bottom, Clear) | Sigma-Aldrich | Corning, 3370 | |
| Corning Costar reagent reservoir (50 mL) | Sigma-Aldrich | Corning, 4870 | |
| Stericup GV PVDF (250 mL, 0.22 µM) | Merck Millipore | SCGVU02RE | |
| Pipet-Aid XP | DRUMMOND | 4-000-101 | |
| Bioshaker (BR-23UM MR) | TAITEC | 0053778-000 | |
| Disposal cell (1.5 mL) | Kartell | 1938 / 2-478-02 | |
| DU 730 Life Science UV/Vis Spectrophotometer | Beckman Coulter | A23616 | |
| EPOCH2 | BioTek | 2014-EP2-002 / EPOCH2T | |
| Beaker (500 mL) | IWAKI | 82-0008 | |
| BIO clean bench | Panasonic | MCV-B131F | |
| Glass tubes | NICHIDEN RIKA GLASS | P-10M~P-30 /101019 | |
| Silicone rubber stoppers | ShinEtsu Polymer | T-19 | |
| Bacterial strains | Strain bank organization; National Bio Resource Project (NBRP) in Japan |
Références
- Kovarova-Kovar, K., Egli, T. Growth kinetics of suspended microbial cells: from single-substrate-controlled growth to mixed-substrate kinetics. Microbiol Mol Biol Rev. 62 (3), 646-666 (1998).
- Soupene, E., et al. Physiological studies of Escherichia coli strain MG1655: growth defects and apparent cross-regulation of gene expression. J Bacteriol. 185 (18), 5611-5626 (2003).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Egli, T. Microbial growth and physiology: a call for better craftsmanship. Front Microbiol. 6, 287(2015).
- Kurokawa, M., Seno, S., Matsuda, H., Ying, B. W. Correlation between genome reduction and bacterial growth. DNA Res. 23 (6), 517-525 (2016).
- Matsumoto, Y., Murakami, Y., Tsuru, S., Ying, B. W., Yomo, T. Growth rate-coordinated transcriptome reorganization in bacteria. BMC Genomics. 14, 808(2013).
- Nahku, R., et al. Specific growth rate dependent transcriptome profiling of Escherichia coli K12 MG1655 in accelerostat cultures. J Biotechnol. 145 (1), 60-65 (2010).
- Dai, X., et al. Reduction of translating ribosomes enables Escherichia coli to maintain elongation rates during slow growth. Nat Microbiol. 2, 16231(2016).
- Madrid, R. E., Felice, C. J. Microbial biomass estimation. Crit Rev Biotechnol. 25 (3), 97-112 (2005).
- Harris, C. M., Kell, D. B. The estimation of microbial biomass. Biosensors. 1 (1), 17-84 (1985).
- Yates, G. T., Smotzer, T. On the lag phase and initial decline of microbial growth curves. J Theor Biol. 244 (3), 511-517 (2007).
- Kargi, F. Re-interpretation of the logistic equation for batch microbial growth in relation to Monod kinetics. Lett Appl Microbiol. 48 (4), 398-401 (2009).
- Peleg, M., Corradini, M. G. Microbial growth curves: what the models tell us and what they cannot. Crit Rev Food Sci Nutr. 51 (10), 917-945 (2011).
- Sprouffske, K., Wagner, A. Growthcurver: an R package for obtaining interpretable metrics from microbial growth curves. BMC Bioinformatics. 17, 172(2016).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Mol Biol Evol. 31 (1), 232-238 (2014).
- Hermsen, R., Okano, H., You, C., Werner, N., Hwa, T. A growth-rate composition formula for the growth of E.coli on co-utilized carbon substrates. Mol Syst Biol. 11 (4), 801(2015).
- Engen, S., Saether, B. E. r- and K-selection in fluctuating populations is determined by the evolutionary trade-off between two fitness measures: Growth rate and lifetime reproductive success. Evolution. 71 (1), 167-173 (2017).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon