A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חומצת שומן 13C איזוטופולוג פרופיל מספק תובנה מטבולי של הגעה צרכנים והעברת פחמן עם מחלות
In This Article
Summary
חומצת שומן מרקר עם מחלות הגישה, קרי, ההטמעה של חומצות שומן כמו כל מולקולה והעברת לתוך רקמות לצרכן ללא או משנית השינוי, היא הקשו על ידי פערי ידע חומצת שומן חילוף החומרים של אדמה קטנים חסרי חוליות. איזוטופולוג פרופיל מסופק כלי חשוב כדי disentangle אינטראקציות עם מחלות.
Abstract
חומצות שומן (FAs) הם סמנים שימושיים אקולוגיה מארג מזון כי הם בדרך כלל מתבוללת כ מולקולה להשלים, להעביר לתוך רקמות לצרכן עם הקטין או ללא כל שינוי, המאפשר את ניתוב התזונה בין רמות הזנה שונות. עם זאת, הגישה מרקר עם מחלות הפא היא עדיין הקשו על ידי הידע מוגבל בנוזל מטבולי של צומח הקרקע. מחקר זה משמש עם תוויות ברורות לגמרי חומצה פלמיטית (13C16:0, 99% אטום) מכשיר מעקב במשעולים חומצת שומן חילוף החומרים של הקרקע בהיקף נרחב שני Collembola, Protaphorura fimata , Heteromurus nitidus. על מנת לחקור את גורלם ואת שינויים מטבוליים של קודמן הזה, שיטת איזוטופולוג פרופיל מוצגת, המבוצעת על ידי ספקטרומטר מסה באמצעות ניטור יון בודד. יתר על כן, המעבדה במעלה האכלה הניסוי מתוארת, כמו גם החילוץ מתילציה של שברים השומנים דומיננטי (ליפידים נייטרלי, פוספוליפידים) ואת הנוסחה קשורים חישובים. איזוטופולוג פרופיל אינה רק התשואה העשרת 13C הכוללת בחומצות שומן נגזר 13ג שכותרתו קודמן אך גם יוצרת התבנית של isotopologues העולה על המסה של האב יונים (קרי, יונים מולקולרית פא ז+) של כל אחד עם התווית הפא על-ידי יחידות מסה אחת או יותר (מ'+1, מ'+2, מ'+3, וכו '). ידע זה מאפשר מסקנות על היחס של ניתוב התזונה הפא נצרך לחלוטין בהשוואה ביוסינטזה de novo . איזוטופולוג פרופיל המוצע ככלי שימושי עבור הערכה של חומצת שומן חילוף החומרים לבעלי הקרקע disentangle אינטראקציות עם מחלות.
Introduction
בבית גידול נסתר כגון אדמה, יחסים עם מחלות קשה כתובת, מוגבלים עוד יותר לפי גודל קטן החי והצומח. בעשור האחרון חלה התקדמות אקולוגיה הביוכימי, במיוחד בשימוש של חומצות שומן כמו סמנים ביולוגיים עבור הגדרת אסטרטגיות האכלה של צומח הקרקע תחת השדה תנאים1,2,3. זה מבוסס על העובדה כי חומצות שומן מכל המשאבים ניתן לשלב ברקמת הצרכן כמו במולקולות שלמות, תהליך הנקרא ניתוב התזונה4. העברה של חומצות שומן דווח על שלוש הזנה רמות, קרי, מן ופטריות על נמטודות Collembola5. לאחרונה, החי והצומח דורסנית נחשבה6,7 , הראשון על חומצות שומן כסמנים עם מחלות במארג המזון בקרקע הביקורות שפורסמו8,9.
מידע מפורט יותר על אינטראקציות עם מחלות מושגת באיזוטופ יציב חומצת שומן חיטוט (פא-SIP). הקביעה של 13C /12C יחסי בחומצות שומן בפח דיאטות ולצרכנים לייחס קישורים בינארי, מעריכים את זרימת פחמן הקשורים ננקטה יבשתי, מים מתוקים, ו במארג המזון ימית10,11 12, ,13. הנחת היסוד היא כי חומצות שומן מנותבים תזונתיים אינם כפופים תהליכים אנזימטי; לכן, שלהם 13ג אות, קרי, 13C /12C יחס של חומצת השומן של הצרכנים דומה לזה דיאטה1. עם זאת, דלדול הדרגתי של החתימה 13C במעלה שרשרת המזון דווח במערכות הימית, ובכך פוגע יישום נרחב של פא-SIP מחקרים עם מחלות14,15,16. יתר על כן, הידע המטבוליזם השומנים לרוב חסרי חוליות ב במארג המזון הארצי הוא עדיין מוגבל.
הבנה של המסלולים מטבוליזם השומנים ב צרכנים חיונית עבור השימוש של חומצות שומן מרקר עם מחלות כמו אומר מצפני הזרם פחמן כמותית ב אקולוגיה מארג מזון. עם זאת בחשבון, 13C-איזוטופולוג פרופיל, ניתן להחיל על איזה עיקרון בתוך לחקירה של חילוף החומרים פחמן של כל מערכות גוף17, היא שיטה מבטיחה. בעקבות כניסתה של מצע מתויג C פחמן 13, ההתפלגות של 13C ברשת מטבולית הוא אתנו מאז המוצרים מטבולית שנוצר במופע הצרכן התפלגות איזוטופולוג ספציפיים. זה יכול להיות מוערך על ידי כמותיים תהודה מטבולית גרעיני ספקטרוסקופיה18,19 -ספקטרומטר מסה20,21, עם דגימות ביולוגיות המועדף ב האחרון עם ביומסה נמוכה בשל שלה גבוה יותר רגישות.
למרות איזוטופולוג פרופיל כולל כבר בהצלחה שהוחל חומצות אמינו, מסופק תובנה ויוו פחמן חילוף החומרים של פתוגנים חיידקיים17,22,23, יישומה של שומן חומצות פיגר אחרי. ניתוח מפורט הראשון על גורלה של איזוטופ יציב מתויג קודמן חומצת שומן, תזונה ניתוב או השפלה ויה β-חמצון, אדמת הגעה הצרכנים, לאחרונה בוצע על ידי מנזל. et al. 24. כאן, היסודות מתודולוגי לניסויים התאגדות עם 13C מתויג חומצות שומן ואחריו איזוטופולוג ניתוח של צאצאי מפתח באדמה תכופות חסרי חוליות, Collembola, הינם מסופקים. Microarthropods אלה הם קבוצה טובה הם מהווים מרכיבים חשובים של מארג המזון של הקרקע, הם נחקרים על שלהם מרקר עם מחלות8,של חומצות שומן25היטב.
הבנה של המסלולים מטבוליזם השומנים ב צרכנים חיונית עבור השימוש של חומצות שומן מרקר עם מחלות כמו אומר מצפני הזרם פחמן כמותית ב אקולוגיה מארג מזון. בפרוטוקול הנוכחי נותן את העיצוב ואת הגדר מעבדה האכלה Collembola ניסוי, וההליכים הביוכימי החילוץ של מתילציה של שברים דומיננטי ליפידים (שומנים נייטרלי, פוספוליפידים). זה מדגים איך ההרכב איזוטופולוג של חומצות שומן ניתוח באמצעות ספקטרומטר מסה, מתאר את הנוסחה קשורים של חישובים. הליך זה מתבטא: (i) את היחס של isotopologues העולה על המסה של האב יונים (קרי, יון מולקולרית חומצת שומן M+) על ידי אחד או יותר המוני יחידות (מ'+1, מ'+2, מ'+3, וכו ') ו- (ii) הכולל 13 C העשרה בחומצות שומן נגזר למבשר 13C עם תוויות ברורות. למרות שימוש עבור Collembola, גישה זו בדרך כלל ניתן להחיל על כל אינטראקציה עם טורף-טרף אחרים על ההנחה כי אלה culturable בכמות מספקת בתנאים מבוקרים כדי להבטיח ספיגת תווית מוצלחת ובעקבות אימות.
Protocol
הפרוטוקול המתואר אינה נופלת בדונו האתי חיה. עם זאת, כאשר אנשים מסתגלים הפרוטוקולים שתואר לבעלי חיים גבוהה יותר, שמור כי ועדת האתיקה חיה מוסדיים אישרה את הפרוטוקול לטיפול בבעלי חיים.
1. טיפוח של חיות
הערה: כל הסביר צעדים ניסיוני מבוססים על פרוטוקולים ומבוססת26,27,28. Biotests במעבדה צריכה אספקה רציפה של אורגניזמים בקלות culturable. . הנה, שימשו המין Collembola Protaphorura fimata (Gisin, 1952) ו- Hetermurus nitidus (טמפלטון, 1835). בשני המינים פשוטים לשמור כמו תרבויות מעבדה פרודוקטיבי נמאס בייקר של שמרים.
- ב- microcosms פלסטיק התאמה הדוקה בשלמותם (בקוטר 7 ס מ, גובה 4.5 ס מ), להוסיף תערובת של פחם פעיל, גבס, ו לגלידה לספק מצע גידול לח מאוד (איור 1 א').
- בעת הכנת תערובת microcosms מספיק המצע, למשל, עבור 10 microcosms באצווה. מיקס 9 חלקים של גבס (225 גרם), 1 חלק יבש פחמים (25 גרם) יחד בסיר טיח, להוסיף בזהירות כ-10 חלקים של מים מזוקקים (250 מ"ל) ולאפשר לשבת 5 דקות ללא ערבוב בטמפרטורת החדר.
- מערבבים עם כפית המעבדה במהירות מתונה בכיוון השעון כדי למנוע בועות אוויר עד עקביות ישנונית עבה מושגת. שופכים מיד לתוך microcosms לגובה של-1 ס מ.
- להחליק הטיח על-ידי הקשה על הספסל ועדין לטמיון. שימו לב כי חורים (אקראי המוצרים של בועות אוויר) תלמים (פעיל נוסף עם מרית סטרילי) עשוי לעודד Collembola פורייה להטיל ביצים שם. מחקר זה נמנע חורים תלמים לטובת נתקל באותם תנאים לשחזור. עם זאת, למטרות הדגמה איור 1B מציג כמה חורים.
- לאפשר ייבוש למשך 1-2 ימים בטמפרטורת החדר; הדגירה ב 60 מעלות צלזיוס עשויה להפחית את הזמן הזה כדי h 1-2.
- להרטיב את microcosms לפני השימוש על-ידי הוספת מי ברז עם פיפטה עד המצע מעט לח. לשמור על לחות מיקרוקוסמוס בהוספת מים מזוקקים בקביעות כפי Collembola יש לציפורן רך היא חשופה לייבוש.
- העברת Collembola בקלות אל בסיס טיח בעזרת צינור שאיבה פשוטה, קרי, צינור סיליקון רב כ- 25 ס מ ארוך עם טיפ פיפטה מצוידים עם רשת שינוי קטן כדי למנוע יניקה של בעלי חיים לתוך הצינור. לחלופין, העברת בעלי חיים בכך שהוא מאפשר להם לדבוק על הזיפים של מברשת קטנה.
- העברה (ראה שלב 1.2) 30 טרי בקעו Collembola לתוך microcosms החדש ולספק בייקר שמרי יבש מגורען כמזון (על טיפ הסכין) (איור 1B); לחדש לפחות פעמיים בשבוע. תוכנית שלוש עצמאית משכפל ליום דגימה; זה ללמוד ימים 0 - 7 ו-14. דגירה-15 ° C בחשכה. שמירה על שטמפרטורת חום קבועה הוא חיוני, כמו חומצות שומן שונו על ידי חילוף החומרים בעלי חיים כדי לענות על הדרישות של נזילות ממברנה.
- להאכיל Collembola עם בייקר של שמרים במשך ארבעה שבועות לפני תחילת הניסויים חשיפה כדי לקבל הומוגנית 13C /12ג אות ו דפוס של חומצות שומן. השתמש צינור שאיבה או מברשת כדי להסיר את כל הביצים (איור 1C), כדורי צואה, ולהאכיל exuviae באופן קבוע כמו חיות עשוי עליהם ובכך לשנות את פרופיל השומנים שלהם.

איור 1: טיפוח של Collembola. (א) מיקרוקוסמוס מלא עם גידול המצע, תערובת יבשים של גבס, פחם פעיל, מים מזוקקים. (B) ו- (ג) הדגימה נציג של תרבות Protaphorura fimata ; שימו לב הכדורסל קטן של בייקר של שמרים יבשים המשמשות כמקור מזון וכן כחורים במצע גידול (חץ שחור) (B) כמו גם שתי ביצים (חץ לבן) (C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
2. labelling דיאטה, קציר, דוגמת טיפול
- Labelling
- ארבעה שבועות לאחר הקמת התרבויות Collembola, למקם את 30 אנשים microcosms חדש, דגירה-15 ° C בחשכה.
- להציג את התווית הדופק מאכילים אותם השמרים של בייקר המכילה של לחלוטין 13התווית על-ידי C חומצה פלמיטית (13C16:0, 99% אטום) על-ידי ערבוב חומצה פלמיטית התווית על-ידי C 13עם בייקר של שמרים עם מרית-יחס 0.5:1, למשל, 5 g 13 C16:0 ו- 10 g יבש שמרים של בייקר. מניחים על קצה הסכין על כל מיקרוקוסמוס.
- לאחר 6 שעות, להחליף את זה עם תוויות מזון עם לחלוטין ללא תווית בייקר של שמרים.
-
טיפוח נוספים
- במהלך הניסוי לחדש את הדיאטה שמרים כל שלושה ימים ולהוסיף כמויות גבוהות מ מה Collembola יצרוך במהלך התקופה הזו. והכי חשוב, השתמש צינור יניקה או מברשת כדי להסיר Collembolan ביצים, כדורי צואה, exuviae באופן קבוע כדי להבטיח האכלה בלעדית על ידי החיות על האוכל שסופקו.
- קציר
- לטעום microcosms משתנה מדי יום עד ליום 7. ואז ביום 14, לאסוף משכפל עצמאית 3 בכל זמן הדגימה; פעמים דגימה שונים אפשריים.
- להכין צינורות זכוכית 10 מ ל מצויד מזרקי מצופה טפלון, אחד עבור כל דגימה. מראש לנקות את הצינורות האלה ב דסקית זכוכית, לשטוף פעמיים עם יונים מים לאחר מכן. בסופו של דבר, להסיר את עקבות של הידרופובי מזהמים לשטוף פעמיים על-ידי הוספת 2 מ של כלורופורם (hplc, קורס כיתה), מערבולת בערך ולמחוק את הממס.
- עבור פקד דגימות (יום 0), לקחת 3 30 שאינו חשוף Collembola מתרבויות קדם כדוגמאות יום 0.
- לקבלת דוגמאות חשוף (יום 1 ו ואילך), לקחת עבור דגימות יומיות בכל מקרה 3 30 חשוף Collembola מן התרבויות intermediately נמאס תערובת של חומצה פלמיטית התווית על-ידי C 13בייקר של שמרים.
- שיא Collembola טרי במשקל על ידי אולטרה-microbalance. העברת בעלי חיים באמצעות שואבי או מברשת על קנה המידה המתאימה-מחבתות. על מנת להבטיח טיפול קל של Collembola במהלך במשקל המחבתות סולם, הלם-cool חיות לפני (-80 מעלות צלזיוס במשך שעתיים). לחלופין, זרם2 CO 10 דקות יכול בבטחה הלם חיות.
- ישירות לאחר שקילה במקום בעלי חיים מן המחבתות סולם בזהירות לתוך 10 מ ל זכוכית מבחנות. למלא את הצינורות 1 מ"ל של מתנול (hplc, קורס כיתה) וחנות ב-20 ° C עד הניתוח.
הערה: משלב זה ואילך, להימנע הדגימה טיפול עם ציוד פלסטיק כמו ממיסים אורגניים מעורבים; במקום זאת השתמש דיספנסרים פיפטות המתאימים ממיסים, כמו גם כלי זכוכית.
3. השומנים החילוץ רקמה חיה, Methanolysis
- להכין 3 זכוכית מבחנות (מצויד מצופה טפלון מזרקי) לכל אצווה המכיל רק 1 מ"ל של מתנול כערכים ריקים. חשוב להוסיף או להעביר כל הממס בשימוש פרוטוקול זה רק על-ידי פיפטות זכוכית או דיספנסרים עמידים הממס כלורופורם/מתנול לשטוף.
- בתחילת תהליך החילוץ השומנים, להפחית את מתנול מיושם עבור אחסון (או לריווח) על ידי אידוי; benchtop קומפקטי מצויד עם משאבת ואקום מלכודת קר רכז ואקום המסתובבת (RVC) מומלץ. העברת הצינורות פתוח לתוך RVC, מתאדים עד יבש בלחץ 50 ° C ו ואקום של hPa 200 עבור 20 דקות.
- הוסף 5 מ של הממס החילוץ חד-פאזי (chloroform/methanol/0.05 מ' פוספט מאגר 1:2:0.8, pH 7.4) כל דגימה (כולל רווחים) ואת תמצית ליפידים Collembolan בטמפרטורת החדר ע י ניעור בין לילה (~ סל ד 200).
- הממס להעביר צינורות חדשים, לחלץ דוגמיות מחדש ע י ניעור במשך 3 שעות עם אוטם 2.5 נוספים מיצוי החומר הממיס. לאחר מכן, משלבים תמציות בשני שלבים; השימוש בזכוכית שפסטר סיליקון מומלץ. להוסיף 0.8 מ של כלורופורם, 0.8 מ ל מים מזוקקים, ואז לערבב, צנטריפוגה ב 2,000 g-20 º C למשך 5 דקות. לבסוף, לאפשר דגימות לעמוד במשך 5 דקות לצורך הקמת מכשול ההפרדה של מימית, כלורופורם שלבים.
- לניתוח דפוס חומצת שומן, לחלק ליפידים סלולרי הכולל של Collembola השומנים נייטרלי גליקוליפיד, שברים פוספוליפיד.
- עבור כל דגימה, להכין עמודה חומצה סיליקה (עמודה מסחרי עם חומצה צורנית 0.5 g, רשת שינוי בגודל 100-200 מיקרומטר, ראה טבלה של חומרים) על-ידי הוספת 1 מ"ל של כלורופורם (preconditioning). כדי להאיץ את התהליך הזה, לטעון את העמודות על בלוק ואקום בשימוש נפוץ הכרומטוגרפיה לחילוץ מעבדתי. אל תשתמש ניילון מחטים; השתמש פלדת אל-חלד מעל הצינורות.
- לאחר ההרדמה משמש preconditioning עבר דרך העברת העמודה השלב מלאה בכלורופורם התחתון של כל מדגם לעמודה בודדים. כדי לפשט את הליך זה, מימית השלב העליון ניתן להסיר מראש. להשתמש פיפטות פסטר זכוכית, עם זאת, שמור על עצמך כי העמודות לא יתייבש.
- במרוכז elute השומנים שברים עם 5 מ של כלורופורם (כולל השומנים נייטרלי חומצות שומן, NLFAs), 10 מ של אצטון (glycolipids - לא נותח בפרויקט זה) ו- 5 מ של מתנול (כולל חומצות שומן פוספוליפיד, PLFAs). לאסוף את כל השבר בכלי זכוכית בודדים.
- בסוף החילוץ, להפחית את הכלורופורם (NLFAs) של מתנול (PLFAs) באמצעות אידוי ב RVC. להעביר RVC הצינורות פתוחים, מתאדים עד יבש, ~ 90 דקות 60 ° C, שואב אבק של hPa 24 שעות ביממה.
- דגירה ב-100 ומתחילים סיבון של ליפידים (שברים NLFA ו- PLFA) בעקבות הפרוטוקול מן וולש (1991)29 עם תוספת של 1 מ"ל של מתנול נתרן הידרוקסידי פתרון (45 גר' נתרן הידרוקסידי, 150 מ ל מתנול ו 150 מ ל מים מזוקקים) ° C למשך 30 דקות באמבט מים. מגניב המדגם במי קרח למשך 2 דקות, ואז לשים את הדגימות לספסל ולהמשיך לעבוד בטמפרטורת החדר.
- להוסיף תקן פנימי כל מדגם כולל את החסר. לבחור חומצת שומן לא נפוץ אצל האורגניזמים ניסיוני; להשתמש גם חומצת שומן רוויה כדי למזער את ההפסד על-ידי פצילות ובחר מולקולה עם שרשרת באורך ביניים. למטרות רבות, חומצה (19:0) nonadecanoic אי-זוגיים עובד היטב. כך, להוסיף 30 µL של פתרון מ מ 0.74 ב- isooctane. הכמות המדויקת. חשוב מאוד - יש להקפיד לבדוק את מידת הדיוק של פיפטה שלך עם microbalance בתיאום מראש.
- להוסיף 2 מ ל חומצה הידרוכלורית-מתנול (mix 325 מ ל חומצה הידרוכלורית N 6.0 עם 275 מ"ל של מתנול), דגירה ב 80 מעלות צלזיוס במשך 10 דקות המים הרותחים וקריר במהירות על קרח למשך 2 דקות. השלב זה זמן וטמפרטורה רגיש; השתמש 80 ± 1 ° C ו- 10 ± 1 מינימלית הסימון עם כמה דגימות יכול להיכנס לאמבט מים בבת אחת כדי לשמור על 80 מעלות צלזיוס.
הערה: הליך זה תוצאות חומצות שומן מתיל אסטרים (FAMEs), קרי, חומצת שומן analytes התייצב על אידוי של גז כרומטוגרפיה. - לבסוף, להוסיף 1.25 מ של האתר הקסאן/מתיל בוטיל שלישוני (1:1) ולהסיר רוק בעדינות במשך 10 דקות, ואז צנטריפוגה ב 2,000 g עבור 5 דק את שלב תחתון ולשמור השלב העליון מורכב FAMEs; השתמש זכוכית שפסטר סיליקון. מוסיפים 3 מ"ל של המימית סודיום הידרוקסיד (10.8 g של NaOH מומס 900 מ ל מים מזוקקים) צעד כביסה.
- צנטריפוגה שוב ורוק.
- קח מלאה העליון המכיל שומנים בדם השלב באמצעות זכוכית פסטר פיפטה העברה כדי בקבוקון מדגם גז כרומטוגרפיה, בעזרתם של מחיצת טפלון. הימנע כולל כמויות קטנות אפילו של שלב מימית, כמו זה יגרום לבעיות עם מדידה GC. לתמצת המבחנה ולאחסן ב-20 ° C עד הניתוח.
4. כימות של חומצות שומן על ידי GC-FID
- השתמש גז כרומטוגרפיה כדי לזהות ולכמת את FAMEs בחלקים NFLA ו- PLFA של ליפידים Collembola (חיה). שמוצאים (GC) מצוידים עם גלאי יינון בלהבה (FID) הוא ציוד הקים ומוכח30.
- זיהוי FAMEs, להשוות בין זמן השמירה של פסגות במדגם לאלה תקן תהילה. אלה הם תערובת סטנדרטי איכותי או כמותי של מפתח FAMEs המכסים מגוון רחב של מוצרי מזון, אורגניזמים.
- מעסיקים תהילה תערובות סטנדרטית הכוללת נציג FAs כדי להפוך את האורגניזם ובדוקים קבוצה דיאטה ניסיוני. ב Collembola, אלו הם חומצות שומן מאפיין פרוקריוטים, למשל, חומצות שומן רב-בלתי רוויות ארוכות שרשרת כגון חומצה ארכידונית (20:4ω6). בעת העסקת שמרים כמו תזונה אלה הם סמנים פטרייתיים כגון חומצה לינולאית (18:2ω6). בחירה טובה הינו שילוב תהילה כביכול, הכולל 37 חומצות שומן שונות בתדירות גבוהה ב בעלי חיים, פטריות ומערבבים חומר צמחי, אסתר חיידקי חומצה מתיל (BAME) (ראה טבלה של חומרים).
- כדי להפעיל את הדגימות ב- GC-FID, להגדיר את רצף עם התוכנה המתאימים של המכשיר. לקבלת הוראות, עיין במדריך של היצרן. הרצף מתחיל חיצוני סטנדרט תערובות (למשל התהילה ואת תערובת BAME), ואחריו את הדגימות. שימו לב כי אין שמירה בזמן משמרת, קרי, עיכוב קל בזמן • תנאי של חומצות שומן מן העמודה GC עם כל הפעלה, בעת הפעלת דוגמאות! או ארוחה רגילה כל 10בתאנון להפעיל רצף הדגימה או להשתמש זמן השמירה נעילה של חומצה פלמיטית (16:0).
- להתאים GC הגדרות התלויים על המכשיר. התוכנית הבאה הוא הציע עבור עמודה נימי ביצועים גבוהים (HP) (25 מ' x 0.2 מ מ זהות, סרט עובי 0.33 מיקרומטר. הזרקת להגדיר אחסון כדי µL 1 במצב splitless ולהשתמש מימן המוביל גז. מעסיקים התחלה תוכנית הטמפרטורה ב 50 מעלות צלזיוס (נערכת במשך 1 דקה) והגברת מאת מינימום 25 ° C-1 עד 175 ° C ואחריו 3 ° C דקות-1 עד 230 מעלות צלזיוס (נערכת 5.7 דקות).
- לחשב את חומצת שומן nmol לפי משקל (יבש) טריים גרם של אורגניזמים באמצעות התגובה מתקבל על ידי FID עבור כל התהילה החלת את סכומי ידוע עבור חומצת השומן המתאימים באמצעות הנוסחה הבאה:
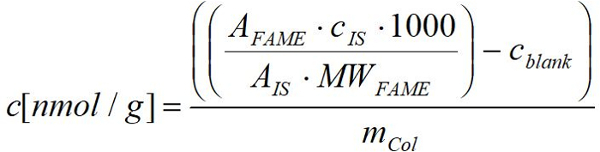
תהילה: שיא בתחום הפירסום בהתאמה במדגם
MWFM: המשקל המולקולרי של הפירסום בהתאמה ב µg/µmol
Cהוא: ריכוז של תקן פנימי ב- µg
הוא: אזור הפסגה של תקן פנימי
זCol: משקל (יבש) טריים בהתאמה מדגם Collembola בסול
1000: פקטור המרה מ µmol nmol
cBW: ריכוז של תהילה בהתאמה הממוצע של ערכים ריקים מתאימים nmol
5. ניתוח 13C על-ידי יצירת פרופיל איזוטופולוג
- להשתמש במערכת GC מצמידים מסה סלקטיבי גלאי (MS) המסופקים עם מקור יינון (EI) אלקטרון עבור איזוטופולוג נחישות.
- להשתמש בעמודת נימי קוטבי (למשל, DB 23, CP-סיל 88) זה עוד יותר מאפשר ההפרדה של חומצות שומן בלתי רוויות, אפילו עם אותם המספרים של קשרים כפולים. הבחירה של העמודה GC הוא קריטי עבור התוצאות כפי קובעת ייצוג טוב יון מולקולה בחומצות השומן.
- עבור עמודה DB 23 (60 מ' x 0.25 מ"מ תעודת-זהות, הסרט עובי 0.15 µm), הפעלת התנור הטמפרטורה ב 130 ° C ולהגדיל מאת 6.5 מעלות/דקות ל- 170 מעלות צלזיוס. בצע עם גידול של 3 ° C/min 203 מעלות והחזק מינימלית 1.9 לעקוב אחר עם גידול של 40 ° C/דקה עד 230 מעלות צלסיוס, לשמור על 8.3 מינימלית קבע העברת קו טמפרטורת 280 מעלות צלזיוס. שוב, להתאים את שיטת GC המכשיר.
- השתמש תקנים כמותיים הכוללת כמויות ידוע של FAMEs כל חומצות שומן כדי שתהיה חקירה עבור 13C התאגדות. להציב סטנדרטים אלה ההתחלה והסוף של כל רצף הדגימה להפעיל. קח טיימס השמירה של חומצות שומן ריבית הסטנדרטים האלה.
- למדוד דגימות מן הניסויים תמיד מתחילים עם הדגימות ללא תווית, את הגששים שכותרתה לאחר מכן. להחיל יחס פיצול המתאים ריכוזי לדוגמה, למשל 1:12.5.If זמין עבור המכשיר, להחיל על backflush עם הליום לאחר כל מדגם לרוץ כדי לנקות בטור analytes הנותרים.
- החל זמן השמירה נעילת בשיטת GC-MS כך רכישת SIM לא סובל הסטה ויש פעמים השמירה analyte לשחזור.
- לקבוע התאגדות 13C ביונים מולקולרית של חומצות שומן על ידי GC/EI-MS באמצעות יונים שנבחר ניטור (SIM) במצב של המכשיר. מבצע במצב ה-SIM מאפשר לזהות analytes ספציפית עם רגישות מוגברת יחסית במצב סריקה מלאה.
- להפעיל את הסריקה הראשונית של קודם כל לבדוק מה קיים ולאחר מכן להפעיל SIM על יונים המתאים. רוכשים נתונים ההמונים מולקולרית של עניין על-ידי בחירה מ/z סריקה windows (קבוצות ה-SIM) המקיף כרומטוגרפי בשיא תקופת חומצת השומן בהתאמה. בדרך כלל, לפקח על שניים עד ארבעה יונים לכל חלון analyte וזמן.
- על מנת להגביר את רגישות, להתאים את קצב הסריקה המוני ושוכנת פעמים (הזמן בילה מסתכל על כל מסה). הנתונים הטוב ביותר באיכות מתקבלים על המהירות הנמוכה ביותר האפשרית, ו- a בדרך כלל כלל ב- SIM הוא 8 עד 12 סריקות על הפסגה analyte. Proxy עבור הגדרות מכשיר זה זמן להתעכב הממוצע לכל מסה של 9 ms, זמן מחזור של 6 s וזמן סריקה של 175 ms cyle-1.
- לזהות את יון מולקולרית (ז+) של חומצת שומן המתאים ואת כל isotopologues שלו (מ'+1, מ'+2 וכן הלאה). ראו דוגמאות, נציג תוצאות.
- להקליט את השפע של כל שבר יון (איזוטופולוג). שימו לב כי השפע של יון מולקולה, isotopologues שלה נמוכה יחסית, האיכות של כימות תלויה במידה רבה הביצועים של מערכת MS. הפעל מנגינה לפני הפעלת רצף מדגם גדולים (ניסוי) ולנקות את מקור יון במידת הצורך.
הערה: ראשית, נתונים אלה התשואה הכוללת 13C enrichments של כל חומצות שומן על ידי למבשר נצרך (כאן 16:0). - להשתמש את הפרופורציה של הרכב איזוטופ של חומצות שומן שכותרתה מהקבצים המקבילים לא מסומן כדי להקצות שטף פחמן עם מחלות. להשתמש בנוסחה % אטום בשלב 6.1 כדי לחשב את אחוז הפחמן שכותרתה (אחוז אטום, אטום %) של חומצת השומן בהתאמה. להשוות את אחוז 13C בחומצות שומן של Collembola בין שכותרתה (יום 1 ולאחר מכן) וחיות ללא תווית (יום 0) בתור אינדיקציה יחסית זרימה של 13C מהתזונה אל הצרכן.
- להקצות את העמדה של 13C השתלבות שרשרת חומצות שומן. מבוסס על חלוקת isotopologues disentangle את הניתוב תזונתיים של חומצת השומן כל מעקב מסומן (כאן 16:0) של התארכות השרשרת על ידי מטבולי. בזמן הטמעה של המולקולה כל סמן מגבירה את השפע isotopologues הרחוק אל האב יונים (M+), למשל, מ'+15, מ'+16, עם התארכות השרשרת על ידי השימוש של 13C מתויג C2 קטעים (13C אצטיל קואנזים a) isotopologues קרוב יונים מולקולרית לקבל בתדירות גבוהה יותר.
6. חישובים של 13C העשרה
- על-פי ההתפלגות של isotopologues, לחשב האחוז הכולל של הפחמן עם תוויות ברורות (ב % אטום) חומצת השומן המתאימים באמצעות מערכת היחסים הבאים: אטום % = (יחס 13C איזוטופולוג שולבו) x (תדירות איזוטופולוג בהתאמה)
חישוב לאחר. Kuppardt et al. 31 כמו: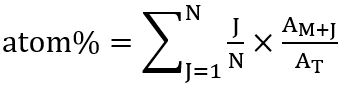
כאשר N הוא מספר אטומי פחמן, חומצת השומן J הוא מספר איזוטופים 13C, M + J הוא שפע איזוטופולוג בהתאמה, ו- T הכולל שפע של כל isotopologues. - לחישוב, סכום שיא באזור הערכים של יונים מולקולרית (ז+) של הפא בהתאמה, כל isotopologues (M+1, מ'+2, וכן הלאה), זוהה על ידי ניתוח SIM-MS, וקבעו השפע היחסי של 100%. לחשב שהחלק של כל איזוטופולוג שזוהו היא בקלות על ידי ביצוע החוק של שלושה.
- חיסור הערך שליטה שאינו מתויג יום 0 (רקע טבעי 13ג) מתוך הערכים ניסיוני כדי לקבל נתונים הסופי נעוצים רק בביצוע חיצוני 13C-תיוג.
תוצאות
תוכן טרי במשקל, ליפיד Collembola
במהלך הניסוי המתואר, התוכן NLFAs ו- PLFAs לא השתנו באופן משמעותי לאורך זמן, ואילו המשקל טריים של דגימות גדל מעט אבל לא באופן משמעותי24. שני הפרמטרים מצביעים על רמה טובה של כושר גופני מהדוגמאות Collembola. להיות מודע לחקור טרי במשקל, ?...
Discussion
איזוטופולוג פרופיל
ניתוח מפורט של היבטים כמותיים בחלוקת 13C ב FAs צריך טכנולוגיה חדשנית כדי להקצות פחמן חלוקה למחיצות בבמארג המזון. העבודה הנוכחית המועסקים איזוטופולוג פרופיל כדי להעריך את 13C /12C יחסי של סמנים פא נפוצות עבור אינטראקציות טרופי. שיטה ?...
Acknowledgements
התמיכה הכלכלית של ר' מנזל, ל' Ruess על ידי פתוח (RU RU780/11-1) הוא הודה בהכרת תודה. ר' Nehring מומן על ידי-RU 780/10-1. בסופו של דבר, אנחנו מאוד אסיר תודה ד ר לוז Ruvimbo Maboreke להגהת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| neoLab-Round jars | neoLab | 2-1506 | 69 x 40 mm, 10 pacs/pack |
| Charcoal activated | Carl Roth | X865.1 | p.a., powder, CAS No. 7440-44-0 |
| Alabaster Dental | RÖHRICH-GIPSE | --- | http://www.roehrich-gipse.de/dentalgipse.php |
| Chloroform | Carl Roth | 7331.1 | HPLC ≥ 99,9 % |
| Methanol | Carl Roth | P717.1 | HPLC ≥ 99,9 % |
| Hexan | Carl Roth | 7339.1 | HPLC ≥ 98 % |
| tert-Butyl methyl ether (MTBE) | Carl Roth | T175.1 | HPLC ≥ 99,5 % |
| Aceton | Carl Roth | 7328.2 | HPLC ≥ 99,9 % |
| NaOH | Carl Roth | 6771.1 | p.a. ≥99 %, in pellets |
| di-Natriumhydrogenphosphat | Carl Roth | P030.1 | p.a. ≥99 % , water free |
| Na-dihydrogenphosphat Dihydrat | Carl Roth | T879.1 | p.a. ≥99 % |
| Hypochloric acid (6 N) | VWR International | 26,115,000 | AVS TITRINORM vol. solution |
| Bond Elut (Columns) | Agilent Tech. | 14102037 | HF Bond Elut-SI, 500 mg, 3 mL, 50/PK |
| Präparatengläser Duran | Glasgerätebau Ochs | 135215 | Ø 16 x 100 mm, plus screw cap with handy knurl and integrated PTFE/silicone gasket |
| Supelco 37 Component FAME Mix | Sigma-Aldrich | 47885-U Supelco | 10 mg/mL in methylene chloride, analytical standard |
| FlowMesh | Carl Roth | 2796.1 | Polypropylene mesh, approximately 0.3 mm thick, with 1 mm strand spacing |
| Bacterial Acid Methyl Ester (BAME) Mix | Sigma-Aldrich | 47080-U Supelco | 10 mg/mL in methyl caproate, analytical standard |
| Methyl nonadecanoate | Sigma-Aldrich | 74208 | analytical standard ≥ 98.0 % |
| Hexadecanoic acid-1-13C (Palmitic) | Larodan Fine Chemicals | 78-1600 | GC ≥ 98.0 % (13C: 99.0 %) |
| RVC 2-25 CDplus | Martin Christ Gefrier-trocknungsanlagen | Compact benchtop midi concentrator | |
| Alpha 2-4 LDplus | Martin Christ Gefrier-trocknungsanlagen | Drying manifold | |
| MZ 2C NT | Vacuubrand GMBH | Vacuum pump | |
| Roto-Shake Genie | Scientific Industries | Combined rocking and rotating device | |
| XP64 Micro Comparator | Mettler Toledo | Super high precision balance | |
| GC-System 7890A | Agilent Tech. | Gas chromatograph | |
| 7000 GC/MS Triple Quad | Agilent Tech. | Triple Quad mass spectrometer | |
| 7683B Series Injector | Agilent Tech. | Sample injector | |
| Heraeus Multifuge 3SR+ | Thermo Scientific | Centrifuge with 10 ml tube rotor |
References
- Ruess, L., et al. Application of lipid analysis to understand trophic interactions in soil. Ecology. 86 (8), 2075-2082 (2005).
- Ruess, L., et al. Lipid composition of Collembola and their food resources in deciduous forest stands - Implications for feeding strategies. Soil Biology and Biochemistry. 39 (8), 1990-2000 (1990).
- Chamberlain, P. M., Bull, I. D., Black, H. I. J., Ineson, P., Evershed, R. P. Fatty acid composition and change in Collembola fed differing diets: identification of trophic biomarkers. Soil Biology and Biochemistry. 37 (9), 1608-1624 (2005).
- Stott, A. W., Davies, E., Evershed, R. P., Tuross, N. Monitoring the routing of dietary and biosynthesised lipids through compound-specific stable isotope (delta C-13) measurements at natural abundance. Naturwissenschaften. 84 (2), 82-86 (1997).
- Ruess, L., Haggblom, M. M., Langel, R., Scheu, S. Nitrogen isotope ratios and fatty acid composition as indicators of animal diets in belowground systems. Oecologia. 139 (3), 336-346 (2004).
- Pollierer, M. M., Scheu, S., Haubert, D. Taking it to the next level: Trophic transfer of marker fatty acids from basal resource to predators. Soil Biology and Biochemistry. 42 (6), 919-925 (2010).
- Ferlian, O., Scheu, S., Pollierer, M. M. Trophic interactions in centipedes (Chilopoda, Myriapoda) as indicated by fatty acid patterns: Variations with life stage, forest age and season. Soil Biology and Biochemistry. 52, 33-42 (2012).
- Ruess, L., Chamberlain, P. M. The fat that matters: Soil food web analysis using fatty acids and their carbon stable isotope signature. Soil Biology and Biochemistry. 42 (11), 1898-1910 (2010).
- Traugott, M., Kamenova, S., Ruess, L., Seeber, J., Plantegenest, M. Empirically characterising trophic networks: What emerging DNA-based methods, stable isotope and fatty acid analyses can offer. Adv Ecol Res. 49, 177-224 (2013).
- Hammer, B. T., Fogel, M. L., Hoering, T. C. Stable carbon isotope ratios of fatty acids in seagrass and redhead ducks. Chemical Geology. 152 (1-2), 29-41 (1998).
- Budge, S. M., Iverson, S. J., Koopman, H. N. Studying trophic ecology in marine ecosystems using fatty acids: A primer on analysis and interpretation. Marine Mammal Science. 22 (4), 759-801 (2006).
- Haubert, D., et al. Trophic structure and major trophic links in conventional versus organic farming systems as indicated by carbon stable isotope ratios of fatty acids. Oikos. 118 (10), 1579-1589 (2009).
- Ngosong, C., Raupp, J., Richnow, H. H., Ruess, L. Tracking Collembola feeding strategies by the natural 13C signal of fatty acids in an arable soil with different fertilizer regimes. Pedobiologia. 54 (4), 225-233 (2011).
- Bec, A., et al. Assessing the reliability of fatty acid-specific stable isotope analysis for trophic studies. Methods in Ecology and Evolution. 2 (6), 651-659 (2011).
- Gladyshev, M. I., Makhutova, O. N., Kravchuk, E. S., Anishchenko, O. V., Sushchik, N. N. Stable isotope fractionation of fatty acids of Daphnia fed laboratory cultures of microalgae. Limnologica. 56 (Supplement C. 56 (Supplement C), 23-29 (2016).
- Gladyshev, M. I., Sushchik, N. N., Kalachova, G. S., Makhutova, O. N. Stable isotope composition of fatty acids in organisms of different trophic levels in the Yenisei river. PLoS One. 7 (3), e34059 (2012).
- Eisenreich, W., Dandekar, T., Heesemann, J., Goebel, W. Carbon metabolism of intracellular bacterial pathogens and possible links to virulence. Nature Reviews Microbiology. 8 (6), 401-412 (2010).
- Eylert, E., Bacher, A., Eisenreich, W. NMR-based isotopologue profiling of microbial carotenoids. Methods Mol Biol. 892, 315-333 (2012).
- Garton, N. J., O'Hare, H. M. Tuberculosis: feeding the enemy. Chemical Biology. 20 (8), 971-972 (2013).
- Rosenblatt, J., Chinkes, D., Wolfe, M., Wolfe, R. R. Stable isotope tracer analysis by GC-MS, including quantification of isotopomer effects. Am J Physiol. 263 (3), E584-E596 (1992).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. J Mass Spectrom. 31 (3), 255-262 (1996).
- Heuner, K., Eisenreich, W. The intracellular metabolism of legionella by isotopologue profiling. Methods Mol Biol. 954, 163-181 (2013).
- Willenborg, J., et al. Characterization of the pivotal carbon metabolism of Streptococcus suis serotype 2 under ex vivo and chemically defined in vitro conditions by isotopologue profiling. J Biol Chem. 290 (9), 5840-5854 (2015).
- Menzel, R., Ngosong, C., Ruess, L. Isotopologue profiling enables insights into dietary routing and metabolism of trophic biomarker fatty acids. Chemoecology. 27 (3), 101-114 (2017).
- Buse, T., Ruess, L., Filser, J. New trophic biomarkers for Collembola reared on algal diets. Pedobiologia. 56 (3), 153-159 (2013).
- Hutson, B. R. Effects of variations of the plaster-charcoal culture method on a Collembolan, Folsomia candida. Pedobiologia. 18, 138-144 (1978).
- Fountain, M. T., Hopkin, S. P. Folsomia candida (Collembola): a "standard" soil arthropod. Annu Rev Entomol. 50, 201-222 (2005).
- ISO, I. O. f. S. . Soil Quality-Inhibition of reproduction of Collembola (Folsomia candida) by soil pollutants. , (1999).
- Welch, D. F. Applications of cellular fatty acid analysis. Clin Microbiol Rev. 4 (4), 422-438 (1991).
- Dodds, E. D., McCoy, M. R., Rea, L. D., Kennish, J. M. Gas chromatographic quantification of fatty acid methyl esters: flame ionization detection vs. electron impact mass spectrometry. Lipids. 40 (4), 419-428 (2005).
- Kuppardt, S., Chatzinotas, A., Kastner, M. Development of a fatty acid and RNA stable isotope probing-based method for tracking protist grazing on bacteria in wastewater. Appl Environ Microbiol. 76 (24), 8222-8230 (2010).
- Zhang, X., He, H., Amelung, W. A GC/MS method for the assessment of 15N and 13C incorporation into soil amino acid enantiomers. Soil Biology and Biochemistry. 39 (11), 2785-2796 (2007).
- Vetter, W., Thurnhofer, S. Analysis of fatty acids by mass spectrometry in the selected ion monitoring mode. Lipid Technol. 19 (8), 184-186 (2007).
- Thurnhofer, S., Vetter, W. A gas chromatography/electron ionization-mass spectrometry-selected ion monitoring method for determining the fatty acid pattern in food after formation of fatty acid methyl esters. J Agric Food Chem. 53 (23), 8896-8903 (2005).
- Haubert, D., Haggblom, M. M., Scheu, S., Ruess, L. Effects of fungal food quality and starvation on the fatty acid composition of Protaphorura fimata (Collembola). Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology. 138 (1), 41-52 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved