Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Жирные кислоты 13C Isotopologue профилирования обеспечивает проницательность в трофических углерода передачи и метаболизма липидов беспозвоночных потребителей
В этой статье
Резюме
Жирные кислоты трофических маркер подход, т.е., ассимиляции жирных кислот как весь молекулы и передачи в потребительских ткани с без или незначительные модификации, препятствуют пробелы в знаниях в метаболизме жирных кислот мелких почвенных беспозвоночных. Isotopologue профилирования предусмотрено как ценный инструмент отделить трофических взаимодействий.
Аннотация
Жирные кислоты (ФАС) являются полезным биомаркеров в пищевой сети экологии, потому что они обычно усваивается как полный молекулы и переведены в потребительских ткани с несовершеннолетним или без модификации, позволяя диетических маршрутизации между различными трофическими уровнями. Однако FA трофических маркер подход по-прежнему препятствует ограниченные знания метаболизма липидов почвенной фауны. В настоящем исследовании использованы полностью помечены пальмитиновая кислота (13C16:0, 99% атом) как трассировщик в пути метаболизма жирных кислот два широко почвы ногохвостки, Protaphorura fimata и Heteromurus nitidus. Для того, чтобы расследовать судьбу и метаболические изменения этого прекурсора, представлен метод профилирования isotopologue, выполнено по масс-спектрометрии с помощью одного иона мониторинга. Кроме того описан вверх по течению лаборатории кормления эксперимент, а также добыча и метилирования доминирующей Липидные фракции (нейтральные липиды, фосфолипиды) и соответствующие формулы и расчеты. Isotopologue профилирования не только урожай, общий 13C обогащения в жирные кислоты, полученных от 13C пометкой прекурсоры, но также производит шаблон isotopologues, превышения массы родительского Иона (т.е. Молекулярный ион FA М+) каждого помечены FA на одной или нескольких единицах массы (M+ 1M+ 2M+ 3, и т.д.). Это знание позволяет сделать выводы о соотношении диетических маршрутизации полностью потребляются Англии по сравнению с de novo биосинтеза. Isotopologue профилирование предлагается как полезный инструмент для оценки метаболизма жирных кислот в почвенных животных отделить трофических взаимодействий.
Введение
В загадочные Хабитат такие почвы трофических связей трудно адрес и далее ограничен небольшой размер фауны. Последнее десятилетие было отмечено прогресса в биохимической экологии, особенно в использовании жирных кислот в качестве биомаркеров для определения стратегии кормления почвенной фауны в полевых условиях1,2,3. Это основано на факте, что жирные кислоты из ресурсов могут быть включены в потребительских ткани как весь молекулы, процесс называется диетических маршрутизации4. Течение трех трофических уровней, т.е. от грибов к струнцы ногохвостки5было сообщено передачи жирных кислот. Недавно хищной фауны считался6,7 , и первые обзоры на жирные кислоты как трофические маркеров в пищевых сетях почвы были опубликованы8,9.
Более подробная информация о трофических взаимодействий достигается стабильный изотоп жирных кислот зондирование (FA-SIP). Определение 13C /12C соотношение жирных кислот в рационе и потребителей могут приписывать двоичные ссылки и оценить поток связанного углерода и был нанят в наземных, пресноводных и морских пищевых сетях10,11 ,12,13. Основное предположение — что диетических перенаправленное жирные кислоты не подлежат ферментативных процессов; Таким образом, их 13C сигнал, т.е. 13C /12C соотношение жирных кислот, в потребитель аналогична в диетические1. Однако постепенное истощение 13C подписи вверх по пищевой цепи поступили в водных системах, тем самым препятствуя широкое применение FA-SIP в трофических исследования14,,1516. Кроме того знания метаболизма липидов в большинстве беспозвоночных в наземных пищевых сетях по-прежнему ограничен.
Понимание путей метаболизма липидов в потребителей имеет важное значение для использования трофических маркер жирных кислот, как средство для определения количественной углерод потока в пищевой сети экологии. Имея это в виду, 13C-isotopologue профилирования, который в принципе может быть применен для исследования метаболизма углеродных любой биологической системы17, является перспективным методом. После введения 13C, меченного углерода субстрата, распределение 13C в метаболических сети прослеживается с сгенерированный метаболических продуктов в шоу потребительской распределение конкретных isotopologue. Это могут быть оценены количественных ядерный резонанс метаболических спектроскопии18,19 или масс-спектрометрии20,21, с последнего благоприятствования в биологических образцов с низкой биомассы из-за его выше чувствительность.
Хотя isotopologue профилирования успешно применяется для аминокислот и предоставляет проницательность в метаболизм углерода в естественных условиях , бактериальных патогенов17,22,23, ее осуществление в жирных кислот отстает. Первый подробный анализ на судьбу стабильного изотопа помечены прекурсоров жирных кислот, ее диетических маршрутизации или деградации через β-окисления, в почве беспозвоночных потребителей, недавно была исполнена Мензел и др. 24. здесь, методологические основы для включения экспериментов с 13C маркировкой жирные кислоты, а затем isotopologue анализ ключевых потомков в частых почвенных беспозвоночных, ногохвостки, предоставляются. Эти microarthropods являются хорошей моделью группой, поскольку они являются важными компонентами почвы пищевой сети и хорошо исследованы на8,их трофических маркер в жирные кислоты25.
Понимание путей метаболизма липидов в потребителей имеет важное значение для использования трофических маркер жирных кислот, как средство для определения количественной углерод потока в пищевой сети экологии. Настоящий протокол дает проектирование и настройка для кормления эксперимент и биохимическими процедурами для извлечения и метилирования доминирующей липиды фракций (нейтральные липиды, фосфолипиды) от ногохвостки лаборатории. Он демонстрирует, как isotopologue состав жирных кислот анализируется по масс-спектрометрии и описывает связанные формулы и расчеты. Эта процедура приводит к: (i коэффициентов превышения массы родительского Ион (т.е., жирные кислоты Молекулярный ион М+) на один или более isotopologues массы единицы (M+ 1M+ 2M+ 3, и т.д.) и (ii) общий 13 C обогащения в жирные кислоты, производный от 13C маркировкой прекурсоров. Хотя используется для ногохвостки, этот подход как правило может применяться к любой другой хищник жертва взаимодействия на той предпосылке, что они culturable в достаточном количестве в контролируемых условиях для обеспечения успешного лейбл поглощения и последующих Проверка.
протокол
Описывается протокол не подпадают под компетенцию животных этики. Однако когда люди адаптировать описанные протоколы для высших животных, заботиться, что институциональные животных этики Комитет утвердил протокол для обработки животных.
1. выращивание животных
Примечание: Все объяснил, что экспериментальные шаги на основе устоявшихся протоколы26,27,28. Биотестов в лаборатории нужна непрерывной поставки легко culturable организмов. Здесь были использованы ногохвостки видов Protaphorura fimata (Gisin, 1952) и Hetermurus nitidus (Темплтон, 1835). Оба вида просто для поддержания продуктивного лабораторных культур, кормили с пекарские дрожжи.
- В пластиковых микромира с крышками плотно пригнанный (диаметр 7 см, высота 4,5 см), добавить смесь активированного угля, гипса и дистиллированной воды для обеспечения высоко влажных разведения субстрата (рис. 1A).
- При подготовке смеси микромира достаточно субстрата, например, для 10 микромира в пакете. Микс 9 частей гипса (225 g) и 1 часть сухого активированного угля (25 г) вместе в горшочке штукатурки, добавьте тщательно около 10 частях дистиллированной воды (250 мл) и позволить сидеть в течение 5 минут без перемешивания при комнатной температуре.
- Перемешать с ложкой лаборатории на средней скорости в направлении по часовой стрелке, чтобы избежать воздушных пузырей, пока не будет достигнуто густую консистенцию густой. Наливайте сразу в микромира на высоту около 1 см.
- Гладкая штукатурка нежным нажатием на скамейке и закрученной. Обратите внимание, что отверстия (случайных товаров пузырьков воздуха) и борозд (активно добавил стерильные шпателем) может поощрять плодородные ногохвостки откладывают яйца там. Это исследование избегать отверстия, борозды пользу того же воспроизводимость условий. Однако для демонстрационных целей Рисунок 1B представляет несколько отверстий.
- Разрешена сушка около 1-2 дней при комнатной температуре; Инкубация при 60 ° C может уменьшить это время до 1-2 ч.
- Смочите микромира перед использованием, добавляя водопроводной воды с пипеткой, пока субстрат слегка влажной. Держите влажной микрокосм, регулярно добавив дистиллированной воды как ногохвостки имеют мягкие кутикулы и подвержен усыхания.
- Легко передать ногохвостки подгипсовая подкладка с использованием простой всасывающую трубу, то есть, долго силиконовая трубка около 25 см длиной с кончиком пипетки оснащен небольшой сетки для предотвращения всасывания животных в трубу. Кроме того передача животных, позволяя им присоединиться на щетина щеточкой.
- Передачи (см. шаг 1.2) 30 свежезаваренным вылупились ногохвостки в новой микромира и гранулированный сухих пекарских дрожжей в качестве пищи (около кончик ножа) (рис. 1B); обновить по крайней мере два раза в неделю. План три независимых реплицирует день выборки; в этом исследовании дней 0 - 7 и 14. Инкубируйте на 15 ° C, в темноте. Поддержание постоянной температуры имеет важное значение, как жирные кислоты были изменены на животных метаболизма для удовлетворения требования к текучесть мембран.
- Кормить ногохвостки с пекарские дрожжи за четыре недели до начала экспериментов экспозиции для получения однородной 13C /12C сигнал и шаблон в жирные кислоты. Используйте всасывающую трубу или щеткой, чтобы удалить все яйца (рис. 1 c), фекальные пеллеты, и exuviae регулярно как животные могут кормить на них тем самым изменяя их липидный профиль.

Рисунок 1: культивирование ногохвостки. (A) микрокосм заполнены с разведения субстрата, сушеные смесь, гипс, активированный уголь и дистиллированной воды. (B) и (C) представительного образца Protaphorura fimata культуры; Обратите внимание мелким самородкам сухих пекарских дрожжей используется как источник пищи, а также отверстия в разведении субстрата (черная стрелка) (B) а также два яйца (белая стрелка) (C). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
2. Маркировка диета, урожая и пробами
- Маркировки
- Через четыре недели после создания культуры ногохвостки, место 30 особей в новые микромира и Инкубируйте на 15 ° C в темноте.
- Ввести метку импульса путем кормления их пекарских дрожжей, содержащий полностью 13C-меченых пальмитиновая кислота (13C16:0, 99% атома), смешивая 13C-меченых пальмитиновая кислота с пекарские дрожжи шпателем на коэффициент 0.5:1, например, 5 g 13 C16:0 и 10 g сухие дрожжи Бейкер. Место кончике ножа на каждом микромира.
- После 6 часов замените помечены пищи с полностью немеченого хлебопекарных дрожжей.
-
Дальнейшее культивирование
- В ходе эксперимента возобновить дрожжи диеты каждые три дня и добавить суммы выше, чем то, что ногохвостки будет потреблять в течение этого периода. Самое главное используйте всасывающую трубу или щеткой для удаления Collembolan яйца, фекальные пеллеты и exuviae регулярно, чтобы обеспечить эксклюзивный кормления животных на предоставленный пищу.
- Урожай
- Образец микромира деструктивно ежедневно до 7 день. Затем на 14 день, Соберите три независимых реплицирует на каждом выборки; Возможны различные выборки раз.
- Подготовка 10 мл стеклянных трубок с тефлоновым покрытием колпачки, один для каждого образца. Заранее очистить эти трубы в омывателя стекла и дважды промойте деионизованной воды потом. Наконец, чтобы удалить все следы гидрофобных загрязнителей мыть дважды, добавив 2 мл хлороформа (ВЭЖХ класс), вихревой примерно и отбросить растворителя.
- Для контрольных образцов (день 0) принимать 3 30-облученных ногохвостки от предварительно культур как день 0 образцы.
- Для выставленных образцов (день 1 и далее), принять для ежедневных образцов в каждом случае 3 30 подвергаются ногохвостки от культур промежуточно кормили смесью 13C-меченых пальмитиновой кислоты и хлебопекарных дрожжей.
- Ультра микровзвешивания для записи ногохвостки свежего веса. Передача животных с помощью вытяжного вентилятора или щетку для соответствующего масштаба кастрюли. Чтобы обеспечить управляемость ногохвостки во время взвешивания в масштабе кастрюли, шок прохладно животных до (-80 ° C 2 ч). Кроме того поток2 CO для 10 мин можно безопасно оглушить животных.
- Непосредственно после взвешивания животных от масштаба жаровня осторожно поместите в 10 мл стеклянные пробирки. Заполните трубы с 1 мл метанола (ВЭЖХ класс) и хранить при температуре от-20 ° C до анализа.
Примечание: От этого шага Избегайте образец обработки пластиковых оборудованием как участвуют органических растворителей; Вместо этого используйте диспенсеры и дозаторы, которые подходят для растворителей, а также стеклянные сосуды.
3. липидов извлечения из тканей животных и метанолиза
- Подготовьте три стеклянные пробирки (оборудован с тефлоновым покрытием колпачки) каждого пакета, содержащего только 1 мл метанола как пустые значения. Важно отметить, что добавить или передавать любой растворитель, используемые в настоящем Протоколе только стеклянные пипетки или хлороформ/метанола промыть растворителем устойчивостью распылителей.
- В начале процесса извлечения липидов, уменьшить метанола, применяется для хранения (или гашения) путем испарения; Компактная настольная ротационные вакуумные концентратор (РВК) оснащены вакуумного насоса и холодную ловушку рекомендуется. Передача открытых трубы в РВК и испарится до сухого при 50 ° C и вакуума давлении 200 гПа за 20 мин.
- Добавьте 5 мл растворителя однофазные извлечения (chloroform/methanol/0.05 M фосфатного буфера 1:2:0.8, рН 7,4) для каждого образца (включая пробелы) и извлечь путем встряхивания на ночь Collembolan липидов при комнатной температуре (~ 200 об/мин).
- Передать новые трубы растворителя и заново распаковать образцов путем встряхивания для 3 h с дополнительной 2,5 мл растворителя извлечения. После этого объединить выдержки из обоих шаги; рекомендуется использовать стекла, которую пипетки Пастера. Добавить 0,8 мл хлороформа и 0,8 мл дистиллированной воды, затем смешать и центрифуги на 2000 g при 20 ° C за 5 мин. Наконец, позвольте образцы постоять 5 мин для разделения водных и хлороформ фазы.
- Для анализа шаблон жирных кислот делят общее клеточных липидов ногохвостки на липидный нейтральными, гликолипиды и фосфолипидного фракций.
- Для каждого образца, подготовить столбец кислоты кремнезема (коммерческие столбец с кремниевой кислоты 0,5 г, сетка размер 100-200 мкм, смотрите Таблицу материалы), добавив 1 мл хлороформа (литраж). Чтобы ускорить этот процесс, смонтируйте столбцы на вакуумный блок, как часто используется в хроматографии для извлечения твердой фазы. Не использовать нейлон иглы; использование нержавеющей стали выше трубы.
- После хлороформа, используемый для предварительной подготовки прошло через столбец передачи этапа полного нижней хлороформ каждого образца для отдельного столбца. Чтобы упростить эту процедуру, верхняя водной фазе могут быть удалены заранее. Использование пипетки Пастера стекла, однако, заботиться, что столбцы не высохнуть.
- Последовательно элюировать фракций липидов с 5 мл хлороформа (включая липидный нейтральными жирных кислот, NLFAs), 10 мл ацетона (гликолипидов - не проанализированы в этом проекте) и 5 мл метанола (включая фосфолипидного жирных кислот, PLFAs). Собирайте каждую долю в отдельных стеклянные сосуды.
- В конце добычи уменьшите хлороформ (NLFAs) и метанола (PLFAs) через испарение в РВК. Передача открытых трубы РВК и испарится до сухого, ~ 90 мин при 60 ° C и вакуум 24 гПа.
- Запустите омыления липидов (NLFA и PLFA фракций) после протокол от29 Уэлч (1991) с добавлением 1 мл раствора гидроксида натрия метанол (45 г гидроксида натрия, 150 мл метанола и 150 мл дистиллированной воды) и Инкубируйте на 100 ° C на 30 минут на водяной бане. Прохладный образца в ледяной воде за 2 мин, затем поместить образцы обратно на скамейке и продолжать работу при комнатной температуре.
- Добавьте внутренний стандарт для каждого образца, включая пробелы. Выберите жирные кислоты не распространены в экспериментальной организмов; также используйте насыщенных жирных кислот, чтобы свести к минимуму потери путем расщепления и выберите молекула с промежуточной длины цепи. Для многих целей, нечетные nonadecanoic кислоты (19:0) работает хорошо. Таким образом добавьте 30 мкл раствора 0,74 мм в изооктане. Точное количество очень важно - не забудьте проверили точность ваших пипетку с микровзвешивания заранее.
- Добавить 2 мл соляной кислоты-метанола (микс 325 мл 6.0 N соляной кислоты с 275 мл метанола), Инкубируйте на 80 ° C в течение 10 мин в водяной бане и прохладный быстро на льду на 2 мин. Этот шаг является, время и температуры чувствительных; Используйте 80 ± 1 ° C и 10 ± 1 мин Check с как многие образцы могут пойти в водяной бане одновременно сохранить 80 ° C.
Примечание: Данная процедура приводит к жирные кислоты метиловый эфир (FAMEs), т.е. жирные кислоты аналитов стабилизированный для испарения в газовой хроматографии. - Наконец, добавьте 1,25 мл гексана/метил третичного бутилового эфира (1:1) и рок мягко в течение 10 мин, затем центрифуги на 2000 g для 5 минут удалите нижней фазе и держать Верхний этап состоит из Фиелд; использование стекла, которую пипетки Пастера. Добавьте 3 мл водного раствора гидроксида натрия (10,8 г NaOH, растворенных в 900 мл дистиллированной воды) для стирки шага.
- Рок и центрифуги снова.
- Возьмите полный верхняя липидов содержащих этапа с помощью стеклянной пипетки Пастера и передачи для газовой хроматографии образца ампулу с тефлоновым перегородки. Избегайте, включая даже небольшое количество водной фазы, как это вызовет проблемы с измерением GC. Инкапсуляция флакона и хранить при температуре от-20 ° C до анализа.
4. Количественная оценка жирных кислот, GC-FID
- Используйте для идентификации и количественной оценки Фиелд в NFLA и PLFA фракций липидов ногохвостки (животное) газовая хроматография. Газовый хроматограф (GC), оснащенных пламенно-ионизационный детектор (FID) является сложившиеся и оправдавшие себя оборудование30.
- Для идентификации Фиелд Сравните время удержания пиков в образце для тех, кто в стандарте славы. Это качественные или количественные стандартную смесь ключа Фиелд, охватывающих целый ряд продуктов питания и организмов.
- Используют стандартные смеси славы составе Представитель ФАС для группы исследуемых организма и экспериментальные диеты. В ногохвостки эти жирные кислоты для характерны эукариот, например, длинноцепочечных полиненасыщенных жирных кислот, таких как арахидоновая кислота (20:4ω6). При использовании дрожжей как диета это грибковые маркеры, такие как линолевая кислота (18:2ω6). Хорошим выбором является так называемый славы микс, состоящий из 37 различных жирных кислот, часто в животное, грибковых и растительного материала и бактериальных кислоты метилового эфира (БАМЭ) смесь (см. Таблицу материалы).
- Для выполнения образцов на GC-FID, Настройка последовательности с соответствующим программным обеспечением инструмента. Для получения инструкций обратитесь к руководству производителя. Последовательность начинается с внешних стандартных смесей (например славы и БАМЭ mix), следуют примеры. Обратите внимание, что сдвиг времени удержания, т.е., небольшая задержка во время элюции жирных кислот из столбца GC с каждого запуска, при запуске образцов! Либо включают стандартный каждые 10й запуск в пример последовательности или использовать время удержания блокировки для пальмитиновая кислота (16:0).
- Адаптировать GC параметров зависит от инструмента. Следующая программа предлагается для высокой производительности (HP) капиллярной колонки (25 м х 0,2 мм и.д., пленка толщиной 0,33 мкм. набор инъекции объем в 1 мкл в splitless режиме и использование водорода в качестве газа-носителя. Использовать программы начало температуры при 50 ° C (проходившей 1 мин) и увеличения на 25 ° C мин-1 до 175 ° C, следуют 3 ° C мин-1 до 230 ° C, (состоявшейся 5.7 мин).
- Вычислите нмоль жирных кислот на грамм свежих (сухой) веса организмов, с использованием полученных FID для каждого славы, применение известной суммы для соответствующих жирных кислот, с использованием следующей формулы:
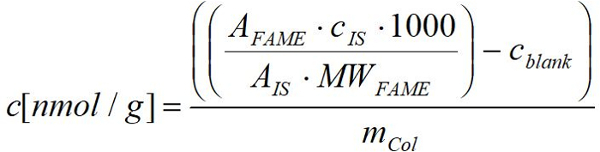
Слава: площадь Пика славы соответствующих в образце
МВтFM: молекулярная масса соответствующих славы в мкг/мкмоль
Cявляется: концентрация внутреннего стандарта в мкг
IS: площадь пика внутреннего стандарта
mCol: свежий (сухой) Вес соответствующих ногохвостки образца в g
1000: коэффициент пересчета из мкмоль в нмоль
cBW: концентрация соответствующих славы в среднем в соответствующих пустых значений в нмоль
5. анализ 13C Isotopologue профилирования
- Используйте систему GC, сочетании для массы селективного детектора (МС) поставляется с источником ионизации (EI) электронов для определения isotopologue.
- Используйте полярных капиллярной колонки (например, 23 дБ, CP Sil 88), как это позволяет дальнейшее разделение ненасыщенных жирных кислот, даже с теми же номерами двойных связей. Выбор столбца GC имеет решающее значение для результатов, как он определяет хорошее представление ионной молекулы жирных кислот.
- Для столбца 23 дБ (60 м x 0,25 мм и.д., пленка толщиной 0,15 мкм), начало температуру в духовке при 130 ° C и увеличить на 6,5 ° C/мин до 170 ° C. Следуйте с увеличением на 3 ° C/мин до 203 ° C и удерживайте 1.9 мин следовать с увеличением 40 ° C/мин до 230 ° C и удерживайте 8,3 мин Set передачи линии температуру до 280 ° C. Опять же измените метод GC для инструмента.
- Использование количественных стандартов, включая известные количества Фиелд для всех жирных кислот должны расследоваться для включения 13C. Положите эти стандарты в начале и конце каждого образца последовательности запуска. Возьмите время удержания жирных кислот интереса от этих стандартов.
- Мера образцы из экспериментов, всегда начиная с неподписанных образцы и помечены зонды после этого. Применять Сплит соотношение соответствующих концентраций образца, например 1:12.5.If для инструмента, применять промывание гелием после каждого запуска погасить столбец из оставшихся аналитов образца.
- Применить время удержания блокировки для метода GC-MS, так что приобретение сим не страдают от ветра и воспроизводимые аналита удержания раз.
- Определите 13C включения в молекулярных ионов жирных кислот GC/EI-МС с использованием выбранного Ион (SIM) режим инструмента мониторинга. Операции в режиме SIM позволяет выявлять конкретные аналитов с повышенной чувствительностью по отношению к режима полного сканирования.
- Запустить первоначальное сканирование первых, чтобы увидеть, что такое настоящее, а затем запустить SIM на соответствующих ионов. Сбор данных в молекулярных масс, представляющих интерес, выбрав m/z сканирования windows (сим групп) охватывающих хроматографического пика время соответствующих жирные кислоты. Как правило контролировать два-четыре ионов на окно аналита и времени.
- Для того чтобы увеличить чувствительность, отрегулировать скорость массового сканирования и жить раз (время провел глядя на каждой массы). Лучшее качество данных получаются с низкой скоростью и вообще правило в SIM 8-12 сканирует над пик исследуемое вещество. Прокси-сервер для настройки инструмента является средняя продолжительность на массы 9 мс, время цикла 6 s и время проверки 175 мс cyle-1.
- Определить молекулярный Ион (M+) соответствующих жирные кислоты и всех его isotopologues (M+ 1, M+ 2 и так далее). Примеры содержатся в разделе представитель результаты.
- Запись обилие каждый Ион фрагмент (isotopologue). Обратите внимание, что обилие ионной молекулы и его isotopologues является относительно низким и качество количественной оценки во многом зависит от производительности системы MS. Выполните настройку перед началом большой образец последовательности (эксперимент) и при необходимости почистите источник ионов.
Примечание: Во-первых, эти данные дают общий 13C обогащения каждого жирных кислот, потребляемых прекурсоров (здесь 16:0). - Используйте долю изотопного состава помечены жирных кислот из их немаркированные коллегами назначить поток трофических углерода. Используйте формулу % атома в шаге 6.1 для вычисления доли маркированных углерода (% атом, атом %) в соответствующих жирных кислот. Сравните процент 13C в жирные кислоты ногохвостки между маркировкой (день 1 и более поздних версий) и непомеченного животных (день 0) как относительный индикация для потока 13C из рациона в потребителей.
- Назначьте положение 13C включения в цепь жирных кислот. На основании распределения isotopologues отделить диетических маршрутизации всей отмеченные трассирующими жирные кислоты (здесь 16:0) из Удлинение цепи на липидный обмен. В то время как ассимиляции всего маркер молекулы увеличивает обилие isotopologues Дальний для родительского Ион (M+), например, M+ 15, М+ 16, с удлинением цепи с использованием 13C маркировкой C2 фрагменты (13C ацетил-КоА) isotopologues недалеко от молекулярных ионов получить более частыми.
6. расчеты 13C обогащения
- Согласно распределению isotopologues, рассчитать общий процент помечены углерода (в % атома) в соответствующих жирных кислот, используя следующие отношения: атом % = (соотношение 13C isotopologue включены) x (частоты соответствующих isotopologue)
Эта ставка рассчитывается после Kuppardt и др. 31 как: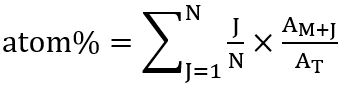
где N -число атомов углерода в жирные кислоты, J — количество изотопов 13C, M + J является обилие соответствующих isotopologue и T всего обилие всех isotopologues. - Для расчета сумма пиковые значения области молекулярных ионов (M+) соответствующих ОС и все isotopologues (M+ 1M+ 2и так далее), обнаружены анализа SIM-MS и равным 100% относительного изобилия. Вычислить, что часть каждого обнаруженного isotopologue легко, следуя правилу трех.
- Вычтите значение элемента управления не помечены день 0 (фон природного 13C) от экспериментальных значений для получения окончательных данных, только восходит к выполненных внешними 13C-маркировки.
Результаты
Свежие содержание вес и липидов ногохвостки
В ходе описанных эксперимента содержание в NLFAs и PLFAs сделал существенно не изменилось с течением времени, в то время как свежие вес образцов немного увеличилась, но не значительно24. Оба параметра указы...
Обсуждение
Isotopologue профилирование
Подробный анализ количественных аспектов в 13C распределения в ФАС требует передовые технологии для присвоения углерода, секционирование в пищевых цепях. Настоящая работа занятых isotopologue профилирования оценить 13C /12C коэф?...
Благодарности
Финансовой поддержке р. Мензел и L. Ruess, Deutsche Forschungsgemeinschaft (RU RU780/11-1) с благодарностью. Р. Неринг финансировалась RU 780/10-1. Наконец мы чрезвычайно благодарны доктор Hazel Ruvimbo Мабореке для корректуры наши рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| neoLab-Round jars | neoLab | 2-1506 | 69 x 40 mm, 10 pacs/pack |
| Charcoal activated | Carl Roth | X865.1 | p.a., powder, CAS No. 7440-44-0 |
| Alabaster Dental | RÖHRICH-GIPSE | --- | http://www.roehrich-gipse.de/dentalgipse.php |
| Chloroform | Carl Roth | 7331.1 | HPLC ≥ 99,9 % |
| Methanol | Carl Roth | P717.1 | HPLC ≥ 99,9 % |
| Hexan | Carl Roth | 7339.1 | HPLC ≥ 98 % |
| tert-Butyl methyl ether (MTBE) | Carl Roth | T175.1 | HPLC ≥ 99,5 % |
| Aceton | Carl Roth | 7328.2 | HPLC ≥ 99,9 % |
| NaOH | Carl Roth | 6771.1 | p.a. ≥99 %, in pellets |
| di-Natriumhydrogenphosphat | Carl Roth | P030.1 | p.a. ≥99 % , water free |
| Na-dihydrogenphosphat Dihydrat | Carl Roth | T879.1 | p.a. ≥99 % |
| Hypochloric acid (6 N) | VWR International | 26,115,000 | AVS TITRINORM vol. solution |
| Bond Elut (Columns) | Agilent Tech. | 14102037 | HF Bond Elut-SI, 500 mg, 3 mL, 50/PK |
| Präparatengläser Duran | Glasgerätebau Ochs | 135215 | Ø 16 x 100 mm, plus screw cap with handy knurl and integrated PTFE/silicone gasket |
| Supelco 37 Component FAME Mix | Sigma-Aldrich | 47885-U Supelco | 10 mg/mL in methylene chloride, analytical standard |
| FlowMesh | Carl Roth | 2796.1 | Polypropylene mesh, approximately 0.3 mm thick, with 1 mm strand spacing |
| Bacterial Acid Methyl Ester (BAME) Mix | Sigma-Aldrich | 47080-U Supelco | 10 mg/mL in methyl caproate, analytical standard |
| Methyl nonadecanoate | Sigma-Aldrich | 74208 | analytical standard ≥ 98.0 % |
| Hexadecanoic acid-1-13C (Palmitic) | Larodan Fine Chemicals | 78-1600 | GC ≥ 98.0 % (13C: 99.0 %) |
| RVC 2-25 CDplus | Martin Christ Gefrier-trocknungsanlagen | Compact benchtop midi concentrator | |
| Alpha 2-4 LDplus | Martin Christ Gefrier-trocknungsanlagen | Drying manifold | |
| MZ 2C NT | Vacuubrand GMBH | Vacuum pump | |
| Roto-Shake Genie | Scientific Industries | Combined rocking and rotating device | |
| XP64 Micro Comparator | Mettler Toledo | Super high precision balance | |
| GC-System 7890A | Agilent Tech. | Gas chromatograph | |
| 7000 GC/MS Triple Quad | Agilent Tech. | Triple Quad mass spectrometer | |
| 7683B Series Injector | Agilent Tech. | Sample injector | |
| Heraeus Multifuge 3SR+ | Thermo Scientific | Centrifuge with 10 ml tube rotor |
Ссылки
- Ruess, L., et al. Application of lipid analysis to understand trophic interactions in soil. Ecology. 86 (8), 2075-2082 (2005).
- Ruess, L., et al. Lipid composition of Collembola and their food resources in deciduous forest stands - Implications for feeding strategies. Soil Biology and Biochemistry. 39 (8), 1990-2000 (1990).
- Chamberlain, P. M., Bull, I. D., Black, H. I. J., Ineson, P., Evershed, R. P. Fatty acid composition and change in Collembola fed differing diets: identification of trophic biomarkers. Soil Biology and Biochemistry. 37 (9), 1608-1624 (2005).
- Stott, A. W., Davies, E., Evershed, R. P., Tuross, N. Monitoring the routing of dietary and biosynthesised lipids through compound-specific stable isotope (delta C-13) measurements at natural abundance. Naturwissenschaften. 84 (2), 82-86 (1997).
- Ruess, L., Haggblom, M. M., Langel, R., Scheu, S. Nitrogen isotope ratios and fatty acid composition as indicators of animal diets in belowground systems. Oecologia. 139 (3), 336-346 (2004).
- Pollierer, M. M., Scheu, S., Haubert, D. Taking it to the next level: Trophic transfer of marker fatty acids from basal resource to predators. Soil Biology and Biochemistry. 42 (6), 919-925 (2010).
- Ferlian, O., Scheu, S., Pollierer, M. M. Trophic interactions in centipedes (Chilopoda, Myriapoda) as indicated by fatty acid patterns: Variations with life stage, forest age and season. Soil Biology and Biochemistry. 52, 33-42 (2012).
- Ruess, L., Chamberlain, P. M. The fat that matters: Soil food web analysis using fatty acids and their carbon stable isotope signature. Soil Biology and Biochemistry. 42 (11), 1898-1910 (2010).
- Traugott, M., Kamenova, S., Ruess, L., Seeber, J., Plantegenest, M. Empirically characterising trophic networks: What emerging DNA-based methods, stable isotope and fatty acid analyses can offer. Adv Ecol Res. 49, 177-224 (2013).
- Hammer, B. T., Fogel, M. L., Hoering, T. C. Stable carbon isotope ratios of fatty acids in seagrass and redhead ducks. Chemical Geology. 152 (1-2), 29-41 (1998).
- Budge, S. M., Iverson, S. J., Koopman, H. N. Studying trophic ecology in marine ecosystems using fatty acids: A primer on analysis and interpretation. Marine Mammal Science. 22 (4), 759-801 (2006).
- Haubert, D., et al. Trophic structure and major trophic links in conventional versus organic farming systems as indicated by carbon stable isotope ratios of fatty acids. Oikos. 118 (10), 1579-1589 (2009).
- Ngosong, C., Raupp, J., Richnow, H. H., Ruess, L. Tracking Collembola feeding strategies by the natural 13C signal of fatty acids in an arable soil with different fertilizer regimes. Pedobiologia. 54 (4), 225-233 (2011).
- Bec, A., et al. Assessing the reliability of fatty acid-specific stable isotope analysis for trophic studies. Methods in Ecology and Evolution. 2 (6), 651-659 (2011).
- Gladyshev, M. I., Makhutova, O. N., Kravchuk, E. S., Anishchenko, O. V., Sushchik, N. N. Stable isotope fractionation of fatty acids of Daphnia fed laboratory cultures of microalgae. Limnologica. 56 (Supplement C. 56 (Supplement C), 23-29 (2016).
- Gladyshev, M. I., Sushchik, N. N., Kalachova, G. S., Makhutova, O. N. Stable isotope composition of fatty acids in organisms of different trophic levels in the Yenisei river. PLoS One. 7 (3), e34059 (2012).
- Eisenreich, W., Dandekar, T., Heesemann, J., Goebel, W. Carbon metabolism of intracellular bacterial pathogens and possible links to virulence. Nature Reviews Microbiology. 8 (6), 401-412 (2010).
- Eylert, E., Bacher, A., Eisenreich, W. NMR-based isotopologue profiling of microbial carotenoids. Methods Mol Biol. 892, 315-333 (2012).
- Garton, N. J., O'Hare, H. M. Tuberculosis: feeding the enemy. Chemical Biology. 20 (8), 971-972 (2013).
- Rosenblatt, J., Chinkes, D., Wolfe, M., Wolfe, R. R. Stable isotope tracer analysis by GC-MS, including quantification of isotopomer effects. Am J Physiol. 263 (3), E584-E596 (1992).
- Fernandez, C. A., Des Rosiers, C., Previs, S. F., David, F., Brunengraber, H. Correction of 13C mass isotopomer distributions for natural stable isotope abundance. J Mass Spectrom. 31 (3), 255-262 (1996).
- Heuner, K., Eisenreich, W. The intracellular metabolism of legionella by isotopologue profiling. Methods Mol Biol. 954, 163-181 (2013).
- Willenborg, J., et al. Characterization of the pivotal carbon metabolism of Streptococcus suis serotype 2 under ex vivo and chemically defined in vitro conditions by isotopologue profiling. J Biol Chem. 290 (9), 5840-5854 (2015).
- Menzel, R., Ngosong, C., Ruess, L. Isotopologue profiling enables insights into dietary routing and metabolism of trophic biomarker fatty acids. Chemoecology. 27 (3), 101-114 (2017).
- Buse, T., Ruess, L., Filser, J. New trophic biomarkers for Collembola reared on algal diets. Pedobiologia. 56 (3), 153-159 (2013).
- Hutson, B. R. Effects of variations of the plaster-charcoal culture method on a Collembolan, Folsomia candida. Pedobiologia. 18, 138-144 (1978).
- Fountain, M. T., Hopkin, S. P. Folsomia candida (Collembola): a "standard" soil arthropod. Annu Rev Entomol. 50, 201-222 (2005).
- ISO, I. O. f. S. . Soil Quality-Inhibition of reproduction of Collembola (Folsomia candida) by soil pollutants. , (1999).
- Welch, D. F. Applications of cellular fatty acid analysis. Clin Microbiol Rev. 4 (4), 422-438 (1991).
- Dodds, E. D., McCoy, M. R., Rea, L. D., Kennish, J. M. Gas chromatographic quantification of fatty acid methyl esters: flame ionization detection vs. electron impact mass spectrometry. Lipids. 40 (4), 419-428 (2005).
- Kuppardt, S., Chatzinotas, A., Kastner, M. Development of a fatty acid and RNA stable isotope probing-based method for tracking protist grazing on bacteria in wastewater. Appl Environ Microbiol. 76 (24), 8222-8230 (2010).
- Zhang, X., He, H., Amelung, W. A GC/MS method for the assessment of 15N and 13C incorporation into soil amino acid enantiomers. Soil Biology and Biochemistry. 39 (11), 2785-2796 (2007).
- Vetter, W., Thurnhofer, S. Analysis of fatty acids by mass spectrometry in the selected ion monitoring mode. Lipid Technol. 19 (8), 184-186 (2007).
- Thurnhofer, S., Vetter, W. A gas chromatography/electron ionization-mass spectrometry-selected ion monitoring method for determining the fatty acid pattern in food after formation of fatty acid methyl esters. J Agric Food Chem. 53 (23), 8896-8903 (2005).
- Haubert, D., Haggblom, M. M., Scheu, S., Ruess, L. Effects of fungal food quality and starvation on the fatty acid composition of Protaphorura fimata (Collembola). Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology. 138 (1), 41-52 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены