Method Article
מדידת אינטראקציות של חלבונים הכדוריים, Filamentous על ידי תהודה מגנטית גרעינית ספקטרוסקופיה (NMR) Microscale Thermophoresis (MST)
In This Article
Summary
כאן, אנו מציגים פרוטוקול על ההפקה ועל טיהור של חלבונים עם התווית עם איזוטופים יציבים, ואפיון עוקבות של אינטראקציות חלבון-חלבון באמצעות תהודה מגנטית גרעינית (NMR) ספקטרוסקופיה ו- MicroScale ניסויים Thermophoresis (MST).
Abstract
Filamentous חלבונים כגון vimentin מספקים הארגון בתוך תאים על-ידי מתן לפיגום מבניים עם אתרים אשר קושרים חלבונים המכילים plakin חוזר. כאן, עבור גילוי ומדידת אינטראקציות כגון פרוטוקול המתואר באמצעות המחשבים אני חוזר plakin הכדוריים של envoplakin והגליל הסליל של vimentin. זה מספק בסיס לקביעה אם חלבון נקשר vimentin (או חלבונים filamentous דומה), למדידת בזיקה של האינטראקציה. החלבון הכדוריים עניין עם 15N תוויות, טיטרציה עם vimentin החלבון בתמיסה. ספקטרום NMR מימדי נרכש כדי לזהות אינטראקציות על ידי התבוננות שינויים שיא צורה או משמרות כימי, להסבר תופעות של תנאים פתרון כולל רמות מלח, אשר משפיעים על מבנה רבעוני vimentin. אם החלבון עניין נקשר ליגנד את filamentous, האינטראקציה איגוד לכמת מאת MST באמצעות החלבונים מטוהרים. הגישה היא דרך פשוטה לקביעת אם חלבון עניין מאגד את הלהט, להערכת כיצד שינויים, כגון מוטציות או פתרון תנאים, משפיע על האינטראקציה.
Introduction
אינטראקציות בין חלבונים לאפשר היווצרות של מכונות מולקולריות ליצור סדר בתוך התאים. האינטראקציות בודדים הם לעתים קרובות חלשים, אך בדרך כלל לתרום מתחמים multivalent יכול להיות שיתופיות מוסדר באופן דינמי. מבחני רגישות המספקים ברזולוציה אטומית ומידע כמותי על אינטראקציות מורכבות כאלה יש צורך להסיק מנגנונים ועיצוב התערבויות כגון סמים כמו מולקולות. NMR ספקטרוסקופיה היא שיטה יעילה להשגת מידע כזה על אינטראקציות חלבון, והוא גם משמש לסינון מהיר עבור ליגנדים כולל אלה לאגד חלש1. בין השיטות NMR ניתן לסווג אלו הם להתבונן חלבון או להתבונן ליגנד. כתב יד זה משתמש הגישה בו קשת של איזוטופ יציב הנקרא חלבון זה הוא קטן יחסית (בדרך כלל תחת 20 kDa) נרכשת, היא, טיטרציה של ליגנד ללא תווית. זה לאפשר את שאריות שכותרתו מעורב האינטראקציה למפות במקרים חיוביים. פעם אחת הצורות מורכבים, ישנם שינויים את סביבות כימיות של שאריות שמעצבת המתבטאים עצמם לשינויים כימיים המשמרת וצורה של אותות NMR שלהם. היקף שינויים כאלה עולה בקנה אחד עם מידת מעורבותם של ארגונים אלה על האינטראקציה. Shift כימי לפליטת (Csp) נמדד על ידי השוואת סדרה של ספקטרום NMR של החלבון שליקט את היעדרות ונוכחות של כמויות משתנות של ליגנד. ליגנדים גדול יותר או אינטראקציות מורכבות, ניתן למדוד בשינוי צורה שיא או עוצמת להסיק אינטראקציות.
הניסוי 2D הנפוץ ביותר המשמש לגילוי ליגנד אינטראקציות הוא ניסוי2מתאם (HSQC) קוונטית בודדת 15N-heteronuclear. פעולה זו דורשת חלבון אחד להיקרא בצורה אחידה עם 15N, אשר מושגת בדרך כלל על ידי הבעת אותם כגירסאות מתויג זיקה בתרבויות חיידקי e. coli גדלו ב 15מועשרת N מדיה. איגוד בולטת כאשר ספקטרום HSQC שנאספו במהלך טיטרציה הן נקודות המגע המוצגים, חשיפת השינויים שיא של תת-קבוצות של שאריות מעורב היווצרות מורכבות. האינטראקציה יכול להתרחש המשטר exchange מהיר בו האותות המדינה בחינם, רווי-ליגנד לקרוס לתוך אוכלוסיה אחת בממוצע שיא. לחילופין, במקרה של המרת איטי בין המדינות, שני אותות הם נצפו עם אינטגרלים המייצגים את הסכומים היחסיים. בזמן ניתוח lineshape NMR ניתן להשתמש כדי להעריך את הזיקות מחייב במקרים מסוימים, שיטות כמו MST גם הוכיחו נוח ולספק קרוס-אימות של אינטראקציות מקורית.
הדוגמה סיפק היא של שני חלבונים המצויים desmosomes. הם צמתי בין תא משטחים את שלד התא לתווך ולסיים multivalent אינטראקציות בין מכונות הדבקה תא חוטים ביניים כדי לשמור על שלמות העור, רקמות הלב, למרות של הטיית הכוחות. מחלות יכול לגרום כאשר desmosomal חלבונים כגון desmoplakin או vimentin הם בסכנה על ידי מוטציות או עצמיים, המוביל destabilization של צמתי תא-תא, ומכאן שהם של החשיבות הקריטית3. הבסיס המבני של ליגנד לכריכה על ידי חלבונים desmosomal יכול להיות מאופיין על ידי ספקטרוסקופיה NMR, בעוד ניתן לכמת את האינטראקציות מאת MST. שיטות בזאת שימשו כדי לאפיין את האינטראקציות בין קבוצות מחשבים אני חוזר plakin "(PRDs)", אשר לעתים קרובות נמצאים כערכות טנדם המציעים חריצים בסיסיים, vimentin, פילמנט ביניים המקיימת אינטראקציה דרך השטח חומצי המוצעים על ידי שלה לוליינית צרור4. מכלולים אלה נוצרות על קרום התא שבו הם עוגן עבור חוטים ביניים של שלד התא התא כדי desmosomes המחברים תאים סמוכים, ובכך יוצרים רשת של קשרים דבק קורן טישו.
Protocol
1. ביטוי חלבון רקומביננטי
-
ביטוי Envoplakin ההקלטה (E-ההקלטה) Vimentin 99-249 (VimRod)
- להפוך e. coli BL21(DE3) תאים עם פלסמיד המכיל את הגן הרצוי. מורחים את התאים על פלטות אגר המכיל אמפיצילין µg/mL 100. דגירה הלוחות ב 37 מעלות צלזיוס למשך הלילה.
- לבחור שמושבה בודדת, לחסן 20 מ ל מרק נהדר (TB) המכיל אמפיצילין µg/mL 100 לבחירה פלסמיד. לגדול התרבות ב 37 ° C עם טלטול (180 סל ד) בן לילה.
- להעביר את התרבות כולה 20 מ ל 1 ליטר של טרה-בתים המכיל 50 אמפיצילין µg/mL. דגירה התרבות ב 37 ° C עם לרעוד-180 סל ד עד ה OD600 = 0.6-0.8.
- להפחית את הטמפרטורה עד 18 ° C, זירוז ביטוי חלבונים על-ידי הוספת איזופרופיל β-D-1-thiogalactopyranoside (IPTG) כדי ריכוז סופי של 1 מ מ. המשך הדגירה ב 18 ° C ברעידות-160 סל"ד. בן לילה, כדי לאפשר ביטוי חלבון.
- לקצור את התאים על ידי צריך שתוציאו את התרבות ב 8000 g x עבור 15 דקות Decant ולמחוק את תגובת שיקוע.
- תשטוף התאים שנקטפו מאת resuspending בגדר תא כ 40 מ"ל של פוספט buffered תמיסת מלח (PBS: 20 מ מ פוספט מאגר, pH 7.4, 120 מ"מ NaCl). להעביר את resuspension צינור 50 מ. צנטריפוגה שוב ב 8000 g x למשך 15 דקות.
- Decant ולמחוק את תגובת שיקוע. באופן מיידי להתחיל פרוטוקול טיהור או להקפיא את כדורי תא ב-20 ° C לשימוש עתידי.
-
ביטוי של חלבונים Isotopically שכותרתו
- להפוך תאים BL21(DE3) e. coli ו להכין 20 מ"ל starter תרבות כמו 1.1.1-1.1.2.
- להעביר את התרבות כולה 20 מ ל 1 ליטר משחפת מועשר המכיל טריפטון g 4.0 נוספים של 5.0 g NaCl, אמפיצילין µg/mL 100. דגירה התרבות ב 37 ° C עם לרעוד-160 סיבובים לדקה עד ה OD600 = 1.6-1.9.
- הקציר התרבות 1 ליטר על ידי צנטריפוגה ב 8000 g x עבור 15 דקות Decant ולמחוק את תגובת שיקוע.
- לשטוף בגדר תא על-ידי בעדינות resuspending כ 40 מ"ל ל- PBS, להעביר resuspension את שפופרת 50 מ.
- צנטריפוגה שוב ב 8000 g x עבור 15 דקות Decant ולמחוק את תגובת שיקוע.
- Resuspend בגדר תא ב- 20 מ של מדיה מינימלי M9 (טבלה 1) להעברת השארית של mL 950 של M9 תקשורתי מזערי המכיל אמפיצילין µg/mL 100.
- להוסיף 50 מ של מסנן לעקר שילוב התזונתי (טבלאות 2 ו- 3).
- ואקלום התרבות עד 18 מעלות צלזיוס למשך 30 דקות לפני הוספת IPTG ריכוז סופי של 1 מ מ.
- דגירה בין לילה ב 18 ° C ברעידות-160 סיבובים לדקה.
- לקצור את התאים כמו סעיף 1.1.4-1.1.6.
2. מרותק למיטה זיקה מתכת טיהור כרומטוגרפיה (IMAC) של VimRod, E-ההקלטה
-
טיהור של מתויג His6 VimRod
- Resuspend בגדר תא ב 5 מ ל/g ל- PBS המכיל פרוטאז מעכב קוקטייל חסר EDTA. Homogenize עם קווים 12 ב מהמגן רקמות דאונס כדי לשפר את פירוק תאים בשלב הבא.
- על קרח, sonicate התליה תא-דופק של s ב/1 s 1 הנחה, משרעת 80% עבור סכום כולל של לפחות 1.5 לחזור את sonication נוספים שני פעמים, מתערבל בעדינות על הקרח בין פועל למניעת התחממות יתר.
- Centrifuge הדגימה ב 75,000 g x עבור 45 דקות Decant ולסנן את תגובת שיקוע באמצעות מסנן מזרק (0.45 מיקרומטר).
- Equilibrate מ ל IMAC עמודה בעלת 5 כרכים עמודה (CV) של איגוד מאגר (20 מ"מ HEPES, pH 7.5, 500 מ מ NaCl, imidazole 10 מ מ) בספיקה של 1 mL/min משתמש במערכת כרומטוגרפיה נוזלית (FPLC) חלבון מהיר.
- לטעון את תגובת שיקוע המסונן אל העמודה בספיקה של 0.5 mL/min.
- לשטוף את העמודה עם מאגר קורות חיים של שטוף 5 (20 מ"מ HEPES, pH 7.5, 500 מ מ NaCl, imidazole 50 מ מ) בספיקה של 1 מ"ל לדקה.
- Elute החלבון עם 3 קורות חיים • תנאי מאגר (20 מ"מ HEPES, pH 7.5, 500 מ מ NaCl, imidazole 350 מ"מ) בספיקה של 0.5 מ ל לדקה לאסוף 1.5 mL שברים. אם הוא זמין, בחר את המצב • תנאי זרימה למעלה כדי להגדיל את הריכוז של חלבון eluted.
- זיהוי השברים של chromatogram FPLC מכילים חלבון עניין מאת מרחביות-דף ולהשתמש בשיטות הרגילות כדי למדוד את הריכוז של חלבון5.
- בריכה ותתרכזו השברים • תנאי המכיל כמויות חלבון שימוש בהתקן צנטריפוגלית אולטראפילטרציה (kDa MWCO 3, 5 מ ל) עד 2 מ"ל הגבוהה ביותר. צנטריפוגה-21,000 g x כדי להסיר את כל המשקע ועובר דרך מסנן 0.22 μm.
- Equilibrate בגודל 120 מ ל אי-הכללה של כרומטוגרפיה (S) עמודה עם מאגר קורות חיים של S 2 (20 מ"מ HEPES, 150 מ מ NaCl, pH 7.5, 0.5 מ מ TCEP) בספיקה של 1 mL/min משתמש של FPLC.
- להזריק את חלבון מרוכז מ 2.1.9 אל העמודה, elute עם מאגר קורות חיים של S 1 בספיקה של 0.5 mL/min, איסוף השברים 1 מ"ל.
- זיהוי שברים המכיל חלבון עניין כמו בעבר.
- בריכת שברים המכיל כמויות חלבון הגבוה ביותר.
- ב 4 ° C לשימוש לטווח קצר או להוסיף גליצרול 20% של החנות ב-80 מעלות צלזיוס ב aliquots קטן.
-
טיהור של E-ההקלטה חלבון עם התגית His6 הוסר
- בצע את השלבים ב 2.1.1-2.1.8 לטהר מתויג His6 E-ההקלטה חלבון. בריכה שברים שיא ולקבוע את הריכוז של חלבון.
- להוסיף טבק לחרוט וירוס (אס) פרוטאז (1 מ"ג/מ"ל) ב 2 µL/מ ג חלבון במאגר. לעבור דיאליזה אבובים (6 kDa) ו- dialyze S מאגר בן לילה ב 4 º C. שלב זה מאפשר המחשוף של התג His6 והסרה של imidazole זה יפריע איגוד שרף Ni-נ בשלב הבא.
- Equilibrate מ של שרף Ni-נ בעמודה המשיכה עם מאגר קורות חיים של S 3. מרוקנים את מאגר עודף מ השרף.
- יוצקים את E-ההקלטה cleaved מחלבון השרף, תקופת דגירה של שעה על פלטפורמה נדנדה כדי לאפשר את uncleaved מתויג His6 E-ההקלטה והתג cleaved His6 לאגד. פרוטאז אס גם מתויג His6, יהיה לאגד השרף. לאסוף את הזרימה, אשר מכיל את ללא תג E-ההקלטה. לשטוף את השרף עם מאגר קורות חיים של S 2 כדי להבטיח כל E-ההקלטה הוא התאושש.
- להתרכז E-ההקלטה הזרימה 2 מ ל שימוש בהתקן צנטריפוגלית אולטראפילטרציה (kDa MWCO 3, 5 מ ל). צנטריפוגה ב g 21 000 x להסיר כל המשקע ולעבור דרך מסנן 0.22 μm.
- Equilibrate עמודה 120 מ ל S עם מאגר קורות חיים של S 2 (20 מ"מ HEPES, 150 מ מ NaCl, pH 7.5, 0.5 מ מ TCEP MST או 20 מ מ טריס-HCl, 1 מ"מ DTT, pH 7 NMR) בספיקה של 1 mL/min משתמש של FPLC.
- להזריק החלבון E-ההקלטה מרוכז מ 2.2.5 אל העמודה, elute עם מאגר קורות חיים של S 1 בספיקה של 0.5 mL/min, איסוף השברים 1 מ"ל.
- זיהוי שברים המכיל חלבון עניין כמו בעבר.
- בריכת שברים המכיל כמויות חלבון הגבוה ביותר.
- ב 4 ° C לשימוש לטווח קצר או להוסיף גליצרול 20% של החנות ב-80 מעלות צלזיוס ב aliquots קטן.
3. NMR שיטות
- הכנת הדוגמא NMR
- לטהר 15פראי-סוג התווית על-ידי N או חלבון R1914E E-ההקלטה כפי שתואר קודם לכן באמצעות 20 מ מ טריס-HCl, 1 מ"מ DTT, pH 7 כמו המאגר S עבור שלב 2.2.6. פתרונות מניות חלבון בדרך כלל בטווח של 0.3 עד 1 מ מ עם אמצעי אחסון של 1 מ"ל.
הערה: חלבון יכול להיות מרוכז כדי > 100 מיקרומטר באמצעות a kDa MWCO 3, 5 מ ל אולטראפילטרציה צנטריפוגלי התקן להביא את הריכוז לתוך מגוון מתאים עבור הכנת הדוגמא. - לטהר מדגם של חלבון VimRod ללא תווית באמצעות 20 מ מ טריס-HCl, 1 מ"מ DTT, pH 7 כמו המאגר S עבור שלב 2.1.10.
- בכרך האחרון של 500 µL, להוסיף חלבון E-ההקלטה פראי-סוג או מוטציה ריכוז הסופי של 100µM, תחמוצת דאוטריום (D2O) כדי ריכוז סופי של 10% (v/v) ו- DSS (חומצה 4,4-dimethyl-4-silapentane-1-sulfonic) כדי ריכוז סופי של 20 מיקרומטר. הבא אמצעי האחסון מדגם עד 500 µL באמצעות 20 מ מ טריס-HCl, 1 מ"מ DTT, pH 7. הכנה במדגם מייצג מתוארת בטבלה4.
הערה: ppm 0 התהודה של DSS משמש כדי לכייל את המשמרות כימית 1H וכן עבור הפניה עקיפה של הכימיקל 15N משמרות של חלבון6. D2O משמש עבור האות נעל דאוטריום לשמור את ספקטרומטר פועלים ב שדה מגנטי קבוע נטו. - לפצות מדגם השני של E-ההקלטה, D2O ו- DSS כמו השלב הקודם ולהוסיף VimRod ריכוז סופי של 50 מיקרומטר לפני שמכניסים את אמצעי האחסון עד 500 µL.
- להעביר את הדגימות µL 500 5 מ מ רחב מרעד לניסוי.
- לטהר 15פראי-סוג התווית על-ידי N או חלבון R1914E E-ההקלטה כפי שתואר קודם לכן באמצעות 20 מ מ טריס-HCl, 1 מ"מ DTT, pH 7 כמו המאגר S עבור שלב 2.2.6. פתרונות מניות חלבון בדרך כלל בטווח של 0.3 עד 1 מ מ עם אמצעי אחסון של 1 מ"ל.
- הגדרת הניסוי NMR
- הפעל זרימת אוויר עם ההוצאה הפקודה "ej"; זה יביא את הדגימה מהמגנט. עכשיו, במקום את הדגימה בתוך ספינר על גבי המגנט על ידי פתיחת והכנס עם הפקודה "ij". המתן עד מדגם המתיישבת בתוך המגנט לפני שתמשיך.
- ליצור dataset חדשה באמצעות הפקודה "edc" וטען רגיל 1H NMR פרמטרים על-ידי בחירת ניסוי "ZGPR" (איור 1). מלאו את השם, EXPNO (ניסוי מספר) והשדות PROCNO (נתונים מעובדים תיקייה מספר). בחר הממס בשדה "קבע הממס" ולחץ על "לבצע 'getprosol'" כדי לקרוא probehead סטנדרטית והפרמטרים תלויי הממס (prosol).
- לנעול את הדגימה deuterated ממס, קרי, D2O, באמצעות הפקודה "נעל" ולהמתין עד סיומה גורף, משיגה את המנעול.
- לתקן את תדר התהודה של המגנט על-ידי כוונון המדגם באמצעות הפקודה כוונון אוטומטי "atma". לפקח על העקומה התנודדות עד כוונון אוטומטי תושלם.
- הגבהה השדה המגנטי באמצעות TOPSHIM (הפקודה "topshim"). Shimming הוא תהליך של שינויים בשדה המגנטי כדי להשיג אחידות סביב המדגם. זה תרגול טוב כדי לאחסן את הערכים shim עם הפקודה "של wsh" ולקרוא אותם באמצעות "rsh" לפני topshim, אם באמצעות דגימות זהות או דומות.
- התאם את רווח מקלט עם הפקודה "rga" כדי להשיג את האות המרבי יחס לרעש.
- מניחים במרכז הספקטרום על ההיסט תהודה מים (o1) ולהגדיר את הדופק פרוטון 90 מעלות (p1) בעוצמה גבוהה באמצעות "calibo1p1".
- לאסוף הפרוטון ספקטרום באמצעות האפס ללכת "zg" הפקודה ותהליך עם "efp" אשר כולל כפל מעריכית ("em"), אינדוקציה חינם דעיכה (FID) שילוב הרחבת קו, "רגל" פורייה טרנספורמציה של FID "pk" כדי להחיל שלב תיקון.
- להחיל את התיקון האוטומטי שלב "apk", את התיקון האוטומטי בסיסית "absn" באמצעות פולינום ללא אפשרות שילוב.
- ליצור dataset חדש (כמו 3.2.2) עבור הניסוי SOFAST HMBC על-ידי בחירה "SFHMQC3GPPH" בניסוי.
- העתק ממוטב P1, O1 מן הפרוטון ספקטרום ואכלוס פולסים התלויים P1 באמצעות הפקודה "getprosol 1H p1 plw1", כאשר p1 הוא הערך P1 אופטימיזציה ו- plw1 הוא רמת צריכת החשמל עבור P1.
- למטב את הקבוע CNST54 כדי להגדיר את ההיסט למשמרת כימי אמיד, CNST55 כדי להגדיר את רוחב הפס כדי להקיף את האזורים ספקטרלי של ריבית אשר מאפשר את רווח המקלט יהיה מיטבי (איור 2). לבחירת הפרמטרים האלה, לחלץ את FID הראשון (דעיכה אינדוקציה חינם) ספקטרום דו מימדי וחפשו את האות שנצפה להגדיר אותם. בנוסף, משתנים העיכוב הרפיה (D1), מספר סריקות (NS), ואת סריקות מזויף (DS) כדי לקבל אות מקובל רגישות עם הפקודה "אלף", אשר מאפשר לך לסרוק כדי לפקח על איכות הנתונים בזמן אמת.
- לתעד את הספקטרום באמצעות אפס Go "zg".
- עיבוד נתונים NMR
- קבע את הפרמטרים עיבוד לגודל של F2 ישיר (1H) ו- F1 עקיף (15N) מידות של הספקטרום באמצעות "סי F2 = 2048, F1 = 512" עם תחזית לינארית אופציונלי בממד עקיף (איור 3).
- בחר "QSINE" כמו פונקציית חלון והזן משמרת בל סינוס (חלטורה) של 2 כדי לעבד את ספקטרום דו מימדי.
- הזן את הפקודה "xfb" לעבד את הנתונים בשני הכיוונים עם פונקציית חלון והתמרת פורייה.
- השתמש בפקודה "apk2d" כדי לבצע את שלב אוטומטי תיקון בשני הכיוונים. אם תהליך אוטומטי לא להשיג רמה מספקת של שלב תיקון, לחלץ FIDs עם הפקודה "rser", לחשב ערכים שלב 1 י עיבוד ולהחיל אותם לנתונים דו-ממדיים.
- תקן את התוכנית הבסיסית עם הפונקציה תיקון אוטומטי בסיסית "abs2" לנתונים דו-ממדיים. זה חל על פונקציה פולינום בין הערכים ppm מוגדר בפרמטרים של עיבוד, יפיקו קשת 2D לצורך ניתוח נוסף.
- אם מתכנן לבצע עיבוד סדרתי להשוואה של נתוני האינטראקציה עם מולקולה נוספת, לאחסן את הפרמטרים עיבוד עם הפקודה "wpar", זוכר אותם עם "rpar". בדרך זו שכל קבצי הנתונים יעובדו עם אותו בפרמטרים ובמשתנים לא יוכנסו עקב עיבוד הבדלים.
- ניתוח נתונים NMR
- הזן את הפקודה "pp" כדי להתחיל בתהליך של איסוף שיא.
- הגדר ppm טווח ומינימום בעוצמה/מספר מירבי של פסגות בהתבסס על פסגות הצפוי (איור 4). לחץ על אישור וודא את התוצאות על ידי בדיקה חזותית. אם יש צורך, הפעל מחדש התהליך עד התוצאות משביעות מתבסס על איכות ספקטרה.
- צור peaklist עם הפקודה "עמודים".
הערה: peaklist הזה מכיל נתוני גובה/שיא עוצמת כברירת מחדל שבאפשרותך לייצא למנסרה עוקבות, ניתן לקרוא על ידי תוכניות אחרות. - שימו לב לשינויים עוצמות שיא או בתנועת כימי במאזן ספקטרום HSQC חלבון להצביע על אינטראקציה עם מולקולה נוספת. אם המולקולה אינטראקציה גדולה, לצפות הפחתות בעוצמות שיא יחד עם היעלמותו של כמה פסגות.
- לייבא את רשימת שיא את ערכת הנתונים הבאה על-ידי לחיצה על הכרטיסיה "פסגות" ובחירה "ייבוא" עם לחץ נכון בחלון פסגות.
- דמיינו את הפסגות על הספקטרום, אם יש צורך להסיט אותם למיקומים חדשים. לחץ על "איפוס עוצמות" עבור "שולחן שלמה" כדי ליצור את peaklist עבור הקשת עם עוצמות (איור 5). רשימה זו שיא ויישא מעל את מידע המיקום מרשימת שיא מאוחסנות.
- לייצא את הרשימות שיא נתונים (datasets) שונות גיליון אלקטרוני או תוכנית אחרת מתמטיים לניתוח על-ידי בחירה בפונקציה "לייצא".
- לחשב את השינוי שחל בעוצמות שיא עם הפונקציה "עוצמת שיא בעוצמתם ספקטרום מתחם/שיא בספקטרום חלבון" עבור כל שיא. הערכים ניתן להמיר אחוזי השינוי על ידי הכפלה של 100. שימו לב כי שיא אחסון שימושיים גם אמנם שיא עוצמות יותר קל למדוד פסגות הממוקמים קרוב אחד לשני, כפי שקורה בדרך כלל חלבונים עם צפיפות גבוהה של פסגות רחב יחסית.
4. MicroScale Thermophoresis (MST)
-
הכנה של ליגנד חלבון E-ההקלטה
- להחליף את ליגנד לתוך מאגר תואם MST מאת dialyzing עד 800 μL של חלבון ביחידת הדיאליזה מיני 3.5 kDa הושעו ב- 1 ליטר של 20 מ מ. HEPES, pH 7.5, 10 מ מ NaCl, לערבב לאט ב 4 מעלות צלזיוס למשך הלילה.
- לרכז את ליגנד באמצעות יחידת אולטראפילטרציה צנטריפוגליות (3 kDa MWCO) על ידי צריך שתוציאו ב g 14 000 x במשך 10 דקות חלבון מרוכז להעברת צינור נקי.
- Centrifuge של ליגנד ב g 21,000 x 10 דקות ולהעביר בזהירות את תגובת שיקוע צינור כדי להסיר כל חלבון precipitated. לקבוע את ריכוז ליגנד באמצעות את ספיגת ב 280 ננומטר, המקדם הכחדה ליגנד. להוסיף 10% Tween-20 לתת בריכוז סופי 0.015%. Tween-20 נוסף למאגר assay כדי למנוע ספיחה הנימים. המאגר הסופית assay המשמשת עבור הניסויים MST הינו 20 מ מ HEPES, pH 7.5, 10 מ מ NaCl, 0.015% Tween-20.
-
הכנת התווית על-ידי צבע היעד חלבון VimRod
- לשקם את הצבע האדום-טריס-נ על-ידי הוספת μL 50 של x 1 PBS-T שסופק עם האדום-טריס-נ לתת ריכוז 5 μM. לוותר על 2 μL aliquots לתוך צינורות μL 200 ולאחסן ב-20 ° C.
- לדלל את חלבון המטרה כדי μM 0.34 עם מאגר וזמינותו. להוסיף μL 58 של יעד aliquot 2 μL של צבע אדום-טריס-נ, תקופת דגירה של 30 דקות בטמפרטורת החדר. הריכוז הסופי של התווית על-ידי צבע היעד הוא 0.33 μM. Centrifuge המטרה שכותרתו 21,000 g x 10 דקות ולהעביר בזהירות את תגובת שיקוע צינור כדי להסיר כל המשקע. הצבע האדום-טריס-נ נקשר חלבונים באמצעות התג His6 ויש לו קבוע דיסוציאציה מחייב (דK) בטווח תת-nanomolar. הוא יעיל 100% חייב את חלבון המטרה אז אין טיהור נוספת נדרשת.
- להפעיל את המכשיר MST ופתחו את תוכנת שליטה. בחר את הגדרת אדום עבור הצבע האדום-טריס-נ. ת. הפעל את בקרת טמפרטורה ל 25 מעלות צלזיוס.
- בחר את Pretest כדי לאמת תיוג של היעד ולבדוק צבירה או ספיחה וואקום. הערכה של פרמטרים אלה ניתנת אוטומטית.
- ΜL מיקס 17 של מאגר assay, 3 μL של חלבונים היעד, מיקס על ידי pipetting. למלא שני נימים סטנדרטי על ידי טובלים אותם בתוך המטרה מדולל וניסוח נוזל אל מרכז נימי. הניחו נימים במגש, ואת לתוך כלי הנגינה. להתחיל את המדידה.
- סקור את התוצאות מחפש לרמה מספקת של זריחה, אין סימנים של ספיחה (עיוות בצורת קו נימי) או צבירת (העיוותים המעקב MST) אשר תסומן בניתוח תוכנה. אם התוצאות הן מהלך חיובי לליגנד השלבים, אם לא מאגר שונים צריך להישפט או ניתן להגדיל את כמות Tween-20 ל- 0.05% ומעלה.
-
הכנה של הסדרה כפולה דילול של ליגנד E-ההקלטה
- להכין סדרה דילול על ידי תיוג 16, צינורות μL 200 מ 1-16.
- להוסיף μL 17 של ליגנד 1.17 x ריכוז גדול יותר מאשר הריכוז ליגנד המרבי הרצוי Tube1. אמצעי אחסון זה הוא פעמיים את הסכום הדרוש (8.5 μL) כמו aliquot ואז יועברו אל הצינור הבא בסדרה. הנפח הסופי של וזמינותו היא 10 μL μL 8.5 של 1.17 x ריכוז של ליגנד להיות מדולל ל- 1 x על ידי תוספת של 1.5 μL של החלבון היעד, VimRod. זה הריכוז המרבי שנבחרו צריך להיות לפחות 20 פעמים הערך KD המשוער.
- הוסף את μL 8.5 assay המאגר באמצעות טיפ פיפטה חדש עבור כל aliquot 16-Tubes2. שימוש חוזר פיפטה טיפים יכולים להשפיע על הדיוק (עבור ייעוץ מדויק pipetting ראה הוראות היצרן). העברת μL 8.5 של ליגנד מ Tube1 כדי Tube2 לאט לשחרר את הפתרון למאגר assay ללא יצירת בועות. מערבבים את ליגנד ואת מאגר על-ידי pipetting למעלה ולמטה לפחות 6 פעמים, שוב ללא יצירת בועות. E-ההקלטה בצינור מרוכז ביותר היה 1.5 מ מ, VimRod שכותרתו היה נוכח ריכוז סופי של 50 ננומטר.
- להעביר μL 8.5 של ליגנד Tube2 Tube3 ומערבבים עם המאגר וזמינותו. חזור על דילול טורי עד לכל הצינורות היו ליגנד נוסף. להתעלם μL 8.5 מ Tube16 כך לכל הצינורות מכילים μL 8.5 של ליגנד בסדרה של דילולים כפולה.
-
הכנה של הניסוי מחייב תגובה ו- MST
- להוסיף 1.5 μL של החלבון היעד שכותרתו לכל אחד הצינורות ולערבב בעדינות על-ידי pipetting למעלה ולמטה וישתדלו להימנע בועות. תקופת דגירה של 15 דקות.
- לבחור את מצב מומחה איגוד וזמינותו והזינו בפרמטרים של סדרה דילול טורי. ודא בקרת טמפרטורה מוגדרת עד 25 ° C, הכוח עירור מוגדר 40%, ואת הכוח MST בינוני. פרמטרים אלה חייבים להיות אופטימיזציה עבור שותפים אחרים מחייב נחקר.
- מילוי הנימים עם תגובות איגוד ומניחים במגש נימי. לטעון את המגש לתוך הכלי, לחכות הטמפרטורה להשיב 25 ° C, ולהתחיל את המדידה.
-
ניתוח נתונים
- פתח את הקובץ וזמינותו מחייבת בתוכנת ניתוח זיקה. סקור את הסריקות נימי; רמות קרינה פלואורסצנטית לא אמור להשתנות יותר מ-10% מן הממוצע, אין צבירה או ספיחה שיזוהו כמתואר בסעיף 3.6.
- בחר את הניתוח MST בלוח השמאלי וגרור את הנתונים assay לתוך ערכת ניתוח. אם קיימים מספר ריצות של היעד-ליגנד באותו איגוד וזמינותו בתנאים זהים הם ניתן למזג על ידי אותה קבוצה. לחלופין, כל הפעלה יכול להיות ירד לתוך ניתוח באופן עצמאי.
- להעביר את הכרטיסייה מינון תגובה מתאימה לגרף את הנתונים. בחר את דגם KD אם אתר איגוד יחיד צפוי. המודל היל הוא גם אופציה עבור מספר אתרי קישור עם ההתנהגות השיתופית. חריג חשוד טעות נקודות זה לא עבר בקרת איכות ניתן להסיר את התאמת בשלב זה. מיזוג קבוצות עם מבחני מרובים ייכללו בממוצע, שגיאות מחושבת סטיית התקן.
- פתיחת הכרטיסיה הסופית ולהשוות את התוצאות בין כל החלקות על גרף יחיד. לאחזר תוצאות המדידה כל עקומה מהטבלה שנוצר. לייצא את הנתונים או עקומות מצויד לתוכנות אחרות מצגת או ניתוח במקרה הצורך.
תוצאות
תחום E-ההקלטה (שאריות 1822-2014 משובטים לתוך pProEX-HTC) של הגן האנושי envoplakin וקבוצת המחשבים VimRod (שאריות 99-249 משובטים לתוך pET21a) של האדם vimentin היו4 הביע בתגים His6, טהור. איור 6 ו- 7 איור להדגים את דרגות טוהר VimRod (18.8 kDa) ו E-ההקלטה (21.8 kDa) המתקבל בשיטה זו של חלבון טיהור. הסרת His6 תג מ הבונה E-ההקלטה הוא חיוני עבור הניסויים MST החלבון VimRod מסומן באמצעות צבע הכריכה תג His6, כל E-ההקלטה תמך תג His6 שלו עשויה להתחרות עבור איגוד של לצבוע. העמודה השנייה IMAC לאחר המחשוף של התג עם אס פרוטאז מסיר את פרוטאז אס, התג cleaved, כל uncleaved His6-E-ההקלטה נשארו. השלב האחרון ליטוש של הטיהור הוא גודל אי-הכללה של כרומטוגרפיה. למרות שני חלבונים בגודל דומה, VimRod elutes מן העמודה ב mL 51 ואילו הפסגה • תנאי E-ההקלטה ממורכזת-72 מ ל איפה יהיה צפוי של מונומר חלבון בסדר גודל כזה. גידול ניכר בגודל של VimRod סביר בשל מאפייניו כמו מוט ארוך filamentous בצורת חלבון כמו בצורה אנליטית ultracentrifuge הניסויים הראו כי VimRod היה monomeric4. תשואות נמוכות של חלבון מתקבלים מן התרבויות גדל M9 מאשר אלה של מרק עשיר עקב כמות נמוכה יותר של תאים שיופקו בתקשורת מינימלי. הגידול הראשוני של תרבויות starter גדול על ההכנות M9 ב TB מאפשר שיפור של התא התשואות תוך שמירה על היקף 15N תיוג הכרחי עבור הניסויים NMR.
15N -1H HSQCs נרכשו עבור פראי סוג ו R1914E מוטציה של E-ההקלטה ב נוכחות או היעדרות של VimRod (איור 8A-ד 8). הספקטרום של E-ההקלטה ב- 8A דמות מראה את המספר הצפוי של פסגות נפתרה. ובכן, הרומז על מצבה העגום של חלבון מקופל כיאות. בנוכחות VimRod (איור 8 ב') הספקטרום מציגה קו מקיף הרחבת והעלמות שיא, המקביל מחייב בין E-ההקלטה לבין VimRod. איגוד זה הוא איבד על ידי מוטציה של R1914E כמו evidenced על ידי השוואה של איור 8C ו ד 8. שינוי קטן הוא ציין בספקטרום על תוספת של VimRod המוטציה R1914E ומעידה על חוסר מחייב בין E-ההקלטה מוטציה זו VimRod. עוצמות שיא E-ההקלטה בהיעדר הנוכחות/VimRod היו יחסית, התווה עוצמות השיא היחסי של איור 8E, אשר מציין את טווח שיא הרחבת במתחם E-ההקלטה. המוטציה R1914E של E-ההקלטה (לא מוצג) נשמר כ 97% של פסגות ב 20% או בעוצמות שיא גבוה יותר בנוכחות של VimRod לעומת כ-20% עבור סוג בר (איור 8E). זה המייצג אובדן של פונקציה בנקודה מוטציה, עם מוטציות נוספות שיש תופעות ביניים גם שיש כבר למדה4.
כדי לאמת, quantitate האיגוד VimRod וניתוח E-ההקלטה MST באמצעות His6-VimRod המסומנת אדום-טריס-נ הפלורסנט כיעד מעורבב עם הפחתת ריכוזים של ליגנד E-ההקלטה מ מ מ 1.28 כדי 39.1 nM בוצעו. Titrations מחייב שלוש בוצעו, התוצאות הן בממוצע, המוצגת באיור9. הנתונים היו מתאימים מודל סטנדרטי של ליגנד אחד-אתר איגוד ונתן KD של 25.7 ± 2.1 μM. הערכה של האיגוד בין VimRod ל- E-ההקלטה על ידי תהודה פלזמון משטח נתן ערך KD דומה של ± 1.3 19.1 μM4.

איור 1: מסך לכידת של ההתקנה של הניסוי NMR. החלון המוצג משמש כדי להגדיר ניסוי תקן שתאסוף HSQC dataset. ניסוי פרמטרים נקראים סמוכים לניסוי. הניסוי ZGPR המוצג נבחר כניסוי הראשונית כדי לטעון את הפרמטרים פרוטון התלויים סטנדרטי, הממס. החלון התואר משמש קלט נסיוני פרטים עבור שמירת למטרות רשומות. כדי לאסוף את הספקטרום HSQC הניסוי ZGPR מוחלף SFHMQC3GPPH. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
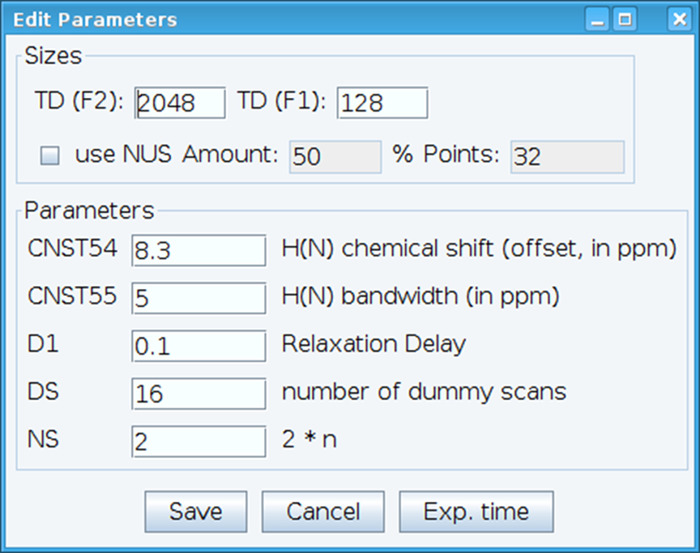
איור 2: התאמת הפרמטרים ניסיוני NMR של. החלון המוצג משמש להזנת את הפרמטרים הבסיסיים על הרצף הדופק NMR כדי לייעל את האות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: עיבוד נתונים NMR. פרמטרים המשמשת לעיבוד כל אחד שני הממדים של הספקטרום NMR מוצגים, עם חיצים המציינים אלו מותאמים בדרך כלל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
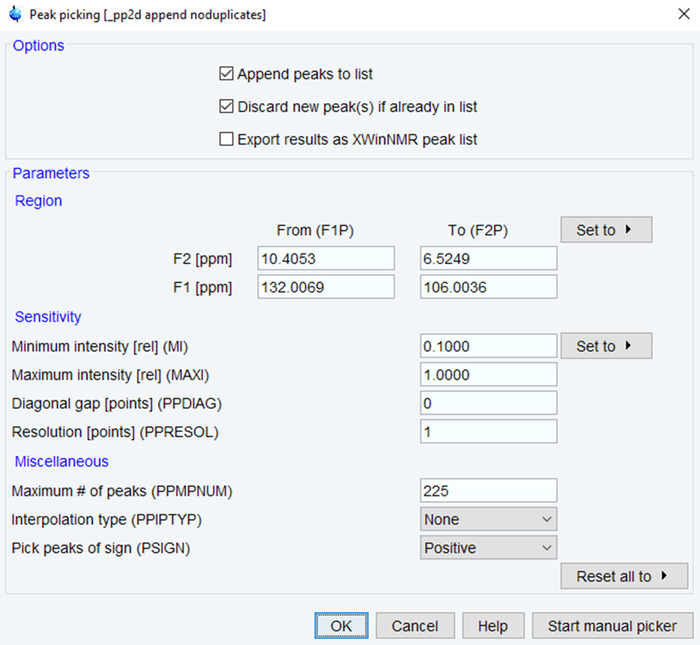
איור 4: פרמטרים עבור איסוף NMR שיא. הפרמטרים המשמש עבור איסוף NMR פסגות בספקטרום NMR מעובד מוצגים עם ערכים אופייניים. להתאים את טווח עמודים לדקה, עוצמת ואת מספר פסגות כדי למטב את הספקטרום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
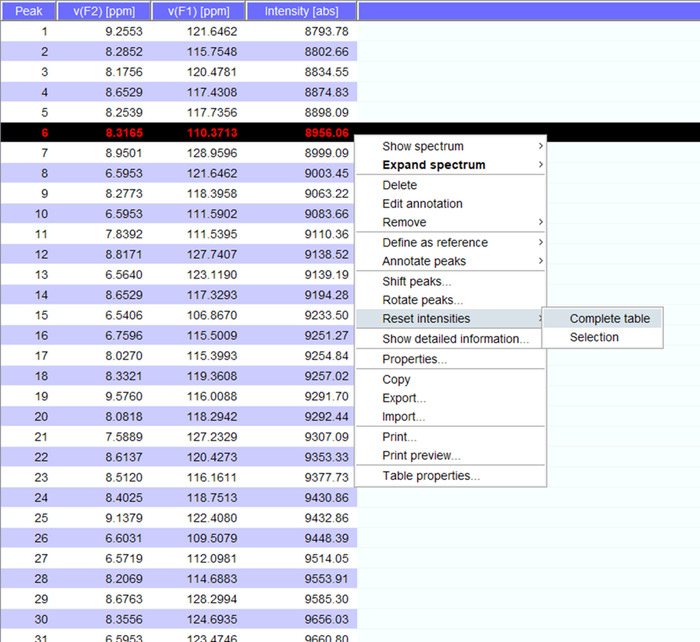
איור 5: נציג Peaklist עם עוצמות. כל שיא זה נבחר בספקטרום NMR ניתנת מספר, ו שלה 1H 15N כימי במשמרות, עוצמת אות מוצגים. Peaklist הזה יכול לשמש לאחר מכן להשוות ספקטרה שהושג בהיעדר הנוכחות/שותף אינטראקציה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
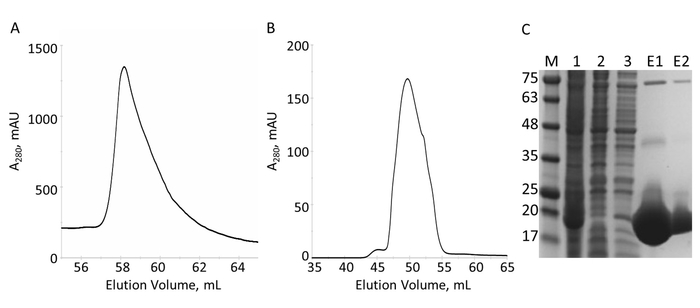
איור 6: טיהור של מתויג His6 VimRod על ידי ה-IMAC ו א ס. Chromatogram עבור • תנאי מן העמודה IMAC מראה שיא מרכזי אחד של VimRod. B. chromatogram עבור • תנאי מהעמודה מראה פסגה רצינית אחת. ג מרחביות-דף שברים שנאספו במהלך טיהור: MW סטנדרטים MW המצוין kDa משמאל ג'ל (ז) תא lysate (1), IMAC זרימה דרך (2), לשטוף (3), במאגר • תנאי (E1), איחדו S • תנאי (E2). להקות גלוי משקלים מולקולרי גבוה הנמצאים בסמטאות E1, E2 הם oligomers של VimRod טהור כמו מאושרות על-ידי תספיג חלבון (נתונים לא מוצג). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
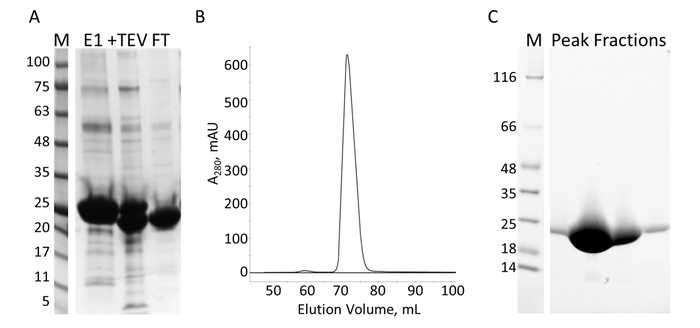
איור 7: טיהור של E-ההקלטה מאת IMAC ו א ס. מרחביות-דף של הטיהור IMAC מציג את הסטנדרטים משקל מולקולרי עם MW המצוין kDa משמאל את הג'ל (ז) ו- eluate את מהעמודה הראשונה IMAC (E1), אס המחשוף מוצרים (+ אס), ולא את הזרימה של העמודה השניה IMAC (FT). B. כרומטוגרפיה מהעמודה מראה פסגה רצינית אחת. ג מרחביות-דף של הסטנדרטים משקל מולקולרי (ז) ושברים מפסגת S. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
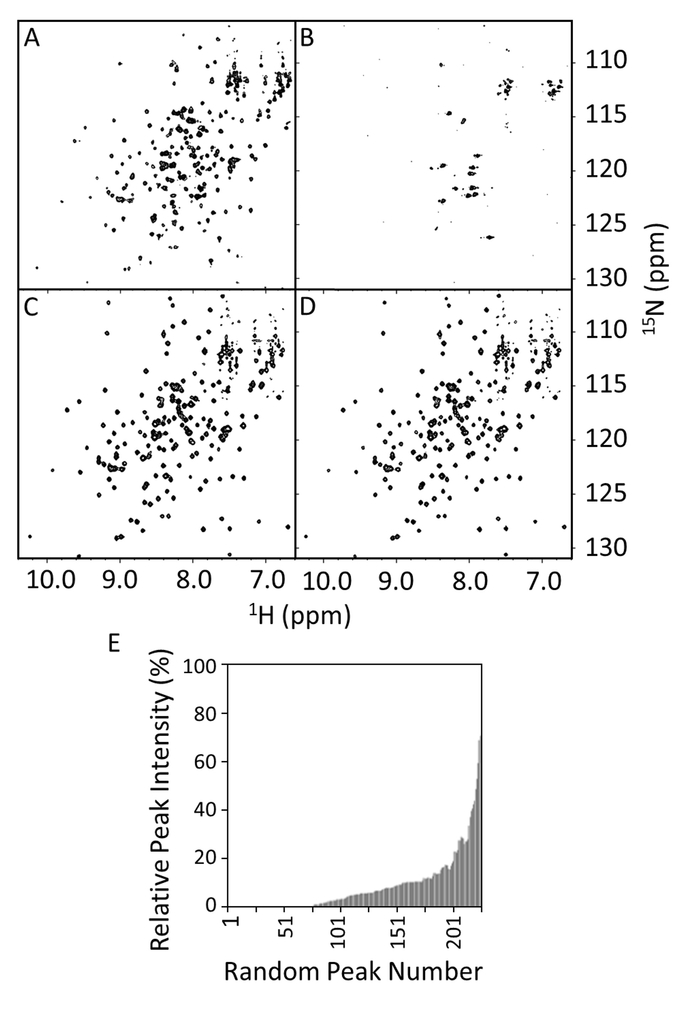
איור 8: HSQC ספקטרום של פראי-סוג של מוטציה R1914E של E-ההקלטה בנוכחות והעדר VimRod. ספקטרום HSQC להראות פראי-סוג E-ההקלטה (100 מיקרומטר) ב- 20 מ מ טריס-HCl, 150 מ מ NaCl, 1 מ"מ DTT, pH 7 של העדר (א) או נוכחות של 50 מיקרומטר VimRod (B). פאנלים C ו- D הם ספקטרום HSQC של המוטציה R1914E (100µM) היעדרות או נוכחות של 50 מיקרומטר VimRod, בהתאמה. בחלונית E הפסגה15N היחסי 1H - עוצמות של E-ההקלטה עם או בלי VimRod האיגוד מוצגים כפונקציה של מספר שיא, אשר הוקצו באופן שרירותי, לא מבוסס על רצף עמדה. ערכים אלה יכולים לשמש להגדרת משמעותה ניתוק להפחתת עוצמת שיא על תוספת של ליגנד. אם הקצאות זמינים, ניתן לראות את הערכים המשמעותיים לעיתים קרובות כדי למפות אזור מחייב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
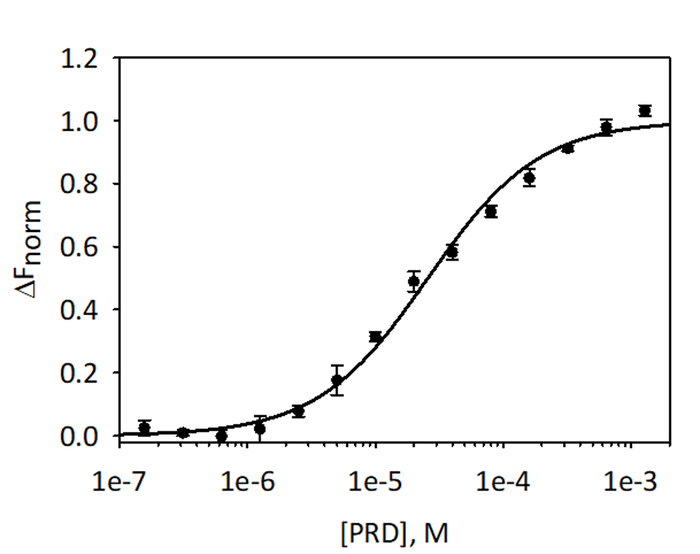
איור 9: איגוד של E-ההקלטה כדי VimRod. E-ההקלטה היה מדולל ב סדרת דילולים כפולה מ מ מ 1.28 כדי 39.1 ננומטר, מודגרות עם VimRod שכותרתו לפני ביצוע ניתוח MST. נתוני שלושת מבחני עצמאית היו משולבות. הנתונים היו מתאימה לדגם KD נותן KD של 25.7 μM עם ביטחון KD של ± 2.1 μM. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| מגיב | כמות |
| סודיום פוספט, dibasic (נטול מים) | 6.0 g |
| אשלגן פוספט, monobasic (נטול מים) | 3.0 g |
| נתרן כלוריד | 0.5 ג'י |
| H2O | עד 950 מ"ל |
טבלה 1. M9 מדיה עבור תיוג איזוטרופי.
| מגיב | כמות |
| 15 מלון NH4קלרנית | 1.0 g |
| גלוקוז (או 13C-גלוקוז) | 2.0 g |
| 1 מ' MgSO4 | 2 מ |
| CaCl 50 מ מ2 | 4 מ"ל |
| 20 מ"ג/מ"ל תיאמין | 1.0 mL |
| FeCl 3 מ מ3 | 400 ΜL |
| מתכת מיקס (טבלה 3) | 500 ΜL |
| H2O | עד 50 מ ל |
בטבלה 2. שילוב מזין עבור תוספת של M9 מדיה.
| מגיב | כמות |
| 4 מ מ ZnSO4 | 323 מ"ג |
| MnSO 1 מ4 | 75.5 מ ג |
| 4.7 מ מ גובה3בו3 | 145 מ ג |
| CuSO 0.7 מ מ4 | 55.9 מ ג |
| H2O | עד 500 מ"ל |
בטבלה 3. שילוב מתכת תוספת מעשירה את התמהיל התזונתי של MT.
| מדגם | 1 מ מ E-ההקלטה מאגר א1 (µL) | 1 מ מ VimRod במאגר A (µL) | מאגר (µL) | DSS מיקרומטר 200 D2O (µL) | מאגר B2 (µL) | הנפח הכולל (µL) |
| E-ההקלטה לבד | 50 | 0 | 50 | 50 | 350 | 500 |
| E-ההקלטה + VimRod | 50 | 50 | 0 | 50 | 350 | 500 |
| 1 מאגר ת: 20 מ מ טריס-HCl, 1 מ"מ DTT, ה-pH 7 | ||||||
| 2 מאגר ב': 23 מ מ טריס-HCl, מ"מ 1.14 DTT, ה-pH 7 | ||||||
בטבלה 4. הכנת הדוגמא NMR.
Discussion
ה 2D 15הניסוי NMR נפתרה-N הוא אחד הנפוצה ביותר שיטות כדי להראות איך שתי מולקולות אינטראקציה. זוהי שיטת ביותר מידע עשיר המאפשר האותות של שני הצדדים להיות במעקב רציף לאורך כל ניסוי טיטור במצב פתרון. אמנם בדרך כלל איכותיים במקרה של מתחמים גדולים, השיטה יכול לשמש גם במקרים חיוביים כדי למדוד את הזיקות מחייב שבו ניתן לעקוב NMR אותות ב ספקטרה ברזולוציה גבוהה. איפה הקצאות בנוחות שניתן יהיה, כמו במקרה של חלבונים רבים תחת kDa 20 בגודל, האתרים מחייב יכול להיות ממופה גם. מבחני משלימים כגון MST מספקים מידע כמותי אודות אינטראקציות בתמיסה, דורשים פחות חלבון במדינות ללא תווית. השוואה של נתוני איגוד מוטציה הוא שימושי עבור מתן פקדים כדי להבטיח כי אינטראקציות שמעידים קו NMR הרחבת מקורי לא בחפצים שונים, לדוגמה, צבירת או צמיגות משתנה.
ביטוי חלבון
ייעול תהליך ביטוי מפחית את כמות ייצור החלבון אינטנסיביות העבודה. כחלק מתהליך אופטימיזציה זה כרוך זיהוי של זן המתאים של e. coli לביטוי חלבון רקומביננטי. זן ההעדפה תלויה רכיבי כולל מהות וקטור בשימוש והביע, ליתר דיוק, היציבות האולטימטיבי של הישות חלבון רקומביננטי7. הסיכון של השפלה של החלבון heterologous על ידי אנדוגני e. coli פרוטאזות יכול להיות מופחת על ידי שימוש פרוטאז לקוי e. coli כגון המתח BL21. עבור גנים המכילים codons נדירים, זן כגון RIPL BL21-CodonPlus (DE3) ייתכן המועדפת. זן זה משלב פרוטאז אופי לקוי המתח BL21 עם עותקים נוספים אנדוגני של codon נדיר tRNAs ארגינין, איזולאוצין, פרולין של לאוצין. לחלופין, ייתכן להימנע codons נדיר שעלולים לפגוע ביטוי על ידי הזמנת בונה אופטימיזציה codon ממקור מסחרי. זנים רבים של e. coli זמינים עבור ביטוי גנים רקומביננטי, אחד אופטימיזציה עבור circumvention של בעיה ספציפית במהלך ביטוי7. במקרה של מחקר זה, המתח לקוי פרוטאז סטנדרטי BL21(DE3) המיוצר נאותה כמויות חלבון מסיס טיהור עוקבות וניתוח.
חלבון טיהור
פרוטוקול טיהור עבור חלבון נתון לעתים קרובות ייחודיים במובן כי כל חלבון נשאר מסיס בתנאים שונים כגון טמפרטורה, ריכוז מלח או pH ויציבה. היעילות הכוללת של טיהור באמצעות כרומטוגרפיית זיקה רגיש גם לריכוז eluting מינים כגון imidazole על השלבים השונים בתהליך טיהור. בעבודה זו, היו התנאים מאגר קריטי עבור IMAC pH E-ההקלטה ריכוז imidazole עבור VimRod. PH של 7.5 היה נדרש להימנע משקעים של E-ההקלטה בעקבות • תנאי ראשוני מן העמודה ה-IMAC. ולטיהור IMAC VimRod, הגדלת ריכוז imidazole בין 30 ל-50 מ מ במהלך השלב שטיפת העמודה נמצאה שיש שיפור ניכר בטוהר השברים • תנאי הסופי. עבור השלב • תנאי, הגדלת הריכוז של imidazole מ- 250 עד 350 מ"מ גם נמצאה כדי לשפר את התשואה של נייר • הסופי תנאי. ניסיונות הראשונית elute חלבון באמצעות 250 מ מ imidazole הובילו לא שלם • תנאי של VimRod כפי רצועה imidazole 1 מ' סופית של העמודה (נתונים לא מוצג). הגדלת ריכוז imidazole עד 350 מ"מ עבור • תנאי היה מספיק כדי לשחזר את כל החלבון מאוגד לעמודה. S יכול לשרת מטרה כפולה, כי היא פועלת כמו צעד ליטוש לטיהור חלבון תוך כדי ביצוע בו זמנית מאגר exchange. מאגר exchange הוא שלב קריטי לניתוח איגוד עוקבות מאז שהיא מסירה את imidazole נהגה elute חלבון מתויג His6. הוא משמש גם כהזדמנות לשינוי תנאים כגון ריכוז מלח או pH, אשר עשוי להשפיע את היעילות של טכניקות במורד הזרם או מבחני מסוימים. חלבון shift תרמי (נק) יכול לשמש כדי לזהות מאגרים אופטימלית עבור מבחני במורד הזרם, במיוחד עבור אלה הזקוקים חלבון יציב עבור ממושכות של זמן בטמפרטורת החדר8,9.
מחייב ניתוח
חלבון זה הטרי הוא קריטי עבור מבחני הכריכה מדויק, למרות חלבונים קפואים יכול לשמש גם כל עוד התוצאות מושווים. Filamentous חלבונים כגון vimentin multimerize אופנה תלויים מלח ו- pH, ואת ומכאן הפתרון תנאי צריך להיות מותאם ובין המדינה oligomeric מוערך על ידי שיטה כגון שניה10,11, דינמי פיזור אור 12 או ultracentrifugation אנליטית13,14,15. NMR ספקטרוסקופיה מתאימה למדידת ליגנד אינטראקציות של חלבונים קטנים ברזולוציה אטומית. עם זאת, כאשר חלבון אינטראקציה עם מולקולה גדולה נופלת לאט מתפתח, התוצאה היא איבוד אותות, אשר יכול לאשר מחייב למרות שזה לא בהכרח מאפשר מיפוי של איגוד אתרים, אשר גם ידרוש לפחות הקצאה של עמוד השדרה מגנטיים. בתרחיש זה, ניסויים NMR אינן מאפשרות זיהוי של אתר אינטראקציה. ומכאן האתר ביים מוטגנזה מכוונת מוחל כדי לזהות את שאריות הקריטי הדרוש עבור האיגוד. מוטציות כאלה ולכן לא מציגים אובדן אות. פרוטוקול זה, טופס מוטציה עם החלפה במיקום 1914 שומרת על עוצמות שיא בנוכחות של VimRod, ולכן מאשרת שיבוש האינטראקציה של E-ההקלטה, VimRod. הקצאה של מגנטיים עמוד השדרה ואת sidechain יוסיף ערך לגישה זו, במיוחד כאשר המבנה E-ההקלטה חינם נפתרה על ידי קריסטלוגרפיה באמצעות קרני רנטגן4. יישומים עתידיים של NMR כוללים אפיון של אינטראקציות מורכבות בין מולקולות גדולות יותר, יהנה אולטרה-גבוהה שדה מגנטים ושימוש של קבוצות הנצפה אחרות כגון 13התווית על-ידי C trifluoro קבוצות מתיל ככתבים.
MST יש מספר יתרונות לימוד מחייב אינטראקציות16. השותפים האיגוד הינם חינם בפתרון לא קיבוע. ניתוח של האיכות של הדגימות בנוי לתוך התוכנה עם בקרת איכות דיווח של מצבור, ספיחה נימים או תיוג פלורסנט לא מספיקות של מולקולת המטרה. כמויות קטנות של היעד משמשים בדרך כלל, הריכוז של המטרה שכותרתו היא בדרך כלל בין 20-50 ננומטר ב 10-20 μL נפח/תגובה. פרוטוקול זה משתמש אחסון קטן מאוד התגובה (10 μL) על מנת למקסם את הריכוז של ליגנד זה ניתן להשיג את titrations המאפשר אינטראקציות איגוד חלש לאפיין. זה מצריך מדויק pipetting וטיפול הננקטים על-מנת להימנע מהחדרה בועות ומתמזגים עדיין ביסודיות. ערבוב נאותה היא קריטית עבור מדידות קרינה פלואורסצנטית מדויק, עקבית לאורך סדרת דילולים טורי. כמות Tween-20 בניסויים MST צומצם מ תקן 0.05-0.015% כדי להוריד את הנטייה ליצור בועות ולשפר את ערבוב.
הצבע האדום-טריס-נ מספק דרך מהירה, קלה ונוחה fluorescently תווית כל חלבון יש את התג. תיוג יושלם ביעילות בתוך 30 דקות בלבד, והוא מאוד הדוקה כך הליך ההסרה אין צבע הוא הכרחי. אין לערוך שינויים שמתבצעים שאריות חומצה אמינית החלבון עלולה לשנות את מאפייני האיגוד ליגנד. אזהרה היא שיש רק החלבון להיות מתויגת תג His6. זה דרש את המחשוף של התג החלבון ליגנד, E-ההקלטה, הסרת התג ואת uncleaved E-ההקלטה עם שלב שני של העמודה ה-IMAC. במידת האפשר, החלבון ליגנד צריך להיות מוכן ללא שימוש שלו תג. לחלופין, חלבונים עשוי להיות covalently מסומן באמצעות fluorophore דרך amine צימוד ליזין שאריות או תיול צימוד על שאריות ציסטאין. עם זאת, יש לנקוט בעת שימוש במערכות כאלה מאז קוולנטיות החזקה של fluorophore עשוי להשפיע על אינטראקציות אלקטרוסטטית או קוטבי מחייב הסתמכות על שאריות ליזין או ציסטאין. כימות של איגוד הזיקה בין VimRod לבין E-ההקלטה מאת MST היה רגיש מהרגיל מלח בריכוז. בעיה זו הייתה חמאני בתחילה dialyzing היעד והן ליגנד אצווה באותו מאגר וזמינותו. בכל זאת, לא יכולה להיות מושגת הרוויה של העקומה איגוד MST בעת ביצוע וזמינותו MST בנוכחותו של 150 מ מ NaCl בשל מורכבות ההתנהגות של VimRod. נתונים אמין, מלאה הושג לאחר הריכוז של NaCl הונמך 10 מ"מ המאפשר חישוב מדויק של KD. לפיכך, אופטימיזציה זהירה של פתרון ותנאים השוואה עם מבחני משלימים מומלצים להשגת תוצאות חזקות. יתר על כן, MST עשוי לשמש כדי לכמת את התלות מלח לאינטראקציה נתון, לכמת את המאפיינים stoichiometric של אינטראקציות חלבון, קיפול חלבונים צג המכשיר לתוך קינטיקה של האנזים17.
Disclosures
המחברים לחשוף שאין ניגודי אינטרסים.
Acknowledgements
פרויקט זה בתמיכתם NSERC RGPIN-2018-04994, חדשנות תוכנית הקמפוס אלברטה (RCP-12-002 C), מכון מחקר פריון אלברטה / פתרונות ביו מחדשת של אלברטה (201600018), זכה להיות המפתח להפיל, הגנום קנדה, קנדה הרישמי חדשנות מענקים מרכז חדשנות מטבולומיקס ה (TMIC), NANUC.
Materials
| Name | Company | Catalog Number | Comments |
| Monolith NT.115, includes control and analysis software | NanoTemper Technologies | MO-G008 | Instrument for microscal thermophoresis |
| His-Tag Labeling Kit RED-Tris-NTA | NanoTemper Technologies | MO-L008 | RED-tris-NTA dye for MST |
| Standard capillaries | NanoTemper Technologies | MO-K022 | capillaries for MST |
| HisTrap HP, 5 mL | GE Healthcare | 17524801 | IMAC column |
| HisPur Ni-NTA resin, 100 mL | Thermo Fisher Scientific | 88222 | IMAC resin |
| HiLoad 16/600 Superdex 75 pg | GE Healthcare | 28989333 | SEC column |
| TEV protease | Sigma Aldrich | T4455 | cleavage of his tag from E-PRD |
| BL21(DE3) Competent E. coli | New England Biolabs | C2527H | cells for protein expression |
| cOmplete Protease Inhibitor Cocktail Tablets EDTA-Free | Sigma Aldrich | 11873580001 | protease inhibitors for protein purification by IMAC |
| TCEP, Tris(2-carboxyethyl)phosphine hydrochloride | Sigma Aldrich | C4706 | reducing agent for protein purification |
| Reagents (HEPES, NaCl, etc) | Sigma Aldrich | various | Preparation of media and buffers |
| Ammonium chloride (15N, 99%) | Cambridge Isotope Laboratories | NLM-467 | isotope labelling for NMR |
| D2O, Deuterium Oxide (D, 99.8%) | Cambridge Isotope Laboratories | DLM-2259 | NMR sample preparation |
| DSS, Sodium 2,2-dimethyl-2-silapentane-5-sulfonate-D6 (D,98%) | Cambridge Isotope Laboratories | DLM-8206 | reference for NMR |
| Precision 5 mm NMR Tubes, 7” long | SJM/Deuterotubes | BOROECO-5-7 | NMR tubes |
| NMR spectrometer (14.1 Tesla) | Bruker | acquisition of NMR data | |
| TCI 5mm z-PFG cryogenic probe | Bruker | acquisition of NMR data | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Bruker TopSpin 4.0.1 | Bruker | processing of NMR data | |
| MO.Control | NanoTemper Technologies | included with Monlith NT.115 | |
| MO.Affinity Analysis | NanoTemper Technologies | included with Monlith NT.115 |
References
- Vinogradova, O., Qin, J. NMR as a unique tool in assessment and complex determination of weak protein-protein interactions. Topics in Current Chemistry. 326, 35-45 (2012).
- McKercher, M. A., Wuttke, D. S. NMR Chemical Shift Mapping of SH2 Peptide Interactions. Methods in Molecular Biology. 1555, Clifton, N.J. 269-290 (2017).
- Al-Jassar, C., Bikker, H., Overduin, M., Chidgey, M. Mechanistic Basis of Desmosome-Targeted Diseases. Journal of Molecular Biology. 425 (21), 4006-4022 (2013).
- Fogl, C., et al. Mechanism of intermediate filament recognition by plakin repeat domains revealed by envoplakin targeting of vimentin. Nature Communications. 7, (2016).
- The Protein Protocols Handbook. Walker, J. M. , 2nd ed, Humana Press. (2002).
- Wishart, D. S., et al. 1H, 13C and 15N chemical shift referencing in biomolecular NMR. J. Biomol. NMR. 6, 135-140 (1995).
- Casali, N. Escherichia coli Host Strains. E. coli Plasmid Vectors. , Humana Press. 27-48 (2003).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Analytical Biochemistry. 357 (2), 289-298 (2006).
- Kozak, S., et al. Optimization of protein samples for NMR using thermal shift assays. Journal of Biomolecular Nmr. 64, 281-289 (2016).
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. , In Press (2018).
- Kunji, E. R. S., Harding, M., Butler, P. J. G., Akamine, P. Determination of the molecular mass and dimensions of membrane proteins by size exclusion chromatography. Methods. 46 (2), 62-72 (2008).
- Stetefeld, J., McKenna, S. A., Patel, T. R. Dynamic light scattering: a practical guide and applications in biomedical sciences. Biophysical Reviews. 8 (4), 409-427 (2016).
- Patel, T. R., Winzor, D. J., Scott, D. J. Analytical ultracentrifugation: A versatile tool for the characterisation of macromolecular complexes in solution. Methods. 95, 55-61 (2016).
- Pearson, J. Z., et al. Chapter One - Next-Generation AUC Adds a Spectral Dimension: Development of Multiwavelength Detectors for the Analytical Ultracentrifuge. Methods in Enzymology. Cole, J. L. 562, Academic Press. 1-26 (2015).
- Gorbet, G. E., Pearson, J. Z., Demeler, A. K., Cölfen, H., Demeler, B. Chapter Two - Next-Generation AUC: Analysis of Multiwavelength Analytical Ultracentrifugation Data. Methods in Enzymology. Cole, J. L. 562, Academic Press. 27-47 (2015).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1, 100(2010).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved